Obniżenie temperatury krzepnięcia (krioskopia)
A©0 µR(c)
µoR(s)
Równowaga krzepnięcia:
µR(c) = µR(s)
W roztworze nie zachodzą!!!! zjawiska dysocjacji i asocjacji
R - rozpuszczalnik
A - substancja rozproszona ( nierozpuszczalna w fazie stałej rozpuszczalnika)
Obecność substancji rozproszonej powoduje obniżenie normalnej temperatury krzepnięcia z Tokrz do Tokrz - ∆T
∆T - jest obniżeniem temperatury krzepnięcia,
∆T = Tokrz - Tkrz
L = µR(c) = µoR(c)(T,p) + RTlnxR
P = µR(s) = µoR(s)
µR(c) = µoR(s)
µoR(s) = µoR(c)(T,p) + RTlnxR
µoR(s) - µoR(c)(T,p) = RTlnxR
µoR(s) - µoR(c)(T,p) = ∆Gkrz
∆Gkrz - molowa entalpia swobodna krzepnięcia czystego rozpuszczalnika
∆Gkrz = ∆Hkrz - T∆Skrz
lnxR = ln(1 - xa)
ln(1 - xa) = ∆Hkrz/ RT - ∆Skrz/R
gdy xa = 0 to ln(1 - xa) = 0
ln(1 - xa) = ∆Hkrz/R![]()
![]()
gdy xa«1 to ln(1 - xa) ≈ - xa
ponieważ bo Tkrz ≈ Tokrz, wynika stąd że
![]()
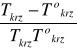
=![]()
xa = ∆Hkrz/R ![]()
![]()
= = ∆Hkrz/R![]()
![]()
bo Tkrz ≈ Tokrz
∆T =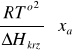
gdzie ![]()
=Kk
∆T = Kk![]()
xb
∆T = Kk![]()
m
Stała Kk jest doświadczalną stałą krioskopową i zależy jedynie od rozpuszczalnika. Obniżenie temperatury krzepnięcia roztworów rozcieńczonych jest więc funkcją właściwości rozpuszczalnika i stężenia w roztworze substancji rozpuszczonej, nie zależy natomiast od rodzaju substancji.
∆T = Kk![]()
xb![]()
i
∆T = Kk![]()
m![]()
i
i - współczynnik izotoniczny równy:
i = 1 + ά(v - 1), przy czym ά jest stopniem dysocjacji, a v liczbą jonów na które dysocjuje substancja rozpuszczona. Współczynnik izotoniczny przyjmuje wartość od 1 w sytuacji gdy substancja rozpuszczona jest nieelektrolitem, do v w sytuacji gdy ά = 1
Równanie van Laara-Hildebranda
Jeśli w stanie stałym substancje R i A są mieszalne to warunek równowagi fazy ciekłej i stałej, gdy obie fazy można uznać za roztwory doskonałe ma standardową postac:
µoR(s)(T,p) + RTlnxR(s) = µoR(c)(T,p) + RTlnxR(c)
Przy założeniu, że ciepło topnienia słabo zależy od temperatury oraz korzystamy z znanych związków termodynamicznych otrzymujemy:
ln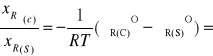
-∆Hkrz,(R)/R![]()
(![]()
)
oraz
ln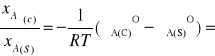
-∆Hkrz(A)/R![]()
(![]()
)
Powyższe równania są niezależne pomimo oczywistego związku xR + xA = 1 zarówno w fazie ciekłej jak stałej, ponieważ w równaniach występują niezależne parametry:
(∆Hkrz,(R), TkrzR) oraz (∆Hkrz,(A), TkrzA)
Jeśli w stanie stałym substancje R i A są całkowicie niemieszalne , to ![]()
= 1 oraz ![]()
= 1 to równanie przyjmuje postać:
lnxR = -∆Hkrz,(R)/R![]()
(![]()
) = -∆Hkrz,(R) 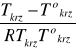
Równanie te nazywane jest równaniem van Laara-Hildebranda i wyraża zależność pomiędzy ułamkiem molowym składnika R w fazie ciekłej (xR(C)) a temperaturą równowagi (T)
R(c) + A
R(s)
Wyszukiwarka
Podobne podstrony:
Laboratorium Podstaw Fizyki spr Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
Skalowanie termopary, oraz badanie temperatury krzepnięcia stopu2, Marcin Meller
,Laboratorium podstaw fizyki, SKALOWANIE TERMOPARY I WYZNACZANIE TEMPERATURY KRZEPNIĘCIA STOPUx
20 Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu 5, Sprawozdania
Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu 6, Sprawozdania
Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu, Pwr MBM, Fizyka, sprawozdania vol
Cechowanie termopary i wyznaczanie temperatury krzepnięcia metalu, Szkoła, penek, Przedmioty, Fizyka
Temperatura krzepnięcia środków pianotwórczych
Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
20 Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu 2, Materiały na studia, Fizyka 2, S
Skalowanie termopary i wyznaczanie temperaty krzepniecia stopu
020 Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu sprawozdanie
Ćw 20 Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
20 Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
więcej podobnych podstron