Mateusz Korycki Gr. Bb I TM
|
DYSOCJACJA
|
|
Data wykonania: 15.01.2009r. |
Ocena: |
Podpis: |
DOŚWIADCZENIE I
Do 2 probówek wprowadzić po 2cm3 roztworu miedzi (III). Do jednej z nich dodać aceton do zmiany barwy, do drugiej- 1cm3 wody destylowanej. Zanotować barwę roztworu. Następnie do probówki z acetonem dodać wody destylowanej do zmiany barwy. Porównać barwy roztworów w obu probówkach.
Obserwacje:
Po dodaniu do pierwszej probówki acetonu, roztwór zmienił barwę z niebieskiej na żółto- zieloną. Następnie po dodaniu do tej samej probówki wody destylowanej kolor roztworu powrócił do barwy pierwotnej (niebieskiej).
Po dodaniu wody destylowanej do drugiej probówki nie zaobserwowano zmiany barwy.
Wnioski:
Zdysocjonowany chlorek miedzi (II) ma barwę niebieską.
Po dodaniu do probówki acetonu zachodzi reakcja odwrotna do reakcji dysocjacji. Chlorek miedzi (II) zmienia barwę na żółto-zielona. Po kolejnym dodaniu wody destylowanej, dochodzi do ponownej zmiany barwy. Chlorek miedzi (II) przyjmuje kolor niebieski- pierwotny.
Przyczyna zmiany barwy chlorku miedzi (II) SA różne wartości stałych dialektycznych.
Jeżeli wartość stałej dialektycznej znajduje się w przedziale do 20, dysocjacja nie zachodzi; w przedziale od 20-40 zachodzi dysocjacja częściowa; powyżej 40 zachodzi dysocjacja.
DOŚWIADCZENIE II
Co probówki wprowadzić 2cm3 roztworu chlorku kobaltu (III). Zaobserwować barwę roztworu. Następnie dodać kroplami (do zmiany barwy) stężony kwas solny. Ponownie rozcieńczyć roztwór wodą destylowaną i jeszcze raz obserwować zmiany barwy.
Równanie dysocjacji:
Stała równowagi
Ponieważ dysocjacja elektrolityczna jest procesem odwracalnym, to w roztworze elektrolitów istnieje równowaga:
![]()
dla której można napisać wyrażenie na stałą równowagi (Kc)
![]()
jeżeli t=const
gdzie: [A+], [B-] - rzeczywiste stężenie jonów w stanie równowagi
[AB] - rzeczywiste stężenie cząsteczek niezdysocjowanych
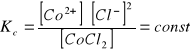
Dodanie mocnego kwasu HCl do roztworu COCl2 powoduje cofnięcie dysocjacji. Dodanie jonu chlorkowego powoduje powoduję zakłócenie istniejącego stanu równowagi.
Dysocjację w CoCl2 i HCl cofa wspólny jon Cl-.
DOŚWIADCZENIE III
W zlewce o pojemności 100cm3 zmieszać 2-3 krople roztworu siarczanu (VI) żelaza (III) z taka samą ilością tiocyjanianu potasowego. Dodać około 5cm3 wody destylowanej, wymieszać i postawić zlewkę na kartce białego papieru. Zaobserwować barwę roztworu. Następnie rozcieńczyć roztwór wodą destylowaną aż do zaniku krwistoczerwonego zabarwienia. Powstały żółty roztwór podzielić na dwie części. Do jednej części roztworu dodać kroplami roztwór siarczanu (VI) żelaza (III) do drugiej roztwór tiocyjanianu potasowego. Obserwować w obu zlewkach barwy na białym tle.
Mieszamy takie same ilości żółtego siarczanu (VI) żelaza (III) i tycjanu potasowego. Po dodaniu wody destylowanej roztwór staje się krwistoczerwony, następnie rozcieńczamy go wodą destylowaną do uzyskania barwy żółtej. Dzielimy powstały roztwór na dwie części:
dodajemy kroplami roztwór Fe2(SO4)3 w rezultacie barwa znowu ciemnieje,
dodajemy KSCN, roztwór w szybkim tempie ciemniejąc dochodzi do czerwoności.
Po rozdzieleniu na dwie części:
Dysocjacje cofnęły wspólne jony:
Fe3+ ( pierwsza probówka) oraz SCN- (druga probówka)
DOŚWIADCZENIE IV
Do 3 probówek wprowadzić po 2cm3 roztworów:
- probówka nr 1: azotan(V) ołowiu(II) + dwie krople kw. siarkowego(VI)
- probówka nr 2: octan ołowiu(II) + dwie krople kw. siarkowego(VI)
- probówka nr 3: chlorek ołowiu(II) + dwie krople kw. siarkowego(VI)
Do 3 innych probówek wprowadzić po 3cm3 roztworów:
- probówka nr 4: siarczan(VI) sodowy + dwie krople azotanu(V) ołowiu(II)
- probówka nr 5: siarczan(VI) potasowy + dwie krople azotanu(V) ołowiu(II)
- probówka nr 6: siarczan(VI) amonowy + dwie krople azotanu(V) ołowiu(II)
Reakcje cząsteczkowe:
W wyniku powyższych reakcji we wszystkich probówkach zatracił się biały osad. Dzieje się tak dlatego, że mamy do czynienia z reakcją strąceniową. Osad PbSO4 mógł powstać w wyniku połączenia kwasu siarkowego (VI) ze związkiem ołowiu lub azotan (V) ołowiu (II) z siarczanami.
DOŚWIADCZENIE V
Do 2 probówek wlewamy 1/5 objętości kwasu octowego. Następnie do każdej probówki dodać dwie krople roztworu oranżu metylowego. Jedną probówkę z kwasem octowym pozostawić jako wzorzec, do drugiej wsypać 1 mikrołopatkę octanu sodowego i wymieszać. Do dwóch następnych probówek wprowadzić około 1/5 objętości roztworu wodorotlenku amonowego. Do każdej z nich dodać po jednej kropli fenoloftaleiny. Jedna probówkę z wodorotlenkiem amonowym pozostawić jaki wzorzec, do drugiej wsypać 1 mikrołopatkę chlorku amonowego i wymieszać roztwór. Porównać zabarwienia otrzymanego roztworu, z zabarwieniem probówki wzorcowej.
W probówce nr 1 po dodaniu octanu sodowego (CH3COONa) do roztworu (CH3COOH + dwie krople oranżu metylowego (czerwony)), otrzymany roztwór ma żółtą barwę.
W probówce nr 2 po dodaniu chlorku amonowego (NH4Cl) do roztworu (NH4OH + jedna kropla roztworu fenoloftaleiny (fioletowy)), roztwór rozbarwia się. Po dodaniu 1 mikrołopatki chlorku amonowego wspólny jon
cofa reakcje dysocjacji.
Dysocjacja CH3COONa
![]()
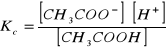
Dysocjacja NH4OH
![]()
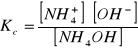
Wyszukiwarka
Podobne podstrony:
w03 Dysocjacja elektrolity, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Dysocjacja ele, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Chemia kataliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Roztwory, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
KOROZJA1, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Hydroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.4, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Szybkość reakcji, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Pierwiastki 2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Redox2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Elektroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.5, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Sprawozdanie 5 ćwiczenia 4 i 5, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Reakcje redoks, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Dysocjacje, Szkoła, penek, Przedmioty, Chemia, Teoria
Korozja, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Korozja-now, Szkoła, penek, Przedmioty, Chemia, Laboratoria
więcej podobnych podstron