Wydział Fizyki Technicznej
Edukacja techniczno-informatyczna Studia stacjonarne |
|
Data wykonywania ćwiczenia: 2.12.2011 |
Nr Grupy: 2
Nr zespołu: 3 |
Nr ćwiczenia:
4 |
mgr Łukasz Waliszewski |
Temat ćwiczenia:
Wyznaczenie potencjału wydzielania wodoru
Cel ćwiczenia:
Celem ćwiczenia jest doświadczalne przebadanie krzywych prąd - napięcie (metodą galwanostatyczną) dla wydzielania wodoru na platynie i na miedzi oraz wyznaczenie nadnapięcia wydzielania wodoru na Pt i Cu.
Pomiary:
Wykresy
Obliczenia
Katoda Cu |
|
Katoda Pt |
||||||||
|
Potencjał Roztworów [V] |
|
|
Potencjał Roztworów [V] |
||||||
Prąd [mA] |
NaOH 0.1N |
NaOH 0.01N |
H2SO4 0.1N |
H2SO4 0.01N |
|
Prąd [mA] |
NaOH 0.1N |
NaOH 0.01N |
H2SO4 0.1N |
H2SO4 0.01N |
0,2 |
1,2 |
1,17 |
0,61 |
0,78 |
|
0,2 |
1,14 |
0,84 |
0,56 |
0,62 |
0,4 |
1,41 |
1,4 |
0,66 |
0,84 |
|
0,4 |
1,36 |
1,36 |
0,62 |
0,71 |
0,6 |
1,45 |
1,43 |
0,69 |
0,87 |
|
0,6 |
1,45 |
1,45 |
0,64 |
0,77 |
0,8 |
1,48 |
1,48 |
0,71 |
0,91 |
|
0,8 |
1,5 |
1,5 |
0,66 |
0,82 |
1 |
1,5 |
1,51 |
0,72 |
0,93 |
|
1 |
1,55 |
1,55 |
0,68 |
0,85 |
1,2 |
1,52 |
1,53 |
0,73 |
0,94 |
|
1,2 |
1,58 |
1,58 |
0,7 |
0,88 |
1,4 |
1,53 |
1,56 |
0,75 |
0,96 |
|
1,4 |
1,61 |
1,61 |
0,71 |
0,91 |
1,6 |
1,54 |
1,59 |
0,76 |
0,98 |
|
1,6 |
1,66 |
1,66 |
0,73 |
0,94 |
1,8 |
1,55 |
1,61 |
0,77 |
1 |
|
1,8 |
1,69 |
1,69 |
0,73 |
0,96 |
2 |
1,56 |
1,63 |
0,77 |
1,02 |
|
2 |
1,73 |
1,73 |
0,74 |
1 |
2,2 |
1,57 |
1,64 |
0,78 |
1,03 |
|
2,2 |
1,75 |
1,75 |
0,76 |
1,02 |
2,4 |
1,58 |
1,66 |
0,79 |
1,05 |
|
2,4 |
1,77 |
1,77 |
0,76 |
1,04 |
2,6 |
1,59 |
1,69 |
0,8 |
1,07 |
|
2,6 |
1,81 |
1,81 |
0,78 |
1,07 |
2,8 |
1,6 |
1,71 |
0,8 |
1,08 |
|
2,8 |
1,83 |
1,83 |
0,78 |
1,09 |
3 |
1,6 |
1,74 |
0,81 |
1,09 |
|
3 |
1,85 |
1,85 |
0,79 |
1,11 |
3,2 |
1,61 |
1,76 |
0,81 |
1,1 |
|
3,2 |
1,88 |
1,88 |
0,8 |
1,13 |
3,4 |
1,62 |
1,78 |
0,82 |
1,12 |
|
3,4 |
1,91 |
1,91 |
0,8 |
1,15 |
3,6 |
1,62 |
1,8 |
0,82 |
1,14 |
|
3,6 |
1,95 |
1,95 |
0,81 |
1,17 |
3,8 |
1,63 |
1,82 |
0,83 |
1,16 |
|
3,8 |
1,98 |
1,98 |
0,82 |
1,2 |
4 |
1,64 |
1,84 |
0,84 |
1,16 |
|
4 |
2 |
2 |
0,82 |
1,23 |
4,2 |
1,64 |
1,85 |
0,84 |
1,18 |
|
4,2 |
2,04 |
2,04 |
0,83 |
1,25 |
4,4 |
1,65 |
1,87 |
0,85 |
1,19 |
|
4,4 |
2,05 |
2,05 |
0,83 |
1,29 |
4,6 |
1,65 |
1,89 |
0,85 |
1,2 |
|
4,6 |
2,09 |
2,09 |
0,83 |
1,31 |
4,8 |
1,66 |
1,91 |
0,85 |
1,21 |
|
4,8 |
2,11 |
2,11 |
0,85 |
1,33 |
5 |
1,67 |
1,93 |
0,86 |
1,23 |
|
5 |
2,14 |
2,14 |
0,85 |
1,36 |
Krzywe prąd - potencjał.
Odczytanie z wykresów wartości potencjałów wydzielania - Ew (w skali kalomelowej)
Katoda Cu |
|
Katoda Pt |
||||
|
NaOH |
H2SO4 |
|
|
NaOH |
H2SO4 |
0,1N |
1,45V |
0,71V |
|
0,1N |
1,55V |
0,64V |
0,01N |
1,43V |
0,87V |
|
0,01N |
1,45V |
0,85V |
Wartości potencjałów wydzielania w skali wodorowej
Ew (w skali wodorowej) =Ew (w skali kalomelowej) + 0,274V
Dla elektrody Cu
NaOH 0,1N Ew = 1,45V + 0,274V = 1,724V
0,01N Ew = 1,43V + 0,274V = 1,704V
H2SO4 0,1N Ew = 0,71V + 0,274V = 0,984V
0,01N Ew = 0,87V + 0,274V = 1,144V
Dla elektrody Pt
NaOH 0,1N Ew = 1,55V + 0,274V = 1,824V
0,01N Ew = 1,45V + 0,274V = 1,724V
H2SO4 0,1N Ew = 0,64V + 0,274V = 0,914V
0,01N Ew = 0,85V + 0,274V = 1,124V
Obliczanie potencjału spoczynkowego E zgodnie z równaniem Nernst'a:
![]()
R - stała gazowa równa 8,314 J·K-1 mol-1
T - temperatura wyrażona w kelwinach
n - liczba elektronów wymienianych w reakcji połówkowej
F - stała Faradaya równa 96485 C·mol-1
Dla NaOH:
Stężenie jonów
![]()
![]()
![]()
![]()
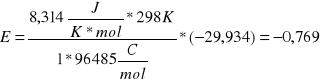
Dla H2SO4
Stężenie jonów
![]()
![]()
![]()
Obliczanie średniej wartości nadnapięcia wydzielania wodoru dla poszczególnych układów:
Ew = E + η
η = Ew - E
Dla elektrody Cu
NaOH:
η = 1,724V - (-0,769V)
η = 2,493V
H2SO4:
η = 0,984V - (-0,059V)
η = 1,043V
Wartość średnia nadnapięcia η dla miedzi wynosi: ηśrednia = 1.768V
Dla elektrody Pt
NaOH:
η = 1,824V - (-0,769V)
η = 2,593V
H2SO4:
η = 0,914V - (-0,059V)
η = 0,973V
Wartość średnia nadnapięcia η dla platyny wynosi: ηśrednia = 1.783V
6. Wnioski:
Obliczona wartość nadnapięcia η dla NaOH jest większa na obu elektrodach niż dla H2SO4, co oznacza, że do spoczynkowego potencjału E elektrody Cu i Pt w roztworze NaOH należy dodatkowo przyłożyć większe napięcie (niż w roztworze H2SO4), aby uzyskać potencjał wydzielania wodoru Ew.
Wartość nadnapięcia jest zależna od stężenia jonów wodorowych [H+].
Średnia wartość nadnapięcia jest większa dla platyny niż dla miedzi.
Wyszukiwarka
Podobne podstrony:
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Entalpia zobojętniania Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
Reakcja oscylacyjna Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Re
Stała rozpadu Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Stała ro
PROTOKÓŁ - analiza termiczna, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
Rozpad nuklidu, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Stała rozpadu
galwanotechnika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Galwanotechni
Reakcje oscylacyjne Guzika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Re
entalpia zobojętnienia Guzika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
rozciaganie wojtek dobre, Studia Politechnika Poznańska, Semestr III, Wytrzymałość materiałów, Proto
Robimy elementy belkowe, Studia Politechnika Poznańska, Semestr VI, Systemy MES, Lab-Projekt Wojtek,
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
charakterystyka sprężyn(1), Studia Politechnika Poznańska, Semestr IV, Wytrzymałość Materiałów, Labo
303 aga303, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE
KRTB-odlewn-zagadnienia 2015, Studia Politechnika Poznańska, Semestr VIII (MiBM), Kierunki rozwoju t
Kulki, Studia Politechnika Poznańska, Semestr II, Podstawy metrologii, metr
Obróbka cieplna stopów nieżelaznych, Studia Politechnika Poznańska, Semestr III, OCiS, Sprawozdania
więcej podobnych podstron