S A C H A R Y D Y (CUKRY)
Cukrami (sacharydami) nazywane są polihydroksyaldehydy i polihydroksyketony oraz niektóre ich pochodne. Związkami o najmniejszej masie cząsteczkowej, które spełniają tę definicję to aldehyd glicerynowy i dihydroksyaceton.
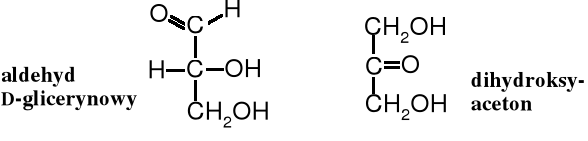
W literaturze cukry znane są też pod nazwą węglowodanów, jako że skład atomowy (wzór sumaryczny) wielu z nich odpowiada wielokrotności atomów węgla i cząsteczek wody - (CH2O)n. Nazwa ta nie jest jednak zalecana, ponieważ wzór sumarycznych nie wszystkich cukrów jest adekwatny do wielokrotności ugrupowania (CH2O)n.
Podział cukrów
Rozróżniane są dwie główne grupy cukrów:
- aldozy - homologi aldehydu glicerynowego i
- ketozy - homologi dihydroksyacetonu.
W zależności od liczby atomów węgla w cząsteczce cukru, dzielą się one na: triozy, tetrozy, pentozy, heksozy i heptozy. Warto zwrócić uwagę na to, że nazwa składa się z liczebnika podającego liczbę atomów węgla i końcówki charakterystycznej dla cukrów - oza.
W innym podziale rozróżniamy cukry proste i złożone, wynika on z ich zdolności do kondensacji (polimeryzacji). Prostymi nazywane są cukry - monomeryczne, a więc te, które nie ulegają hydrolizie. Do cukrów prostych należy aldehyd glicerynowy (gliceroza), ryboza, glukoza, fruktoza i wiele innych. Jeżeli cząsteczka cukru składa się z dwóch lub więcej reszt cukrów prostych to należy on do cukrów (sacharydów) złożonych. Jej hydroliza prowadzi do cukrów prostych. Najbardziej znanymi cukrami złożonymi są celuloza i skrobia. Cukier złożony z dwóch reszt cukrów prostych nazywany jest dicukrem (disacharydem). Dicukrem jest laktoza, maltoza, cukroza i wiele innych.
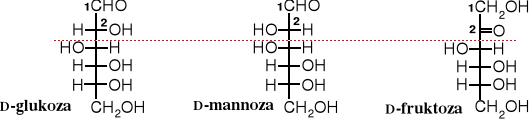
Znany jest podział cukrów na szereg D i L.
Cukry mogą należeć do szeregu D lub L w zależności od konfiguracji ostatniego chiralnego atomu węgla. Do szeregu D należą te homologi aldehydu D-glicerynowego lub dihydroksyacetonu, w których w projekcji Fischera grupa HO- przy ostatnim chiralnym atomie C znajduje się po prawej stronie.
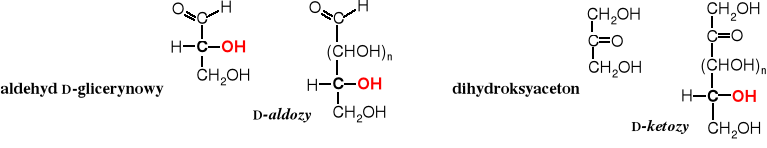
Analogicznie wyglądają szeregi L-aldoz i L-ketoz. Cukry szeregu D są bardziej rozpowszechnione w przyrodzie niż szeregu L.
Występowanie
Do popularnych cukrów prostych zaliczane są D-ryboza, D-galaktoza, D-mannoza, D-glukoza i D-fruktoza. Miód jest mieszaną D-glukozy i D-fruktozy. Pośród nielicznych naturalnych cukrów prostych szeregu L znajduje się L-arabinoza i L-galaktoza. Wolne triozy nie zostały wykryte w przyrodzie, występują jednak w żywych komórkach w postaci fosforanów. Również nie znaleziono wolnych tetroz. Fosforylowana erytroza bierze udział w procesach biochemicznych.
D-Glukoza i D-fruktoza są produkowane przez rośliny zielone w procesie fotosyntezy z CO2 i wody. Inne cukry powstają w wyniku transformacji głównie D-glukozy. D-Glukoza występuje w wielu owocach, we krwi, stanowi też wyłączne źródło energii dla mózgu.
Wolne cukry spotyka się w owocach lub innych częściach roślin, np. w łodygach (trzcina cukrowa), korzeniu (buraki) czy w kwiatach (nektar). W mleku znajduje się laktoza (cukier mleczny), która jest dimerem D-glukozy i D-galaktozy. W słodzie (w kiełkujących zbożach) pojawia się inny dimer - maltoza (cukier słodowy), złożony wyłącznie z D-glukozy. Powstaje on w wyniku hydrolizy skrobi. Skrobia, podobnie jak i celuloza oraz glikogen są polimerami D-glukozy. Celuloza stanowi około 80% suchej masy roślin wyższych. Wiele innych produktów roślinnych należy do cukrów złożonych, czyli polimerów cukrów prostych, w tym łupiny orzechów, gumy roślinne, wyciągi typu agaru, dekstrany, pektyny i inne.
D-Ryboza i D-dezoksyryboza w postaci nukleotydów są składnikami kwasów nukleinowych: RNA i DNA. Znajdują się one we wszystkich komórkach organizmów żyjących i martwych.
Znane są także naturalne analogi cukrów, np. dezoksycukry (D-dezoksyryboza), aminocukry (D-glukozoamina czy D-galaktozoamina). Pośród pochodnych cukrów do najpopularniejszych należą glikozydy (np. amigdalina czy salicyna), alditole (D-glucitol, zwany też sorbitolem, D-mannitol) oraz kwasy (D-glukonowy, D-glukuronowy, D-galakturonowy).
Cukry są składnikami wielu substancji czynnych, bardzo ważnych dla życia, np. glikoprotein i glikolipidów. Na powierzchniach komórek, w tym erytrocytów, występują oligocukry. Pełnią one rolę determinantów antygenowych. Skład tych oligocukrów decyduje o grupach krwi.
Funkcja, jaką pełnią cukry w procesach biochemicznych jest bardzo zróżnicowana, polega ona między innymi na tym, że stanowią materiał budulcowy, są substancjami zapasowymi, przenośnikami i magazynami informacji, substancjami znakującymi (determinantami, kwas sjalowy), a także podstawowym, obok białek i tłuszczów składnikiem pożywienia.
Nomenklatura
Powszechnie stosowane są zwyczajowe nazwy cukrów, ponieważ ich nazwy systematyczne są zbyt skomplikowane. Często do nazwy cukru dodaje się końcówkę -furanoza (5-członowa) lub -piranoza (6-członowa), które informują o wielkości pierścienia hemiacetalowego cząsteczki cukru, np. D-glukopiranoza.
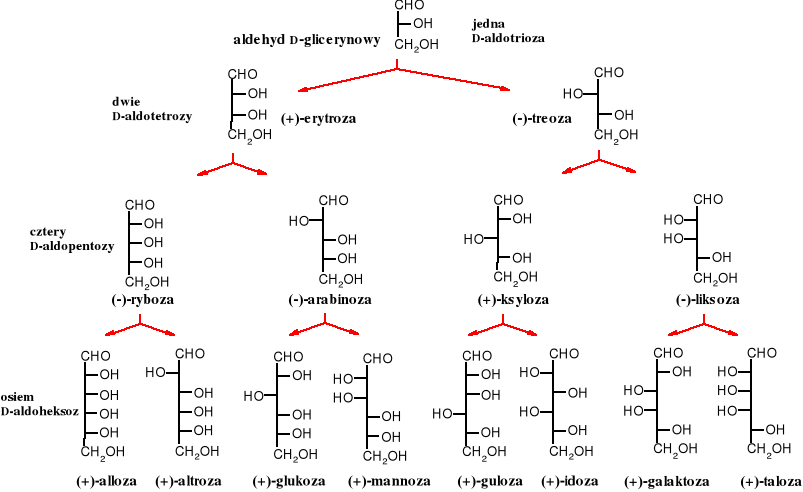
Przykłady cukrów prostych
szereg D-aldoz
Szereg D-ketoz
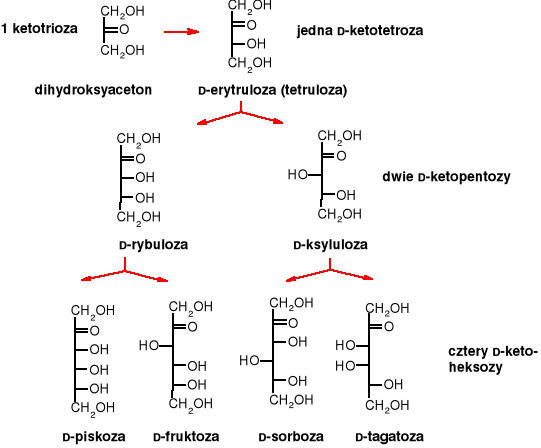
Podobne szeregi można utworzyć dla L-aldoz i L-ketoz. Najpopularniejszym cukrem prostym jest D-glukoza.
Właściwości fizyczne i fizjologiczne
Triozy są syropami, ale tworzą krystaliczne dimery. Dimer aldehydu glicerynowego jest trudno rozpuszczalny w wodzie. Erytroza jest także syropem, ale dobrze rozpuszcza się w wodzie i w etanolu. Wyższe cukry proste są substancjami krystalicznymi, chociaż krystalizacja niektórych z nich może nastręczać trudności, z uwagi na tendencję cukrów do tworzenia syropów. W roztworze łatwo izomeryzują (tworzą anomery i epimery), co utrudnia ich krystalizację. Wyższe cukry proste dobrze rozpuszczają się w wodzie, trudno w rozpuszczalnikach organicznych, w tym w etanolu. Wiele cukrów ma właściwości hygroskopijne, tzn. chłoną wilgoć z powietrza w skutek czego zlepiają się, zbrylają, a nawet rozpływają się w postaci syropu.
Większość cukrów prostych ma słodki smak. Najbardziej słodka jest D-fruktoza, potem D-glukoza, a następnie cukroza (sacharoza) - dicukier otrzymywany z trzciny cukrowej lub buraków cukrowych, stosowany w codziennym użytku do słodzenia potraw. D-Fruktoza jest ponad 5 razy słodsza od cukrozy. Stosując ją do słodzenia potraw można znacznie obniżyć ich kaloryczność. Jeszcze większa redukcja kaloryczności, głównie napojów, jest możliwe poprzez użycia do słodzenia tzw. słodzików. Najpopularniejszymi słodzikami są sacharyna (związek aromatyczny) i aspartam (dipeptyd). Aspartam jest 200 razy słodszy od cukrozy. Znane są białka tysiące razy słodsze niż cukroza, jednak słodki smak tej ostatniej jest dla większości ludzi najprzyjemniejszy. Słodziki nie mogą zastąpić cukrów w wypiekach, ponieważ podczas pieczenia dochodzi do reakcji cukrów z aminokwasami i powstają cenne związki aromatyczne i smakowe, co jest niemożliwe przy udziale słodzików.
Pytanie: dlaczego miód jest znacznie słodszy od cukrozy?
Chiralność
Dihydroksyaceton jest związkiem achiralnym. Aldehyd glicerynowy i ketotetrozy zawierają po jednym centrum chiralnym, wyższe cukry mają ich odpowiednio więcej.

Wyższe cukry mają tendencje do tworzenia cyklicznych układów hemiacetalowych, w wyniku czego powstaje nowe centrum chiralne. W trakcie zamykania pierścienia hemiacetalowego pojawiają się dwa nowe stereoizomery nazywane anomerami. Anomery są trwałe w stanie krystalicznym, w roztworze zaś dochodzi do przemiany jednego w drugi i wytwarza się stan równowagi. Przejście jednego anomeru w drugi, zwane mutarotacją jest katalizowane zarówno kwasami, jak i zasadami i biegnie poprzez formę otwartą (karbonylową).
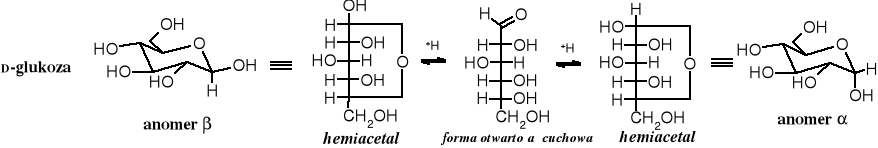
W obojętnym wodnym roztworze glukozy stężenie formy aldehydowej jest tak małe (0,02%), że pasmo absorpcji grupy aldehydowej w widmie UV jest niewidoczne. Po zakwaszeniu pojawia się sygnał absorpcji w zakresie 184 nm, typowy dla niesprzężonego karbonylu. Tak więc, katalityczne działanie kwasów w procesie anomeryzacji polega na ułatwieniu otwierania się pierścienia hemiacetalowego. Reakcja tworzenia się hemiacetali jest katalizowane wyłącznie przez kwasy.
Przekształcanie wzorów otwartej formy cukrów w hemiacetalowe pierścienie
Na schemacie poniżej pokazane jest procedura przekształcania wzoru łańcuchowego cukru w pierścień hemiacetalowy. Kolejność operacji na wzorze jest następująca. Zaczynamy od zagięcia końca C6 łańcucha węglowego w lewo do góry, tak żeby cząsteczka utworzyła otwarty pierścień sześcioczłonowy. Zagięciu w tym kierunku ulegają również atomy C6, C5 i C4. Górna część łańcucha, obejmująca atomy C1 i C2 zaginana jest w prawo w dół. W takim ułożeniu atom tlenu grupy hydroksylowej przy C5 łatwo utworzy wiązanie hemiacetalowe z karbonylowym atomem węgla przy C1, przy czym atom wodoru z grupy hydroksylowej przechodzi do karbonylowego atomu tlenu. W rezultacie powstaje nowa grupa hydroksylowa, zwana glikozydową lub anomeryczną. W aldozach, grupa glikozydowa znajduje się przy C1, a w ketozach przy C2. Atomy węgla C1 (dla aldoz) i C2 (dla ketoz) nazywane są glikozydowymi (anomerycznymi).
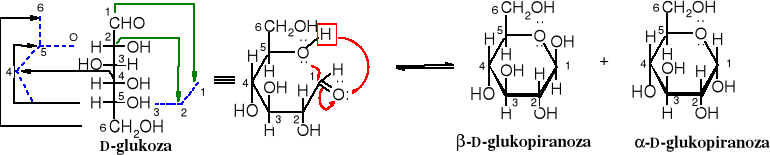
Tego typu wzory perspektywiczne, pogrubione z przodu, jak powyżej nazywane są wzorami Haworth'a. Wyraźnie widoczne są na nich grupy znajdujące się pod i nad płaszczyzną pierścienia.
Częściej jednak cząsteczki cukrów przedstawiane są za pomocą wzorów pokazujących krzesełkową konformację pierścienia sześcioczłonowego. Ułatwiają one identyfikację wiązań aksjalnych i ekwatorialnych. Atomy wodoru związane z atomami węgla są zwykle pomijane. Można również pogrubić frontową część pierścienia.
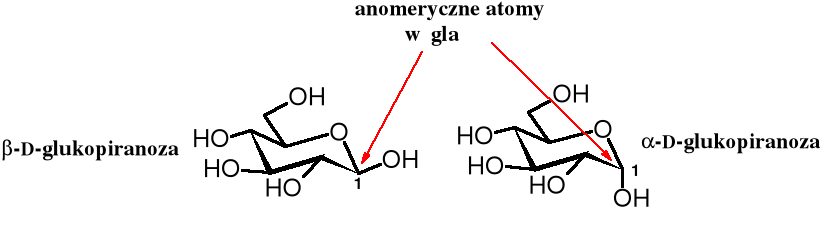
Izomery i , różniące się ułożeniem grupy OH przy C1 względem pierścienia narysowanego, jak na powyższym wzorze, zwane są anomerami. W anomerze grupa OH przyłączona jest do C1 aksjalnie i znajduje się pod płaszczyzną pierścienia, a w anomerze jest przyłączona ekwatorialnie nad płaszczyzną pierścienia. Warto zauważyć, że w cukrach szeregu D grupa CH2OH zajmuje miejsce ponad płaszczyzną pierścienia. Z tego powodu glikozydowa grupa OH i CH2OH w anomerze są ułożone względem siebie w sposób trans, a w anomerze cis.
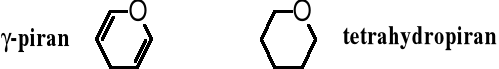
Przyrostek -piranoza wywodzi się od piranu, heterocyklicznego, nienasyconego, sześcioczłonowego związku, który zawiera atom tlenu w pierścieniu. Taki fragment (-piranoza) pojawia się w nazwie cukru występującego w formie pierścieniowego, sześcioczłonowego hemiacetalu, np. glukopiranoza. W nazwie nie uwzględnia się tego, że są to pochodne tetrahydropiranu. Piran jest nietrwały, znane są jednak jego pochodne, w tym - tetrahydropiran.
W trakcie tworzenia się hemiacetalu D-fruktozy powstaje pierścień pięcioczłonowy przypominający furan, dlatego cukry w tej formie zawierają w nazwie przyrostek -furonoza, np. D-fruktofuranoza.
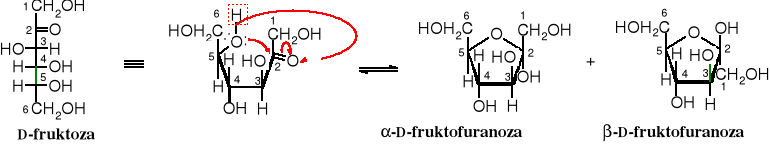
Pierścienie pięcioczłonowe są płaskie, zatem nie są obrazowane wzorami przestrzennymi (konformacyjnymi). Furan w przeciwieństwie do piranu jest trwały. Uwodorniony furan - tetrahydrofuran - znalazł szerokie jako popularny rozpuszczalnik.
Właściwości chemiczne
1. Anomeryzacja
W stanie krystalicznym anomery cukrów są trwałe. Po rozpuszczeniu ustala się pomiędzy nimi dynamiczna równowaga. Anomeryzacja jest katalizowana zarówno kwasami, jak i zasadami. Wystarczy CO2 z powietrza, jako katalizator kwaśny i szkło, jako zasadowy do przyspieszenia przemiany jednego anomeru w drugi. W roztworze przeważa izomer trwalszy. Dla D-glukozy jest to anomer , ponieważ wszystkie grupy OH w tym izomerze zajmują bardziej korzystne pozycje ekwatorialne.
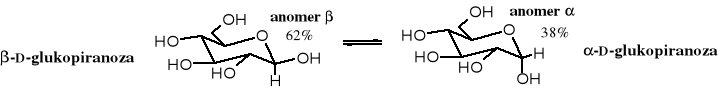
W wodzie -D-glukopiranoza jest trudniej rozpuszczalna niż jej anomer , dlatego krystalizuje jako pierwsza z roztworu wodnego. Po wykrystalizowaniu części anomeru zostaje zaburzona równowaga, wobec czego odpowiednia ilość przechodzi w , co umożliwia dalszą krystalizację tej właśnie odmiany. Zatężając wolno wodny roztwór glukozy można ją prawie całkowicie wykrystalizować w formie . W pirydynie i w kwasie octowym trudniej rozpuszczalny jest anomer i dzięki temu można go otrzymać w formie krystalicznej.
Po rozpuszczeniu określonego anomeru ustala się dynamiczna równowaga w roztworze. W roztworze wodnym D-glukozy, jak już wspomniano, w stanie równowagi znajduje się 38% izomeru i 62% izomeru . Wzajemnej przemianie anomerów towarzyszy zmiana skręcalności właściwej roztworu. Stąd nazwa tego zjawiska - mutarotacja, czyli zmieniająca się rotacja. Skręcalność właściwa roztworu cukru ulegającego mutarotacji zmienia się do momentu ustalenia równowagi pomiędzy anomerami. Wartość skręcalności właściwej -D-glukopiranozy []D = +112o po jej rozpuszczeniu w wodzie ulega zmniejszeniu aż do poziomu []D = +52,5o. Wartość skręcalności właściwej -D-glukopiranozy []D = +18,7o po rozpuszczeniu w wodzie rośnie i po pewnym czasie osiąga tę samą równowagową wartość +52,5o. Szybkość mutarotacji zależy od obecności katalizatorów, jaki są kwasy lub zasady.
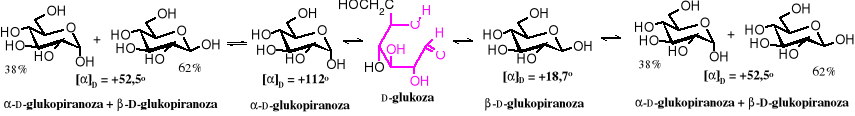
W stanie równowagi []D roztworu D-glukozy przyjmuje wartość +52,5o, taka samą jak dla mieszaniny składającej się z 38% anomeru i 62% anomeru .
Zwykle skład roztworu cukru jest jeszcze bardziej skomplikowany. W stanie równowagi znajdują się w nim nie tylko dwa anomery, np. dla D-glukopiranozy (prawie 62% i prawie 38% ), ale również, chociaż w mniejszych ilościach oba anomery D-glukofuranozy (0,14% , poniżej 0,1% ), forma otwarta (0,02%) oraz ślady septanozy (siedmioczłonowy pierścień) i oksetanozy (czteroczłonowy pierścień). Po dłuższym czasie pojawiają się dodatkowo epimery D-glukozy, czyli D-mannoza i D-fruktoza.
2. Epimeryzacja
Epimerami nazywają się izomery cukrów różniące się budową chemiczną lub/i stereochemiczną przy C1 lub/i C2. Epimerami D-glukozy są więc D-mannoza i D-fruktoza. Niektórzy autorzy zaliczają do epimerów jedynie te izomery, które różnią się układem sterycznym przy C2, a więc byłaby to para D-glukozy i D-mannozy bez D-fruktozy.
epimery
Epimery mogą przechodzić wzajemnie w siebie dzięki tautomerii (poprzez utworzenie wiązania podwójnego pomiędzy C1 oraz C2 i enolizację).
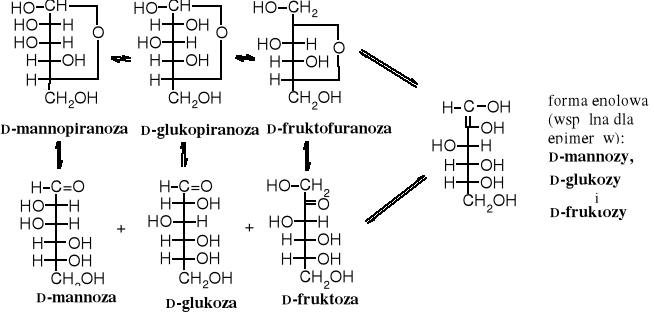
Zadanie: zaproponuj mechanizm epimeryzacji.
3. Utlenienie
3.1 Utlenienie do kwasów onowych
Karbonylowy atom węgla aldoz łatwo ulega utlenieniu, powstają przy tym polihydroksykwasy, zwane kwasami onowymi (dawniej kwasami aldonowymi). Najczęściej stosowanymi utleniaczami w tej reakcji jest chlor lub brom w wodzie. Kwasy onowe tracąc wodę łatwo przechodzą w laktony.
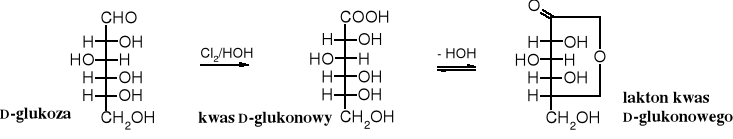
Sól wapniowa kwasu D-glukonowego jest stosowana jak lek będący źródłem wapnia w chorobach alergicznych i w leczeniu osteoporozy.
Kwasy glukonowe powstają z aldoz również pod wpływem utleniającego działania soli srebra Ag+ lub soli miedzi Cu+2. Reakcje z tymi jonami zostały wykorzystane jako testy (Tollensa i Fehlinga) na obecność aldoz. Warto pamiętać, że podobnie reagują aldehydy.
Test Tollensa
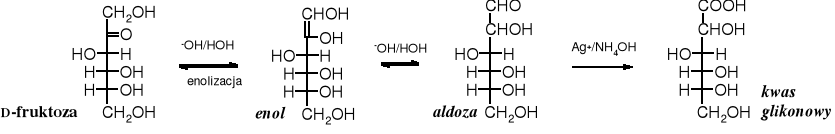
Odczynnikiem Tollensa jest amoniakalny roztwór azotanu srebra. W reakcji z aldehydami, w tym z aldozami, kation srebrowy ulega redukcji do srebra metalicznego, które w postaci lustra osadza się na powierzchni szklanego naczynia. Aldoza utlenia się przy tym do kwasu glikonowego. Szybka reakcja tworzenia lustra srebrowego jest dowodem na obecność w środowisku aldehydu (aldozy). Jeżeli tej reakcji poddamy ketozę, to lustro srebrowe będzie powstawać znacznie wolniej, zauważymy go dopiero po wielokrotnie dłuższym czasie, potrzebnym do przekształcenia się ketozy w epimeryczną aldozę. Ketony zwykłe są niewrażliwe na test Tollensa.
aldoza + Ag+ _→ Ag↓ + kwas glikonowy
lustro srebrowe
ketoza _→ aldoza + Ag+ _→ Ag↓ + kwas glikonowy
lustro srebrowe
Redukcja soli srebra za pomocą aldehydów jest wykorzystywana do wytwarzania luster.
Test Fehlinga
Test Fehlinga polega na utlenianu aldoz solą Cu(II) w zasadowym roztworze winianu sodowo-potasowego. W wyniku reakcji aldoza utlenia się do kwasu glikonowego, a jony Cu(II) redukują się do Cu(I) i w środowisku zasadowym wytrąca się w postaci pomarańczowego osadu Cu2O. Ketozy reagują z odczynnikiem Fehlinga podobnie jak z odczynnikiem Tollensa, czyli pomarańczowy osad zaczyna się wolno wytrącać po wielu minutach.
Z D-galaktozy w wyniku delikatnego utleniania powstaje kwas D-galaktonowy.
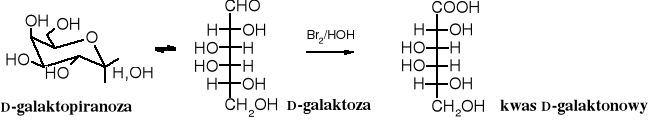
3.2 Utlenienie do kwasów uronowych
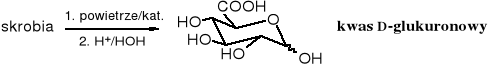
Kwasy uronowe są pochodnymi aldoz, których reszta CH2OH (ostatni atom węgla) jest utleniona do grupy karboksylowej. Utlenienie tej grupy można przeprowadzić po zabezpieczeniu funkcji aldehydowej, która jak wiadomo utlenia się łatwiej niż pierwszorzędowy alkohol. Kwas D-glukuronowy powstaje w reakcji utlenienia, np. 1,2,34-tetraacetylo-D-glukopiranozy.

Selektywnie chronione aldozy, tzn. takie ich pochodne, w których wolna jest jedynie grupa hydroksylowa przy C6 (jak wyżej) są trudne do otrzymania, jednak przy odpowiednio dobranym utleniaczu wystarczy zablokować jedynie grupę aldehydową cukru. Warunek ten spełniają glikozydy, a także tania i łatwo dostępna skrobia - polimer D-glukozy, w której poszczególne reszty monomerów połączone są w sposób 1-4, tzn. mają chronioną grupę aldehydową.
Kwasy uronowe łatwo tworzą laktony. Krystaliczny kwas D-glukuronowy występuje głównie w postaci furanurono-6→3-laktonu, podczas gdy najtrwalszą formą kwasu D-galakturowego jest piranurono-6→3-lakton.
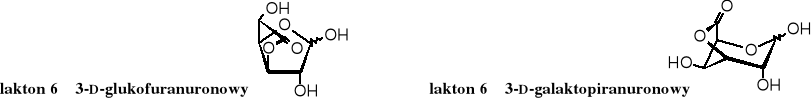
Warto zwrócić uwagę na to, że powstawaniu laktonów towarzyszy wydzielenie cząsteczki wody, podczas gdy hemiacetale tworzą się w reakcji addycji (nie wydziela się żadna cząsteczka).
Kwasy glikuronowe zachowują właściwości redukujące, zdolność do mutarotacji, mogą też tworzyć glikozydy. Kwas D-glukuronowy został wykryty po raz pierwszy w moczu, stąd jego nazwa (ang. urine - mocz). Występuje również we krwi. Pełni on ważną rolę w organizmie, służy bowiem do usuwania wielu substancji toksycznych. Tworzy z nimi glikozydy, np. z fenolem, i w tej postaci są one usuwane wraz z moczem.
Kwasy uronowe należą do popularnych związków organicznych. Kwas D-glukuronowy oprócz roli wspomnianej powyżej jest składnikiem gumy arabskiej i ksantanów, kwas D-galakturonowy nadaje właściwości żelujące produktom naturalnym typu agar czy peptyny, kwasy L-guluronowy i D-mannuronowy występuje w alginianach, policukrach wyodrębnianych z brunatnych glonów.
3.3 Utlenianie do kwasów arowych
Utlenianie aldoz silnym utleniaczem, np. kwasem azotowym prowadzi do kwasów polihydroksy-,-dikarboksylowych, zwanych kwasami arowymi (dawniej kwasami cukrowymi). Z D-glukozy powstaje kwas D-glukarowy.
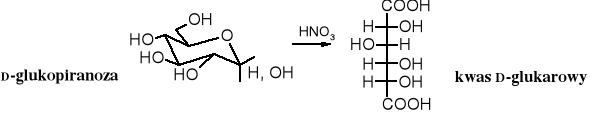
Kwasy arowe, podobnie jak kwasy uronowe łatwo tworzą laktony, jednak w przypadku kwasów arowych, z uwagi na zawartość dwóch grup karboksylowych istnieje większa możliwość wzajemnej wewnątrzcząsteczkowej reakcji, wobec czego może powstać więcej laktonów.
Laktony kwasu D-glukarowego
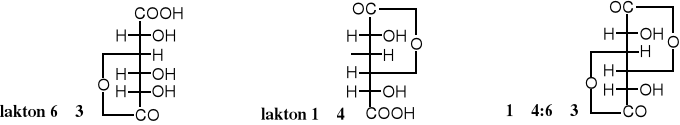
Kwas arowy otrzymywany z D-galaktozy (lub laktozy) czyli kwas D-galaktarowy znany jest pod zwyczajową nazwą kwasu śluzowego. Występuje w postaci 4 laktonów: 2 mono- i 2 dilaktonów.
D-galaktopiranoza lakton 1→4 lakton 6→3 dilakton 1→4:6,3 dilakton 1,5→6,3 kwasu śluzowego
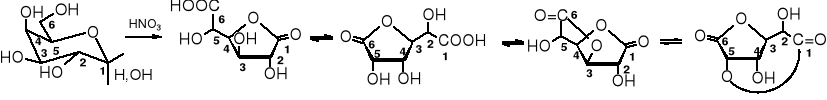
3.4 Utlenianie kwasem nadjodowym
Kwas nadjodowy, podobnie jak tetraoctan ołowiu utleniają wicinalne glikole (1,2-glikole), dochodzi przy tym do rozerwania wiązania C-C i utworzenia dwóch grup karbonylowych.
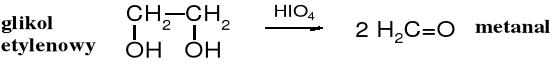
W przypadku utleniania kwasem nadjodowym atomu węgla, który ma w sąsiedztwie dwa ugrupowania -C-OH zostaje on przekształcony w grupę karboksylową -COOH.
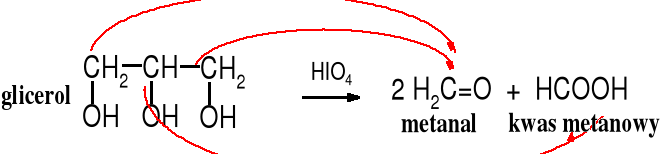
Podobnie utlenieniu do grupy karboksylowej ulega aldehyd lub keton, który ma w sąsiedztwie ugrupowania -C-OH lub karbonylowe.
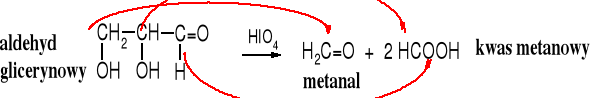
W cząsteczkach wolnych cukrów zwykle wszystkie atomy węgla są podatne na utleniające działanie tego typu utleniaczy, dlatego z wolnych cukrów powstaje głównie kwas metanowy.
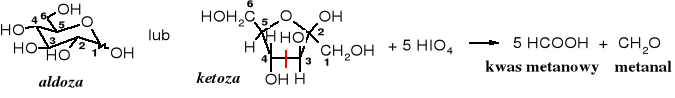
Pytanie: z którego atomu węgla cząsteczki cukru powstaje metanal?
Wiązanie hemiacetalowe nie stanowi przeszkody w utlenieniu wg powyższego schematu, natomiast etery, w tym glikozydy są odporne na utleniające działanie kwasu nadjodowego. Produkty utleniania glikozydów zależą od wielkości utlenianego pierścienia glikozydowego, tzn. od tego czy występuje on w formie piranozowej czy furanozowej. Utlenianie cukrów kwasem nadjodowym było dawniej głównym sposobem określania wielkości pierścienia cukrowego. Obecnie, do tego celu służą metody spektralne.
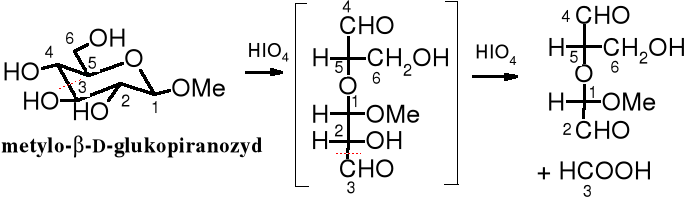
Zadanie: nazwij produkt utlenienia, który powstaje obok kwasu metanowego.
Produkt utlenienia furanozydu różni się zasadniczo od produktu utlenienia piranozydu; na podstawie tej różnicy poznaje się wielkość pierścienia.
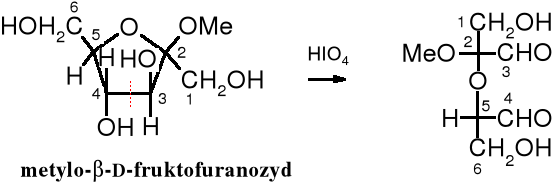
Zadanie: nazwij produkt utlenienia metylo--D-fruktofuranozydu kwasem nadjodowym.
4. Redukcja
Redukcja aldoz i ketoz prowadzi do polioli (polihydroksyalkanów), zwanych alditolami. Ulegają one redukcji łatwiej niż zwykłe aldehydy czy ketony. Glikozydy są odporne na redukcję. Warto zwrócić uwagę na to, że ten sam alditol powstaje w wyniku redukcji dwóch różnych aldoz, a z ketozy tworzą się dwa alditole, ponieważ pojawia się nowe centrum chiralne.
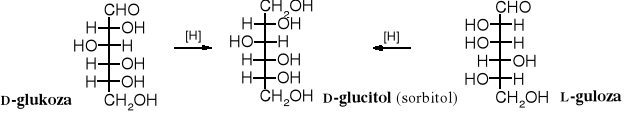
Nazwę alditolu tworzy się zamieniając w nazwie aldozy końcówkę -oza na -itol, np. mannoza _→ mannitol. Wyprowadza się ją od popularniejszej aldozy, z której może powstać; stąd znane są D-glucitol i D-mannitol, chociaż oba te alditole powstaję również w redukcji D-fruktozy i odpowiednich aldoz. Niektóre alditole mają nazwy zwyczajowe, np. sorbitol (D-glucitol).
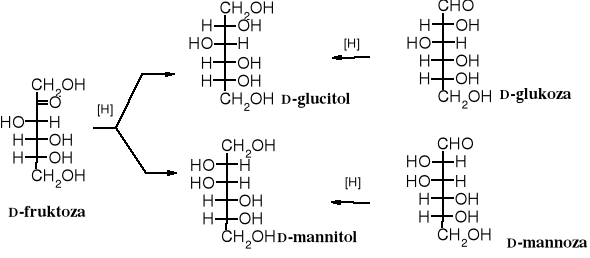
Dawniej alditole otrzymywało się z cukrów poprzez redukcję amalgamatem sodu lub glinu. Obecnie w laboratorium stosuje się do tego celu tetrahydroboran sodu, a w przemyśle wodór pod zwiększonym ciśnieniem, w obecności katalizatora niklowego.
Właściwości, występowanie i zastosowanie
Alditole są słodkie; słodkość D-glucitolu odpowiada 50% słodkości cukrozy (sacharozy), tzn. stężenie wyczuwalnej słodkości D-glucitolu jest dwa razy większe niż cukrozy.
Najbardziej znanym alditolem jest glicerol. Warto zwrócić uwagę na to, że on też jest słodki, co przejawia się w jego nazwie. Do alditoli rozpowszechnionych w przyrodzie należy D-glucitol. W niektórych owocach stanowi on aż 10% ich suchej masy (np. w jarzębinie górskiej, Sorbus aucuparia), w małych ilościach występuje w jabłkach, morelach, gruszkach i innych. Nie stanowi pożywki dla bakterii i nie ulega fermentacji. Mogą go spożywać diabetycy i osoby dbające o smukła sylwetkę, ponieważ ma niską wartość kaloryczną. Służy jako wypełniacz niektórych farmaceutyków, kosmetyków i wyrobów papierniczych. Wykorzystywany jest w przemyśle do produkcji polieterów i detergentów niejonowych. D-Ksylitol dodawany jest jako słodzik do gum do żucia, ponieważ nie przyczynia się do rozwoju próchnicy zębów.
D-Mannitol jest często spotykany w naturze, np. w oliwkach, glonach morskich czy cebuli. Warto wiedzieć o tym, że D-galaktitol jest szkodliwy. Schorzenie nazwane galaktozemią, wywołane brakiem enzymu metabolizującego galaktozę prowadzi do nagromadzenia się galaktitolu u niemowląt. Nie leczona galaktozemia powoduje niedorozwój umysłowy i w końcu śmierć. Obecność galaktitolu w oku prowadzi do zaćmy.
5. Azotowe pochodne cukrów
W czasach, kiedy nie znano spektralnych metod badania związków organicznych oznaczanie budowy i identyfikacja cukrów opierała się głównie na tworzeniu ich pochodnym i utlenianiu kwasem nadjodowym. Duże znaczenie w identyfikacji cukrów, podobnie jak i innych związków karbonylowych, miały pochodne azotowe, w tym np. fenylohydrazony. Powstają one jak wiadomo w reakcji związku karbonylowego z fenylohydrazyną.
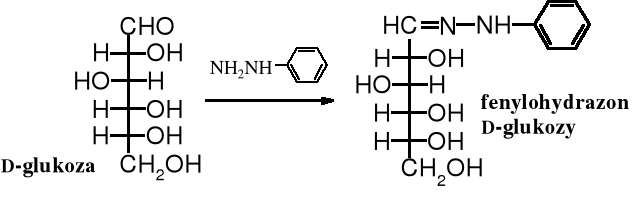
Fenylohydrazyna użyta w nadmiarze w reakcji z cukrami daje specyficzne produkty - 1,2-difenylohydrazony, zwane osazonami. W pierwszym etapie reakcji powstaje fenylohydrazon, po czym zostaje on na sąsiednim atomie węgla utleniony nadmiarem fenylohydrazyny do oksyfenylohydrazonu. Ten z kolei z trzecią cząsteczką fenylohydrazyny tworzy 1,2-difenylohydrazon, czyli osazon.
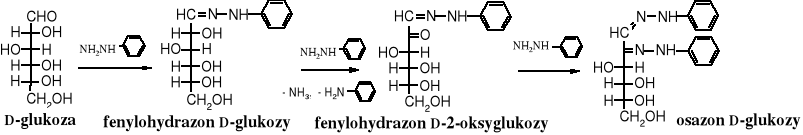
Warto zwrócić uwagę, że epimery, np. D-glukozy, D-mannozy i D-fruktozy tworzą ten sam osazon.
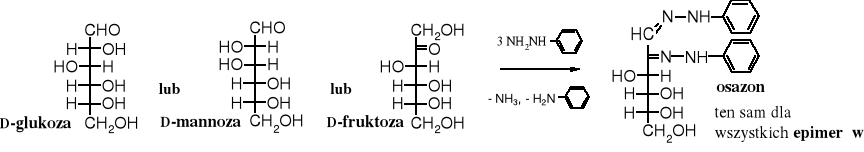
6. Skracanie i przedłużanie łańcucha węglowego cukrów
Cząsteczki cukrów można rozbudowywać, tak żeby np. z pentoz otrzymać heksozy, można je degradować, np. heksozy do pentoz, a pentozy do tetroz, można również aldozy przekształcać w ketozy i odwrotnie. Te reakcje zostały opracowane w celu umożliwienia otrzymywania cukrów rzadko spotykanych w naturze z cukrów powszechnie dostępnych lub, na które jest największe zapotrzebowanie. Najbardziej znaną transformacją jest enzymatyczna izomeryzacja D-glukozy do D-fruktozy. Jest to proces prowadzony na dużą przemysłową skalę, ponieważ D-glukoza otrzymywana poprzez hydrolizę skrobi (kukurydzianej lub ziemniaczanej) jest tania, a D-fruktoza jest ponad pięć razy słodsza od cukrozy. Zastąpienie cukrozy przez D-fruktozę do słodzenia napojów lub wyrobów cukierniczych pozwala na znaczne obniżenie kaloryczności tych produktów spożywczych.
6. Acylowanie
Acylowanie jest przykładem reaktywności grup hydroksylowych (alkoholowych) występujących w cząsteczkach cukrów. Do acylowania cukrów najczęściej stosuje się bezwodniki; produktami są estry. W zależności od warunków acetylowania D-glukozy bezwodnikiem octowym powstaje anomer (w środowisku lekko kwaśnym od ZnCl2) lub (w środowisku lekko zasadowym od AcONa).
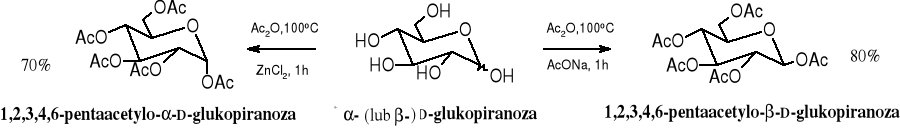
Reszty octanowe można traktować jako czasowe grupy ochronne. Usuwa się je najłatwiej w wyniku metanolizy katalizowanej metanolanem sodu.
Zadanie: napisz schemat reakcji usuwania grup octanowych z 1,2,3,4,6-pentaacetylo--D-glukopiranozy.
Do czasowej osłony grup hydroksylowych cukrów stosuje się też inne reszty acylowe, np. borany, fenyloborany czy węglany. Cukry w stanie naturalnym występują często w postaci fosforanów, np. w DNA czy RNA.
7. Alkilowanie
W wyniku reakcji cukrów jodkiem metylu tworzą się etery metylowe. Alkilowanie cukrów zachodzi łatwiej niż zwykłych alkoholi, ponieważ atomy wodorów grup hydroksylowych w cukrach są bardziej kwaśne niż w alkoholach izolowanych.
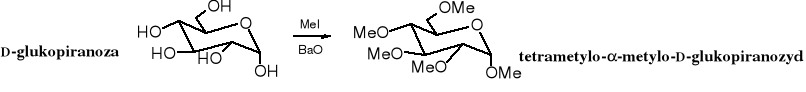
Zazwyczaj powstaje mieszanina anomerów. W nazwie permetylowanego cukru często grupę metylową przy glikozydowym atomie węgla wyodrębnia się i zmienia się końcówkę z -oza na -ozyd, dla podkreślenia, że jest to glikozyd, tzn. pochodna cukru będąca acetalem, a nie hemiacetalem, jak wolne cukry.
Dzięki podwyższonej kwasowości grup hydroksylowych cukry można metylować diazometanem.
8. Otrzymywanie glikozydów
W określonych warunkach cukier można przekształcić w glikozyd (acetal) poprzez alkilowanie wyłącznie glikozydowego atomu tlenu. Glikozydy powstają w reakcji cukru z alkoholem w obecności mocnych, bezwodnych kwasów jako katalizatorów. Produkt jest zwykle mieszaniną anomerów.
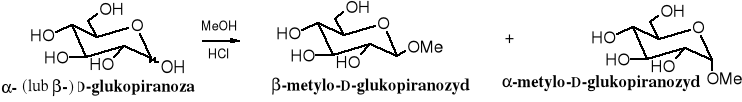
W podobny sposób powstaje glikozyd benzylowy. W podanych warunkach, niezależnie od konfiguracji substratu, otrzymuje się głównie anomer
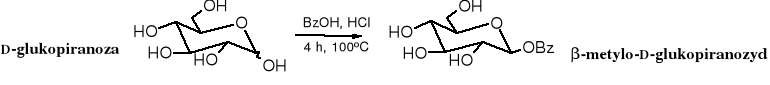
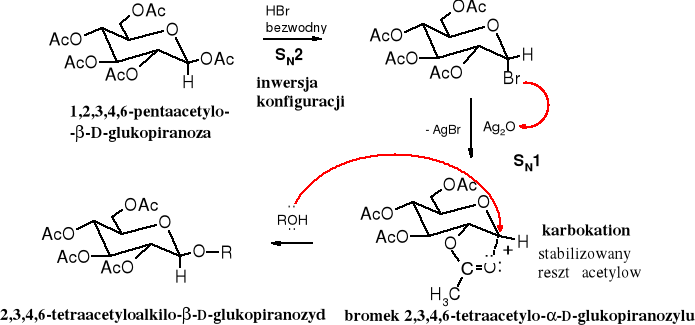
Dogodnymi substratami do syntezy glikozydów są chronione halogenki glikozylowe (chlorki bądź bromki). Powstają one w reakcji pentaacetylopiranoz z bezwodnym halogenowodorem. Reakcja alkoholizy halogenku glikozylowego biegnie nie tylko łatwo, ale i stereoselektynie (z inwersją konfiguracji), prowadzi więc do czystego anomeru.
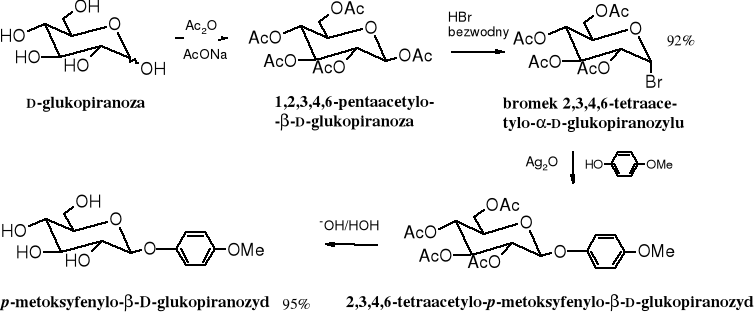
Inwersję konfiguracji podczas alkoholizy halogenku glikozylowego tłumaczy się oderwaniem anionu halogenkowego pod wpływem Ag2O i utworzeniem karbokationu stabilizowanego grupą acetylową z sąsiedniego atomu węgla. Dalsza stabilizacja karbokationu następuje w wyniku addycji cząsteczki alkoholu. Addycja ta jest możliwa tylko od strony przeciwnej w stosunku do reszty acetylowej.
Glikozydy są selektywnie hydrolizowane przez enzymy. Wydobywana z drożdży -glikozydaza hydrolizuje glikozydy , podobnie jak maltaza wytwarzana w kiełkujących ziarnach (w słodzie), a anomery rozkłada -glikozydaza, zwana również emulsyną. Znajduje się ona w gorzkich migdałach. Lizozym natomiast hydrolizuje oba izomery.
Glikozydy, jako acetale różnią się właściwościami chemicznymi w stosunku do wolnych cukrów, które są hemiacetalami i zachowują się jak związki zawierające grupę karbonylową. Glikozydy mają zablokowana grupę karbonylową, dlatego nie ulegają mutarotacji, nie epimeryzują, są odporne na utlenianie i redukcję, nie tworzą pochodnych azotowych, np. osazonów. W środowisku kwaśnym łatwo jednak hydrolizują i tym samym odzyskują właściwości typowe dla cukrów.
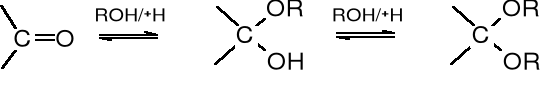
związek karbonylowy hemiacetal acetal
Oprócz O-glikozydów znane są także N-glikozydy i S-glikozydy, tzn. związki, w których alkil lub aryl połączone są z glikozydowym atomem węgla reszty cukrowej poprzez atom azotu lub siarki. W ten sposób powstają glikoproteiny, cukrowe analogi białek. Część cukrowa jest w nich przyłączona do łańcucha białkowego za pomocą wiązania O- lub S-glikozydowego. To wiązanie tworzy się pomiędzy cząsteczką cukru, a znajdującymi się w łańcuchu białkowym resztami seryny lub cysteiny.
OLIGOCUKRY
Do najbardziej znanych oligocukrów należą dicukry: maltoza (cukier słodowy), celobioza (powtarzająca się jednostka celulozy), laktoza (cukier mleczny) i cukroza (sacharoza, czyli cukier spożywczy). Maltoza i celobioza składają się z dwóch reszt D-glukozy, połączonych z sobą 1,4. Różnią się konfiguracją wiązania glikozydowego: w maltozie jest , a w celobiozie .
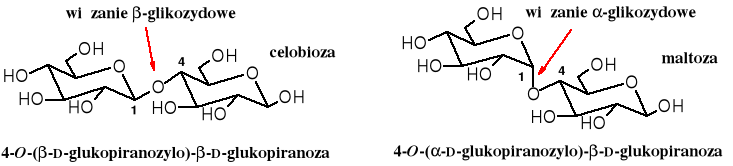
Zadanie: w jaki sposób można stwierdzić konfigurację przy glikozydowym atomie węgla w celobiozie i maltozie?
Oba powyższe dicukry zachowują większość właściwości monocukrów (aldoz), np. ulegają mutarotacji i utlenieniu, tworzą glikozydy i osazony.
Maltoza powstaje ze skrobi w kiełkujących ziarnach (w słodzie). Podczas kiełkowania uaktywnia się enzym zwany maltazą, który hydrolizuje skrobię. Celobioza nie występuje w stanie wolnym, można ją otrzymać z celulozy poprzez enzymatyczny rozkład lub ostrożną hydrolizę chemiczną.
Laktoza jest złożona z reszt D-galaktozy i D-glukozy, które powiązane są z sobą w sposób -1,4, przy czym wolna grupa glikozydowa należy do D-glukozy. Zawartość laktozy w świeżym mleku dochodzi do kilku procent. Kwaśnienie mleka polega na fermentacyjnym utlenieniu laktozy do kwasu mlekowego. Wytrąca się przy tym kazeina (białko mleka), ponieważ środowisku kwaśnym jest ona nierozpuszczalna w wodzie. Proces kwaszenia mleka (również kapusty czy ogórków) zachodzi pod wpływem bakterii. Zakwaszenie mleka kwasem, np. cytrynowym też powoduje wytrącenie kazeiny, ale w mleku (serwatce) pozostaje niezmieniona laktoza.
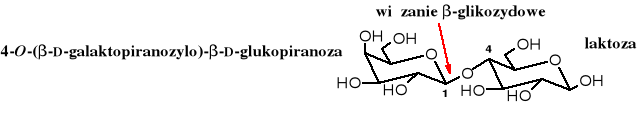
Podobnie jak dwa poprzednio omówione dicukry laktoza jest cukrem redukującym, ulega mutarotacji i tworzy glikozydy oraz osazony.
Pytanie: co to znaczy, że laktoza ulega mutarotacji? Jak poznać, która składowa laktozy ma wolną grupę glikozydową?
Laktoza, składnik mleka ulega w przewodzie pokarmowym enzymatycznej hydrolizie do wolnych cukrów: D-galaktozy i D-glukozy. U niektórych ludzi, częściej u dorosłych, zdarza się, że nie mają oni enzymu koniecznego do tej hydrolizy i dla nich mleko słodkie jest szkodliwe. Mleko naturalnie skwaszone i wyroby z niego (np. twarożek) nie zawierają laktozy i mogą być bezpiecznie spożywane przez osoby uczulone na nią.
Cukrem, z którym najczęściej spotykamy się w życiu codziennym jest cukroza, zwana też sacharozą. Pozyskuje się ją w wielkości wielu milionów ton rocznie z trzciny cukrowej (w krajach tropikalnych) i z buraków cukrowych (w strefie umiarkowanej). Cząsteczka cukrozy składa się D-glukozy i D-fruktozy, które połączone są z sobą w sposób -1--2. W tak połączonych cząsteczkach tych cukrów obie grupy glikozydowe są zablokowane, uczestniczą bowiem w tworzeniu wiązania glikozydowego. Z tego powodu cukroza jest cukrem nieredukującym, nie ulega też mutarotacji i nie tworzy osazonów. Cukrozę można nazwać 2-O-(-D-glukopiranozylo)--D-fruktofuranozą lub 1-O-(-D-fruktofuranozylo)--D-glukopiranozą.
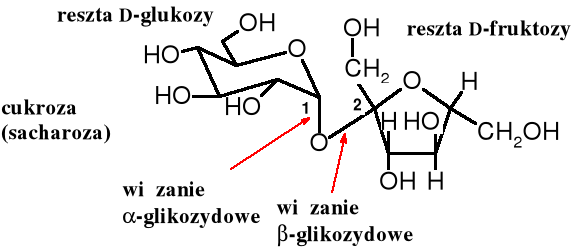
Zhydrolizowana cukroza pod względem składu przypomina miód - zawiera bowiem w podobnych ilościach D-glukozę i D-fruktozę. Taki hydrolizat nosi nazwę miodu sztucznego lub cukru konwertowanego.
POLICUKRY
Policukry są bardzo rozpowszechnione w przyrodzie. Celuloza stanowi 50% suchej masy drewna, a nawet 90% surowej bawełny. W suchych liściach jej zawartość dochodzi do 20%. Celuloza stanowi materiał budulcowy szkieletu wielu roślin. Pod względem chemicznym jest liniowym polimerem D-glukozy, przy czym stopień polimeryzacji w zależności od źródła waha się od kilkuset do kilkunastu tysięcy. Powtarzającą się jednostkę w łańcuchu celulozy jest dicukier - celobioza, w której reszty glukozy powiązane są z sobą wiązaniem glikozydowym -1,4. Jest powszechnie wykorzystywana przez ludzi, do wytwarzania naturalnych włókien (bawełnianych), do przetwarzania na papier, nitrocelulozę, acetylocelulozę, karboksycelulozę i włókna syntetyczne, tzw. wiskozowe.
Skrobia jest także polimerem glukozy, z tym że monomery w niej powiązane są głównie wiązaniami glikozydowymi -1,4. Nie jest to substancja jednorodna, bowiem składa się amylozy i amylopektyny. Amyloza jest polimerem liniowym tworzącym spiralne łańcuchy połączone w pęczki. Amylopeptyna jest polimerem rozgałęzionym. Boczne łańcuchy oligomerowe są dołączone do głównego łańcucha wiązaniami -1,6.
Policukrami są także roślinne: pektyny, gumy, dekstrany oraz zwierzęce: glikogen czy chityna. Glikogen ma podobną strukturę jak skrobia i pełni rolę magazynu energii chemicznej zwierząt, a chityna, polimer N-acetyloglukozoaminy, tworzy mechaniczną osłonę (pancerz) miękkich części owadów i skorupiaków.
1
Wyszukiwarka
Podobne podstrony:
22. Hydroksykwasy i halogenokwasy, Studia, Technologia chemiczna, Wykład I
Podstawy chemii organicznej - wstęp, Studia, Technologia chemiczna, Wykład I
11. Tiole i sulfidy, Studia, Technologia chemiczna, Wykład I
23. Kwas weglowy, Studia, Technologia chemiczna, Wykład I
12. Fenole (2), Studia, Technologia chemiczna, Wykład I
12. Fenole (1), Studia, Technologia chemiczna, Wykład I
Otrzymywanie wapna palonego, materiały naukowe do szkół i na studia, technologia chemiczna sprawozda
20. Oznaczanie zawartosci wody w cialach stalych i cieczach, materiały naukowe do szkół i na studia,
pytania na zaliczenie-zagrożenia ekologiczne, Studia, Technologia Chemiczna, I stopień, PK, II semes
wykaz cwiczen, materiały naukowe do szkół i na studia, technologia chemiczna sprawozdania
16. Oznaczanie zawartosci tluszczu w nasionach oleistych, materiały naukowe do szkół i na studia, te
otrzymanie żywicy fenolowo-formaldehydowej, materiały naukowe do szkół i na studia, technologia chem
15. Otrzymywanie polistyrenu metoda perelkowa, materiały naukowe do szkół i na studia, technologia c
Węgle aktywne, Studia, Technologia chemiczna, Różne
Wnioski wapno palone, materiały naukowe do szkół i na studia, technologia chemiczna sprawozdania, wa
Technologia chem - pyt na egz, Politechnika Wrocławska- Wydział Chemiczny (W3), technologia chemiczn
więcej podobnych podstron