12. F E N O L E
Fenolami nazywane są areny zawierające grupę hydroksylową -OH związaną bezpośrednio z pierścieniem aromatycznym. Podobnie jak w enolach atom tlenu grupy hydroksylowej przyłączony jest w nich do atomu węgla o hybrydyzacji sp2, jednak w przeciwieństwie do enoli, które są zwykle nietrwałe, gdyż ulegają przekształceniu w związki karbonylowe, fenole w większości są trwałe; należą do nielicznych trwałych enoli.
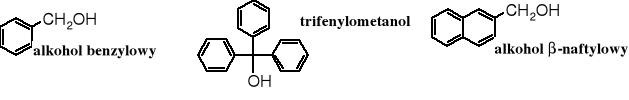
Do fenoli nie są zaliczane areny zawierające grupę -OH związaną z atomem węgla o hybrydyzacji sp3 (w łańcuchu bocznym); te związki noszą nazwę alkoholi aromatycznych, ich reprezentantem jest alkohol benzylowy.
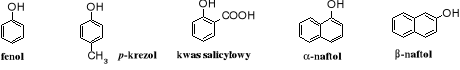
Przykłady fenoli
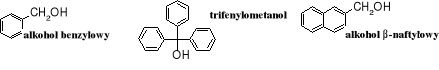
i alkoholi aromatycznych
Warto zwrócić uwagę, że alkohol benzylowy jest izomerem krezoli.
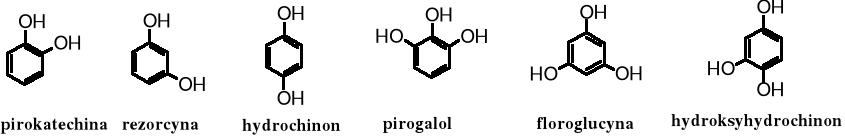
Fenole wielowodorotlenowe
12.1 Występowanie w przyrodzie
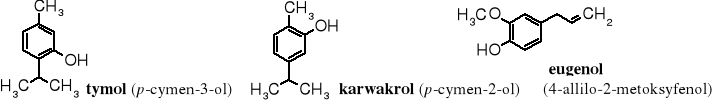
Fenole są popularnymi związkami naturalnymi, chociaż nie występują w dużym stężeniu, głównie; na szczęście, gdyż są bardzo toksyczne. Towarzyszą, np. terpenom w niektórych olejkach eterycznych. Do najbardziej znanych należą tymol i karwakrol z grupy cymenoli. Fenole nie są zaliczane do terpenów. Tymol znajduje się w macierzance, tymianku i innych ziołach. Karwakrol zaś w olejku oregano i cząbrze. Tymol stosowany jest jako środek dezynfekcyjny oraz do zwalczania robaczycy; jest 25 razy aktywniejszy od fenolu w działaniu przeciwbakteryjnym, głównie z uwagi na wyższą hydrofobowość. Eugenol nadaje przyjemny zapach goździkom.
Do popularnych fenoli naturalnych należy kwas salicylowy, aldehyd salicylowy (główny składnik chińskiego olejku cynamonowego - ang. cassia oil) i alkohol salicylowy (saligenina):
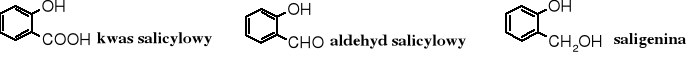
Wolny kwas salicylowy występuje w wielu roślinach, jeszcze bardziej rozpowszechnione są jego estry i glikozydy. Kwas salicylowy pełni rolę hormonu roślinnego, jako tzw. fytohormon - stymuluje wzrost pąków, kwiatów i korzeni. Ma działanie przeciwbakteryjne i przeciwgrzybowe. Pochodną kwasu salicylowego jest znany lek - aspiryna (kwas O-acetylosalicylowy).
Wiele fenoli naturalnych występuje w postaci estrów lub eterów (np. anizol - w anyżu)). Żeńskie hormony płciowe i morfina zawierają grupę fenolową.

Pośród hydroksyaminokwasów kodowanych na uwagę zasługuje L-tyrozyna, ze względu na obecność grupy fenolowej. Warto również wiedzieć, że niektóre antybiotyki też zawierają grupę fenolową, np. adriamycyna.
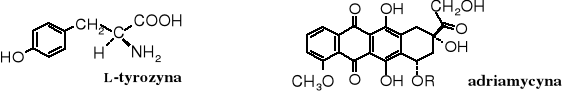
Alergogennymi składnikami trujących bluszczy (np. sumaka jadowitego) i trującego dębu (ang. poison-oak) są alkilokatechole (alkilodihydroksybenzeny), zwane toksykodendrolami (urusziolami). Są to alkilowe pochodne pirokatechiny, przy czym reszta alkilowa (lub alkenylowa) usytuowana w pozycji 3 zawiera 15 atomów węgla.
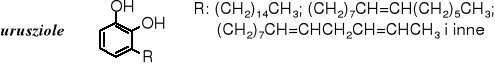
12.2 Źródła fenoli
Początkowo fenol i jego homologi wydobywano ze smoły pogazowej. Obecnie fenole wytarza się na dużą skalę przemysłową. Niektóre fenole izoluje się z materiału biologicznego.
12.2.1 Otrzymywanie fenolu
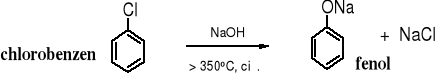
Znanych jest wiele reakcji prowadzących do fenolu. Część z nich stosowana do przemysłowej produkcji fenolu ma obecnie już tylko historyczne znaczenie. Do nich należą pierwsze metody wykorzystane w przemyśle, jedna zwana stapianiem, polegająca na termicznym rozkładzie benzenosulfonianu sodu i druga - oparta na zasadowej hydrolizie chlorobenzenu. W obu przypadkach powstawało dużo szkodliwych ścieków.
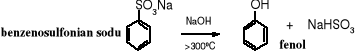
1. Stapianie
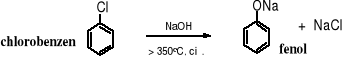
2. Alkaliczna hydroliza chlorobenzenu
3. Kwaśna hydroliza chlorobenzenu
Jedna ze współczesnych metod produkcji fenolu polega na hydrolizie chlorobenzenu w środowisku kwaśnym.
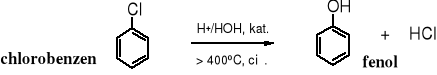
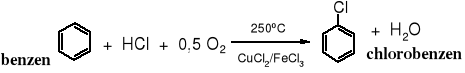
Produktem kwaśnej hydrolizy chlorobenzenu obok fenolu jest chlorowodór, który służy do otrzymywania chlorobenzenu w bezodpadowej technologii, tzw. chlorowanie utleniające.
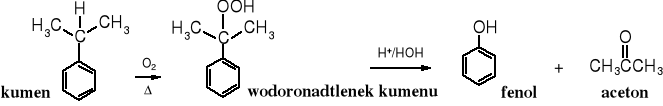
4. Metoda kumenowa:
Ważną sposobem produkcji fenolu jest utlenienie kumenu do wodoronadtlenku kumenu i jego rozkład do fenolu i acetonu. ä
5. Utlenianie toluenu
Jedna z najnowocześniejszych metod otrzymywania fenolu polega na utlenienie toluenu powietrzem. Istotną rolę w tym procesie pełni katalizator.
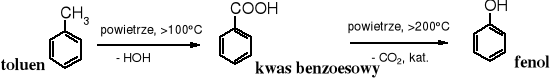
12.3 Właściwości fizykochemiczne i fizjologiczne
Fenol jest bezbarwną (jasnoróżową) substancją krystaliczną (tt. 43oC., tw. 183oC), szybko jednak zmienia kolor pod wpływem pojawiających się produktów utlenienia, początkowo różowy staje się ciemno-brunatny. Jest higroskopijny. W zimnej wodzie rozpuszcza się umiarkowanie (8 g w 100 ml w 15oC), ale wraz ze wzrostem temperatury jego rozpuszczalność szybko rośnie i powyżej 65oC miesza się z wodą w każdym stosunku. Podobnie w etanolu, eterze czy benzenie rozpuszcza się w każdej ilości tych rozpuszczalników. Jego roztwory, nawet rozcieńczone stają się czerwonofioletowe w obecności FeCl3, krezole w tych warunkach zabarwiają się na niebiesko, a wiele innych fenoli na zielono. Jest to test na wykrywanie fenoli.
Fenol należy do bardzo toksycznych związków, ma właściwości bakteriobójcze i przez długi okres czasu, pod nazwą krezolu był stosowany jako popularny środek dezynfekujący. Obecnie nowoczesne, bardziej skuteczne preparaty, które są mniej niebezpieczne i nie tak cuchnące jak fenol całkowicie go wyparły z tej roli. Na skórze po kontakcie z fenolem tworzą się trudno gojące pęcherze. Krezole mają silniejsze działanie bakteriobójcze i też były stosowane jako środki dezynfekujące (lizol). Tymol, jeszcze silniejszy preparat bakteriobójczy znalazł zastosowanie w leczeniu zębów - do wyjaławiania oczyszczonych ubytków przed ich wypełnieniem. Silniejsze bakteriobójcze działanie tymolu wynika z jego wysokiej lipofilowości - łatwiej przenika przez błonę komórkową niż hydrofilowy fenol.
12.4 Właściwości kwasowo-zasadowe
Fenole są silniejszymi kwasami niż alkohole; pKa fenolu wynosi 9,9, podczas gdy etanolu 16, a cykloheksanolu 17.
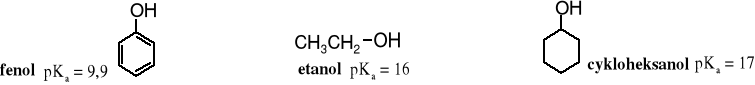
W reakcji fenolu z wodnymi roztworami wodorotlenków alkalicznych tworzą się fenolany.
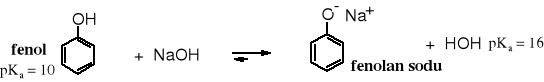
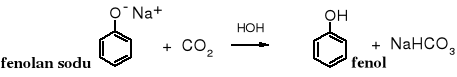
Fenolany, jako sole słabych kwasów hydrolizują częściowo w wodnych roztworach i przez to ich odczyn jest zasadowy. Fenol z fenolanów jest wypierany ditlenkiem węgla, ponieważ kwas węglowy jest silniejszym kwasem niż fenol. Z tej samej przyczyny fenol nie wypiera CO2 z węglanów.
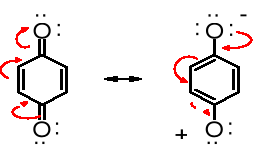
Przyczyną podwyższonej kwasowości fenoli w porównaniu do alkoholi jest mezomeryczna stabilizacja jonu fenolanowego
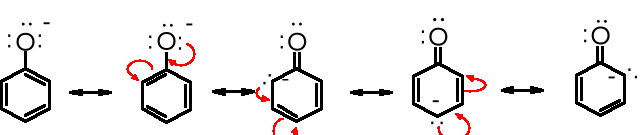
Duży wpływ na kwasowość fenoli wywierają podstawniki obecne w pierścieniu. Mogą one oddziaływać mezomerycznie lub indukcyjnie. Efekt mezomeryczny jest skuteczny z położenia orto- lub/i para-, a siła efektu indukcyjnego zmniejsza się wraz ze wzrostem odległości od grupy fenolowej.
Grupy elektrodonorowe wykazujące efekt +M (EDG), np. -CH3, -OCH3, -NH2, -NHR czy -NR2 obniżają kwasowość fenoli, natomiast grupy o efekcie -M (EWG), np. halogeny, -NO2, -COOH i -CN zwiększają moc kwasową fenoli.

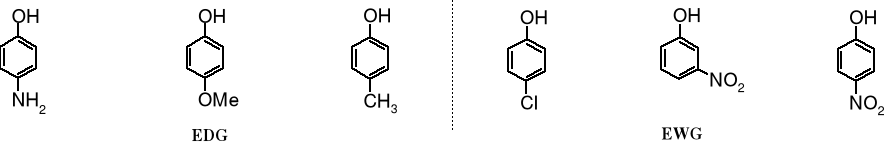
pKa: aminofenol 10,5 p-metoksyfenol 10,2 p-metylofenol 10,2 p-chlorofenol 9,4 m-nitrofenol 8,3 p-nitrofenol 7,1
Na przykładzie nitrofenoli widać, że w przypadku p-nitrofenolu efekty indukcyjny i mezomeryczny (-M i -I) sumują się, a dla m-nitrofenolu obserwowany jest jedynie efekt -I.
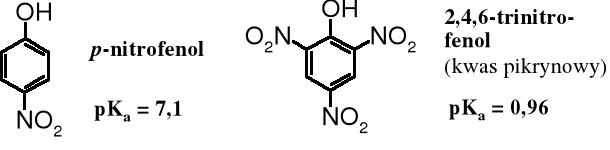
Każda dodatkowa, przyłączona do pierścienia grupa o zgodnym efekcie zwiększa oddziaływanie na kwasowość fenoli:
12.5 Czynniki wpływające na kwasowość związków organicznych
Rodzaj atomu związanego z atomem wodoru
wraz ze wzrostem liczby atomowej pierwiastka związanego z kwaśnym atomem wodoru
rośnie kwasowość związku, np. tiole są silniejszymi kwasami niż alkohole;
Rezonans
delokalizacja ujemnego ładunku anionu powstałego po oderwaniu protonu zwiększa
kwasowość; fenole są silniejszymi kwasami niż alkohole
Grupy sąsiadujące
grupy wyciągające elektrony (-I lub/i -M) zwiększają kwasowość;
grupy oddające elektrony (+I lub/i +M) obniżają kwasowość.
12.6 Właściwości chemiczne fenoli
12.6.1 Reakcje na grupie hydroksylowej
1. Alkilowanie
W wyniku reakcji fenolanów z odczynnikami alkilującymi powstają etery alkilowo-arylowe.
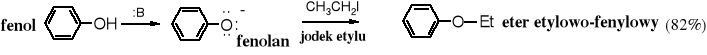
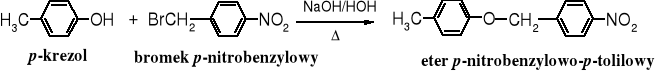

o-Nitrofenol jest na tyle silnym kwasem, że do przekształcenia go w fenolan wystarczy węglan sodu lub potasu.
2. Acylowanie
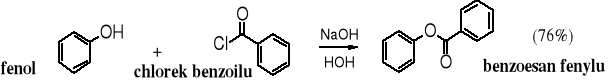
Fenole podobnie jak alkohole łatwo ulegają acylowaniu tworząc odpowiednie estry. Do acylowania stosuje się bezwodniki lub chlorki kwasowe. Estry fenylowe można też otrzymywać zgodnie z reakcją estryfikacji Fischera, tzn. poprzez działanie kwasami na fenole, przy czym usuwanie wody ze środowiska reakcji, korzystnie azeotropowo, ułatwia przesunięcie równowagi na prawo. Przykładem może być otrzymywanie estru fenylowego w reakcji estryfikacji fenolu kwasem benzoesowym.
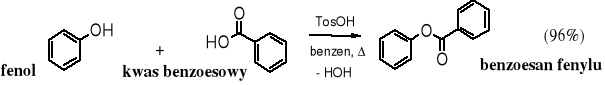
Procedura acylowania fenoli (prowadząca do estrów) lub acylowania amin aromatycznych (prowadząca do amidów) polegająca na wytrząsaniu tych substratów w środowisku zasadowym z bezwodnikami lub halogenkami kwasowymi nosi nazwę reakcji Schottena-Baumanna.
3. Reakcje z halogenkami fosforu
Fenole inaczej reagują z halogenkami fosforu niż alkohole. W alkoholach pod wpływem PCl3 lub PBr3 dochodzi do podstawienia grupy -OH halogenem, a fenole w tych warunkach tworzą estry kwasu fosforowego (III).
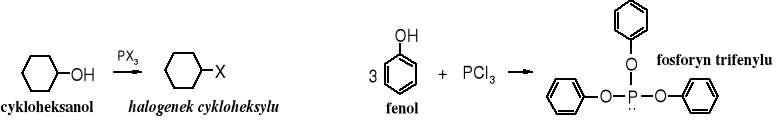
Fenole zawierające w pozycjach o- lub p- grupy elektroakceptorowe reagują z halogenkami fosforu podobnie jak alkohole, tzn. halogen podstawia funkcję hydroksylową. Tak więc z 2,4-dinitrofenolu można otrzymać 1-chloro-2,4-dinitrobenzen. W praktyce postępuje się odwrotnie, to raczej w reakcji hydrolizy 1-chloro-2,4-dinitrobenzenu otrzymuje się 2,4-dinitrofenol.
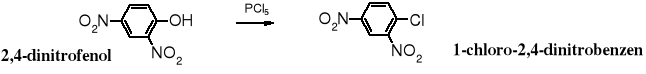
12.6.2 Utlenianie
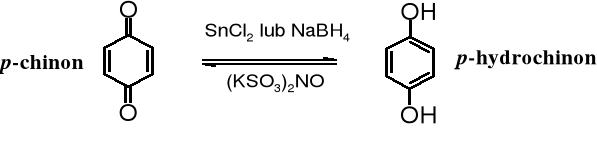
Utlenianie jest charakterystyczną reakcją fenoli. Pod wpływem wielu utleniaczy fenole zostają przekształcane w ugrupowania zwane chinonami. Z fenolu w tych warunkach powstaje 2,5-cykloheksadieno-1,4-dion (p-benzochinon, p-chinon lub krótko chinon). Do otrzymywania chinonów używa się tritlenku chromu w kwasie octowym, dichromianu sodu, a obecnie częściej soli Fremy'ego - nitrozodisulfonianu potasu, (KSO3)2NO.
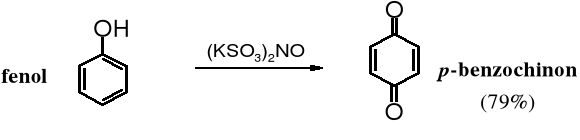
Chinony otrzymuje się również poprzez utlenienie amin aromatycznych.
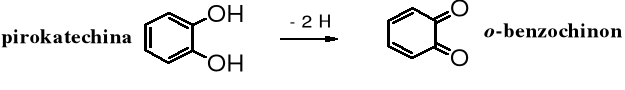
Izomeryczny o-benzochinon najłatwiej otrzymać poprzez utlenienie (odwodorowanie) pirokatechiny:
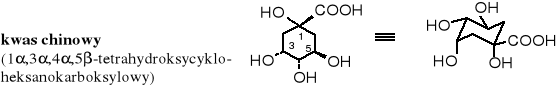
Nazwa chinon pochodzi od substratu - kwasu chinowego, z którego po raz pierwszy (w 1838 r.) poprzez jego utlenianie otrzymano p-chinon. Kwas chinowy jest bardzo rozpowszechniony w przyrodzie, występuje w korze drzewa chinowego, w ziarnach kawy, w sianie, w burakach cukrowych, w czarnych jagodach i innych roślinach.
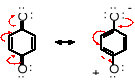
Z analizy struktury elektronowej chinonów wynika, że utraciły one aromatyczność, ponieważ pierścień chinonowy nie spełnia reguły Hückla - są w nim jedynie 4 elektrony , zamiast wymaganych 6. Dlaczego zatem chinony tworzą się łatwo, chociaż jak wiadomo utrata aromatyczności wiąże się ze zmniejszeniem stabilności energetycznej cząsteczki. Otóż w przypadku chinonów sprzężenie elektronów pierścienia zostaje rozszerzone na wiązania -C=O i wolne pary elektronowe atomów tlenu, co dodatkowo obniża energię potencjalną cząsteczki. Właściwości chemiczne chinonów jednoznacznie wskazują, że nie są one związkami aromatycznymi, ale nie zachowują się też jak typowe sprzężone diketony. Stanowią one odrębną klasę związków - chinonów.
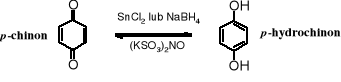
Chinony wraz ich z formą zredukowaną - hydrochinonami tworzą ważne z praktycznego punktu widzenia pary związków o właściwościach redoks (redukująco-utleniających). Te związki łatwo przechodzą jeden w drugi pod wpływem reduktorów i utleniaczy
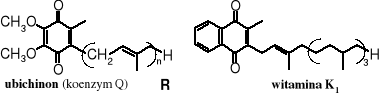
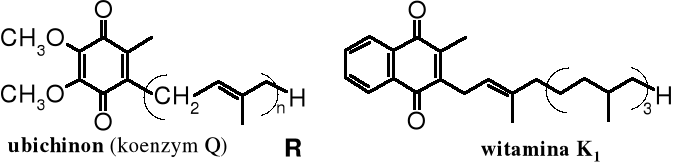
Układ p-chinonowy występuje w wielu związkach biologicznie czynnych, pełniąc ważną rolę w biochemicznych reakcjach redoks. Najbardziej znanymi należącymi do chinonów związkami, biorącymi udział w przemianach biochemicznych są ubichinony, zwane również koenzymami Q. Jest to grupa alkilowanych analogów p-chinonu różniących się długością łańcucha R, który z kolei jest oligomerem izoprenu o stopniu oligomeryzacji n = 1-10. Ubichinony w reakcjach biochemicznych działają jako utleniacze, biorą między innymi udział w procesach przenoszenia energii, w tym w oddychaniu. Na uwagę zasługuje podobieństwo strukturalne witaminy K (czynnika koagulacyjnego) z ubichinonami.
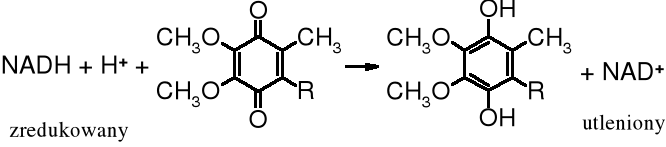
Rola ubichinonów w procesie oddychania polega na tym, że w I etapie utleniają w mitochondriach NADH (zredukowany dinukleotyd nikotynoamidoadeninowy) do NAD+ (utlenionego dinukleotydu), a same redukują się do układu hydrochinonowego, który z kolei w II etapie zostaje utleniony tlenem ponownie do ubichinonu. Tak więc w wieloetapowym procesie oddychania, którego celem jest dostarczenie organizmowi energii, ubichinony pełnią rolę pośrednika.
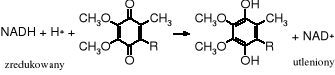
I etap - utlenienie NADH:
II etap - odtworzenie ubichinonów (utlenienie hydrochinonu):
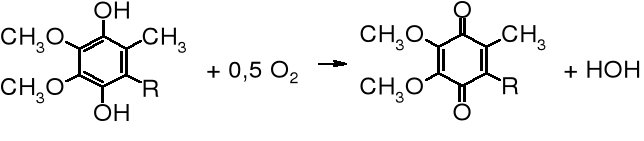
Sumarycznie wieloetapową reakcję utlenienia w mitochondriach można przestawić następującym równaniem:
ubichinony
NADH + 0,5 O2 + H+ ___→ NAD+ + HOH
Fenole łatwo ulegają różnorodnym, innym przemianom pod wpływem utleniaczy, między innymi rodnikowej (utleniającej) oligomeryzacji. Odpowiednie środowisko oraz substancje sprzyjające tworzeniu rodników ułatwiają przekształcanie fenoli w mezomerycznie stabililizowane rodniki fenoksylowe.
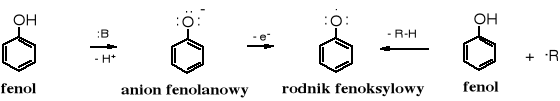
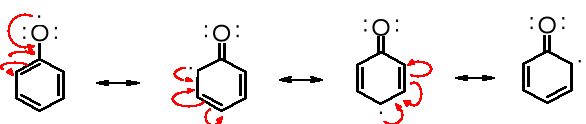
Mezomeria stabilizuje rodnik fenoksylowy, a tym samym ułatwia jego powstawanie:
Rodniki fenoksylowe dimeryzują do dihydroksybifenyli, które w ciągu kolejnych podobnych reakcji mogą dalej zwiększać masę cząsteczkową.
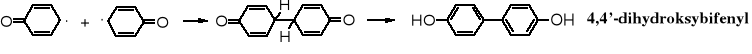
Podstawniki w położeniu orto- lub/i para- w pierścieniu fenolu, w tym reszty alkilowe, a szczególnie grupa t-butylowa dodatkowo zwiększają trwałość rodnika fenoksylowego. Już nie tylko efekt mezomeryczny stabilizuje tego rodzaju rodniki, ale zajęte miejsca reaktywne (o- i p-) i objętościowo duże grupy utrudniają rekombinację wolnych rodników. Do związków łatwo tworzących trwałe wolne rodniki należą 3,5-di-t-butylo-4-hydroksytoluen (BHT - butylated hydroxytoluene), 2-t-butylo-4-hydroksyanizol + 3-t-butylo-4-hydroksyanizol (BHA) i 2,4,6-tri-t-butylofenol.
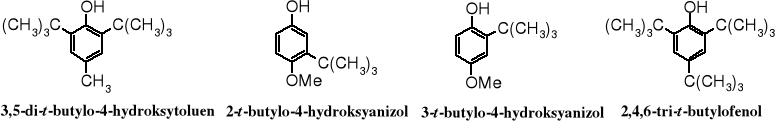
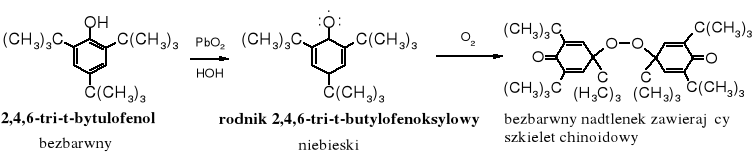
Utlenienie 2,4,6-tri-t-butylofenolu, np. za pomocą, np. PbO2 lub K3Fe(CN)6 prowadzi do otworzenia trwałego wolnego rodnika, który w roztworze przybiera niebieskie zabarwienie; w stanie stałym jest bezbarwny. W warunkach beztlenowych nie dimeryzuje, ale pod wpływem tlenu jego roztwory szybko tracą zabarwienie, przekształcając się w bezbarwny nadtlenek.
2-t-Butylo-4-hydroksyanizol jest dodawany do żywności jako antyutleniacz. Przeciwdziała on reakcjom utleniania, obniżającym wartość zdrowotną produktów żywnościowych.
12.6.3 Reakcje substytucji elektrofilowej SE
1. Bromowanie
Fenolowa grupa hydroksylowa należy do podstawników najsilniej uaktywniających pierścień aromatyczny na podstawienie SE. Tego typu reakcje z fenolami biegną szybciej i często w niższych temperaturach niż z arenami nieuaktywnionymi. Bromowanie i chlorowanie fenolu w wodzie biegnie bez katalizatora i nie zatrzymuje się na etapie monobromowania, lecz powstaje od razu 2,4,6-tribromo- lub trichlorofenol. W celu otrzymania monobromofenolu bromowanie należy przeprowadzić w niskiej temperaturze, w roztworze disiarczku węgla, a brom wprowadzać do mieszaniny reagującej wolno w postaci rozcieńczonego roztworu, tak żeby w trakcie bromowania nie było nadmiaru bromu.
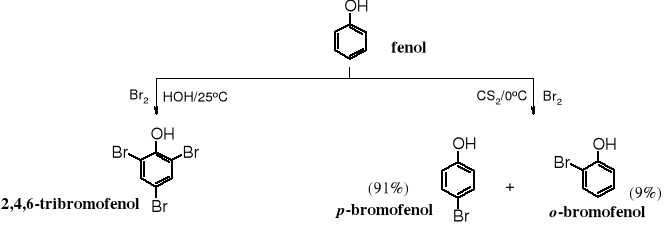
Czysty o-bromofenol można otrzymać w reakcji kilkustopniowej. W pierwszym etapie blokuje się pozycję para- i jedną orto- usuwalnymi resztami (np. grupami sulfonowymi), następnie przeprowadza bromowanie, po czym usuwa się grupy ochronne.
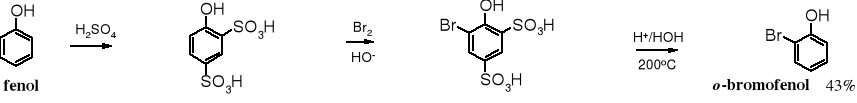
kwas 4-hydroksybenzeno-1,3-disulfonowy kwas 5-bromo-4-hydroksybenzeno-1,3-disulfonowy
Również bromowanie aniliny bromem w wodzie, podobnie jak bromowanie fenolu, prowadzi do 2,4,6-tribomoaniliny.
2. Alkilowanie
Reakcje alkilowania fenoli biegną łatwiej niż alkilowanie samego benzenu. W podwyższonej temperaturze fenol można alkilować bez katalizatora chlorkiem t-butylu lub t-pentylu.
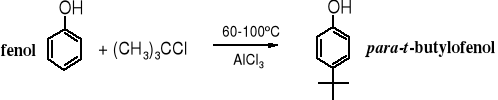
Do alkilowania fenoli służą też alkeny lub alkohole; reakcje alkoholami biegną tym łatwiej im wyżej rzędowy jest alkohol. Alkilowanie tymi odczynnikami prowadzi się w obecności kwasu siarkowego, fluorku boru lub chlorku glinu.
3. Nitrozowanie
Fenol, pod wpływem kwasu azotowego (III) zostaje przekształcony w nietrwały p-nitrozofenol, który ulega tautomerycznemu przegrupowaniu do oksymu p-chinonu. Czynnikiem nitrozującym jest jon nitrozoniowy NO+ powstający z kwasu azotowego (III).

4. Reakcja Kolbego (karboksylowanie Kolbego-Schmitta)
Herman Kolbe (1818-1884), ur. w Niemczech; doktorat w Getyndze, prof. uniwersytetów w Marburgu i Lipsku.
Robert Schmitt (1830-1898); ur. w Wippershain, Niemcy, doktorat w Marburgu, prof. Uniwersytetu w Dreźnie.
CO2 jest słabym elektrofilem i nie reaguje z benzenem, ale z silnie uaktywnionymi arenami jest w stanie wchodzić w reakcje SE. Do takich arenów należy anion fenolanowy. Fenolan sodu w podwyższonej temperaturze i pod zwiększonym ciśnieniem zostaje w reakcji z CO2 przekształcony w salicylan sodu, z którego po zakwaszeniu powstaje kwas salicylowy; substrat w syntezie aspiryny. Jest to przemysłowa reakcja otrzymywania kwasu salicylowego.
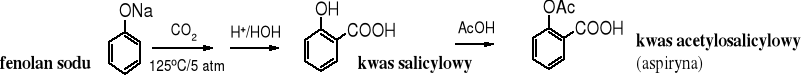
Mechanizm reakcji:
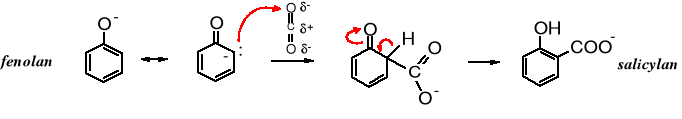
W reakcji karboksylowania fenolanu potasu ditlenkiem węgla powstaje mieszanina izomerów kwasu o- i p-hydroksybenzoesowego, z dużą przewagą izomeru para.
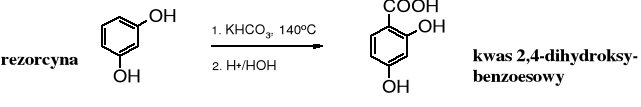
Polifenolany reagują z ditlenkiem węgla łatwiej niż fenole monohydroksylowe, np. rezorcyna ulega karboksylowaniu w obecności wodorowęglanów.
5. Reakcja Reimera-Tiemanna
Fenole, w obecności z chloroformem zostają w środowisku zasadowym przekształcane w hydroksyaldehydy, przy czym grupa formylowa (aldehydowa) zajmuje położenie orto- lub para- w stosunku do grupy -OH. Z orientacji tej można wywnioskować, że reakcja biegnie mechanizmem SE, jednak na pierwszy rzut oka trudno wskazać elektrofil biorący udział w tej reakcji. Elektrofilem jest dichlorokarben tworzący się z chloroformu pod wpływem zasady.
![]()
Dichlorokarben reaguje z fenolanem zgodnie z mechanizmem SE podstawiając atomy wodoru w pozycji orto- i para- w stosunku 4:1.
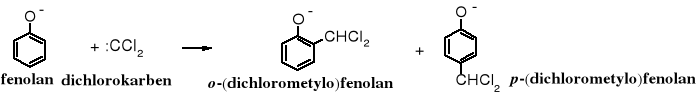
Ugrupowanie dichlorometylenowe szybko hydrolizuje w alkalicznym środowisku do funkcji aldehydowej.
Mechanizm reakcji:
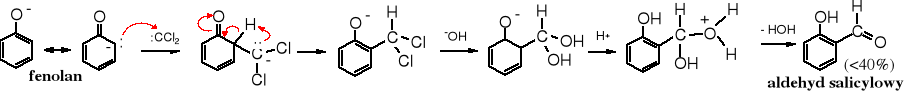
Wydajność aldehydu salicylowego otrzymywana tą metodą nie jest duża, nie przekracza bowiem 40%. Niska wydajność jest powodowana zarówno tworzeniem się izomeru para- (produkt niepożądany), jak i innych towarzyszących reakcji ubocznych; nie mniej jest to najtańszy i najczęściej stosowany sposób otrzymywania tego związku.
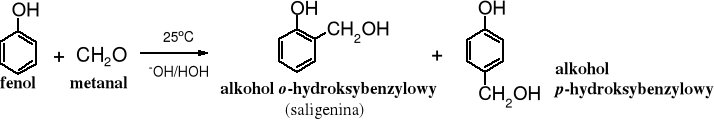
6. Reakcja fenoli z aldehydami
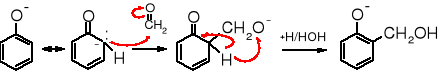
W środowisku zasadowym fenol bardzo łatwo reaguje z metanalem, powstają przy tym alkohole hydroksybenzylowe (orto- i para-):
W przypadku nadmiaru metanalu powstają produkty zawierające dwie lub trzy reszty hydroksymetylowe. Mechanizm reakcji przypomina pierwszy etap kondensacji aldolowej, w którym karboanion, w tym przypadku fenolan przyłącza się w formie mezomerycznej do karbonylowego atomu węgla, po czym następuje przemiana tautomeryczna:
W środowisku lekko kwaśnym, w temp. pokojowej w reakcji fenolu z metanalem też powstaje alkohol p-hydroksybenzylowy, ale on reaguje dalej kondensując z kolejną cząsteczką fenolu, w wyniku czego tworzy się bis(hydroksyfenylo)metan. Produktem tej kondensacji może być izomer orto-, jak i para-.
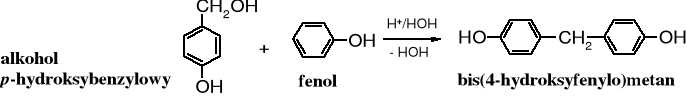
W podwyższonej temperaturze fenol w reakcji z metanalem ulega polikondesacji, której produkty znane, jako żywice fenolowoformaldehydowe, znalazły szerokie zastosowanie (nazwy techniczne - rezole, bakelit, rezit czy nowolak).
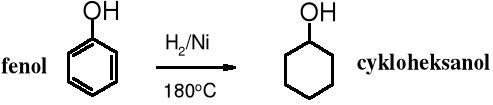
10.3.7 Uwodornienie fenolu
Fenol można uwodornić katalitycznie w obecności niklu.
12.7 Fenole o dużym znaczeniu praktycznym
Pośród wymienionych na początku fenoli naturalnych wiele znalazło praktycznie zastosowanie, np. witamina E czyli -tokoferol, tymol, tyrozyna, adriamycyna czy estriol; są one używane między innymi w lecznictwie. Duże znaczenie ma fenol - cenny surowiec w produkcji wielu związków. Jego analogi i ich pochodne znalazły zastosowanie jako herbicydy, pestycydy, środki do konserwacji drewna (przeciwgrzybowe i przeciwbakteryjne), żywice czy barwniki.
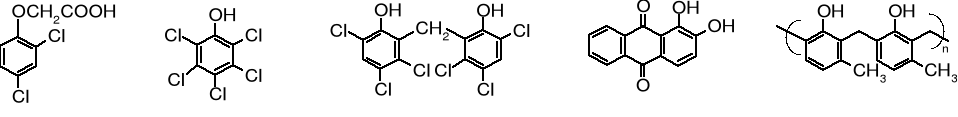
kwas 2,4-dichloro pentachlorofenol heksachlorofen alizaryna żywica nowolakowa
fenoksyoctowy (preparat do konserwacji (antyseptyk) czerwony barwnik do wełny stosowana do wytwarzania
(2,4-D; herbicyd) drewna) powłok polimerowych
w produkcji obwodów
scalonych
1
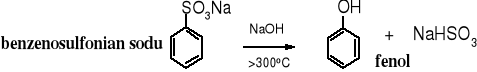
Wyszukiwarka
Podobne podstrony:
12. Fenole (2), Studia, Technologia chemiczna, Wykład I
22. Hydroksykwasy i halogenokwasy, Studia, Technologia chemiczna, Wykład I
24. Cukry, Studia, Technologia chemiczna, Wykład I
Podstawy chemii organicznej - wstęp, Studia, Technologia chemiczna, Wykład I
11. Tiole i sulfidy, Studia, Technologia chemiczna, Wykład I
23. Kwas weglowy, Studia, Technologia chemiczna, Wykład I
Otrzymywanie wapna palonego, materiały naukowe do szkół i na studia, technologia chemiczna sprawozda
20. Oznaczanie zawartosci wody w cialach stalych i cieczach, materiały naukowe do szkół i na studia,
pytania na zaliczenie-zagrożenia ekologiczne, Studia, Technologia Chemiczna, I stopień, PK, II semes
wykaz cwiczen, materiały naukowe do szkół i na studia, technologia chemiczna sprawozdania
16. Oznaczanie zawartosci tluszczu w nasionach oleistych, materiały naukowe do szkół i na studia, te
otrzymanie żywicy fenolowo-formaldehydowej, materiały naukowe do szkół i na studia, technologia chem
15. Otrzymywanie polistyrenu metoda perelkowa, materiały naukowe do szkół i na studia, technologia c
Węgle aktywne, Studia, Technologia chemiczna, Różne
Wnioski wapno palone, materiały naukowe do szkół i na studia, technologia chemiczna sprawozdania, wa
Technologia chem - pyt na egz, Politechnika Wrocławska- Wydział Chemiczny (W3), technologia chemiczn
więcej podobnych podstron