MATERIAŁOZNAWSTWO 7.10.2004
Materiałem- jest wszystko to co może być zastosowane przez człowieka w procesie produkcji.
Materiał to materia ( z cząstek elementarnych).
Materia składa się z 300 cząstek elementarnych.
Do najważniejszych należą:
6 kwarków i 6 leptonów.
Kwarki - nie są trwałe samodzielnie lecz wchodzą w skład innych cząstek po 2 lub 3.
Są spojone tzw. gluonami , które są kwantami energii.
Z kwarków zbudowane są protony i neutrony.
Leptony - to cząstki elementarne na które nie wpływają oddziaływania silne wywoływane przez
gluony.
Najbardziej rozpowszechnionym przykładem leptonu jest elektron.
PODSTAWOWE GRUPY MATERIAŁÓW
Materiał w pojęciu technicznym - to ciało stałe o właściwościach umożliwiających jego stosowanie przez człowieka do wytwarzania produktów.
Pierwszy podział materiałów:
Materiały naturalne
Przykładami materiałów naturalnych są : -drewno -materiały skalne -piasek itp.
|
Materiały inżynierskie
Przykładami materiałów inżynierskich są: -stal -materiały budowlane -stopy metali itp. |
Drugi podział materiałów dzieli je na 4 podstawowe grupy.
Podstawowe grupy materiałów inżynierskich.
Pośrednia grupa pomiędzy metalami i polimerami są szkła metaliczne.
O własnościach poszczególnych grup materiałów w dużej mierze decyduje istniejący w nich rodzaj wiązań międzyatomowych.
Do podstawowych wiązań międzyatomowych należą:
1 . wiązania jonowe
2 . wiązania kowalencyjne
3 . wiązania metaliczne
ad.1 NaCl ad.2 CH4
do do
jonu+ jonu+
do do
jonu+ jonu+
przyciąganie
ox - uwspólnione elektrony
Siła przyciągania Coulomba
Ad.3 metaliczne
Wiązania jonowe - mają miejsca wtedy gdy w wyniku utraty elektronów walencyjnych ( tych z ostatniej warstwy) przez jeden atom i przyłączenia ich do drugiego atomu powstają dwa jony elektro dodatni i elektro ujemny, które się wzajemnie przyciągają.
Wiązanie kowalencyjne - zwane też atomowym polega na tym ,że elektrony walencyjne pierwotnie różnych atomów tworzą pary elektronów należące wspólnie do jąder dwóch atomów.
Wiązania atomowe najczęściej występują w gazach ale posiadają je także diament ,krzem i niektóre inne ciała stałe.
Wiązania metaliczne - występują w dużych skupiskach atomów metalu ,które po zbliżeniu się na wystarczająco małą odległość charakterystyczną dla stałego stanu skupienia, oddają swoje elektrony walencyjne na rzecz całego zbioru atomów.
Elektrony walencyjne przemieszczają się swobodnie pomiędzy rdzeniami atomowymi i tworzą tzw. gaz elektronowy, dzięki niemu metale mają dobrą przewodność elektryczną.
METALE
Metale i ich stopy charakteryzuje dobre przewodnictwo cieplne i elektryczne oraz dodatni temperaturowy współczynnik rezystywności (oporowości).
Innymi charakterystycznymi cechami metali są: połysk metaliczny i plastyczność.
Plastyczność - to zdolność do trwałych odkształceń pod wpływem przyłożonych naprężeń.
Metale otrzymuje się z rud ( są najczęściej tlenkami metali ) .
Procesy metalurgiczne polegają zwykle na redukcji tlenków i ekstrakcji metali z rud oraz na rafinacji usuwającej pozostałe zanieczyszczenia.
Elementy metalowe otrzymuje się przez odlewanie ,przeróbkę plastyczną i metalurgię proszków.
Najbardziej wytrzymały materiał to diament - trudno poddaje się obróbce , jest twardy.
Stal jest ciągliwa , plastyczna i jednocześnie sprężysta.
Powierzchnie metali uszlachetnia się metodami inżynierii powierzchni.
POLIMERY
Polimery - zwane tworzywami sztucznymi ,plastikami .
Są to materiały organiczne złożone ze związków węgla. Oprócz węgla w skład tworzyw sztucznych wchodzą wodór, tlen, krzem, siarka, chlor, fluor.
Polimery to makrocząsteczki w których połączono wiązaniami kowalencyjnymi grupy atomów zwanych monomerami.
W skład polimerów wchodzą: - barwniki
- pigmenty
- katalizatory
- napełniacze
- zmiękczacze
- antyutleniacze
Najprostszym monomerem jest cząsteczka etylenu CH4 , natomiast przez polimeryzację otrzymuje się folię.
W monomerze etylenu jeden wodór zamieni się na grupę CH3 to otrzymuje się polipropylen.
Jeżeli wodór zamieni się na C6H5 to otrzymujemy polistylen.
Jeżeli wodór zamieni się na chlor to mamy polichlorek winylu.
Jeżeli wszystkie wodory w cząsteczce CH4 zamieni się na fluor to otrzymamy teflon.
Własności polimerów
- mają małą gęstość
- mają dobre izolacyjne własności cieplne i elektryczne
- słabo odbijają światło i na ogół są przezroczyste
Tworzywa możemy podzielić na:
-plastomery - charakteryzują się wydłużeniem względnym nie większym niż 200%.
Plastomery dzieli się na : - termoplastyczne
- termoutwardzalne
- elastomery - to tworzywa ,które charakteryzuje duże odkształcenie w temperaturze pokojowej.
CERAMIKA INŻYNIERSKA
Ceramika inżynierska obejmuje : cer metale, ceramikę porowatą , szkła, ceramikę szklaną.
Rodzaje wiązań między atomami występującymi w podstawowych grupach materiałów inżynierskich.
Energia wiązania w elektronowoltach na atom, jon, cząsteczkę
W przypadku : - diamentu 7,4 elektronowoltach
- krzemu 4,7 ev.
- wodór 0,52 ev.
- wolframu 8,08 ev.
- sól kuchenna 3,3 ev.
Najwyższą energię wiązania obserwuje się w wiązaniach kowalencyjnych i metalicznych, mniejszą w jonowych.
KOMPOZYTY
Materiały kompozytowe są połączeniami dwóch lub więcej odrębnych i nie rozpuszczających się
w sobie faz z których każda odpowiada innemu podstawowemu materiałowi inżynierskiemu zapewniającymi lepszy zespół własności i cech strukturalnych od właściwych dla każdego z materiałów składowych oddzielnie.
Klasy materiałów kompozytowych
Polimery mogą mieć osnowę metalową, polimerową i ceramiczną .Osnową mogą być też drobne cząstki , krótkie włókna, płytki.
Materiały ocenia się według kryteriów , o których decydują określone własności .
Kryteria ogólne :
- względny koszt
- gęstość
Kryteria mechaniczne:
- moduł sprężystości ( moduł Yauga ) : jak dalece sprężysty jest materiał, im wyższy tym mniejsze
odkształcenie pod wpływem obciążenia
- wytrzymałość
- odporność na pękanie ( udarność ) : odporność na gwałtowne przyłożenie obciążenia
- wskaźnik zmęczeniowy : bardzo wiele materiałów wytrzymuje bardzo duże statyczne obciążenia np. wał
silnika spalinowego
б
б
obciążenie pulsacyjne sytuacja gorsza dla materiału- zginamy w dwie strony
obciążenie zmienne obustronnie
Rm
107
Jest 107 cykli przy których max siła jest już ustalona (żeby sprawdzić jaka jest wytrzymałość na zmęczenie )
1. Kryteria cieplne :
- przewodność cieplna : może być mankamentem w materiałach izolacyjnych, ale w tulejach silnika
samochodowego jest przydatna , żeby szybko odprowadzać ciepło na zewnątrz
- dyfuzyjność : wędrówka cząsteczek jednego składnika do drugiego składnika na skutek różnicy
stężeń. Żeby przyśpieszyć dyfuzję stosuje się obróbkę cieplną metali.
Dyfuzja w wyższych temperaturach.
- pojemność cieplna : ile w jednostce masy lub objętości danego materiału można zmagazynować ciepło.
Jeżeli coś ma dużą pojemność cieplną będzie bardzo długo się rozgrzewać i bardzo
wolno to ciepło oddawać.
Jeżeli coś ma małą pojemność cieplną szybko się nagrzewa i szybko ciepło oddaje.
- temperatura topnienia: ma ogromne znaczenie w technice kosmicznej, w kosmosie zero bezwzględne.
- temperatura zeszklenia : stopiony materiał ceramiczny zamienia się w szkło
- współczynnik rozszerzalności cieplnej : różna rozszerzalność cieplna różnych elementów powoduje duże
naprężenia wewnętrzne.
- odporność na udary cieplne : odporność na gwałtowny wzrost temperatury.
- odporność na pełzanie : w normalnych warunkach tego zjawiska nie obserwujemy , można je
zaobserwować w warunkach podwyższonej temperatury.
Jedna z granic możliwości energii jądrowej (termojądrowej) .
Coś w wysokiej temp przy obciążeniach stałych wydłuża się.
2. Zużycie materiału ma miejsce podczas eksploatacji . Zazwyczaj to ścieranie
3. Odporność na korozję Odporność na pękanie :
(Najmniejszej)
Co ma małą gęstość: - ceramika porowata
(Najmniejszej) : - szkła
- Korek - drewno
-pianki polietanowe - ceramika inżynierska
-drewno - metale
-elastomery - stopy metali.
-polimery
-szkła
-metale
-stopy metali
Moduł sprężystości:
(Najmniejszej) : korek, elastomery, drewno, polimery inżynierskie, kompozyty, ceramika porowata, inż. stopy metali, ceramika inżynierska .
METALOZNAWSTWO 14.10.2004
1. Krystaliczna budowa metali
Ciała krystaliczne przechodząc ze stanu ciekłego w stan stały otrzymują strukturę o prawidłowym rozmieszczeniu atomów tworząc sieć krystaliczną.
Węzły sieci przestrzennej określają średnie położenie atomów dookoła których oscylują atomy ciała stałego krystalicznego.
Atomy są powiązane wiązaniami metalicznymi.
W węzłach sieci krystalicznej znajdują się zasadniczo jony dodatnie metalu, natomiast pewna ilość elektronów porusza się swobodnie pomiędzy tymi jonami tworząc tzw. gaz elektronowy.
Istnieją 3 elementarne sieci przestrzenne , w których krystalizują właśnie metale.
TYP A1 Komórka płasko- centrowana. TYP A2 Przestrzennie centrowana
a a
TYP A3 Heksagonalna zwarta
c
a
Odległość pomiędzy atomami w sieci zależy od najniższej energii potencjalnej jaką może mieć atom w danej sieci.
Ta odległość zależy również od parametru sieci.
Siły pomiędzy dwoma atomami w zależności od ich odległości.
Siła odpychania |
odpychanie
wypadkowa
Energia potencjalna |
|
przyciąganie
A0 odległość atomów a
Odległość pomiędzy atomami w sieci jest ustalona przy minimum energii potencjalnej atomów.
W sieci krystalicznej oprócz parametru sieci wyróżnia się również proste sieciowe , płaszczyzny sieciowe
i węzły sieciowe.
Proste sieciowe - łączą środki rdzeni atomowych
Węzły sieciowe - to przecięcia tych prostych.
Płaszczyzny sieciowe - to płaszczyzny, które zawierają co najmniej 2 proste sieciowe.
Komórki które mają atomy wyłącznie w narożach nazywa się prymitywnymi, jeśli natomiast mają atomy wewnątrz i na ścianach bocznych nazywa się komórkami złożonymi.
ALOTROPIA ALBO POLIMORFIZM
Niektóre metale w zależności od panujących warunków fizycznych takich, jak: temperatura, ciśnienie wykazują zdolność przegrupowywania swoich atomów tworząc odmienne sieci przestrzenne ( diament, grafit)
Cyna - dwie postacie alotropowe; 1 składnik do stopów lutowych , 2 szary proszek; w temp poniżej 18° C jest proszkiem, przy spadku temp stop odpadnie.
Dwie odmiany alotropowe mają:
- żelazo - bar
- nikiel - beryl
- kobalt - uran
- wolfram - cyrkon
- tytan
Trzy odmiany alotropowe mają : - chrom - wapń - lit
Podczas przejścia metalu z jednej odmiany alotropowej w drugą zachodzi skokowa zmiana energii wewnętrznej metalu i występuje tzw. ciepło przemiany alotropowej.
Jeśli przemiana zachodzi przy ochładzaniu to ciepło to jest wydzielane.
Jeśli przemiana zachodzi przy ogrzewaniu to ma miejsce pochłanianie ciepła przemiany alotropowej.
Przemianę alotropową zazwyczaj wywołuje zmiana temperatury . Może ją jednak wywołać stosowanie bardzo wysokich ciśnień.
KRZEPNIĘCIE METALI
Z ogólnych praw termodynamiki wynika, że trwałą postacią metalu jest ta postać , która w danych warunkach reprezentuje najmniejszą energię swobodną.
C
S - ciało stałe
C - ciecz
S S Tk - temp krzepnięcia
• Wyższą energię w tym zakresie ma ciecz
C a niższą ciało stałe
przechłodzenie Tk przegrzanie
Krzywa krystalizacji metalu Krzywa krzepnięcia metalu przechłodzonego
w układzie temp ( T ) i czas (τ ) do tp
t° t°
tk
tp
τ τ
Do czynników umożliwiających przechłodzenie metalu stopionego należą:
brak wstrząsów
czystość samego metalu
gładkość powierzchni formy.
Do czynników wpływających na przebieg krystalizacji należą:
szybkość tworzenia się zarodków krystalizacji
zarodkiem krystalizacji - nazywamy skupienie pewnej ilości komórek sieci krystalicznej
Szybkość tworzenia się zarodków mierzymy ilością zarodków tworzonych w jednostce objętości i w jednostce czasu.
na szybkość krystalizacji wpływa szybkość narastania warstw krystalicznych w pojedynczym
krysztale.
Szybkość ta dla :
Złota - 20 mm / min
Cyny - 192 mm / min
Ołowiu - 27 mm / min
Szybkość krystalizacji zależy od temperatury przechłodzenia, ale ta zależność jest dość złożona.
Szybkość krystalizacji
t
Temperatura przechłodzenia
wtrącenia obcej fazy stałej
Obca faza stała ( złożona z atomów innego metalu )może zastępować zarodki krystalizacji.
Przykładem jest otrzymywanie żeliwa modyfikowanego.
d) drgania ultradźwiękowe
Jeżeli je wprowadzimy to ułatwimy tworzenie się zarodków krystalizacji.
napięcie powierzchniowe
Jeżeli zmniejszymy napięcie powierzchniowe poprzez dodatki stopowe też możemy wpłynąć na krystalizację.
W czasie krzepnięcia kryształ nie narasta równomiernie we wszystkich kierunkach, ale krzepnąc tworzy struktury zwane dendrytami.
Dendryt tworzy się przez narastanie płaszczyzn o najgęstszym obsadzeniu atomami w kierunku maksymalnej szybkości krystalizacji .
W sieci płasko - centrycznej tymi płaszczyznami o największym obsadzeniu atomami są płaszczyzny sześcianu, w którym jest komórka elementarna.
Schemat szkieletu dendrytu. Schemat narastania płaszczyzn w kierunku
[100] - tworzenie się dendrytu.
[100]
[100]
[100]
Większość metali ma budowę polikrystaliczną tzn. , że złożona jest ze zlepka małych kryształów zwanych ziarnami o wymiarach od 10-3 do 10-5 mm.
Jednak w wielu dziedzinach techniki szczególnie w elektronice ogromne znaczenie mają monokryształy.
Metody uzyskiwania monokryształów
Metoda Czochralskiego 2. Metoda Bridgman
W tyglu osadzonym w piecu znajduje się Stosuje się tygiel oraz piec pierścieniowy. Tygiel
metal ,igła zawieszona na cięgnie zanurza zawieszony jest na cięgle i wypełniany stopionym metalem
się i wychodząc z metalu wyciąga i powoli wynurzany z pieca i zaczyna krzepnąć na
kryształ 0,2 - 0,4 mm. wierzchołku powstaje tylko jeden zarodek krystalizacji
i krzepnięcie we wszystkie strony
cięgno
tygiel
piec elektryczny
•
W obu metodach dąży się do tego aby w czasie krystalizacji powstał tylko jeden zarodek krystalizacji.
Strukturę metalu lub stopu otrzymaną podczas krystalizacji nazywa się strukturą pierwotną , ta struktura była później bardzo często zmieniana w wyniku obróbki cieplnej lub plastycznej.
WADY W BUDOWIE KRYSZTAŁÓW
Do wad w budowie krystalicznej metali zalicza się :
granice ziaren
tzw. luki lub pustki
przemieszczenia atomów
wtrącenia między węzłowe
strukturę mozaikową
strukturę pochodzenia
Wady te ilustrują następujące rysunki.
Schematy wad struktury krystalicznej
a) puste węzły b) przesunięcie atomu c) wtrącenie wśród węzłowe
°
°
°
d) struktura mozaikowa e) struktura pochodzenia
Małe ziaren polikryształów składają kierunki krystalizacji nie zachowywane
się z bloków krystalicznych skierowanych i tworzy się struktura pochodzenia
do siebie pod niewielkimi kątami
Wady bardzo obniżają wytrzymałość do pewnej gęstości, przy której wytrzymałość znów się podwyższa
wytrzymałość.
gęstość wad krystalicznych
warunki ziemskie
KRZEPNIĘCIE STOPÓW
Reguła faz Gibbsa:
Fazą - nazywamy część stopu dającą się od reszty wyodrębnić powierzchniami podziału jednorodną pod względem składu i struktury.
Najmniejsza część fazy musi mieć taką samą strukturę i taki sam skład jak reszta fazy.
Jeśli układ wieloskładnikowy i wielofazowy znajduje się w stanie równowagi termodynamicznej to obowiązuje następująca zależność :
S = n - c - f + p
gdzie: S- tzw. ilość stopni swobody czyli ilość zmiennych niezależnych tj. temperatura czy stężenie, które mogą zmieniać się bez naruszenia stanu równowagi.
n - ilość składników
c - ilość reakcji chemicznych
p - ilość czynników fizycznych wpływających na równowagę
Reguła faz dla stopów
W przypadku stopów nie ma właściwie reakcji chemicznych czyli c = 0 , natomiast wpływ ciśnienia można zaniedbać i wtedy jedynym czynnikiem istotnym jest temperatura czyli p = 1 i mamy:
S = n - f + 1
W stanie ciekłym metale mogą się w sobie rozpuszczać czyli mieszać na poziomie atomów albo tworzyć osobne fazy.
Podobnie jak w stanie stałym dwa metale mogą się ze sobą mieszać na poziomie atomowym tworząc wspólne sieci krystaliczne w których poszczególne węzły obsadzone są przez atomy jednego lub drugiego pierwiastka.
Wtedy mówimy o roztworze stałym metalu B w metalu A.
Rzadko spotyka się sytuację w której metale rozpuszczają się w sobie nawzajem w całym zakresie stężeń.
Z reguły mamy do czynienia z tzw. ograniczoną rozpuszczalnością w stanie stałym.
Krzepnięcie stopów metali o różnym składzie obrazują tzw. wykresy fazowe.
Podstawowym wykresem fazowym jest wykres ilustrujący krzepnięcie stopu metali A i B o wzajemnej nieograniczonej rozpuszczalności.
czas
c) struktury podczas i po skrzepnięciu w stanie równowagi.
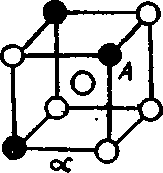
Górna linia na wykresie czyli L - likwidus , ponad tą linią znajduje się tylko ciekły metal.
Dolna linia nosi nazwę solidus - jest linią pod którą występuje tylko ciało stałe, tzw. roztwór α jednego metalu .
Pomiędzy liniami likwidus i solidus znajduje się stopiony metal, w którym pływają pojedyncze kryształy stopu metali A i B .
Czysty metal A krzepnie w temperaturze tA , czysty B w tB .
Stop 1 zaczyna krzepnąć w temperaturze t1L , a kończy w t1S .
Stop 2 zaczyna krzepnąć w t2L a kończy krzepnięcie w temperaturze t2S .
Linia likwidus wyznacza początek krzepnięcia stopu, a solidus koniec jego krzepnięcia .
Stop 1 zaczyna krzepnąć w t1L i początkowo tworzą się w nim kryształy roztworu stałego metalu B bogate w metal A .
W miarę spadku temperatury ciecz krzepnąca ubożeje w metal A i zmienia swój skład wzdłuż linii likwidus.
Ostatnie kryształy ( ostatnie warstwy kryształów krzepnących ) w temp. t1S mają skład odpowiadający przecięcia się linii poziomej temperatury z linią likwidus czyli są znacznie bogatsze w metal B niż na początku krzepnięcia .
Powoduje to niejednorodność kryształu niekorzystną z punktu widzenia cech użytkowych otrzymanego stopu.
RODAJE FAZ W STOPACH 21.10.2004r
Fazy występujące w stopach można podzielić na 3 następujące rodzaje :
metal czysty ciekły ( fazy składające się zawsze z tego samego pierwiastka )
metal czysty stały ( roztwór ciekły , roztwór stały oraz odmiany alotropowe )
odmiany alotropowe metalu ( fazy międzymetaliczne roztworów stałych )
Bardzo wiele roztopionych metali rozpuszcza się w sobie w fazie ciekłej tworząc jeden roztwór ciekły.
Taki roztwór jest całkowicie jednorodny czyli jego najdrobniejsza cząstka, którą mechanicznie można oddzielić od reszty jest taka sama , co do składu i budowy, jak pozostała część roztworu.
Analogicznie do roztworu ciekłego jednego metalu w drugim występują roztwory w stanie stałym, kiedy metal stały, zwany w tym wypadku rozpuszczalnikiem jest w stanie rozpuścić drugi metal, zwany metalem rozpuszczalnym.
Roztwory stałe, pod względem budowy, dzielą się na :
- roztwory stałe zaatomowe - zamiast atomu - roztwory stałe międzyatomowe
rozpuszczalnika występuje atom metalu
rozpuszczanego.
•
• •
Podwójny układ fazowy metali tworzących eutektykę
a) Krzywe termiczne b)układ podwójny
Często występuje sytuacja, w której dwa metale tworzą roztwór ciekły w całym zakresie stężeń, a nie są w stanie utworzyć roztworu stałego.
Krzepną wtedy oddzielnie, w rezultacie powstaje, po skrzepnięciu, stała mieszanina kryształów obu metali.
Mieszaniny takie wykazują zazwyczaj dla pewnego, ściśle określonego składu najniższą temperaturę krzepnięcia, która nazywa się temperaturą eutektyką .
Mieszaniny elektryczne maja zawsze strukturę drobnoziarnistą - pożądaną z punktu widzenia cech wytrzymałościowych stopu.
Stała temperatura krzepnięcia eutektyki wynika z reguły faz Gibbsa.
W punkcie eutektycznym E występują następujące fazy :
→ ciecz o składzie eutektycznym ( roztwór ciekły metalu A i B )
→ stały metal A ( kryształki )
→ stały metal B ( kryształki )
E S = 2-3+1 = 0 brak stopni swobody, nie może się zmienić ani skład, ani temperatura ,
dlatego krzepnięcie jest w stałej temperaturze.
Rozpatrzmy przebieg krzepnięcia stopu 1.
Stop 1 rozpoczyna krzepnięcie w temperaturze t1 i wykrystalizowuje czysty metal A.
Ciecz ubożeje w metal A i skład krzepnącej cieczy , wraz ze spadkiem temperatury, zmienia się wzdłuż linii likwidus.
Po osiągnięciu składu eutektycznego krzepnie już wyłącznie eutektyka obu metali.
OGRANICZONA ROZPUSZCZALNOŚĆ METALI W STANIE STAŁYM A EUTEKTYKĄ
Bardzo nieliczne są sytuacje, w których metale w stanie stałym albo rozpuszczają się w całym zakresie stężeń ( wykres 1 ) albo nie rozpuszczają się wcale ( wykres 2 ).
W praktyce najczęściej metale rozpuszczają się w sobie w stanie stałym w ograniczonym zakresie - często do ułamka procenta oraz tworzą eutektykę.
Podwójny układ fazowy metali z ograniczoną rozpuszczalnością z eutektyką roztworów granicznych :
a - krzywe termiczne
b - układ fazowy
c- sieci przestrzenne
d - wykres ilości składników strukturalnych
e - schemat struktur
a) b)
Stop 1 zaczyna krzepnąć w t1 tworząc kryształy roztworu stałego α o składzie bogatym w metal A.
Wraz ze spadkiem temperatury skład warstw narastających na pierwsze osie dendrytów zmienia się według linii solidusu, wzbogacając się w składnik B, natomiast skład cieczy zmienia się według linii likwidus .
Koniec krzepnięcia następuje w temperaturze t1 . Otrzymuje się po skrzepnięciu niejednorodny roztwór stały.
Stan eutektyczny cieczy krzepnącej nie został osiągnięty.
Niejednorodność roztworu stałego polega na tym, że wewnątrz kryształów jest więcej metalu A niż na zewnątrz .
Ta dysproporcja stężenia jest z punktu widzenia własności stopu niekorzystna i dlatego usuwa się ją stosując tzw. wyżarzanie ujednoradniające.
Polega ono na przetrzymywaniu stopu w podwyższonej temperaturze, w której w wyniku dyfuzji następuje wyrównanie stężeń w kryształach stopu.
Przebieg krzepnięcia stopu 5 jest analogiczny, z tą tylko różnicą, że tworzące się kryształy roztworu stałego strukturę krystaliczną od stopu 2.
Drugi stop rozpoczyna krzepnięcie, podobnie jak to miało miejsce w stopie 1 , od tworzenia kryształów roztworu α o składzie zmiennym ze spadkiem temperatury tak, że kryształy te po osiągnięciu temperatury tE
mają skład zewnętrznych warstw kryształu gα .
Natomiast skład cieczy krzepnącej osiąga skład eutektyczny i pozostała część roztworu krzepnie jako mieszania eutektyczna, przy czym nie jest to mieszanina eutektyczna czystych metali tylko roztworów granicznych α i β o składach gα i gβ .
Roztwór graniczny α można inaczej określić jako roztwór nasycony α , czyli zawierający maksymalną ilość metalu B , jaką w danych warunkach ( temperatura, ciśnienie ) można rozpuścić w metalu A.
Stop 4 krzepnie podobnie jak stop 2 , z tą tylko różnicą, że w stopie czwartym pierwotnie tworzą się kryształy roztworu stałego B .
W miarę ubożenia cieczy w składnik A , skład cieczy zmienia się do składu eutektycznego.
Na każdym etapie mamy jakąś zawartość eutektyki, poza roztworami granicznymi.
W tA αg graniczne E występują dwa składniki : metal A i metal B oraz dwie fazy : roztwór ciekły i roztwór stały α .
Jest 1 stopień swobody, czyli można dowolnie zmieniać tylko jeden parametr np. temp. , drugi natomiast zmienia się samorzutnie, co ma potwierdzenie w samorzutnej zmianie składu faz.
W polu tA A gα mamy 2 składniki i jedną fazę ( roztwór stały α ) S = 2
W tym polu można zmieniać temperaturę oraz skład stopu przez dyfuzję, a równowaga nie będzie zachwiana.
W polu od gα do gβ reguła faz przyjmuje znowu postać S = 1 .
Fazy : kryształy roztworu stałego α i kryształy roztworu stałego β .
Przy zmianie temperatury samorzutnie zmienia się skład roztworu β i α .
Można stwierdzić, że w układach podwójnych w polach jednorodnych występują dwa stopnie swobody .
Na prostych granicznych gdzie występują 3 fazy brak jest stopni swobody - zmiana temperatury pociąga za sobą zmianę składu.
STOPY ŻELAZA 28.10.2004r
Bardzo istotną rolę w technice odgrywają stopy żelaza .
Żelazo występuje w przyrodzie w związkach chemicznych najczęściej z tlenem.
W technice nie stosuje się czystego żelaza, ale stopy żelaza z różnymi składnikami, z których najważniejszy jest węgiel .
Oprócz węgla stosowane w technice stopy żelaza zawierają zawsze pewne ilości krzemu, manganu, siarki i fosforu, które przedostają się do stopu w trakcie procesu metalurgicznego albo są zawarte w rudzie i nie dają się łatwo z niej usunąć.
W czasie nagrzewania lub chłodzenia stopów żelaza zachodzi w nich szereg przemian, które mają swoje źródło w przemianach alotropowych czystego żelaza.
Krzywe ochładzania . Przemiany alotropowe.
°C 1539°
δ Fe
1400°
293
γ Fe
902°
365 α Fe paramagnetyczne
768°
290
α Fe
286 ferromagnetyczne
czas
Rozróżnia się następujące alotropowe odmiany żelaza :
α , γ , δ .
α do temperatury 768° C jest ferromagnetyczna, zaś powyżej 768° C paramagnetyczna
( niemagnetyczna ).
Istotną cechą odmian alotropowych żelaza jest ich zdolność do tworzenia roztworów stałych węgla.
I tak : żelazo α rozpuszcza węgiel tylko w znikomych ilościach mniej więcej do 0,025% ; natomiast żelazo γ odznacza się znacznie większą rozpuszczalnością węgla ( do 2% ) .
W trakcie nagrzewania lub chłodzenia stopów żelaza zachodzi w nich szereg przemian, aż do topnienia włącznie.
Przemiany przedstawia wykres żelazo- węgiel.
Linie ciągłe dotyczą tzw. układu żelazo - cementyt, w których węgiel znajduje się pod postacią węglika żelaza Fe3C ( zwanego cementytem ) zawierającego 6,67% węgla a linie przerywane dotyczą układu żelazo - grafit, a więc stopów w których węgiel występuje pod postacią grafitu.
Litery znajdujące się w poszczególnych węzłach wykresu stanowią ogólnie przyjętą międzynarodową symbolikę, pozwalającą na określanie temperatur początku i końca poszczególnych przemian.
Linie ABCD są liniami likwidus, ograniczającymi występowanie ciała stałego ( powyżej jest tylko ciecz ).
Linia AHJECF jest linią solidus, powyżej której występuje wyłącznie ciało stałe.
Natomiast linie HNJ oraz GSE i GPSK dotyczą przemian w stanie stałym.
Na wykresie tym występuje eutektyka przy zawartości 4,3% węgla, ma miejsce w punkcie C.
Przy zawartości wynoszącej 0,8% węgla występuje tzw. struktura eutektoidalna, która jest zjawiskiem analogicznym do eutektyki , ale dotyczy przemian występujących wyłącznie w stanie stałym.
Prześledźmy przykładowo krzepnięcie stopu o zawartości 3% węgla.
Początek krzepnięcia w temperaturze około 1280°C , zaczynają się w sieci wydzielać kryształy o składzie, który można odczytać na linii JE.
W miarę procesu krzepnięcia skład kryształów zmienia się po linii JE aż do punktu E , natomiast skład cieczy krzepnącej, ubożejącej w żelazo zaczyna dążyć do punktu C i pozostała ciecz po osiągnięciu temp. 1130°C skrzepnie jako eutektyka. Tę samą temp. końca krzepnięcia będą miały wszystkie stopy o zawartości żelaza powyżej 2%.
STRUKTURA STALI
Stopy żelaza zawierające mniej niż 2% węgla są kowalne i noszą nazwę stali.
Budowa stali jest polikrystaliczna . W stalach węglowych, niestopowych w stanie wyważonym
( znormalizowanym ) kryształy, a ściśle mówiąc ziarna, składają się z dwóch podstawowych składników : ferrytu i cementytu.
Ferryt - to prawie czyste żelazo, bardzo miękkie , o twardości zbliżonej do miedzi.
Natomiast cementyt Fe3C - jest materiałem bardzo twardym. Jego twardość ma wartość pośrednią pomiędzy twardością korundu i diamentu. ( papier ścierny, tarcze szlifierskie ).
Własności stali zależą od tego , jak wiele zawiera cementytu . Im więcej cementytu tym stal jest bardziej twarda.
Specyficzną strukturę ma stal o zawartości 0,8% węgla - punkt S na wykresie żelazo - węgiel .
Powstały eutektoid składa się z jednakowych ziaren posklejanych, z bardzo cienkich, występujących naprzemiennie płytek.

Rys. 3. Stal o zawartości ok. 0,8% C (pow. x500). Perlit
Omawiana struktura eutektoidalna nosi nazwę perlitu, gdyż wytrawiona ma pod mikroskopem połysk przypominający masę perłową .
Stany, które zawierają poniżej 0,8% C noszą nazwę podeutektoidalne natomiast te, które mają ponad 0,8% nazywa się nadeutektoidalnymi.
W stali podeutektoidalnej obok ziaren perlitu występują jeszcze ziarna ferrytu.

Rys. 4. Stal o zawartości ok. 0,35% C (pow. x 500).
Perlit (ciemne ziarna) i ferryt (jasne ziarna)
Stal o zawartości do 0,025% węgla jest pozbawiona cementytu.
Ten nieznaczny procent węgla jest rozpuszczony w żelazie w sposób niewidoczny pod mikroskopem, a w strukturze występują wyłącznie ziarna ferrytu.
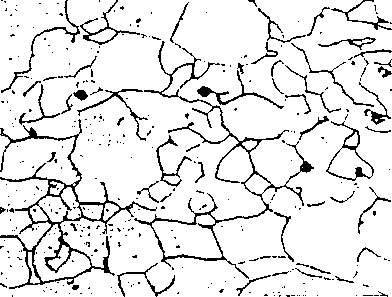
Rys. 5. Stal o zawartości ok. 0,02% C (pow. y 250). Ferryt
W stalach nadeutektoidalnych nadmiar cementytu wykrystalizowuje w postaci płytek układających się siatkowo pomiędzy ziarnami perlitu.
Przy nagrzewaniu stali od temp. otoczenia do temp. 723°C struktura stali nie ulega zmianie .
W temperaturze 723°C w skutek zachodzącej przemiany alotropowej żelaza α w żelazo γ budowa stali ulega zmianie .
Zmiana ta wynika z faktu, że żelazo γ w znacznie większym stopniu rozpuszcza w swojej sieci krystalicznej węgiel aniżeli żelazo α .
W rezultacie następuje rozpuszczenie płytek cementytu i powstają kryształy roztworu stałego węgla w żelazie γ . Ten roztwór nosi nazwę austenitu.
W stalach podeutektoidalnych rozpuszczanie pierwotnej struktury odbywa się w ten sposób, że kryształy ferrytu rozpuszczają się w roztworze stałym powstałym z ziaren perlitu. Dzieje się tak pomiędzy liniami PS i GS .
Powyżej linii GS występują same kryształy austenitu, natomiast poniżej, między liniami GS i PS - kryształy austenitu plus ferryt.
W stalach nadeutektoidalnych w pierwszej kolejności rozpuszczają się zawarte w perlicie cementyt i ferryt, a dopiero w następnej kolejności cementyt znajdujący się na granicach ziaren.
W zakresie temperatur poniżej linii SE współistnieją kryształy austenitu i płytki cementytu, a powyżej linii SE znajdują się już tylko kryształy austenitu.
Jeżeli stal nagrzana powyżej linii GSE jest powoli studzona to opisane powyżej przemiany zachodzą w odwrotnym porządku i tworzy się z powrotem budowa perlityczna .
Składniki stopowe mogą w znacznym stopniu zmienić położenie poszczególnych linii na wykresie żelazo - węgiel.
Szczególnie silne oddziaływanie mają molibden i wolfram.
Wykres żelazo - węgiel odnosi się do przemian w stanie zbliżonym do równowagi tzn. do przemian zachodzących bardzo wolno i nie dotyczy przypadków w których stal jest np. gwałtownie chłodzona
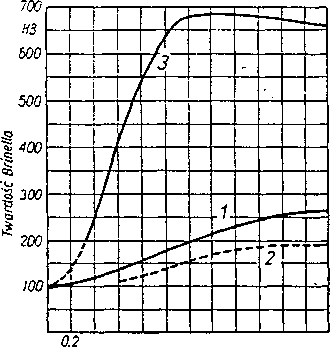
( hartowanie ).
Rys 2. Twardość stali węglowych w zależności od zawartości węgla ;
1 - wyżarzonych, o strukturze z cementytem pyłkowym, 2 - wyżarzonych,
o strukturze z cementytem kulkowym, 3 - hartowanych w wodzie
OBRÓBKA CIEPLNA
Obróbka cieplna jest to zabieg lub połączenie zabiegów cieplnych , pod wpływem których zmienia się w stanie stałym strukturę stopów, a tym samym ich własności chemiczne , fizyczne i mechaniczne w celu dostosowania ich do wymaganych warunków użytkowania .
Rozróżnia się obróbkę cieplną zwykłą i obróbkę cieplno - chemiczną, przy której oprócz czynników temperatury i czasów występuje jeszcze chemiczne oddziaływanie ośrodka, w którym odbywa się grzanie przedmiotów.
HARTOWANIE
Hartowanie jest zabiegiem cieplnym, składającym się z dwóch, następujących bezpośrednio po sobie operacji grzania ( nagrzewania i wygrzewania ) i szybkiego chłodzenia w celu uzyskania struktury martenzytycznej lub bainitycznej .
Jeśli stal węglową lub niskostopową nagrzeje się do temperatury, w której przyjmie ona strukturę austenistyczną i jeżeli tą stal gwałtownie się ochłodzi to rozpuszczony cementyt nie zdąży się z powrotem wydzielić i otrzymuje się strukturę nadzwyczaj drobnoziarnistą, składającą się z „ igiełek ” przecinających się pod kątem 60°.
I ta struktura cechuje się dobrą wytrzymałością .
Przemiana austenitu w martenzyt rozpoczyna się w określonej temperaturze zależnej od składu chemicznego stali.
Dla stali węglowych ta temperatura przemiany martenzytycznej zawiera się w granicach od 300°C do 100°C.
Gwałtowne chłodzenie początkowe ma na celu przetrzymanie przechłodzonego austenitu, aż do początku temp. przemiany martenzytycznej.
Jeśli chłodzenie jest zbyt wolne to zanim zostanie osiągnięta temp. przemiany martenzytycznej, to austenit zacznie rozkładać się na struktury trostytu i sorbitu hartowane ( mają mniejszą twardość niż martenzyt )
Przy hartowaniu stal wygrzewa się do temperatury o 30 - 50°C wyżej ponad linią GS.
Nagrzewanie do temperatur dużo wyższych jest niekorzystne, bo powoduje nadmierny wzrost ziaren austenitu. Przy nagrzewaniu stali nadeutektoidalnych dopuszcza się często do częściowego tylko rozpuszczenia płytek cementytu , znajdujących się na granicach ziaren - rozpuszcza się głównie cementyt zawarty w perlicie.
RODZAJE HARTOWANIA
Rozróżniamy następujące, podstawowe rodzaje hartowania:
hartowanie zwykłe
hartowanie stopniowe
hartowanie z przemianą izotermiczną
Ad. 1) Hartowanie zwykłe + polega na podgrzaniu stali do temp. przemiany austenicznej, czyli powyżej linii
GS i następnie szybkim ochłodzeniu w kąpieli chłodzącej do temperatury poniżej temperatury
przemiany martenzytycznej ( zazwyczaj od 15°C do 60°C ).
Hartowanie takie zapewnia uzyskanie największej twardości z drugiej jednak strony najbardziej
naraża stal na pęknięcia i odkształcenia hartownicze.
Problem polega na tym, że martenzyt ma objętość o ok. 1 - 1,5% większą od austenitu, z którego
powstaje.
Gdyby temperatura w każdym punkcie hartowanego przedmiotu jednakowo zmieniała się w czasie
to nie dochodziłoby do wad.
Szybkość chłodzenia poniżej początku przemiany martenzytycznej nie ma wpływu na uzyskiwaną twardość. Dlatego korzystnie jest stosowanie w zakresie temperatur poniżej początku przemiany
martenzytycznej stosunkowo wolnego chłodzenia .
Wolniejsze chłodzenie można uzyskać zanurzając przedmiot w oleju, zamiast w wodzie.
Jednak dla większości stali chłodzenie w oleju w zakresie od struktury austenicznej do temperatury początku przemiany martenzytycznej jest zbyt wolne.
Ad. 2) Hartowanie stopniowe - polega , jak przy wszystkich hartowaniach , do nagrzania przedmiotu powyżej linii GS i następnie chłodzeniu w kąpieli o temp. pośredniej - nieco powyżej temp. początku przemiany martenzytycznej, krótkim przetrzymaniu w tej temperaturze ( w celu wyrównania temperatur ) i dalszym chłodzeniu w oleju lub wodzie.
Jako kąpiele pośrednie stosuje się stopniową saletrę sodową lub potasową ( NaNO3lub KNO3 )
( temp. topnienia 308°C; 335°C )
Mogą być też stosowane mieszaniny tych związków lub kąpiele chlorowe , złożone z soli kuchennej oraz chlorku wapnia i baru.
Przy hartowaniu stopniowym znacznie zmniejszają się naprężenia i odkształcenia hartownicze.
W tej metodzie bardzo istotne jest właściwe dobranie czasu przetrzymywania przedmiotu w kąpieli pośredniej. Zależy on nie tylko od wielkości przedmiotu.
Ad. 3) Hartowanie z przemianą izotermiczną - Przedmiot nagrzewa się jak przy hartowaniu zwykłym, a następnie chłodzi się w nagrzanej kąpieli saletrzanej lub ołowiowej.
Przemiana martenzytyczna, jaka przy tym zachodzi do końca odbywa się w stałej temperaturze i stąd jej nazwa.
Temp. kąpieli wynosi od 300 do 500°C i dobiera się ją w zależności od tego, jakie własności ma mieć zahartowany przedmiot.
Z reguły nie otrzymuje się struktury martenzytycznej, a jedynie struktury bainityczne i sorbityczne .
Stal poddana temu hartowaniu ma twardość, strukturę i inne własności podobne do stali zahartowanej w sposób zwykły i następnie poddanej odpuszczaniu, jednak pozbawiona jest odkształceń i pęknięć hartowniczych. Ograniczeniem stosowania tej metody jest zbyt mała hartowność stali.
Niektóre stale stopowe wymagają również zbyt długiego przetrzymywania stali w nagrzanej kąpieli.
HARTOWANIE POWIERZCHNIOWE
Bardzo często w praktyce zależy nam na tym, żeby utwardzeniu uległa tylko zewnętrzna warstwa materiału, a rdzeń przedmiotu pozostał miękki i ciągliwy.
Typowym przykładem są wszelkiego rodzaju wały maszyn, skrzyń przekładowych, wały karbowe.
Stal zahartowana jest twarda, ale jednocześnie krucha i mało odporna na uderzenia.
Natomiast drobnoziarnista struktura stali ulepszanej cieplnie ( hartowanej i odpuszczanej ) jest zarówno wytrzymała, jak i plastyczna - w konsekwencji odporna na uderzenia.
Dlatego korzystnie jest, żeby materiał pozostający w środku, wewnątrz przedmiotu miał tą strukturę, a twarda była jedynie warstwa zewnętrzna.
Uzyskuje się to przez hartowanie powierzchniowe.
Rozróżnia się hartowanie powierzchniowe:
- płomieniowe - indukcyjne - kąpielowe
Hartowanie płomieniowe - polega na miejscowym nagrzaniu palnikiem części przedmiotu, a następnie intensywnym chłodzeniu strumieniem wody z dyszy.
grzanie
chłodzenie
Ten sposób hartowania jest stosowany do czopów, wałów korbowych, silników lotniczych i samochodowych, kół zębatych, łańcuchów napędowych.
Hartowanie indukcyjne - Przedmiot jest ogrzewany prądami wirowymi wzbudzanymi w warstwie zewnętrznej przedmiotu.
Stosowane są przy tym prądy o bardzo wysokich częstotliwościach.
Przy grzaniu indukcyjnym wykorzystuje się zjawisko tzw. efektu powierzchniowego .
Przy tego typu grzaniu środek przedmiotu może pozostać zimny.
Wymaga ono znacznego zużycia energii elektrycznej.
Hartowanie powierzchniowe kąpielowe - polega na tym krótkim zanurzeniu przedmiotu w kąpieli solnej lub ołowiowej, nagrzanej do temp. znacznie wyższej od temp. przemiany austenicznej, tak aby przemiana ta szybko zaszła jedynie w warstwie zewnętrznej i następnie chłodzeniu w oleju lub wodzie.
HARTOWNOŚĆ STALI
Zahartowanie stali zależy od tego, czy została osiągnięta krytyczna szybkość chłodzenia.
Jest to najmniejsza szybkość chodzenia stali nagrzanej powyżej linii GS, przy której ma miejsce przemiana martenzytyczną.
Szybkość ta dla stali węglowych i niskostopowych jest bardzo duża ( od 200 do 600°C/ S ).
Przy hartowaniu przedmiotów o większych rozmiarach warstwy stali leżące głębiej pod powierzchnią stygną z szybkością mniejszą od krytycznej i nie hartują się.
Podatność stali do hartowania określa hartowność stali.
Na hartowność stali składają się :
głębokość hartowania
maksymalna twardość uzyskiwana na powierzchni
wielkość ziaren po zahartowaniu
skłonność do pęknięć
1) i 2 ) świadczą korzystnie o hartowności stali.
Im większa głębokość i twardość tym stal jest hartowniejsza .
3 ) i 4 ) świadczą o niskiej hartowności.
WYŻARZANIE
Wyżarzanie - jest to zabieg cieplny, polegający na nagrzaniu metalu do żądanej temp., wygrzaniu w tej temp. i następnie studzeniu.
Wyróżnia się następujące rodzaje wyżarzania:
wyżarzanie zupełne
wyżarzanie normalizujące
wyżarzanie zmiękczające
wyżarzanie rekrystalizujące
wyżarzanie odprężające
wyżarzanie niezupełne
Temperatury wyżarzania stali węglowych
1300
1200
E
1100
Temperatura |
1000
900 wyż. zupełne i normalizujące
800 wyż. niezupełne
K
700 - wyż. zmiękczające
600
wyż. rekrystalizujące
500
400
wyż. odprężające
300
0,5 1,0 1,5 2,0 % zawartość węgla
Ad. 1) Wyżarzanie zupełne - polega na nagrzaniu przedmiotów o 30 - 50°C powyżej linii GSE, wygrzaniu w tej temp. i następnie powolnym studzeniu, najczęściej razem z piecem.
Wyżarzanie to ma na celu nadanie stali drobnoziarnistej budowy, w rezultacie której stal staje się bardziej plastyczna ( ciągliwa ) oraz mniej twarda. Ma na celu usunięcie gruboziarnistości.
Ad. 2) Wyżarzanie normalizujące - Stal podgrzewa się tak, jak przy wyżarzaniu zupełnym, a następnie studzi się w spokojnym powietrzu.
Wyżarzanie normalizujące usuwa naprężenia własne, polepsza własności wytrzymałościowe i przygotowuje strukturę do ostatecznej obróbki cieplnej oraz plastycznej.
Różnica między wyżarzaniem zupełnym i normalizującym polega jedynie na sposobie studzenia ( zupełne razem z piecem, a normalizujące w spokojnym powietrzu )
Ad. 6) Wyżarzanie niezupełne - stosuje się niekiedy dla stali nadeutektoidalnych ( powyżej 0,8% C ), wtedy gdy nie zależy nam na przemianie całego węgla , zawartego w cementycie w austenit, a chcemy otrzymać strukturę drobnoziarnistą.
Temp. wygrzewania jest zawarta między liniami SK i SE.
Ad. 3) Sferoidyzacja - ma na celu otrzymanie struktury cementytu kulkowego.
Nagrzewa się do temp. zbliżonej do linii PSK , zazwyczaj poniżej tej linii, następnie dość długo wygrzewa się i następnie studzi w powietrzu .
Istnieje odmiana tego wyżarzania zwana wyżarzaniem zmiękczającym z przemiana izotermiczną.
Polega ono na tym, że najpierw wygrzewa się w temp. powyżej PSK 15 - 30°C, a następnie kontynuuje się wygrzewanie poniżej PSK 15 - 30°C. Na końcu powolne studzenie w powietrzu.
Ad. 4) Wyżarzanie rekrystalizujące - ma zastosowanie do stali podanej uprzednio obróbce plastycznej na zimno .
Wyżarzanie to usuwa objawy zgniotu tzn. zastępuje zdeformowaną twardą strukturę foremna- miękką i zazwyczaj drobnoziarnistą .
Odbywa się w zakresie temp. 550°C - 650°C.
Ad. 5) Wyżarzanie odprężające - ma na celu usunięcie naprężeń własnych bez powodowania wyraźnych
zmian strukturalnych .
Odbywa się w stosunkowo niskim zakresie temp. zazwyczaj poniżej 500°C.
Temp. dobiera się tak, aby była ona niższa od temp. , w której metal traci w sposób wyraźny na wytrzymałości i staje się plastyczny .
Naprężenia wewnątrz przedmiotu są wtedy usuwane przez niewielkie odkształcenia plastyczne.
W ten sposób wyżarza się odlewy żeliwne, staliwne, przedmioty spawane oraz kute i prasowane na zimno.
Oprócz wyżej wymienionych sposobów wyżarzania w hutnictwie i odlewnictwie stali stosuje się jeszcze wyżarzanie ujednoradniające, które ma na celu wyrównanie składu chemicznego stali w całym przedmiocie w wyniku dyfuzji.
OBRÓBKA CIEPLNO - CHEMICZNA
Obróbka cieplno - chemiczna wykorzystuje nie tylko zabiegi cieplne, ale również celowo spowodowane działanie chemiczne ośrodka, w którym przedmiot się wygrzewa.
Do obróbki cieplnej zalicza się :
Zabiegi utwardzające powierzchnię
nawęglanie
azotowanie
węgloazotownie ( cyjanowanie )
zabiegi uodparniające na korozję
aluminiowanie
chromowanie
W obróbce chemicznej ma miejsce adsorpcja przez stal z ośrodka zewnętrznego składnika lub składników wpływających na własności warstwy i następnie ich dyfuzji w głąb przedmiotu.
Ad . 1a) Nawęglanie polega na dyfuzyjnym nasyceniu węglem warstwy powierzchniowej przedmiotu, wykonanego zazwyczaj z miękkiej stali .
Celem nawęglania jest uzyskanie twardej i odpornej na ścieranie warstwy powierzchniowej .
Po nawęglaniu nawęglona warstwa jest hartowana.
Rodzaje hartowania :
- nawęglanie w proszkach - nawęglanie gazowe
Nawęglanie w proszkach
Podstawowym składnikiem proszków nawęglających jest węgiel, głównie drzewny ( z drzew liściastych: dąb, buk, brzoza ) o ziarnistości 4-6 mm .
Do węgla dodawane są środki przyśpieszające nawęglanie tj. węglan baru, sodu, żelazo-cyjanek potasu i inne.
Ilość dodatków stanowi ok. 10-20 % całej masy proszku. Stal nawęgla się w temperaturze od 900°C - 950°C .Grubość warstwy nawęglonej zależy od temperatury i czasu nawęglania.
1000°C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 4 6 8 10 12 14 h
czas nawęglania
Po nawęglaniu warstwa nawęglana jest jednokrotnie lub dwukrotnie hartowana.
Jednokrotnie hartuje się tylko niektóre stale stopowe oraz drobnoziarniste stale węglowe.
Hartowanie dwukrotne stosuje się w celu rozdrobnienia ziarna wzrosłego w wyniku wysokiej temperatury i długiego czasu nawęglania.
Pierwsze hartowanie odbywa się z temp. 870°C - 900°C w przypadku stali stopowych.
Pierwsze hartownie powoduje rozdrobnienie ziarna w rdzeniu przedmiotu, jednak temp. tego hartowania jest zbyt wysoka dla warstwy nawęglonej, która otrzymuje gruboziarnistą strukturę martenzytyczną odznaczającą się znaczną kruchością.
W celu poprawy własności warstwy nawęglonej przedmiot hartuje się ponownie nagrzewając go do temp. niższej 750°C - 770°C i następnie studzi w wodzie .
W rezultacie podwójnego hartowania uzyskuje się warstwę nawęgloną z drobnoziarnistym martenzytem i rdzeń, który jest miękki i ciągliwy .
Zabiegiem końcowym po hartowaniu jest zawsze odpuszczanie w niskiej temperaturze 150°C - 180 °C , którego celem jest usunięcie naprężeń hartowniczych.
Nawęglanie gazowe
Przy nawęglaniu gazowym środkiem nawęglającym jest najczęściej gaz świetlny lub gaz ziemny oraz gazy otrzymywane w przemyśle petrochemicznym.
Głównym problemem jest odpowiednie oczyszczenie i przygotowanie gazów do procesu nawęglania.
Nawęglanie gazowe wymaga też zastosowania specjalnych pieców zabezpieczających bezpieczeństwo procesu.
Do zalet nawęglania gazowego zalicza się ;
→ większą szybkość nawęglania, niż w przypadku nawęglania proszkowego.
→ większą równomierność nawęglania
→ łatwość regulacji grubości warstwy nawęglonej
→ czystość miejsca pracy
Ad. 1b) Azotowanie przeprowadza się z reguły w środowisku gazowym.
Jako środek azotujący stosuje się gazowy amoniak. W temp. 500°C amoniak rozkłada się na wodór i aktywny azot.
Azot adsorbuje się na powierzchni stli, dyfunduje w głąb, tworząc azotki żelaza.
Po zakończonym azotowaniu, po wyjęciu przedmiotu z pieca następuje samoczynny proces starzenia i dodatkowego utwardzenia powierzchni azotowanej.
Wyniki procesu w znacznym stopniu zależą od gatunku stali i do azotowania używa się przede wszystkim stali o odpowiednim składzie.
Azotowanie jest procesem wolniejszym od nawęglania i trwa zazwyczaj kilkadziesiąt godzin.
Przykładowo: dla uzyskania warstewki grubości 0,4 mm trzeba wygrzewać przedmiot w temp. 520°C przez 60 h .
Warstwa azotowana jest bardzo twarda, odporna na ścieranie i zachowuje swoje własności, aż do temp. 550°C.
Ad. 1c) Węgloazotowanie ( dawniej cyjanowanie ) polega na nasycaniu powierzchni przedmiotów stalowych, jednocześnie węglem i azotem.
Uzyskuje się to przez wygrzewanie stali w ośrodku wydzielającym węgiel i azot.
Są dwa rodzaje węgloazotowania :
- węgloazotowanie kąpielowe
- węgloazotowanie gazowe.
Węgloazotowanie kąpielowe
Odbywa się ono w stopionej soli NaCN + sól obojętna ( np. NaCl ).
Innym rodzajem kąpieli jest kąpiel zawierająca dodatkowo BaCl2 , który aktywizuje proces.
Wszystkie kąpiele zwierające NaCN są silnie trujące.
Węgloazotowanie jest procesem przebiegającym dużo szybciej niż samo azotowanie.
Aby otrzymać warstewkę 0,4 mm należy przetrzymywać w temp. 850°C przedmiot węgloazotowany przez okres ok. 2 h.
Węgloazotowanie gazowe
Polega na wygrzewaniu w mieszaninie amoniaku i gazu nawęglającego.
Temperatury grzania dla procesu niskotemperaturowego wynoszą od 510 °C do 560°C i są stosowane do węgloazotowania już po szlifowaniu narzędzi ze stali szybkotnącej, gdzie uzyskuje się bardzo cienkie warstewki rzędu 0,02 ÷ 0,07 mm.
Natomiast węgloazotowanie wysokotemperaturowe 730°C - 860°C jest stosowane do stali konstrukcyjnych i pozwala na uzyskiwanie grubszych warstw utwardzonych.
Węgloazotowanie gazowe jest aktualnie metodą najczęściej stosowaną do utwardzania powierzchni odpowiedzialnych elementów.
Do jego realizacji służą specjalne instalacje, w których proces przebiega automatycznie.
POMIARY TWARDOŚCI
Pomiary twardości powierzchni odgrywają szczególną rolę w materiałoznawstwie, pozwalają bowiem na międzyoperacyjną kontrolę procesów obróbki cieplnej i cieplno - chemicznej.
Do najpopularniejszych metod pomiaru twardości należy;
metoda Brinella 2 ) metoda Rockwella 3) metoda Vickersa
Metoda Brinella
historycznie najstarsza jest metoda Brinella. Polega ona na wciskaniu wgłębnika w postaci kulki stalowej w powierzchnię materiału badanego.
Średnicę kulki dobiera się w zależności od grubości badanej próbki średnica ta może wynosić 1; 2 ; 2,5 ; 5 i 10 mm.
Wielkość stosowanego obciążenia zależy od średnicy kulki i przewidywanego zakresu twardości .
Zmienia się ono od 1 do 3000 kG, tj. od 10 do 30 000N.
Czas próby wynosi 10 - 15 s dla stali i żeliwa ; 30 s dla innych metali o twardości w skali HB ≥ 32 ; 60s dla materiałów o twardości HB < 32. Twardość Brinella HB jest stosunkiem siły obciążającej w kG do powierzchni odcisku w mm2 .
d
![]()
Średnicę odcisku mierzy się pod mikroskopem albo przy pomocy specjalnej lupy.
Metoda Brinella nadaj e się do określania twardości stopów żelaza i innych metali do twardości ok. 650 HB.
Powyżej tej twardości odkształcenia kulek są na tyle duże, że metoda staje się zbyt mało dokładna.
Metodę Brinella stosuje się przede wszystkim do pomiaru twardości materiałów hutniczych dla precyzyjnego określania twardości podaje się zazwyczaj oprócz samej twardości , średnicę kulki , obciążenie i czas.
400HB/5/250/15.
Metoda Rockwella
W tej metodzie twardość mierzy się na podstawie głębokości wnikania stożka diamentowego o kącie wierzchołkowym 120° , albo hartowanej kulki o średnicy 1/16 cala ( ok. 1,5875 mm ) .
Pomiarów dokonuje się w specjalnym aparacie, który podaje mierzoną czujnikiem głębokość wnikania od razu w stopniach twardości Rockwella.
W metodzie Rockwella występuje 6 skal twardości .
Skala C , A i N maja zastosowanie wtedy, gdy wciskany jest diamentowy stożek, a skale B , F i T, gdy wciskana jest stalowa kulka.
Skale C i A są stosowane do stali węglowych i stopowych w stanie zahartowanym i ulepszonym cieplnie.
Zakres skali C : od 20 do 70 HRC. Natomiast skala A ma zakres od 60 do 90 HRA.
Skale B i F stosuje się do stli węglowych i stopowych w stanie zmiękczonym lub normalizowanym oraz stopów metali nieżelaznych o twardościach od 30 do 100 HRB oraz od 60 do 100 HRF.
Skale N i T stosuje się tylko w przypadków wyrobów bardzo cienkich ( rzędu dziesiątych części mm ).
W metodzie Rockwella jednostka pomiarowa jest działka elementarna, odpowiadająca głębokości wnikania stożka lub kulki równej 0,002 mm.
Twardość Rockwella otrzymuje się odejmując głębokość wnikania, wyrażoną w jednostkach pomiarowych od 100, w przypadku skal C i A, oraz od 130 w przypadku skali B i F .
Metoda Rockwella jest bardzo wygodna do kontroli części hartowanych, przy ich masowej produkcji.
Decyduje o tym szybkość pomiaru i łatwość odczytu na czujniku.
Metoda Vickersa
Polega ona na wgniataniu w badany metal diamentu w kształcie piramidy o kącie 136° pomiędzy przeciwległymi ścianami.
Nacisk, z którym wgniata się piramidę dobiera się w zależności od rodzaju badanego materiału i grubości próbki. Jest on dobierany w zakresie od 1 do 100 kG ( czyli od 0,98 do 98 N).
Dzięki małemu odciskowi można badać nawet bardzo cienkie warstwy materiału, tj. warstewki azotowane lub węgloazotowane o grubości nawet kilku setnych części milimetra.
Na podstawie pomiaru przekątnej odcisku odczytuje się z tabel powierzchnię pobocznicy odcisku.
Twardość Vickersa oznacza się HV
![]()
D
136°
Skala Brinella i skala Vickersa to skale analogiczne.
W jednym i drugim przypadku twardość definiuje się jako stosunek siły wciskającej wgłębnik do powierzchni odcisku.
Jednak twardości Vickersa i Brinella różnią się od siebie zwłaszcza przy większej twardości , ze względu na różny kształt wgłębnika i różnicę w jego sztywności.
Pomiar Vickersa jest pomiarem nieniszczącym, dlatego jest powszechnie stosowany w produkcji.
Wytrzymałość na rozciąganie ( MPa ) jest równa w przybliżeniu 3,4 HB .
Średnica odcisku przy mm |
HB przy F = 30D2 |
HV |
( HRB ) |
Rm MPa orient |
2,45 2,50 |
627 601 |
667 640 |
58,7 57,3 |
- - |
2,70 2,75 |
514 495 |
547 528 |
52,1 51,0 |
- - |
2,95 3,00 |
429 415 |
451 444 |
45,4 44,8 |
- - |
3,20 3,25 |
363 352 |
382 372 |
39,0 37,8 |
- 1210 |
4,50 4,55 |
179 174 |
189 183 |
91,2 90,2 |
620 600 |
4,75 4,80 |
159 156 |
168 164 |
85,7 84,5 |
550 530 |
5,25 5,30 |
128 126 |
135 133 |
74,0 73,0 |
440 430 |
Gatunki stali
Znaki stali dzielą się na dwie grupy:
znaki z symbolami wskazującymi na zastosowanie oraz własności mechaniczne lub fizyczne stali
znaki z symbolami wskazującymi na skład chemiczny stali
Najpopularniejszą grupa stali są stale niestopowe ( węglowe )
Składniki symbolu głównego znaku stali oznaczonych według ich zastosowania oraz własności mechanicznych lub fizycznych.
Stal Wyrób stalowy |
Składniki znaku stali |
Stale konstrukcyjne |
Oznacza się litera S i liczbą oznaczającą minimalna wartość granicy plastyczności w MPa np. S 235 |
Stale maszynowe |
E i liczba odpowiadająca minimalnej granicy plastyczności w MPa, np. E 295 |
Stale na urządzenia ciśnieniowe |
P i liczba odpowiadająca minimalnej granicy plastyczności w MPa, np. P 460 |
Stale na rury przewodowe |
L i liczba odpowiadająca minimalnej granicy plastyczności w MPa, np. L 360 |
Stale do zbrojenia betonu |
B i liczba odpowiadająca minimalnej granicy plastyczności w MPa, np. B 500 |
Stale do betonu sprężonego |
Y i liczba odpowiadająca minimalnej wytrzymałości na rozciąganie w MPa, np. Y 1770 |
Stale na szyny lub w postaci szyn |
R i liczba odpowiadająca minimalnej wytrzymałości na rozciąganie w MPa, np. R 0900 |
Produkty płaskie walcowane na zimno ze stali o podwyższonej wytrzymałości, przeznaczonych do kształtowania na zimno |
H ( lub HT ) i liczba odpowiadająca minimalnej granicy plastyczności w MPa, ( lub liczba odpowiadająca minimalnej wytrzymałości na rozciąganie w MPa,) |
Produkty płaskie ze stali miękkich, przeznaczonych do kształtowania na zimno z wyjątkiem stali z grupy H |
DC - dla produktów walcowanych na zimno DD - dla produktów walcowanych na gorąco DX - dla produktów bez wymaganego sposobu walcowania Oprócz liter występują dwie cyfry lub litery, charakteryzujące dana stal np. DC 03 |
Produkty blacha i taśma walcowni blachy ocynkowanej |
TH i liczba odpowiadająca minimalnej twardości dla produktów o jednokrotnie redukowanej grubości w wyniku walcowania T i liczba odpowiadająca nominalnej granicy plastyczności w MPa, dla produktów o dwukrotnie redukowanej grubości |
Stale elektrotechniczne |
N
|
Składniki głównego symbolu znaku stali oznaczamy według ich składu chemicznego.
Stale niestopowe bez stali automatowych |
C i liczba oznaczająca średnie stężenie węgla w setnych częściach procenta np. C 35 |
Stale niestopowe o średnim stężeniu manganu wyższym od jedności, stale niestopowe automatowe i stale stopowe o stężeniu każdego pierwiastka stopowego mniejszym od pięciu procent |
Liczba oznaczająca średnie stężenie węgla w setnych częściach procenta, następnie symboli chemicznych pierwiastków stopowych i na końcu liczb rozdzielonych kreskami, podających średnie stężenie głównych pierwiastków stopowych w procentach, pomnożone przez odpowiedni współczynnik np. 33 MnCrB - 2 Współczynnik wynosi → 4 dla Cr, Co, Mn, Ni, Si, Wo →10 dla Al., Be, Cu, Mo, Nb, Pb, Ta, Ti, v i Zr →100 dla Ce, N, P, S →1000 dla B |
Stale stopowe, do których należą stale o stężeniu przynajmniej jednego pierwiastku stopowego większym od 5% |
X, potem następuje liczba oznaczająca średnie stężenie węgla w stali w setnych częściach procenta, następnie symbole chemiczne pierwiastków stopowych i na końcu liczby rozdzielone kreskami, podające średnie stężenie głównych pierwiastków stopowych w procentach np. X 8 CrNiMoAl 15 - 7 - 2 →wg Pn - EN 10027 - 2 każdy gatunek stali jest oznaczony także numerem, który można podać zamiast znaku stali ; numer zawiera cyfr 1.xxnn, gdzie 1- oznacza stop żelaza xx - cyfry oznaczające grupę stali nn- cyfry wyróżniające konkretne gatunek w grupie i przykładowa stale niestopowe jakościowe mają numery grup od 01 - 07 i 91 do 97 natomiast stale niestopowe specjalne od 10 do 18 stale stopowe odporne na korozję i żaroodporne od 40 do 49,stale konstrukcyjne , maszynowe i na zbiorniki stopowe ciśnieniowe od 50 do 99. |
Struktury stali niestopowych
Stale o małym stężeniu węgla do ok.0.1% wykazują strukturę ferrytu, który pod mikroskopem po wytrawieniu widać w postaci wielokątnych, jasnych ziarn z ciemnymi granicami.
Po przekroczeniu 0,1% zawartości węgla obok ferrytu pojawia się perlit . Przy stężeniu ok. 0,4% udziały perlitu i ferrytu są zbliżone. Przy zawartości 0,6 do 0,7% węgla ferryt występuje już w postaci siatki wokół ziarn perlitu, natomiast czysto perlityczną strukturę ( eutektoidalną ) ma stal o zawartości 0,77% węgla.
W stalach nadeutektoidalnych na granicach ziaren perlitu występuje siatka cementu.
Wpływ węgla na właściwości stali niestopowych.
Dominujący wpływ na własności stali niestopowych wywiera węgiel. W miarę podwyższania stężenia węgla zmniejsza się udział twardego i kruchego cementytu.
Zwiększenie zawartości węgla powoduje zwiększenie twardości , wytrzymałości na rozciąganie i jednocześnie zmniejszenie plastyczności, ciągliwości stali, a w szczególności wydłużenia A.
Przy większym stężeniu węgla stal cechuje wyższy współczynnik liniowej rozszerzalności cieplnej i mniejsza przewodność cieplna.
Zwiększona zawartość węgla pogarsza podatność stali na obróbkę plastyczna na zimno i gorąco.
Węgiel o stężeniu powyżej 0,25% zdecydowanie pogarsza spawalność stali .
Stale poniżej 0,25% są źle skrawalne ze względu na dużą ciągliwość stale nadeutektoidalne ze względu na swoją twardość również są źle skrawalne.
Wpływ domieszek i zanieczyszczeń na własności stali niestopowych
Źródłem domieszek w stalach niestopowych są pozostałości z procesu wytapiania stali oraz z zawartości złomu stalowego .
Różne domieszki inaczej oddziaływują na własności stali :
→ Mangan-działa korzystnie tworząc siarczek manganu MnS o temp. topnienia wyższej od siarczku żelaza. Mangan wpływa jednak również na niekorzystny rozrost ziaren w czasie obróbki cieplnej i plastycznej na gorąco.
→Krzem-powoduje korzystne obniżenie stężenia gazów stali lanej i przeciwdziała segregacji fosforu i siarki.
→Fosfor i siarka są zanieczyszczeniami niekorzystnymi.
Fosfor powoduje podwyższenie temp. przejścia w stan kruchości, skłonnością do kruchości na niebiesko
( gdy stal jest rozżarzana do koloru niebieskiego ), gruboziarnistość i segregacji.
Siarka-tworzy siarczki MnS ,ciekłe już w temp. 1000°C co powoduje kruchość stali na gorąco.
Siarka pogarsza spawalność i wytrzymałość stali na zmęczenie.
→Wodór-działa zdecydowanie szkodliwie powoduje powstawanie tzw. płatków śnieżnych ,odwęglanie, tworzy pęcherze gazowe oraz sprzyja segregacji fosforu.
→Azot- zmniejsza plastyczność i przyśpiesza starzenie stali, szczególnie po obróbce plastycznej na zimno.
→Tlen-powoduje zmniejszenie wytrzymałości i plastyczności stali. Z tego względu przed wytopem stosuje się tzw. odlewanie stali przez dodatek odtleniaczy np. żelazokrzemu.
Stale o specjalnych własnościach
Stale odporne na korozje
Z punktu widzenia odporności na korozję stale dzieli się na :
I Stale trudnordzewiejące ( np. wysokomanganowe )
II Stale odporne na korozję
Ze względu na strukturę stale odporne na korozję dzieli się na :
I Stale ferrytyczne
II Stale martenzytyczne
III Stale martenzytyczne umacniane wydzieleniowo
IV Stale austenityczne
V Stale ferrytyczno - austenityczne
Inny podział stali odpornych na korozję to podział uwzględniający ich skład chemiczny :
I Stale wysokochromowe
II Stale chromowo - niklowe
III Stale chromowo - niklowo - manganowe
Stale wysokochromowe o strukturze ferrytycznej, ferrytyczno - martenzytycznej lub martenzytycznej są odporne głównie na korozję chemiczną, a więc na utlenianie w atmosferze powietrza, wody naturalnej i pary wodnej w niskiej i podwyższonej temperaturze na działanie zimnych roztworów alkalicznych, rozcieńczonych kwasów i soli z wyjątkiem chlorków i jodków oraz na działanie ropy naftowej i jej par, paliw, olejów, alkoholi, a także środków spożywczych.
Stale chromowo - niklowe i chromowo - niklowo - manganowe o strukturze austenitycznej są odporne głównie na korozję elektrochemiczną.
W środowisku kwasów nieorganicznych i organicznych, związków azotu, roztworów soli i agresywnych środków spożywczych.
Stale odporne na korozję, należące do stali nierdzewnych, są objęte następującymi normami:
PN - EN 10088 - 1 : 1998
PN - EN 10088 - 2 : 1999
PN - EN 10088 - 3 : 1999
Osobne normy ujmują wymagania dotyczące odkuwek z tych stali i są zawarte w normie :
PN - EN 10250 - 4 : 2001
Stale odporne na korozję, zgodnie z normami, mają oznaczenie zaczynający się od X , a później jest zawartość węgla w setnych częściach procenta, później symbole chemiczne głównych pierwiastków stopowy i dalej następują liczby określające zawartość pierwiastków stopowych w procentach oddzielone poziomymi kreskami, np. X 12 Cr Ni 18 - 8
Stale ferrytyczne wysokochromowe
Podstawowym dodatkiem stopowym we wszystkich stalach odpornych na korozję jest chrom.
W stężeniach powyżej 14% wykazuje on skłonność do tworzenia warstwa pasywnych , o trwałości zdecydowanie większej od takich samych warstw tworzących się na czystym żelazie.
Chrom stabilizuje odmianę żelaza alfa, ograniczając występowanie austenitu.
W stopach żelazo - chrom maksymalna rozpuszczalność chromu w austenicie wynosi 12%.
Przy stężeniu większym od 12% w całym zakresie od temp. pokojowej do temp. solidusu trwały jest ferryt.
Węgiel powoduje przesunięcie zakresu występowania austenitu, zwiększając zakres obszaru dwufazowego α + γ
Stale o małym stężeniu węgla poddaje się wyżarzaniu w temp. 680°C - 1000°C, schłodzenie w powietrzu lub wodzie.
1500
1300
1200
|
1000
900
800
W1 → ( Cr , Fe )23 C6 α - ferryt
W2 → ( Cr , Fe )2 C3 węgliki γ - austenit
Stale ferrytyczne wysokochromowe, odporne na korozje mają dość dobrą wytrzymałość na rozciąganie od 380 - 750 MPa.
Austenit występujący w wyższych temperaturach w tym stalach podczas chłodzenia zmienia się w martenzyt.
Zmienia to plastyczność i spawalność tych stali praktycznie uniemożliwiając proces spawania.
W celu przeciwdziałania temu zjawisku do stali dodaje się tytan w stężeniu ok. 5 - krotnie większym od łącznej zawartości węgla i azotu.
Węgliki tytanu są trwałe do temp. 1150°C. Podobnie jak tytan działa niob i cyrkon.
Stale martenzytyczne wysokochromowe odporne na korozje.
Stale o zawartości 13% - 175 chromu, przy stężeniu węgla większym od 0,005% mają w wysokiej temp. strukturę dwufazową α + γ , a przy jeszcze wyższym stężeniu węgla strukturę jednofazową γ.
Występowanie austenitu w wysokiej temp. umożliwia hartowanie tych stali w celu uzyskania struktury martenzytycznej i następnie ich odpuszczanie.
Tak otrzymana struktura martenzytu odpuszczonego umożliwia otrzymanie wysokich wytrzymałości sięgających Rm = 1100 MPa.
Stale umacniane wydzieleniowo odporne na korozje.
Jeszcze wyższe własności wytrzymałościowe otrzymuje się w stalach chromowo - niklowych umacnianych wydzieleniowo.
Skład tych stali jest tak dobrany , aby przy małym stężeniu węgla poniżej 0,1% umożliwić wydzielanie faz międzymetalicznych, tj. Ni2Mo, Ni3Mo, NiAl2 .
Fazy międzymetaliczne wydzielają się podczas obróbki cieplnej z martenzytu.
Obróbka cieplna polega na hartowaniu i odpuszczaniu.
Wysoka wytrzymałość sięgającą nawet 1500 MPa nadawana jest stali w czasie odpuszczania, w czasie którego z martenzytu wydzielają się węgliki i fazy międzymetaliczne.
Orientacyjny skład chemiczny, warunki obróbki cieplnej i wytrzymałość ferrytycznych, wysokochromowych stali odpornych na korozję
Stale austenityczne chromoniklowe odporne na korozję
Wysoką odporność na korozję, szczególnie elektrochemiczna wykazują stale i stopy jednofazowe.
W przypadku dodania ponad 8% niklu do stali zawierających minimum 18% chromu otrzymuje się stale, które w całym zakresie temperatury maja strukturę austeniczną.
Stale o strukturze austenitycznej maja większą odporność na korozję i mniejszą skłonność do rozrostu ziarn niż stale o strukturze ferrytycznej.
W stalach chromoniklowych typu 18 - 8 rozpuszczalność węgla w austenicie zmniejsza się wraz z obniżeniem temp. i w temp. pokojowej wynosi ok. 0,04%.
Zmniejszającej się rozpuszczalności węgla towarzyszy wydzielanie się węglików W1.
Jednofazową strukturę austenitu o wysokiej odporności na korozję bez wtrąceń węglików uzyskuje się w wyniku przesycania 9 hartowania ) w wodzie z temp. 1100 °C.
Jednak w przypadku ponownego nagrzania przesyconej stali do temp. ok. 500°C np. w czasie spawania następuje wydzielanie węglików chromu w postaci siatki na granicy ziaren.
Proces ten zmniejsza bardzo odporność na korozję w strefie spawania.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Temperatura [ °C] |
0,2 0,4 0,6 0,8 1,0
stężenie węgla [ % ]
Wpływ węgla na strukturę stali o stężeniu 18% Cr i 8% Ni.
Jednofazową strukturę austenitu o wysokiej odporności na korozję bez wydzieleń węglików uzyskuje się w wyniku przesycania w wodzie z temp. 1100°C.
Jednak tak obrobiona cieplnie stal chromoniklowa podczas ogrzewania do temp. rzędu 500°C ulega zmianom strukturalnym polegającym na wydzielaniu węglików na granicach ziaren.
Utworzone węgliki zawierają chrom i powodują, że zaczyna go brakować na granicach ziaren o strukturze austenitu. Jest to przyczyną tzw. korozji międzykrystalicznej .
W temp. 500°C szybkość dyfuzji węgla jest znacznie większa od szybkości dyfuzji chromu, zatem węgiel zawarty w węglikach pochodzi z całego ziarna, a chrom tylko z obszarów przylegających do granic ziarna.
Może to powodować lokalne zmniejszenie zawartości chromu poniżej 12% i uwrażliwienie stali na działanie korozji elektrochemicznej. Wrażliwość stali na korozję międzykrystaliczną zależy od stężenia węgla w roztworze, temperatury i czasu wygrzewania. Korozji międzykrystalicznej w stalach chromoniklowych przeciwdziała się przez niedopuszczenie do wydzielania węglików chromu.
Osiąga się to :
ponowne przesycanie stali, w których z jakiś powodów ( np. spawanie ) doszło do wydzieleń węglików
zmniejszenie stężenia węgla poniżej 0,03% i ten sposób przeciwdziałania korozji międzykrystalicznej jest najbardziej skuteczny, ale wymaga stosowania specjalnych zabiegów przy produkcji stali
poprzez stabilizowanie stali dodatkami pierwiastków węglikotwórczych o większym niż chrom powinowactwie chemicznym do węgla, najczęściej są to: tytan lub niob; pierwiastki te tworzą trwałe węgliki o wysokiej temp. topliwości nie przechodzące do roztworu stałego podczas przesycania; stężenie tych pierwiastków ( Ti, Nb ) dobiera się tak, aby związać cały węgiel zawarty w stali; jeśli dodaje się sam tytan, to jego zawartość powinna być 4 - krotnie większa od zawartości węgla; jeśli dodaje się niob, to jego zawartość powinna być 8 - krotnie większa od zawartości węgla; [1H18N9T] nadmiar tytanu zmniejsza odporność na korozję zwłaszcza w pobliżu spoin, a ponadto utlenia się całkowicie w strefie przetopienia spoiny; niob wykazuje mniejsze powinowactwo chemiczne do tlenu i nie ma tej wady, jednak jest droższy i stale stabilizowane mają dobre własności wytrzymałościowe do ok. 600°C ; do stali tych dodaje się czasem niewielkie ilości molibdenu lub krzemu ; dodatek od 1-3% Mo zwiększa odporność stali chromoniklowych, austenitycznych na działanie kwasu siarkowego i octowego i na obecność jonów chlorkowych; dodatek 2-3% krzemu polepsza odporność na działanie kwasu solnego i rozcieńczanego kwasu siarkowego oraz żaroodporność ; dodatek 3% miedzi zwiększa odporność omawianych stali na korozję naprężeniową; zwiększenie wytrzymałości stali austenitycznych można uzyskać stosując dodatek azotu lub przez odkształcenie plastyczne na zimno.
Znak stali |
Stężenie pierwiastków |
|
Temp. przesycania [ °C ] |
Wytrzymałość na rozciąganie Rm [Mpa] |
C Cr Ni Mn Mo inne |
||||
X10CrNi 18-8 |
0,1 17,5 7,8 - ≤ 0,8 |
N≤ 0,11 |
1000 - 1100 |
500 - 750 |
X6CrNiMoTi 17-12-2 |
≤0,08 17,5 12 - 2,3 |
T: 5C - 0,7 |
1020 - 1120 |
500 - 700 |
X3CrNiCu 19-9-2 |
≤0,035 18,5 8,5 1,8 - |
Cu: 1,8N < 0,11 |
1000 - 1100 |
450 - 650 |
X1NiCrMoCu 31-27-4 |
≤0,002 27 31 < 2 3,5 |
Cu: 1,1N ≤ 0,11 |
1050 - 1150 |
500 - 750 |
Stale żaroodporne i żarowytrzymałe
Żaroodporność to cecha pozwalająca na zachowanie składu chemicznego i struktury stali w czasie dłuższego przebywania w podwyższonej temperaturze.
Stale żaroodporne nie korodują w podwyższonej temperaturze .
Stale żarowytrzymałe zachowują dobre własności wytrzymałościowe w podwyższonych temp. w długim okresie czasu.
W zależności od składu chemicznego i struktury stale żaroodporne i żarowytrzymałe można podzielić na :
Stale chromowe i chromowo krzemowe o strukturze ferrytyczno - perlitycznej w stanie równowagi , hartujące się na martenzyt po ochłodzeniu w powietrzu.
Stale wysokochromowe a dodatkiem aluminium i podwyższonym stężeniem krzemu o strukturze ferrytycznej z wydzieleniami węglików, głównie węglików M7C3 o ich udziale zależnym od stężenia węgla.
Stale chromoniklowe zawierające do ok. %% niklu o strukturze ferrytyczno - austenitycznej.
Stale chromoniklowe lub chromoniklowo manganowe o strukturze austenitycznej z niewielką zawartością węglików lub węglikoazotków.
Stale chromoniklowe z dodatkiem krzemu o strukturze austenitycznej z wydzieleniami węglików, typu M23C6
Znak stali |
Stężenie pierwiastków |
Rz 1000[ MPa ] 700°C 800°C |
Żaroodporne w powietrzu do temp.[ °C] |
C Mn Si Cr Ni N inne |
|||
Stale ferrytyczne |
|||
X10CrAlSi 7 |
≤0,12 - 0,75 7 - - Al.: 0,75 |
- - |
800 |
X10CrAlSi 25 |
≤ 0,12 ≤ 1 1,05 24,5 - - Al.:1,45 |
9,5 4,3 |
1150 |
Stale austenityczno - ferrytyczne |
|||
X15CrNiSi 25- 4 |
0,15 ≤ 2 1,15 25,5 4,5 ≤ 0,11 - |
9,5 4,3 |
1100 |
Stale austenityczne |
|||
X8CrNiTi 18 - 10 |
≤ 0,1 ≤ 2 ≤1 18 10,5 - Ti:5C-0,8 |
48 15 |
850 |
X10NiCrSiNb 35-22 |
≤0,15 ≤ 2 1,5 21,5 35 ≤ 0,11 Nb:1,25 |
55 26 |
1100 |
X6NiCrNbCe 32- 27 |
0,06 ≤1 ≤0,3 27 32 ≤ 0,11 Ce:0,07 Nb:0,8 Al. ≤ 0,025 |
80 24
|
1150 |
METALE NIEŻELAZNE
Miedź
Jest metalem o charakterystycznej barwie brązowo - złocistej. Jest odporna na gorącą wodę, roztwory alkaliczne
( z wyjątkiem amoniaku ) i kwas solny. Jest słabo odporna na wodę morską, kwasy , zasady i sole.
Tworzący się łatwo pod wpływem słabych nawet kwasów, octan miedzi zwany grynszpanem jest silnie trujący.
Na wilgotnym powietrzu miedź, brązy i mosiądze pokrywają się ciemnobrązową patyną, która z czasem przechodzi w tzw. patynę szlachetną o kolorze zielonym.
Patyny te tworzą różne związki chemiczne miedzi, a przede wszystkim ciemnobrązowy lub czarny tlenem miedziawy
( Cu2O ) zwany kuprytem oraz zielone w różnych odcieniach, zasadowe węglany miedzi tj. malachit lub azuryt. W atmosferze nadmorskiej w skład patyny mogą również wchodzić chlorki miedzi.
Miedź jest bardzo plastyczna i daje się obrabiać zarówno na zimno, jak i na gorąco. Gęstość miedzi wynosi 8,96 g/ cm3 , temp. topnienia 1083°C. Miedź ma bardzo niską rezystywność 0,0167 μΩ / m ; 16,5 ⋅ 10-6- współczynnik rozszerzalności liniowej. Wytrzymałość na rozciąganie w stanie miękkim: od 210 do 240 MPa. Skurcz odlewniczy miedzi wynosi ok. 2,1%. Miedź daje się lutować: lutem miękkim ołowiano - cynowym, albo lutem twardym - mosiężnym. Miedź stosuje się przede wszystkim w elektrotechnice na przewody.
W przemyśle maszynowym wykorzystuje się wysoką przewodność cieplną miedzi, a samą miedź wykorzystuje się w aparaturze przemysłowej - odporność na korozję. Miedź jest składnikiem wielu stopów: mosiądzu, brązów itp.
Nikiel
Ma gęstość 8,9 g/cm3 , stosunkową wysoką temp. topnienia 1453° C ,dlatego stosowany jest w wielu stopach żaroodpornych. Wytrzymałość na rozciąganie w stanie lotnym 350 - 550 MPa , a po zgniocie 700 - 800 MPa. Charakteryzuje go również niezłe wydłużenie względne w stanie lanym lub miękkim 40 - 15% , a w stanie obrobionym plastycznie 30 - 6% .
Nikiel jest jednym z najbardziej odpornych na wpływy atmosferyczne metali. Odporność na utlenianie ma miejsce również podwyższonej temp. aż do ok. 500° C.
Jest odporny na działanie wody morskiej, stopionych akaliów ( zasad ) , roztworów zasadowych soli i kwasów organicznych. W gorących kwasach jednak się rozpuszcza .
Nikiel jest materiałem łatwo poddającym się obróbce plastycznej na gorące od 1050° do 1150°C.
Nikiel daje się spawać zarówno gazowo, jak i elektrycznie, można go też zgrzewać i lutować, zarówno spawami miękkimi i twardymi.
W stanie czystym nikiel jest stosowany głównie do wyrobu specjalistycznej aparatury w przemyśle chemicznym i spożywczym, natomiast największe ilości niklu zużywa się w charakterze dodatków stopowych do stali, żeliw i innych stopów oraz do pokryć galwanicznych. Grubość powłok niklowych przy niklowaniu wynosi od 5 do 30μm.
Cynk
Cynk jest metalem o barwie srebrzystej z odcieniem błękitnym. Gęstość to 7,13 g/cm3 , natomiast temp. topnienia to 419° C. Wytrzymałość na rozciąganie w stanie lanym lub miękkim 30-60 MPa.
Natomiast po obróbce plastycznej 120-150 MPa. Jest jednak metalem, który w stanie lotnym lub miękkim ma niewielkie wydłużenie względne 0,5 - 0,3%.
Cynk jest odporny na wpływy atmosferyczne j działanie wody. Na powierzchni cynku tworzy się powłoka tlenkowo - węglanowa, która chronić metal przed dalszą korozją.
Cynk jest powszechnie stosowany na powłoki ochronne na stal , które mogą być nakładane na gorąca, galwaniczne lub natryskowo.
Powłoki ochronne z cynku maja istotną zaletę, polegającą na tym, że są dla stali powłokami anodowymi.
W przypadku przebicia powłoki koroduje cynk a nie stal.
Powłoki galwaniczne cynkowe są nakładane jako błyszczące lub półbłyszczące i następnie pasywowane w kąpielach chromianowych, dających na zewnątrz naloty bezbarwne, niebieskawe lub żółtawe.
Cynk jest małoodporny na kwasy i akalia. Daje się łatwo przerabiać plastycznie i jest dobrym materiałem odlewniczym. Rekrystalizacja przebiega w temp. otoczenia.
Cyna
Jest metalem o barwie srebrnobiałej lub szarawej. Pospolicie znana odmiana cyny to cyna biała, twarda jedynie od temp. 18 °C. Cyna ma gęstość 7,30 g/ cm3 , niską temp. topnienia 232°C, niewielką wytrzymałość 25 - 40 MPa i bardzo duże wydłużenie względne 40% , niska temperaturę rekrystalizacji 10°C - 20°C .
Przebywanie w dłuższym czasie w temp. poniżej 18°C powoduje rozpadanie się cyny w szary proszek, który jest jej drugą odmianą alotropową.
Cyna jest odporna na działanie czynników atmosferycznych i wody, rozpuszcza się natomiast w kwasach nieorganicznych i ługach. Kwasy organiczne i produkty spożywcze na cynę nie działają i dlatego jest ona stosowana w przemyśle spożywczym. Cyna jest stosowana głównie jako składnik stopów tj. brązy czy stopy łożyskowe oraz w lutowiach . Aż od XIX w była uważana za metal półszlachetny i były z niej produkowane talerze, łyżki, kubki, misy, kubki do piwa itd.
Ołów
Ołów ma gęstość 11,34 g/cm3 , temp. topnienia 327°C, bardzo niewielką wytrzymałość na rozciąganie 11 - 15 MPa i bardzo duże wydłużenie względne 73 - 21% . Ołów ma barwę szarą z metalicznym połyskiem. Na powietrzu pokrywa się szarą powłoką tlenków. Jednak w obecności wody tworzy się Pb(OH)2 , która jest silnie trująca. Wszystkie sole ołowiu rozpuszczalne w wodzie są trujące. W wodzie twardej ołów pokrywa się powłoką ochronną nierozpuszczalnych siarczanów i węglanów. Kontakt ołowiu z wodą miękką : powstają związki trujące. Kontakt ołowiu z wodą twardą : związki nietoksyczne. Pod wpływem kwasów ołów pokrywa się cienką warstwą nierozpuszczalnych soli. Wyjątkiem jest kwas azotowy. Ołów nie jest odporny na zasady.
Ołów łatwo poddaje się obróbce plastycznej i ma dobre własności odlewnicze. Daje się łatwo spawać i lutować . Twardość ołowiu można zwiększyć dodatkami antymonu, arsenu, kadmu lub sodu.
Ołów jest stosowany do spoin, stopów łożyskowych, stopów niskotopliwych oraz w przemyśle elektrotechnicznym np. w akumulatorach.
Pewne ilości ołowiu są również stosowane w przemyśle chemicznym.
Aluminium
Gęstość 2,70 g/cm3 , temp. topnienia 660°C , wytrzymałość na rozciąganie w stanie lanym lub miękkim
70 - 110 MPa a po obróbce plastycznej 150 MPa - 250 MPa.
W stanie lanym lub miękkim wydłużenie względne 40 - 30% a po obróbce 8% - 4%.. Skurcz odlewniczy ok. 1,7
Jest metalem odpornym na korozję atmosferyczną. Pokrywa się cienką warstwą tlenku zabezpieczającą przed dalszym utlenianiem. Jest odporne na działanie wody, zarówno słodkiej, jak i morskiej.
Odporny na działanie większości kwasów organicznych : octowego, jabłkowego, cytrynowego, mlekowego.
Rozpuszczają aluminium kwasy : solny, siarkowy i ługi ( potasowy i sodowy ).
Łatwo daje się przerabiać plastycznie ( folie aluminiowe ) . Daje się lutować lutami miękkimi i twardymi.
Powłokę aluminium można sztucznie pokryć powłokami tlenkowymi w procesach chemicznych lub elektrochemicznych ( alodynowanie lub eloksalowanie czyli utlenianie anodowe ) ; oba te procesy tworzą na powierzchni przedmiotu warstwę Al2O3 o grubości od 5 do 30 μm.
Warstwa taka jest porowata i można ją uszczelnić we wrzącej wodzie lub odpowiednim pasywatorze ( K2Cr2O7 w roztworze wodnym ). Powłokę można barwić na kolor złoty lub inny barwnikami organicznymi.
Magnez
Ma gęstość 1,74 g/cm3, temp. topnienia 649 °C. Wytrzymałość w stanie lanym lub miękkim 130 - 250 MPa.
Wydłużenie względne 7 - 10%. Temp. rekrystalizacji 25°C. Magnez oznacza się wybitnie małą odpornością na korozję. Powłoka tlenkowa powstała w warunkach atmosferycznych nie chroni przed dalszą korozją.
Magnez szybko utlenia się , a nawet zapala i można topić wyłącznie pod warstwą topnika. Praktycznie w stanie czystym stosowany głównie w pirotechnice i odlewnictwie. Występuje jednak w wielu stopach głównie z Al., Mn i Zn.
Metale szlachetne
Do metali szlachetnych zalicza się złoto, srebro, platynę, ruten, rod, pallad, osm i iryd.
Metale szlachetne obok rzadkości występowania na kuli ziemskiej charakteryzuje szczególna odporność korozyjna.
Metale szlachetne, ogólnie biorąc, są kwasoodporne. Rozpuszczają się jedynie w mieszaninie kwasu solnego i azotowego ( woda królewska ), a także w akalicznych cyjankach i rtęci . Z wyjątkiem srebra, na powietrzu nie utleniają się - zachowują połysk.
Złoto
Jest metalem o charakterystycznej żółtej barwie i gęstości 19,32 g/cm3, temp. topnienia 1063ႰC.
Złoto jest najbardziej ciągliwym i kowalnym ze wszystkich metali. Przy pomocy wyklepywania można otrzymać folie złote o grubości 0,1μm.
1 g złota daje się wyciągnąć na nitkę o długości 2,5 km. Czyste złoto jest bardzo miękkie, łatwo się ściera i odkształca. Nawet w postaci biżuterii jest stopem. Złoto oprócz zastosowań monetarnych stosowane jest w przemyśle jubilerskim, elektronice i innych przemysław, przy czym przemysłowe wykorzystanie złota to ok. 20% produkcji. Pozłacaniem nazywa się pokrywanie złotem zarówno metali jak i niemetali ( np. drewno i gips ).
Jest 6 różnych metod pozłacania :
→ pozłacanie płatkowe
→ pozłacanie złotem proszkowym
→ ogniowa
→ platerowanie
→ powlekanie galwaniczne
→ rozpylanie katodowe
Najstarsza jest metoda pozłacania płatkowego. Polega na podklejaniu na podkładzie typu malarskiego płatków złotej folii o grubości 0,1 - 0,3μm.
Złocenie ogniowe - nakłada się złoto za pomocą amalgamatu złota ( roztworu złota w rtęci ), a następnie odparowuje się rtęć za pomocą płomienia.
Platerowanie polega na nawalcowaniu na gorącą, najczęściej na blachę miedzianą lub srebrną, blachy złotej. Grubość srebra 20% - 30% grubości podkładu.
Najczęściej stosowane jest złocenie galwaniczne. Ma duże znaczenie w przemyśle elektrotechnicznym i elektronicznym.
W przemyśle jubilerskim i w mennicach stosowano dawniej tzw. próbę karatową.
Czyste złoto miało 24 karaty. Popularne złoto 14 karatowe do wyrobu biżuterii ma 0,583% złota, 17 karatowe 0,75% .
Złoto monetarne w większości krajów miało zawartość 0,900 czyli było złotem 20 - karatowym.
33
Kompozyty
Metale
Polimery
Ceramika
Szkła metaliczne
półprzewodniki
nadprzewodniki
grafit
Cl-
Cl-
Cl-
Na
Cl-
Na
Na
Cl-
Na
Cl-
Cl-
Na
Cl-
Na
Na
Na
H
•
H
•
H
•
H
•
C
•
uwspólniony elektron
od węgla
uwspólniony elektron
od wodoru
x
x
x
x
o
o
o
o
Kowalencyjne
Metaliczne
Jonowe
Wtórne
polimery
półprzewodniki
metale
ceramika i szkło
Metale
Ceramika
Polimery
Osnowa metalowa
włókno ceramiczne
Osnowa ceramiczna
włókno metalowe
Osnowa metalowa
włókno polimerowe
Osnowa polimerowa
włókno metalowe
Osnowa ceramiczna
włókno polimerowe
Osnowa polimerowa
włókno ceramiczne
Rdzenie kationowe
Gaz elektronów walencyjnych
Powłoki elektronowe
Mieszanina drobnoziarnista obu metali
( eutektyka )
B
100%B
Trójkąty ilości składników strukturalnych
Roztwór α jednego metalu w drugim
Schematy struktur
Sieci przestrzenne metali
100% A
100% B
0,4 0,6 0,8 1,0 1,2%
Zawartość węgla
ciecz +kryształy
Fe3C piewotnego
Zawartość węgla
Surówka i żeliwo
Fe3C pierwotny
+ledeburyt przemieniony
Perlit+Fe3C wtórny
+ ledeburyt przemieniony
Perlit+Fe3C
wtórny
+Fe3C trzeciorz.
Fe3C pierwotny
+ledeburyt
Austenit+ledeburyt
terryt+austenit
G910
0,025 0,8 1 2 3 4 4,3 5 %
G
Wyż. ujednoradniające
S
P
1,0
2,0
3,0
950°C
900°C
siły obciążające
0 0,5 1 1,5 2 2,5
L +α + γ
L +α
L + γ
L + γ + W2
γ + W2
γ
α + W2
L + W1 + W2
L + W1
α + γ + W2
γ + W1 +W2
γ + W1
α + γ + W1
L +γ
L
0,375 D
Odcisk Vickersa
F = 30 kG
Odcisk Rockwella
F = 150 kG
120°
Odcisk Brinella
F = 3000 kG
Austenit + węgliki ( w )
1600
1400
1200
1000
800
600
400
200
γ austenit
L + W + γ
Ciecz l
C
E
L + γ
α (δ) + γ
α +W
γ + α + W
L +α( δ ) + γ
L +α( δ )
Granica rozpuszczalności węgla w austenicie
Wyszukiwarka
Podobne podstrony:
Pedagogika-praca, pedagogika resocjalizacyjna - notatki, Prezentacja i materiały - SZKOŁA JAKO INSTY
Rachunkowość- bardzo przydatne materiały, Szkoła, Rachunkowość
wytrzymalosc materialow, Szkoła Mechatronika, Semestr III, Wydyma
Promocja zdrowia psychicznego a uzaleznienia, MATERIAŁY - SZKOŁA, PROMOCJA ZDROWIA PSYCHICZNEGO
Rachunkowość- bardzo przydatne materiały, Szkoła, Rachunkowość
M.J materiały do nauki na J.P, ULO sem.1(Żak) materiały, szkoła
ulo - 1 semestr 2012, ULO sem.1(Żak) materiały, szkoła
Rachunkowość- bardzo przydatne materiały, Szkoła, Rachunkowość
Rachunkowość- bardzo przydatne materiały, Szkoła, Rachunkowość
Rachunkowość- bardzo przydatne materiały, Szkoła, Rachunkowość
Rachunkowość- bardzo przydatne materiały, Szkoła, Rachunkowość
Rachunkowość- bardzo przydatne materiały, Szkoła, Rachunkowość
Tworzenie przypisow, MATERIAŁY - SZKOŁA, PEDAGOGIKA
Pomiar rezystancji metodą techniczną(1), materialy szkola
GEOGRAFIA - CAŁOŚĆ MATERIAŁU, szkola, Geografia
więcej podobnych podstron