Nazwisko______________________________
Imię__________________________________
Kierunek______________________________
Rok studiów___________________________
Grupa laboratoryjna_____________________
|
WYŻSZA SZKOŁA PEDAGOGICZNA w Rzeszowie I PRACOWNIA FIZYCZNA |
||||
|
W y k o n a n o |
O d d a n o |
|||
|
Data |
Podpis |
Data |
Podpis |
|
Ćwiczenie nr
|
Temat |
||||
CZĘŚĆ TEORETYCZNA
Wektor polaryzacji dielektryka P definiujemy jako wypadkowy moment dipolowy na jednostkę objętości dielektryka
P=1/dV
n- liczba dipoli w jednostce objętości dielektryka
<Pe>- uśredniony po wszystkich dipolach moment dipolowy
Wektor polaryzacji P ma prosty związek z gęstością ładunku powierzchniowego δp w spolaryzowanym dielektryku .
Stała dielektryczna ∈ ośrodka izotropowego lub o symetrii układu regularnego zdefiniowana jest
∈=D/E=1+4π(P/E)=1+4πχ
χ=P/E- jest to podatność elektryczna.
makroskopowe uśrednione pole elektryczne
Polaryzowalność α atomu definiujemy : α=P/Elok
moment dipolowy atomu
Elok- lokalne pole elektryczne w miejscu w którym znajduje się atom
αjest zdefiniowane jako właściwość atomowa lub jonowa, χ oraz ∈ będą zależały również od sposobu w jaki atomy ułożone są w krysztale ponieważ E nie jest na ogół równe Elok.
Polaryzacja jest równa momentowi dipolowemu przypadającemu na jednostkę objętości
P=ΣNi*αi*Elok(i)
Ni- liczba atomów o polaryzowalności αi przypadająca na jednostkę objętości
Jeżeli pole lokalne związane jest z polem przyłożonym za pośrednictwem związku Lorentza.
Elok=E+4πP/3
P- lorentzowski współczynnik pola lokalnego
Wówczas otrzymujemy:
P/E=ΣNiαi / 1-(4π/3)ΣNiαi = (∈-1) / 4π
Możemy przedstawić w postaci:
(∈-1) / (∈+2) = 4π ΣNiαi / 3
Jest to związek Clausiusa - Mossottiego
PRZEBIEG ĆWICZENIA
Sporządzamy 8 roztworów (wody z cukrem) o stężeniach 0,5-10%. W tym celu posługujemy się wagą laboratoryjną. Po wykonaniu roztworów mierzymy kolejno współczynnik załamania światła w tych roztworach za pomocą refraktometru Abbego wykonując następujące czynności:
przemywamy pryzmat czterochlorkiem wodoru
nanosimy na niego kilka kropel badanego roztworu tak aby cała powierzchnia była pokryta cieczą
lewym pokrętłem szukamy rozgraniczenia w postaci jasnej i ciemnej barwy
prawym pokrętłem ustawiamy ostrość obrazu
odczytujemy wskazania dla poszczególnych roztworów i zapisujemy w tabeli pomiarów
Obliczamy polaryzowatość α ze wzoru:
Obliczamy błędy pomiarów stężenia procentowego .
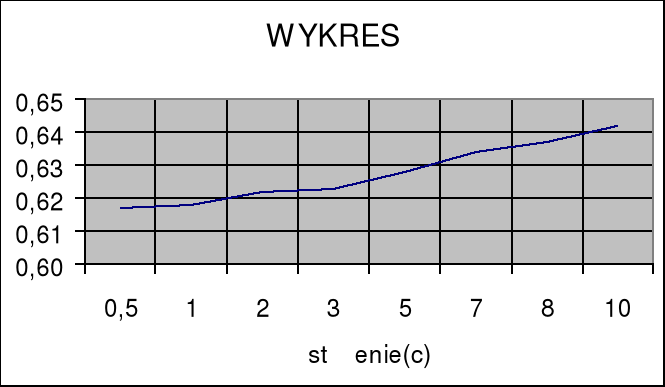
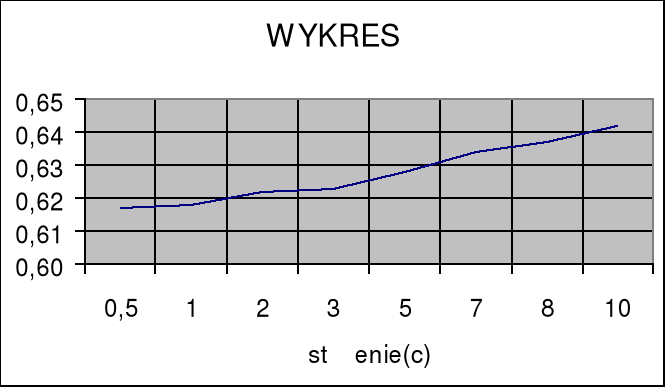
Sporządzamy wykres zależności ζ(c).
TABELA POMIARÓW
Ms2=1g Mr2=101g
Ms3=2g Mr3=102g
Ms4=3,2g Mr4=103,2g
Ms5=2,6g Mr5=52,6g
Ms6=3,6g Mr6=53,6g
Ms7=4,3g Mr7=54,3g
Ms8=5g Mr8=55g
DYSKUSJA BŁĘDÓW
![]()
Obliczam błąd stężenia metodą pochodnej logarytmicznej:
Wykreślam zależność ζ(c).
Obliczam polaryzowalność α dla wody ze wzoru:
N=3,346⋅1029
![]()
Dla wody współczynnik załamania światła: n=1,3325
Zatem :
![]()
Błąd α obliczam metodą różniczki zupełnej. W związku z tym, że w mianowniku mamy stałą wartość błąd obliczam różniczkując licznik
![]()
Δn=0,0001

WNIOSKI:
Na błąd pomiaru miały wpływ :
niedoskonałość zmysłu obserwatora oraz przyrządów pomiarowych
błędny pomiar stężenia roztworów spowodowany niewielkimi masami substancji mieszanych w porównaniu z dokładnością wagi
błąd odczytu wskazań refraktometru
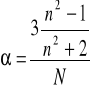
![]()
![]()
![]()

Wyszukiwarka
Podobne podstrony:
71-Lorentza-Lorenza, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr71
Lorentza-Lorenza2, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwi
Lorentza-Lorenza-teoria, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatori
Ćwiczenie nr 50b, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr50b
Doświadczalne spr p. Malusa, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr70
Ćwiczenie nr 82, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr82
Ćwiczenie nr 65c, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr65c
F-71, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr71
Ćwiczenie nr 65, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr65
Oscyloskop, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr85
53 wykres, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr53
Ćwiczenie nr 36, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr36
Ćwiczenie nr 8, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr8
Ćwiczenie nr 78, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr78
Siatka dyfrakc-teoria, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr67
Wnioski do Ćw 65b, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr65b
Ćwiczenie nr 6, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr6
Ćwiczenie nr 73a, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr73a
Ćwiczenie nr 42, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr42
więcej podobnych podstron