1. Zdefiniować pracę bezwzględną i techniczną.
Praca bezwzględna- sposób wykonywania pracy przez układ zamknięty, kiedy m=const. Związana jest ze zmianą objętości substancji wypełniającej układ. Praca ta jest równa 0, gdy w układzie nie ma zmiany objętości.
Dla p=const : L1-2=p*ΔV
Dla p≠ const: L1-2=
≈Pm*(V2-V1), gdzie pm- średnie ciśnienie podczas przemiany
Praca techniczna- definiuje się ją dla układu otwartego, gdzie związana jest ona ze zmianą ciśnienia na wlocie i wylocie tego układu. Wynosi ona 0, gdy nie ma zmiany ciśnienia.
Gdy V=const: Lt= -VΔp
Gdy V≠const: Lt= -Vm(p2-p1), gdzie Vm- średnia objętość czynnika podczas przemiany
2. Opisać cykl termodynamiczny przemian sprężarkowej pompy ciepła na wykresie T=f(s).
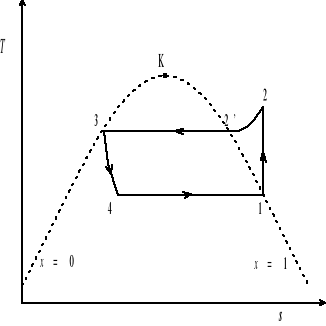
Na realizację pełnego cyklu składają się następujące przemiany:
• 1-2 sprężanie izentropowe pary (przemiana adiabatyczna odwracalna)
• 2-2' chłodzenie izobaryczne pary
• 2'-3 skraplanie izotermiczno-izobaryczne
• 3-4 rozprężanie izentalpowe
• 4-1 parowanie izotermiczno-izobaryczne
Przemiana 1-2 realizowana jest w sprężarce, przemiany 2-2'-3 zachodzą w skraplaczu, przemiana 3-4 przebiega w zaworze rozprężnym, zaś przemiany 4-1 w parowaczu.
3. Czym różni się pojęcie entropii od pojęcia entalpii?
Entropia- jest to funkcja wiążąca ilość pobranego/oddanego ciepła z przyrostem temperatury lub temperaturą przemiany. Przyrost entropii jest to ilość pobranego lub oddanego ciepła przez czynnik lub układ. Entropię obliczamy „schodząc” do 0K!!!
Entropia-funkcja termodynamicznego stanu niosąca inf. O stopniu jej uporządkowania. Określa kierunek przebiegu zjawisk fizycznych związanych z jej przemianami.
Dla przemiany izotermicznej (T=const): ΔS=Q1-2/T
Dla T≠const: ΔS= mclnT2/T1
Jednostka: kJ/K
Entalpia- jest miarą energii czynnika lub układu termodynamicznego wynikającą z temperatury i ciśnienia (lub z ich przyrostu), zwykle odnoszona do punktu potrójnego 0°C.
I=E + pV lub ΔI=ΔU + ΔpV
dla procesów gdzie p= const mamy, żeΔI=ΔE= m*c*Δt (dla gazów 2 rodzaje ciepła właściwego cp i cv).
Jeśli proces przemiany związany jest z zmianą mas, entalpia wypadkowa jest równa sumie entalpii składowych.
Jednostka: kJ
4. Czym skutkuje wg prawa Charlesa (podać formułę) pozostawienie butli z gazem na słońcu?
PRAWO CHARLESA: p1/p2=T1/T2
Jak możemy zauważyć, z prawa Charlesa wynika, że stosunek zmiany ciśnienia jest proporcjonalny do zmiany temperatur. Z tego możemy zauważyć, że jeśli pozostawimy butlę z gazem na słońcu, ta zacznie się nagrzewać, czyli nastąpi wzrost temperatury. Skoro temperatura zaczęła wzrastać, więc to samo dzieje się z ciśnieniem. Następstwem tego może być eksplozja butli z gazem.
1.Uzasadnić dlaczego w stechiometrii przyjmujemy stałą objętość kilomola dla każdego gazu ?
Kilomol każdego gazu posiada tę samą liczbę cząstek ( 6,022*10^26) objętość kilomola każdego gazu jest równa w tych samych warunkach temperatury i ciśnienia.
Przy ciśnieniu p=1bar i t=0 C objętość kilomola każdego gazu wynosi 22,71 m^3
Z prawa AVOGADRO (dla gazów doskonałych) wynika, że dla jednakowych ciśnień, temperatur i objętości ilość cząstek każdego rodzaju gazu jest równa.
2.Formuła wyznaczania mocy emitowanej przez grzejnik - kaloryfer zasilany wodą sieciową
P=m(strumień masy) * c * Δ t
P=V(strumień objętości) * gęstosć * c * Δ t
P=1,2 * V ( strumień objętości) * Δ t
Punkt krytyczny - jest to taki punkt na wykresie fazowym, w którym kończy się krzywa równowagi cieczy i gazu; określa on parametry krytyczne. Poza tym punktem nie występują różnice pomiędzy gazem a cieczą, można mówić wówczas o jednej fazie (płynu) 374 st. 220 bar
Punkt potrójny- punkt na wykresie fazowym, w którym przecinają się 3 krzywe równowagi pomiędzy poszczególnymi fazami( s-c; c-g; s-g) stanowi stan równowagi termodynamicznej 3 faz równocześnie O stop, 0,006 atm
4.Opisać zasadę działania lodówki
Lodówka działa jak pompa cieplna - pobiera ciepło z wewnątrz, by oddać je na zewnątrz.
Czynnik chłodniczy występuje najpierw w formie gazu pod niskim ciśnieniem; w momencie przedostania się do sprężarki gaz ten zostaje gwałtownie sprężony co powoduje jego ogrzanie; następnie przedostaje się do skraplacza ( w strefę wysokiego ciśnienia). Gaz rozgrzany do wysokiej temperatury i pod wysokim ciśnieniem oddaje swoje ciepło otoczeniu, po czym przechodzi do postaci schłodzonej cieczy pod wysokim ciśnieniem; ciecz,która uległa przechłodzeniu przedostaje się do zaworu rozprężnego w strefę niskiego ciśnienia , a procesowi rozprężania towarzyszy gwałtowne ochłodzenie cieczy. W efekcie w lodówce wytwarza się rozprężony ciekły czynnik chłodniczy o bardzo niskiej temperaturze. W parowniku pochłaniane jest ciepło z otoczenia lodówki, a tym samym czynnik chłodzący przechodzi w ponownie w rozprzężony gaz. Powstały gaz przedostaje się do sprężarki, a cały proces rozpoczyna się na nowo.
Dlaczego lodówka nie działa jak klimatyzator? Lodówka działa jak pompa cieplna - pobiera ciepło z wewnątrz by oddać je na zewnątrz. Próba dłuższego chłodzenai nią pomieszczenia przyniesie odwrotny skutek od zamierzonego gdyż sprężarka lodówki by nadążyć ze sprężaniem substa chłodzącej będzie przez cały czas pracować, wytwarzając dodatkowe ciepło(wzrost temperatury)
__________________________________________________________________________________
Rówanie Clapeyrona pV=mRT lub pV=nRT
p - ciśnienie gazu [Pa = N/m2]
V - objętość gazu [m3]
m - masa gazu [kg] (tak mi się wydaje :D)
R - stała gazowa, którą obliczamy Cp - Cv lub uniwersalna stała gazowa = 8,314 [kJ/kg*K]
T - temperatura [K/ °C]
Równanie Calepyrona, zwane również równaniem stanu gazu doskonałego pozwala na obliczenie objętości gazu w dowolnych warunkach.
Podać I i II formułę pierwszej zasad termodynamiki za pomocą pracy bezwzględnej i technicznej
I formuła Q1-2= Δ E+ L Układ zamknięty zmienia swą energię poprzez wymianę ciepła z otoczeniem i/ lub wykonanie pracy
Układ otwarty: energia doprowadzona do ukł jest sumą energii wyprowadzonej z ukł i przyrostu energii ukł Ed=ΔE +Ew
II formuła Q1-2= Δ I + Lt
Przemiana izotermiczna: definicje, formuły i związki.
T=const.
Prawo Boyle'a Mariotta: p1V1=p2V2= mRT= const.
p1/p2 = V2/V1
Q1-2 =Lt= L1-2
L1-2= mRT ln V2/V1
Lt=mRT lnp1/p2
deltaS= mR ln V2/V1 = mR ln p1/p2
Reguła Gibbsa ilość stopni swobody ukł termodynamicznego
Reguła faz Gibbsa dla gazu jednorodnego, do określenia jego stanu wystarczą dwa parametry termodynamiczne (np. T i p) w celu określenia pozostałych parametrów tzn. objętości właściwej, entalpii, entropii, zawilżenia (kategorii fazowej). Służy do tego termiczne rówanie stanu czyli równanie Clapeyrona: pV=mRT
Równanie to spełniają tylko gazy doskonałe tzn. takie, których cząsteczki nie przyciągają się, są nieskończenie małe, nie wykonują drgań wewnętrznych i c =/= f(t)
Metoda emisji
12kg->20kg C kam. * 25 *0,8 = 400MJ
22,71 * 35 * 0,95 = 755MJ
755/400=1,8
4.Zasada działania klimatyzatora
Powietrze z klimatyzowanego pomieszczenia kierowane jest przez wentylator na wymiennik ciepła zwany parownikiem, gdzie oddaje ciepło do czynnika chłodzącego, a tym samym ulega ochłodzeniu i powraca do pomieszczenia. Jest to układ chłodzenia powietrza w pomieszczeniu.
Ponieważ czynnik chłodzący klimatyzatora został ogrzany, aby urządzenie mogło w dalszym ciągu działać (chłodzić) należy obniżyć temperaturę czynnika chłodzącego. W wyniku ogrzania czynnik chłodzący rozpręża się i odparowuje, a pary płyną dosprężarki, gdzie zostają poddane sprężaniu. Sprężanie powoduje wzrost ciśnienia oraz temperatury. Następnie dostają się do skraplacza, a tam oddają ciepło na zewnątrz (przy pomocy wentylatora chłodzącego skraplacz) i skraplają się - stają się przechłodzoną cieczą pod wysokim ciśnieniem.
Następnie poprzez zawór rozprężny czynnik chłodzący ponownie przepływa doparownika, gdzie pobiera ciepło z powietrza pomieszczenia i cykl się zamyka.
Tak działa klimatyzator typu kompakt, gdzie wszystkie części znajdują się w jednej obudowie.
Klimatyzatory typu split składają się z dwóch oddzielnych jednostek - wewnętrznej, w skład, której wchodzi wymiennik ciepła oraz wentylator nadmuchowy.
Jednostka zewnętrzna znajduje się na poza budynkiem i tworzy ją sprężarka, skraplacz oraz zawór rozprężny. Zaletą tego typu klimatyzatorów jest to, że części wytwarzające hałas znajdują się poza budynkiem.
Bardziej rozbudowana wersja klimatyzatorów typu split umożliwia do jednej jednostki zewnętrznej podłączyć kilka jednostek wewnętrznych i nosi nazwę multi split.
1.Wykazać, że dla COP>4 pompy ciepła można uznać za odnawialne źródła energii
3L = L-> COP → Q
Qodn
np. dla L=1 kWh, COP=5
Q=5 kWh, Qodn =4kWh, 3L= 3kWh (spalanie węgla by powstała energia)
3L<Qodn możemy uznać za odnawialne źródło energii
np. dla L=1kWh, COP=4
Q=4 kWh, Qodn =3kWh, 3L= 3kWh (spalanie węgla by powstała energia)
3L=Qodn nie możemy uznać za odnawialne źródło energii
Dla COP większego od 4 pompy można uznać za odnawialne wtedy 3L<Qodn
3.Podać I i II formułę pierwszej zasad termodynamiki za pomocą pracy bezwzględnej i technicznej
I formuła Q1-2= Δ E+ L
II formuła Q1-2= Δ I + Lt
4.Przemiana izotermiczna: T=const.< sprężanie z gazu z chłodzeniem; np. sprężarka chłodzona>
Prawo Boyle'a Mariotta: p1V1=p2V2= mRT= const.
p1/p2 = V2/V1
Q1-2 =Lt= L1-2
L1-2= mRT ln V2/V1
Lt=mRT lnp1/p2
ΔS= mR ln V2/V1 = mR ln p1/p2
Przemiana izobaryczna: p=const. <ogrzewanie gazu przy ciśnieniu atmosf, ruchomy tłok w podgrzewanym cylindze>
Prawo Gaya Lussaca V2/V1=T2/T1 Q1-2=ΔI+Lt=ΔI=mcp(T2-T1) L1-2=mR(T2-T1) Lt=0 ΔS=mcplnT2/T1
Przemiana izochoryczna V=const <podgrzewanie gazu w zamkniętej objętości>
Prawo Charlesa Q1-2=ΔU+L1-2=ΔU=mcv(T2-T1) L1-2=0 Lt=-mR(T2-T1) ΔS=mcvlnT2/T1
Przemiana adiabatyczna Q1-2=0 <w procesie zmiany temp gazu jedynie poprzez sprężanie lub rozprężanie w izolacji z otoczeniem bez dostarczenia Q>
Prawo Poissona TV^k-1=const pK^k=const k=cp/cv T1/T2=(V2/V1)^k-1 p1/p2=(V2-V1)^k p1/p2=(T1/T2)^k/k-1 Q1-2=0 L1-2=-ΔE=-mcv(T2-T1) Lt=-ΔI=-mcp(T2-T1) ΔS=Q/T=0
__________________________________________________________________________________
1. Reguła Gibbsa
Reguła faz Gibbsa dla gazu jednorodnego, do określenia jego stanu wystarczą dwa parametry termodynamiczne (np. T i p) w celu określenia pozostałych parametrów tzn. objętości właściwej, entalpii, entropii, zawilżenia (kategorii fazowej). Służy do tego termiczne rówanie stanu czyli równanie Clapeyrona: pV=mRT
Równanie to spełniają tylko gazy doskonałe tzn. takie, których cząsteczki nie przyciągają się, są nieskończenie małe, nie wykonują drgań wewnętrznych i c =/= f(t)
3. Prawo Boyle'a - Marriota
p1V1 = p2V2 = mRT = const
jedno z podstawowych praw opisujących przemiany termodynamiczne w gazie doskonałym, zgodnie z którym ciśnienie zmienia się odwrotnie proporcjonalnie do zmian objętości.
p - ciśnienie
V - objętość
m - masa
R - stała gazowa
T - temperatura
I chyba z tego wynika, że:
ΔI = 0 ΔE = 0
Stąd (por. I + II forma pierwszej zasady termodynamiki) Q1-2 = Lt = L1-2
4. Prawo Gay-Lussac
wynika to z prawa Clapeyrona, jeśli mamy przemianę izobaryczną to możemy to zapisać w ten sposób: pV1=mRT1
pV2=mRT2
i po skróceniu otrzymujemy właśnie prawo Gay-Lussaca
Ogólnie: jest to jedno z praw dotyczących zachowania się gazu doskonałego podczas zmiany jego stanu. Prawo Gay-Lussaca opisuje przemianę izobaryczną (przy stałym ciśnieniu) takiego gazu i stwierdza, że podczas przemiany stosunek objętości gazu do jego temperatury jest stały.
5. Prawo Poissona
Te dwa zapisy to dwie różne formy tego prawa.
Z tego wynika:
Prawo to dotyczy przemiany adiabatycznej
p - ciśnienie
V - objętość
T - temperatura [K (zawsze jak jest duże T to kelwiny :D)]
k - stała obliczana k = cp/cv
Wykresem dla przemiany adiabatycznej jest krzywa zwaną adiabatą
1) dla przemiany izotermicznej: ΔT = 0 ΔI = 0 ΔU = 0, więc Q1-2 = L = Lt
2) dla przemiany izobarycznej: Δp = 0 Lt = 0 L = pΔV, czyli Q1-2 = ΔI = ΔU + pΔV
3) dla przemiany izochorycznej: ΔV = 0 L = 0 Lt = -VΔp Q1-2 = ΔU = ΔI - VΔp
4) dla przemiany adiabatycznej: Q1-2 = 0 L = -ΔU Lt = -ΔI
70 Zalety i wady CHP( sprężarkowa pompa cieplna)
Zalety:
- koszt
- wysoki COP
- indywidualny odbiorca
Wady:
- szum i awaryjność
- niska temperatura wyjścia (do 55 stopni C)
Zalety i wady AHP (absorpcyjna pompa cieplna)
Zalety:
- cicha praca
- mała awaryjność
- moce > 1 MW
- temp do 90 stopni C
Wady:
- koszt
- niski COP
- odbiorca grupowy
- temp źródła dolnego 40 stopni C
EGZERGIA - nadwyżka energii czynnika w danym stanie termodynamicznym względem stanu termodynamicznego otoczenia
Spalanie-to łaczenie się pierwiastków lub związków chemicznych palnych z tlenem prz czym proces ten przebiega z kontrolowaną szybkością reakcji ( bezwybuchowo), z wydzieleniem określonej ilości ciepła i produktów spalania
Spalanie całkowite występuje gdy wszystkie palne stałe składniki paliwa i produkty zostają utlenione a niecałkowite gdy przy spalaniu pozostaje część niespalonego węgla, siarki lub sadza.
Spalanie zupełne- to proces gdzie składniki i produkty palne gazowe zostają utlenione do CO2,SO2 i H2O a niezupełne gdy np. w przypadku zbyt małej ilości tlenu pozostają nie spalone
Spalanie całkowite i zupełne - proces w którym wszystkie stałe palne składniki paliwa zostają utlenione ,a składniki palne gazowe zostają utlenione do CO2,SO2 i H20
Ciepło spalania- jest to ilość ciepła powstała przy spalaniu całkowitym i zupełnym jednostki paliwa przy założeniu że odebrano również ciepło spalin, a wytworzona para wodna została skroplona kJ/kg,kJ/m^3
Wartosć opałowa- częściej stosowana w praktyce - to ciepło spalania pomniejszone o ciepło skraplania wytworzonej pary wodnej zawartej w spalinach KJ/kg, kJ/m^3
Ciepło właściwe to ilość ciepła potrzebna do ogrznia jednostki masy o jeden stopień KJ/kg*K
Sposoby wymiany ciepła:
KoNDUKCJA(przewodzenie) transfer ciepła przez materiał na skutek wibracji atomów (wewnątrz ścianki grzejnika)
KONWEKCJa- transfer cepła poprzez ruch mas; naturalna (zewnątrz ścianki grzejnika- powietrze) ; wymuszona( woda w grzejniku)
Radaicja(promieniowanie) transfer ciepła poprzez promieniowanie(podczerwone) zew. Ścianka grzejnika
WYMIENNIK(konwekcja wymuszona+radiacja) Qd=Qw, Ed=Ew
Wyszukiwarka
Podobne podstrony:
termo 1, AGH Imir materiały mix, Studia
termo pyt 8-16, Studia - Inżynieria Środowiska
PP-TERMO-K, na studia, Podstawy inżynierii materiałowej, PIM, wykłady
Studia slajdy1
Studia slaidy
oszustwa studia cywilne
Mazowieckie Studia Humanistyczn Nieznany (11)
Mazowieckie Studia Humanistyczne r2001 t7 n2 s157 160
Mazowieckie Studia Humanistyczne r1996 t2 n1 s165 173
Mazowieckie Studia Humanistyczne r1998 t4 n1 s79 101
Mazowieckie Studia Humanistyczn Nieznany (14)
Mazowieckie Studia Humanistyczne r1997 t3 n1 s290 292
Mazowieckie Studia Humanistyczne r1996 t2 n1 s113 126
Mazowieckie Studia Humanistyczne r2002 t8 n2 s109 114
eis 2002 10 adaptacja akustyczna domowego studia
Krwawienie, studia pielęgniarstwo
fotosynteza i metabolizm-ściąga, Pomoce naukowe, studia, biologia
akademia dobrych manier scen, Studia PO i PR, przedszkolaki, scenariusze konspekty
więcej podobnych podstron