TERMOCHEMIA
Termodynamika chemiczna zajmuje się przemianami energii we wielkich zbiorowiskach cząsteczek. Jednostka energii = jednostce pracy J = kg · m2/s2. Stara jednostka kaloria cal = 4,184 J.
Definicja układu.
Definicja otoczenia.
Układ otwarty Układ zamknięty Układ izolowany
Funkcja stanu jest to funkcja termodynamicznej układu, której wartość zależy od aktualnego stanu układu określonego przez temperaturę T, ciśnienie p, skład n. p. ułamki molowe poszczególnych składników.
Energia wewnętrzna układu jest sumą energii kinetycznych wszystkich cząstek w układzie, wynikających z ich bezładnych ruchów cieplnych oraz ruchów w jednym kierunku wynikających z ruchu układu jako całości. Energia potencjalna wynika z ułożenia cząsteczek względem siebie. Np. napięta sprężyna. Energia wewnętrzna jest to miara zdolności układu do wykonania pracy.
Zasada zachowania energii (pierwsza zasada termodynamiki). Energia wewnętrzna układu izolowanego jest stała. Energia nie może się tworzyć ani ulegać unicestwieniu, jedynie może się przekształcać z jednej postaci w drugą,
Temperatura. Interpretacja molekularna: jest to miara średniej energii kinetycznej cząsteczek układu. Cząsteczki wykonują ruchy translacyjne, oscylacyjne i rotacyjne. Różnice temperatury określają kierunek przepływu ciepła.
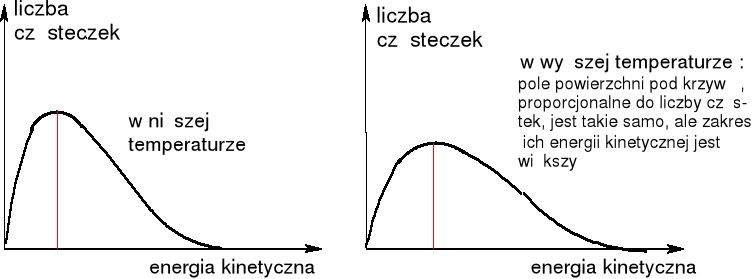
Energia cząsteczek zmienia się wraz z temperaturą, określa to rozkład Maxwella - Boltzmana.
Praca - przenoszenie energii, gdy obiekt się porusza pokonując jakąś siłę. Np. rozprężający się gaz w cylindrze silnika napędza samochód. W interpretacji molekularniej, jest to jednokierunkowy ruch cząsteczek pokonujący opór.
Ciepło - interpretacja molekularna, bezładny ruch w odróżnieniu od pracy.
Energia wewnętrzna jest funkcją stanu. Jest to wielkość ekstensywna, zależna od wielkości układu. Określenie bezwzględnej wartości energii wewnętrznej U jest niemożliwe, mierzymy tylko ΔU = Ukońc - Upocz.
Istnieją trzy sposoby zmieniania energii wewnętrznej:
zmiana ilości materii w układzie
wymiana energii w postaci ciepła
wykonanie pracy na układzie
ΔU > 0 Ukońc większe od Upocz, np. podgrzanie próbki, napięcie sprężyny, sprężenie gazu.
Dla układu zamkniętego ΔU = w + q. Jeżeli doprowadziliśmy do układu energię (q) w postaci ciepła (+ 50 KJ) i układ wykonał pracę (w) (-20 KJ) to energia wewnętrzna U wzrosła o 30 KJ.
Praca (w) w przemianach chemicznych - zasadniczo emisja gazów.
w = -p ΔV ΔV = Vkońc - Vpocz (jeżeli układ się rozpręża to wykonuje pracę pokonując ciśnienie zewnętrzne i energia wewnętrzna maleje).
ΔU = q - p ΔV q = ΔU + p ΔV
wprowadzamy funkcję entalpii H = U + pV
Przemiany chemiczne z reguły zachodzą przy stałym ciśnieniu. Zatem
ΔH = ΔU + Δ(pV) ΔH = ΔU + p ΔV
q = ΔU + pΔV = ΔH
Zmiana entalpii układu ΔH jest równa ciepłu przekazanemu do układu lub oddawanemu przez układ do otoczenia w warunkach reakcji pod stałym ciśnieniem. Entalpia jest funkcją stanu.
Zmiana energii wewnętrznej układu ΔU jest równa ciepłu przekazanemu lub oddawanemu przez układ do otoczenia w warunkach reakcji w stałej objętości.
Entalpii nie możemy mierzyć bezpośrednio. Mierzymy tylko ΔH. Pierwiastki (najbardziej trwałe termodynamicznie odmiany alotropowe) w warunkach standardowych (25 oC, 298 K i pod ciśnieniem 1013 hPa)
mają entalpię równą zero i według tego mierzy się zmiany entalpii.
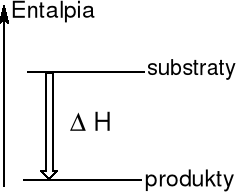
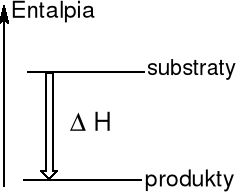
Reakcja egzotermiczna
Układ przekazuje energię na
na sposób ciepła do otoczenia
ΔH < 0 ΔH0 = - 602 kJ
(pokaz Mg + ½O2 → MgO)
2 Al(s) + Fe2O3(s) = Al2O3(s) + 2 Fe(l) mieszanina termitowa
Reakcje egzotermiczne są to z reguły samorzutne.
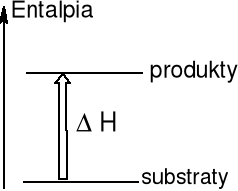
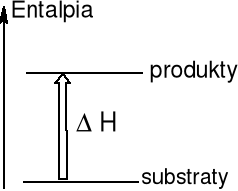
Reakcja endotermiczna
Otoczenie przekazuje energię na
sposób ciepła do układu ΔH > 0
Reakcje endotermiczne są z reguły wymuszone
Reakcja wymuszona Ca(OH)2 → CaO + H2O
Reakcja samorzutna - pokaz rozpuszczania NH4NO3.
Ba(OH)2∙8H2O(s) + 2NH4SCN(s) → 2NH3(g) + 10H2O(l) + Ba(SCN)2(aq)
Kryterium samorzutności reakcji - zmiana entalpii swobodnej układu
ΔG = ΔH - TΔS ΔG < 0 - reakcja samorzutna
Przykład. Oblicz zmianę energii wewnętrznej ΔU dla 1 mola CO2 w reakcji z węglem biegnącej w 900 K, pod ciśnieniem 1013 hPa.
ΔHotw (CO2) = -394 kJ · mol-1, ΔHotw (CO) = -111 kJ · mol-1
R = 8,315 J · mol-1 · K-1 = 83,15 dm3 · hPa · mol-1 · K-1
C(s) + CO2(g) → 2CO(g) Δn = 1
ΔH = ΔU + p ΔV ΔU = ΔH - p ΔV
pV = nRT pΔV = RT Δn = 1mol · 900K · 8,315 J · mol-1 · K-1 =
= 7484 J = 7,48 kJ
ΔH = 2 ΔHotw (CO) - ΔHotw (CO2) = -222 kJ - (-394 kJ) = + 172 kJ
metoda entalpii tworzenia
ΔU = ΔH - p ΔV = + 172 kJ - 7,5 kJ = 164,5 kJ
Przykład. Oblicz zmianę energii wewnętrznej ΔU dla reakcji 2 moli wodoru z tlenem biegnącej w 900 K, pod ciśnieniem 1013 hPa.
ΔHotw (H2O(g)) = -241,8 kJ · mol-1, R = 8,315 J · mol-1 · K-1 = 83,15 dm3 · hPa · mol-1 · K-1
2H2(g) + O2(g) → 2H2O(g) Δn = -1
ΔH = ΔU + p ΔV ΔU = ΔH - p ΔV
pV = nRT pΔV = RT Δn = 1mol · 900K · 8,315 J · mol-1 · K-1 =
= 7484 J = -7,48 kJ
ΔH = 2 ΔHotw (H2O) = 2 mol · (-241,8 kJ · mol-1) = - 483,6 kJ
ΔU = ΔH - p ΔV = - 483,6 kJ - (-7,5 kJ) = - 491,1 kJ
nie było tycH zadań w 2009 roku Na wykładach.
Najważniejsze standardowe zmiany entalpii ΔHo.
Podaje się dla jednego mola cząstek i w warunkach standardowych, stężenia powinny wynosić 1 mol/dcm3 , t = 25 °C (298 K) i ciśnienie 1013 hPa (1 atm.).
Energia jonizacji: (IE) zmiana entalpii przy usuwaniu 1 mola elektronów z 1 mola cząstek w fazie gazowej.
Na(g) = Na+(g) + e-(g) ΔHoj = 502 kJ ∙ mol-1
Al(g) = Al+(g) + e-(g) ΔHoj = 577 kJ ∙ mol-1
Al+(g) = Al2+(g) + e-(g) ΔHoj = 1817 kJ ∙ mol-1
Al2+(g) = Al3+(g) + e-(g) ΔHoj = 2745 kJ ∙ mol-1
Al(g) = Al3+(g) + 3e-(g) ΔHoj = 5148 kJ ∙ mol-1
Powinowactwo elektronowe: (EA) zmiana entalpii przy przyłączaniu 1 mola elektronów do 1 mola atomów pierwiastka w fazie gazowej.
Uwaga na znaki EA - electron affinity
Cl(g) + e-(g) = Cl-(g) ΔHo1 = -348 kJ ∙ mol-1 EA = 348 kJ ∙ mol-1
O(g) + e-(g) = O-(g) ΔHo1 = -142 kJ ∙ mol-1 EA = 142 kJ ∙ mol-1
O-(g) + e-(g) = O2-(g) ΔHo2 = +844 kJ ∙ mol-1 EA = -844 kJ ∙ mol-1
O(g) + 2e-(g) = O2-(g) ΔHo1+2 = +702 kJ ∙ mol-1 proces endotermiczny.
Entalpia tworzenia: (ΔHotw) zmiana entalpii przy tworzeniu 1 mola cząsteczek substancji z pierwiastków w ich stanach standardowych.
Entalpia atomizacji: (ΔHoat) zmiana entalpii przy tworzeniu w stanie gazowym 1 mola atomów substancji z pierwiastka w stanie standard.
Entalpia spalania: (ΔHosp) zmiana entalpii przy spalaniu 1 mola cząsteczek substancji w nadmiarze tlenu.
Entalpia sieciowa: (ΔHosieć) zmiana entalpii przy przeprowadzeniu 1 mola cząsteczek substancji z fazy stałej w gaz złożony z oddalonych od siebie jonów. MX = M+(g) + X- (g) np. CaF2 (s) = Ca2+(g) + 2F-(g)
Substancje jonowe: NaCl 770 kJ ∙ mol-1, CaF2 2610 kJ ∙ mol-1, MgO 3850 kJ ∙ mol-1,
Dla substancji kowalencyjnych jest to entalpia sublimacji.
H2O(s) → H2O(g) ΔHosieć = ΔHosubl.= 43,5 kJ ∙ mol-1
Substancje kowalencyjne: Ne 2,5 kJ ∙ mol-1, CO2 23,4 kJ ∙ mol-1.
Metale: Na 105 kJ ∙ mol-1, Wolfram 840 kJ ∙ mol-1,
Prawo Hessa
Zmiana entalpii podczas reakcji chemicznej zależy jedynie od stanu początkowego i końcowego reagentów a nie zależy od drogi reakcji. Entalpia reakcji sumarycznej jest sumą entalpii etapów na które tę reakcję można podzielić.
Umożliwia to obliczanie entalpii reakcji trudno mierzalnych.
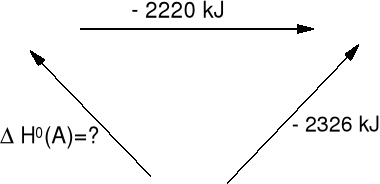
Przykład 1
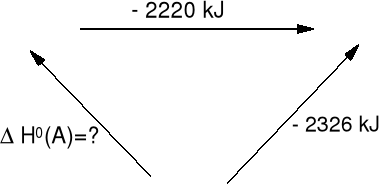
3C(s) + 4H2(g) = C3H8(g) ΔHo = ? metodą entalpii spalania.
(A) C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(c) (B)
3C(s) + 4H2(g) + 5O2 (C)
Dane:
C3H8(g) + 5O2(g) = 3 CO2(g) + 4 H2O(c) ΔHosp(C3H8) = -2220 kJ · mol-1
H2(g) + ½O2(g) = H2O(c) ΔHosp(H2) = -286 kJ · mol-1
C(s) + O2(g) = CO2(g) ΔHosp(C) = -394 kJ · mol-1
Etap C-B ΔHo(CB) = (-286 · 4) + (-394 · 3) = -2326 kJ
ΔHo(CA) + (-2220 kJ ) =-2326 kJ ΔHo(CA) =-106 kJ · mol-1
Można to zrobić inaczej metodą dodawania równań termochemicznych.
szukamy 3C(s) + 4H2(g) = C3H8(g) ΔHo = ?
3 CO2(g) + 4 H2O(c) = C3H8(g) + 5O2(g) +2220 kJ
4H2(g) + 2O2(g) = 4H2O(c) -1144 kJ
3C(s) + 3O2(g) = 3CO2(g) -1182 kJ
3C(s) + 4H2(g) = C3H8(g) -106 kJ
ΔHo(reakcji) = Σ ns ΔHosp(substraty) - Σ np ΔHosp(produkty)
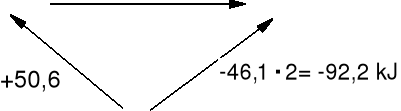
Przykład 2. Oblicz standardową entalpię reakcji redukcji hydrazyny
N2H4(c) + H2(g) = 2NH3(g) ΔHo = ? metoda entalpii tworzenia
N2(g) + 2 H2(g) = N2H4(c) ΔHotw(N2H4) = + 50,6 kJ · mol-1
½N2(g) + 1½ H2(g) = NH3(g) ΔHotw(NH3) = - 46,1 kJ · mol-1
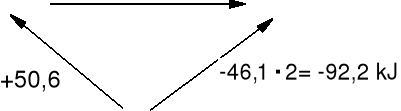
N2H4(c) + H2(g) ΔHo 2NH3(g)
N2(g) + 3H2(g)
+ 50,6 kJ + ΔHo = -92,2 kJ ΔHo = -142,8 kJ
ΔHo(reakcji) = Σ np ΔHotw(produkty) - Σ ns ΔHotw(substraty)
Proszę to zrobić inaczej metodą dodawania równań termochemicznych
Przykład 3. Oblicz standardową entalpię reakcji termitowej
2 Al(s) + Fe2O3(s) = Al2O3(s) + 2 Fe(s) ΔHo = ?
2 Al(s) + 1½ O2(g) = Al2O3(s) ΔHo = -1675.7 kJ
Fe2O3(s) = 2 Fe(s) + 1½ O2(g) ΔHo = 822.0 kJ
2 Al(s) + Fe2O3(s) = Al2O3(s) + 2 Fe(s) ΔHo = - 853.7 kJ
Przykład 4. Oblicz standardową entalpię reakcji spalania siarczku cynku
mamy dane: ΔHotw(ZnS) = -202.9 kJ ,
ΔHotw(ZnO) = -348.0 kJ,
ΔHotw(SO2) = -348.0 kJ,
ZnS(s) + 1½ O2(g) = ZnO(s) + SO2(g)
Zn(s) + ½ O2(g) = ZnO(s) ΔHo = - 348.0 kJ
S(s) + O2(g) = SO2(g) ΔHo = - 296.9 kJ
ZnS(s) = Zn(s) + S(s) ΔHo = 202.9 kJ
ZnS(s) + 1½ O2(g) = ZnO(s) + SO2(g) ΔHo = - 442.0 kJ
9
Wyszukiwarka
Podobne podstrony:
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
15-azotowceTECHa, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
6-VSEPR TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
17-borowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt3, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
INŻYNIERIA, Technologia chemiczna, I stopień, III rok, Inżynieria chemiczna, Wykłady
więcej podobnych podstron