1)Stała dysocjacji / stopień dysocjacji - Stała d. określa moc dysocjowanych elektrolitów, zależy od temperatury, stosunek iloczynu stężeń jonów powstałych w wyniku d. elektr. Do stęż. cząst. niezdysocjowanych w danej temp. K = [A+][B-]/[AB]. Elektrolity to subst. które rozpuszczając się w wodzie/rozpuszcz. ulegają rozpadowi na jonu dod. I ujemne. W zależności od stopn. dys - słabe i mocne. Stopień d. - stosunek liczy moli cząst. danego związku chem. które uległy rozpadowi na jony do łącznej liczy cząst. tego związku znajdującego się w roztworze, w którym zaszła dysocjacja.
2) Dysocjacja elektrolityczna, def. kw. i zasad wg. Arrheniusa / Bronsteda -
Arrheniusa - niektóre związki chem. posiadają zdolność do rozkładania się na jony. Kwasem jest zw. który dysocjuje z wytworzeniem jonu wodorowego H+ a zasadą - jon hydroksylowy OH-. Woda jest jednocześnie tym i tym. |
Bronsteda - kwasem jest subst. mogąca odłączać ze swojej cząst. jony wodoru(protony), zasadą - substancja przyłączająca protony. Stąd kwas jest protonodonorem, a zas. protonoakceptorem protonu. Kwas+zasada=spręż.zas.+spręż.kwas. K: H20 + HA = H30+ + A- Z: B + H20 = BH+ + OH- |
3) Właściwości grupy karboksylowej / celulozy
- Grupa karboksylowa - R-COOH - ma właśc. do dysocjacji, jedna z podstawowych grup funkcyjnych charakterystyczna dla kwasów karboksylowych, należy do złożonych grup funk. bo składa się z grupy karbonylowej połączonej z grupą hydroksylową. Charakter → kwasowy, a kwas. zależy od reszty węglowodorowej. Podobnie jak w kwasach nieorganicznych reaguje z metalami, tlenkami, wodorotlenkami metali, tworząc SOLE. Poza bardzo słabymi kwasami tłuszczowymi ulega dysocjacji elektrolitycznej w roztworze wody. R- grupa alkilowa lub arylowa (wyj. kwas mrówkowy r=wodór). Są tez kwasy których cząsteczki zawierają więcej niż jedną grupę karboksylową → kw. monokarboksylowe, dikarboksylowe, trikarboksylowe.
Celuloza: nierozgałęziony biopolimer, polisacharyd, o cząst. złożonych z jednostek glukozy połączonych wiązaniami β-1,4-glikozydowymi. Nierozp. w wodzie, ale dobrze absorbuje. Najw. c. zawieraja włókna bawełny, drewno, ulega estryfikacji kwasem: (C6H7O2-(OH)3)n + 3nHNO3 Ⴎ (C6H7O2 -(ONO2)3)n + 3n H2O - azotan celulozy w wyniku całk. e. wszystkich grup OH w cząst.
4) Reakcje związków organicznych / nieorganicznych - W zw. org. reakcje zachodzą między cząsteczkami, w nieorg - między jonami. Nieorg. - zw. w których nie wyst. wiązanie C-H
5) Wapno, zaprawy wapienne / woski, domieszki hydrauliczne - Spoiwem w wapieniach jest wodorotlenek wapnia. Spoiwo wapienne otrzym. się z kamienia wapiennego i k. marmurowego. CaCO3 {1170K} CaO + CO2. Aby z tej reakcji otrzymać wł. spoiwo należy zrobić z tego w. gaszone, wystarczy zalać wodą: CaO + H2O Ca(OH)2. W. gaszone rodz: Dołowane - b. gęste, dobre wł. często przy mal. ściennych, ma wiekszą V niż w. suchogaszone. Dodanie padliny do wapnia - tworzyły się mydła wapienne nierozp. w H2O, ale za to zaprawa była bardziej odporna na wodę. Podczas procesu powst. następuje r. egzotermiczna. suchogaszone - prod. ze względu na niebezp. powyższej metody. Otrzymuje się suchy produkt zawierający Ca(OH)2. to suchy proszek, przy przygotowywaniu zapraw wapiennych i cementowo-wapiennych. Dyspergowane - otrzym. z w suchogaszonego.
Wiązanie wapnia: 1. Ca(OH)2 + 2H2O Ca(OH)2 + 2H2O (,proces krystaliczny w głębi murów). 2. Ca(OH)2 + CO2 CaCO3 + H2O (węglan wapnia, na zewnątrz murów).
Zaprawy - wł. zaczynu: dobra plastyczność, urabialność z kruszywem, duży skurcz w trakcie wiązania. Właściwości zapraw: stos. Spoiwa do kruszywa - 1:3/1:4, b. dobre właśc.. kapilarne, niska wytrzymałość mech. Charakt. się stosunkowo małą odpornością na działanie H2O, CO2 i kwaśnych czynników korozyjnych. Wszystkie zaprawy charakt. się małym kapilarnym wznoszeniem wody. Wł. zapraw bez dodatków: jeśli materiał ma duży skurcz trzeba dobrać odpowiednie tworzywa np. gips, wpływa na wytrzymałość. Więcej kruszywa = zmalenie skurczu. Proces wiązania i twardnienia wapna zachodzi w wyniku następujących procesów: przez krystalizację zaprawy tracącej wodę, przez karbonatyzacje: Ca(OH)2 + nH2O + CO2 = CaCO3 + (n+1)H2O, przez tworzenie się krzemianów wapnia. Odpowiednie proporcje między wysychaniem a karbonizacją są ważne przy wykonywaniu powłok malarskich farbami wapiennymi. Jeżeli proces schnięcia farby następuje zbyt szybko, to proces twardnienia nie zajdzie (tzw. spalenie farby) i farba będzie ścierać się ze ściany. Jeżeli proces schnięcia będzie przebiegał zbyt wolno proces twardnienia obejmie zbyt dużą część wapna, powstała powłoka straci biały kolor, będzie szklista, nałożone następne warstwy będą odpadały. Modyfikacje spoiw wapiennych - przymieszki hydrauliczne: puzzolana i ziemia santoryjska. Także glina, bentonit, diatomit, metakaolinit i trass. Zawierają aktywną krzemionkę.
Woski, domieszki hydrauliczne - subst. o różnej bud. chem, nat i szt, ale o wł. podobnych do wosku pszczelego. Estry wyższych kwasów tł. monokarboksylowych (do 80 atomów C) oraz wyższych alkoholi monowodorotlenowych. . W woskach nat. ponadto występują domieszki węglowodorów parafinowych, wolne alkohole, i kwasy tłuszczowe. Również temperatury topnienia wosków są wyższe niż tł -w granicach 50-90 C. Powoli rozpuszczają się w rozpuszczalnikach organicznych. Ulegają trudniej hydrolizie niż glicerydy, przez co są od nich bardziej trwałe. Ciała stałe - w grubszych warstwach nieprzezroczyste, ogrzewane topią się tworząc ciecz o niskiej lepkości. Plastyczne przy zgniataniu, wł. hydrofob. Nie rozpuszczają się w wodzie. W. pszczeli, carnauba, kopalny - w. ziemny, po oczyszczeniu - cerezyna. Woski mikrokrystaliczne: Cosmolloid (dość twardy), montanowy, cerezyna. W. polioksyetylenowe (białe rozp. w wodzie), polietylenowe (w wyniku degradacji polietylenem).
6) Podział ciekłych tłuszczów / mydła, właściwości i budowa. Tłuszcze- nasycone i nien. Stałe, półstałe i ciecze, o parzystej liczbie at.C, mieszaniny glicerydów, o ich właśc. decydują reszty kw. tłuszcz. Nie można ich oczyścić poprzez destylację, rozp. w eterze, disiarczku C, chlorowcopod., benzenie, węglow. arom. Rozpuszczalnikach niepolarnych. Nie w wodzie i innych alkoholach. hydroliza: RCOOR + H2O [H+] RCOOH [kwas] + ROH - gliceryna, jest alkoh. R. zmydlania: RCOOR+KOH RCOOK [mydło] + ROH [gliceryna]. Proces nieodwracalny. Liczby charakt. dla tł: Służą do badania rodzaju tłuszczu: - LICZBA JODOWA [LJ] -określa ilość wiązań =. LICZBA ZMYDLANIA [LZ] -do badania jego jakości. Jeśli jest mała to rodniki są duże, reakcja z KOH. LICZBA KWASOWA [LK], określa ilość wolnych kwasów tłuszczowych, ilość mp KOH potrzebną do zobojętnienia kwasów tłuszczowych zawartych w 1 g badanego tłuszczu. Miara zawartości wolnych kwasów tł, czyli określa stopień hydrolizy tłuszczu. Im większa tym więcej wolnych rodników kw. tł. - tł. jest mniej świeży. Lk podwyższa się w wyniku starzenia. Tł. tworzą długie łańcuchy → kwasy 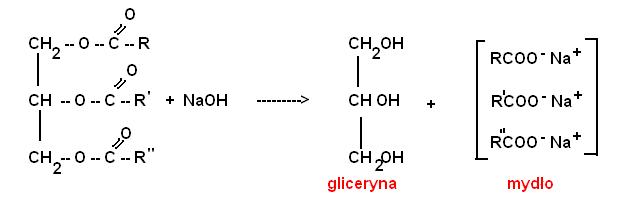
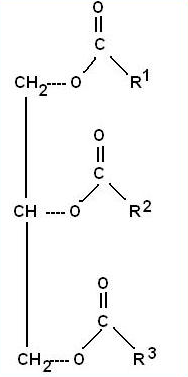
tłuszczowe, wyst. w tkankach zwierzęcych, nasionach roślin, smalec, masło, łój, oleje. W TŁUSZCZACH NIE WYSTEPUJĄ WIĄZANIA POTRÓJNE.!!! Z H20 mogą tworzyć emulsją lub dyspersję, ulegają utlenianiu i polimeryzacji. Ogólny wzór:
T. schnące: Lj 154 - 176: lniany, konopny i tungowy - są to twarde, suche powłoki o wys. stopniu wsiąkania, odporne na rozp. org. usuwa się je poprzez zmydlanie.
T. półschnące Lj. 127-144: makowy, orzechowy i słonecznikowy. Powłoki łatwe do usunięcia, pęcznieją, mniej odporne na rozp. org.
T. nieschnące: Lj<90: rzepakowy i o. z oliwek.
NASYCONE: Kwasy mające reszty kw. nasyconych są CIAŁAMI STAŁYMI. (wiązania pojedyncze zazwyczaj). Palmitynowy - C16H32O2 /C15H31COOH stearynowy -C18H36O2 / C17H35COOH Mirystynowy - C14H28O2 arachinowy - C20H40O2/ C19H39COOH
NIENAS. kwasy które mają reszty kwasów nienasyconych są CIECZAMI (1 lub więcej wiązań podwójnych). Oleinowy - C18H34O2 : CH3(CH2)7CH = CH3(CH2)7COOH linolowy - C18H32O2: : CH3(CH2)4CH = CH - CH2 - CH - CH= CH(CH2)7COOH linolenowy - C18H30O2 : CH3(CH2)4CH = CH - CH2 - CH = CH- CH2 - CH= CH(CH2)7COOH aleostearynowy - C18H30O2 :CH3(CH2)3 - CH = CH - CH = CH- CH = CH - CH(CH2)7COOH
Taka struktura kwasów odpowiada za szybkość polimeryzacji. W środowisku kwasowym hydrolizie odwracalnej w zasadowym ulegają zmydleniu:
Tłuszcze ulegają hydrolizie pod wpływem wody lub roztworów zasad. Zasadowa hydroliza tł. zwana jest reakcją zmydlania. jej produktami są → gliceryna i sole kwasów tł. → mydło! Sykatywy - rozkładają ukł. wodorotl. Reakcja mydeł alkaicznych tlenków metali glicerydami - powst. mydło. Sykat. jest MYDŁEM nierozp. w wodzie, dobre wł. hydrofobowe. SOLE SODOWE, AMONOWE LUB POTASOWE WYŻSZYCH KWASÓW TŁUSZCZOWYCH (GŁ. KWAS STEARYNOWY, PALMITYNOWY) TO MYDŁA. Powstają w reakcji ZMYDLANIA. Mydła: (RCOO)4 Me: nierozp. w wodzie, stałe, półstałe i ciekłe(potasowe), ze względu na odczyn wodnych roztworów: alkaliczne i obojętne. Rozp. w rozp. org - bezynie lakowej, mają niską temp. topnienia. Ich proces produkcji polega na długotrwałym gotowaniu tłuszczów ze stęż. roztworem zasady NaOH, zas. Mg lub Li, na skutek czego dochodzi do zerwania wiązań estrowych oraz powstania gliceryny i mydła właściwego. Współcześnie coraz częściej produkuje się też mydła poprzez bezpośrednią reakcję zasad z kwasami tłuszczowymi otrzymanymi z rafinacji ropy naftowej.
7) Wiązanie gipsu jastrychowego / budowlanego - SO4 + 2H2O CaSO4 + 2H2O CaO+2H2OCa(OH)2 Ca(OH)2+CO2CaCO3+ H2O
Tworzenie gipsu bud: CaCO3+SO2+H2O=CaSO3+CO3+H2O CaSO3+IOI=CaSO4 Wiązanie g: CaSO4 x0,5H2O+1,5H2O=CaSO4+2H2O
8) Utlenianie alkoholi / chlorki
Poprzez utlenienie alkoholu I-rzęd. (za pom. Utleniacza) powstają aldehydy: R - CH2OH + [O] ----> R - CHO + H2O Poprzez utlenianie alkoholu II rzęd. powstają ketony:
R - CH - R' + [O] -----> R - C - R' + H2O
I II OH O
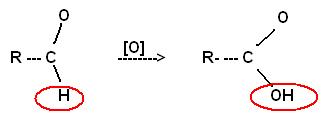
Ketony to aktywne rozpuszczalniki, np. do impregnacji drewna. ALDEHYDY - zw. zbud. z gr. aldehydowej połączonej z gr. Alkilową/arylową. → Wyjatek stanowi metanal, połączony z dwoma atomami wodoru. REAKCJE CHARAKTERYSTYCZNE: utleniania do kwasów karboksylowych: reakcja redukcji do alkoholi I rzędowych.
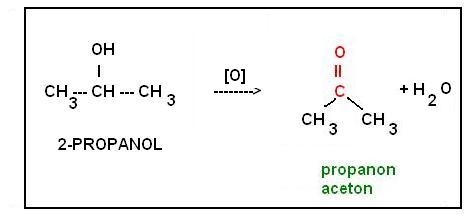
R. utlenienia wodolnego alko IIrz. - propanol:
9) Szkło, budowa i korozja / budowa szkła wodnego - Szkło - mat. Izotropowy, duża odporność chem.(ale nie na kw. fluorowodorowy). Składniki - piasek kwarcowy+dodatki Na2CO3, CaCO3+ topniki: B2O3, PbO + pigmenty. Wypalane w piecu 1200-1300C.
W wyniku reakcji krzemionki Na2SiO3 z wodorotlenkami metali alkalicznych, takich jak sód i potas, powstają tzw. szkła wodne, będące mieszaniną oligomerów krzemianowych o różnej strukturze. Ze względu na dobrą rozp. w wodzie szkła w. nazywa się „rozpuszczalnymi krzemianami”/krzemianami. Najczęściej stosowane i najbardziej rozpowszechnione są szkła wodne sodowe. Mogą być wytwarzane z dwóch podst. składników: krzemionki i tlenku metalu alkalicznego- SiO2 do Na2O. Najłatwiejszy sposób na otrzymanie szkła wodnego - to prażenie piasku z sodą, a następnie rozpuszczenie powstałego szkła w wodzie. Im bardziej stężone szkło wodne, tym ma wyższą lepkość. Sodowe szkło wodne jest używane do produkcji betonów o szczególnych właściwościach - kwasoodpornych oraz odpornych na oddziaływanie wysokich temperatur; do produkcji żaroodpornych farb i materiałów ogniotrwałych, żelu krzemionkowego, krzemianu ołowiu. W budownictwie używane do ochrony fundamentów od wód gruntowych. Jest popularnym naturalnym, nietoksycznym klejem. stosuje się go w charakterze spoiwa do materiałów ceramicznych. Odczyn zasadowy szkła w. - w reakcji hydrolizy wydziela się jon OH- , reakcja: Na4SiO3 + H2O -> H4SiO4 + 4Na + 4 OH szkło wodne jest z słabych kw. krzemowych i mocnej zas.
10) Woski rozpuszczalne w wodzie, zastosowanie / wosk pszczeli, mikrokrystaliczna budowa i właściwości
Wyszukiwarka
Podobne podstrony:
Kalendarz 2009 Dla każdego, ściaga maturalna , fajne cytaty , kawaly itp. - duzo fajnych rzeczy
ściąga z analizy instrumentalnej, Chemia Przydatne dla studentów
Ściąga z chemi na sprawdzan dla liceum ,,Chemia nieorganiczna,, docx
sciagaCHEMIA2, Chemia, sciaga chemia
chemia żywnosci dobra sciaga
chemia żywnosci dobra sciaga
chemia egz sciaga
chemia żywności ściaga 1 kolos (2)
Chemia 2 ściąga (klasówka aldehydy alkohole estry kw karb ?nole)
Chemia nieorganiczna sciaga
chemia sciaga
sciaga na egzamin. z fizy, PWR, Chemia, Fizyka II, Egzamin
sciaga chemia, chemia, chemia
CHEMIA-Sciaga
więcej podobnych podstron