
chemia analityczna - odkrywanie i formułowanie zasad, kryteriów i metod umożliwiających ustalenie z
określoną czułością, precyzją i dokładnością jakościowego i ilościowego składu obiektów materialnych
Podział:
1. Analiza chemiczna
a. Alkacymetria - miareczkowanie oparte na reakcjach zobojętniania zasad kwasami
(acydymetria) i kwasów zasadami (alkalimetria) Miareczkowanie - dodawanie małymi
porcjami roztworu mianowanego (o ściśle określonym stężeniu – titranta) do badanego
roztworu
b. Kompleksometria - wykorzystują reakcje tworzenia się trwałych, trudno dysocjujących
związków koordynacyjnych
c. Redoksymetria - wykorzystuje reakcje utleniania i redukcji, manganometria, jodometria
2. Analiza instrumentalna
a. Spektroskopia - metoda badania wykorzystująca widmo emisyjne lub absorpcyjne badanej
substancji oraz fakt, że różne grupy atomów a także same atomy absorbują i emitują w
różnych zakresach długości fal
b. Chromatografia - technika służąca do rozdzielania lub badania składu mieszanin związków
chemicznych, najpierw rozdziela się badaną mieszaninę, a następnie przeprowadza się
detekcję poszczególnych składników
c. Analiza termiczna - technika pozwalająca badad stan agregacji materii podczas zmian
temperatury. różnorodnośd zastosowao (przemysł, chemia, biologia, ochrona środowiska,
przemysł farmaceutycznym i spożywczym)
Analiza jakościowa - wykrywanie pierwiastków, jonów, grup funkcyjnych wchodzących w skład badanej
substancji lub mieszanin
Podział metod analizy jakościowej:
1. Na sucho – badanie substancji bez przeprowadzania jej do roztworu (np. charakterystyczne
barwienie płomienia)
2. Na mokro - badane składniki znajdują się w toku analizy w roztworze
Analiza ilościowa - określanie składu ilościowego substancji lub mieszanin
Analiza elementarna - oznaczanie zawartości poszczególnych pierwiastków wchodzących w skład badanej
substancji
Próba Trommera - reakcja pozwalająca wykryd grupę aldehydową w związkach, redukcja Cu(OH)
2
do Cu
2
O
Próba Tollensa - działanie metanalu na amoniakalny roztwór AgNO
3
, próba lustra srebrnego,
potwierdzająca redukujące właściwości aldehydów
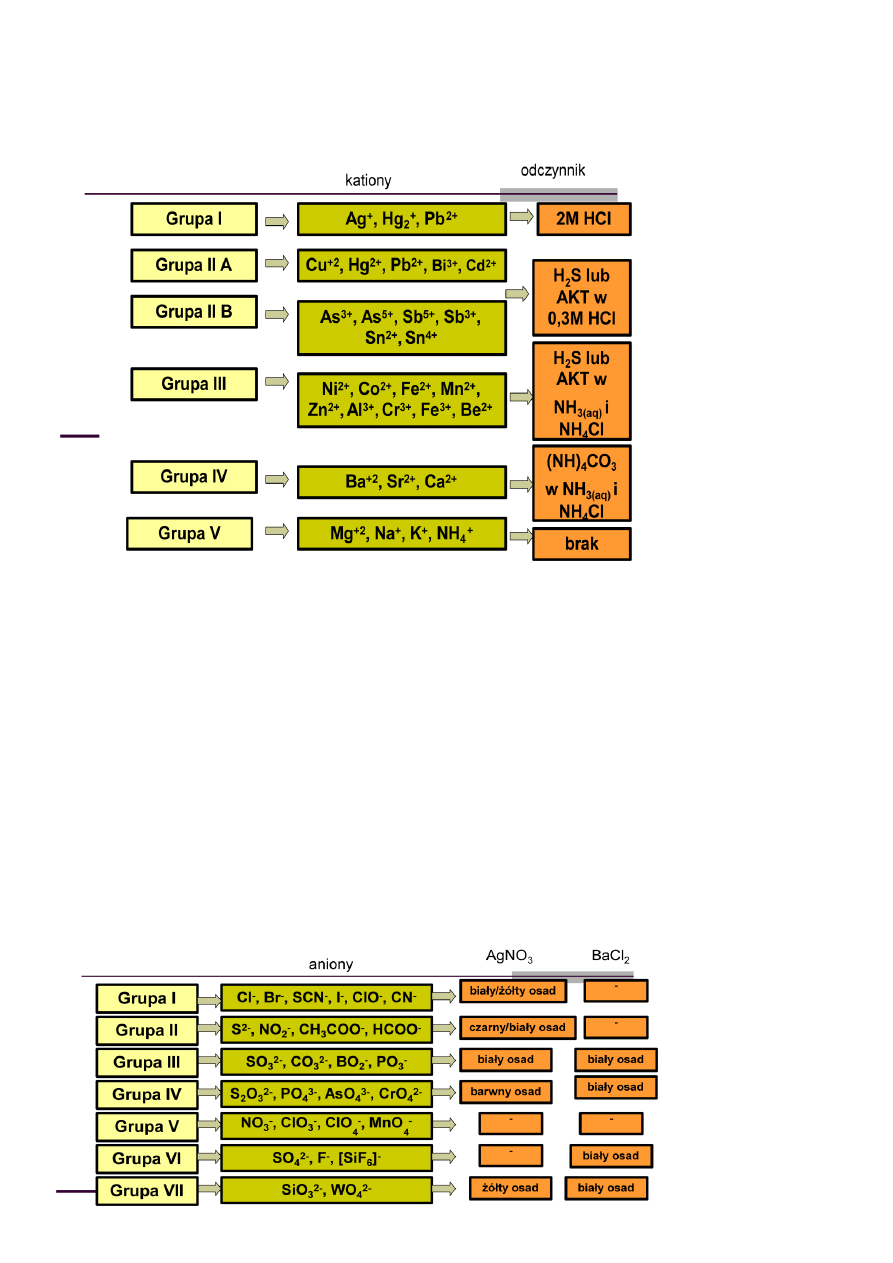
Podział kationów na grupy analityczne:
Identyfikacja kationów grupy I - Białe krystaliczne lub serowate osady
Identyfikacja kationów grupy II - Analiza kationów oparta jest na stosowaniu 0,5 M wodnego roztworu
tioacetamidu zamiast siarkowodoru i siarczku amonu à związki H
2
S są bardziej szkodliwe dla zdrowia
(wyjątkowo przykry zapach)
Identyfikacja kationów grupy III - NiS, CoS, FeS - czarne osady
Al(OH)
3
, ZnS białe osady
MnS cielisty osad
Cr(OH)
3
szarozielony osad
Fe(OH)
3
brunatny osad
Identyfikacja kationów grupy IV - BaCO
3
, SrCO
3
, CaCO
3
białe osady
Ca
2+
+ CO
3
→CaCO
3
↓ pomaraoczowy płomieo
Sr
2+
+ CO
3
→SrCO
3
↓ Czerwony płomieo
Ba
2+
+ CO
3
→BaCO
3
↓ żółty płomieo
Identyfikacja kationów grupy V - Kationy grupy V pozostają w roztworze po oddzieleniu poprzednich grup
Podział anionów (wybrane) na grupy analityczne (Bunsena)

Elektrochemia - zajmuje się wykorzystaniem:
1. ogniwa galwaniczne - samorzutnych reakcji do wytwarzania elektryczności
2. elektroliza - prądu elektrycznego do przeprowadzania reakcji, które nie zachodzą samorzutnie
Przewodniki - ciała posiadające zdolnośd przewodzenia prądu
I.
rodzaju - przewodzą prąd elektronowo (metale i ich stopy)
II.
rodzaju - przewodzą prąd za pośrednictwem jonów
Ogniwo galwaniczne - źródło prądu elektrycznego dzięki zachodzącym w nim samorzutnym reakcjom
składa się z 2 elektrod, które pozostają w kontakcie z elektrolitem Podział:
1. ze względu na mechanizm działania
a. chemiczne (tworzenia) źródło energii elektrycznej - reakcja chemiczna
b. stężeniowe źródło energii elektrycznej - proces wyrównywania się stężeo materiałów
elektrodowych (2 jednakowe elektrody)
2. ze względu na praktyczne stosowanie ich jako źródeł energii elektrycznej
a. pierwotne - po wyczerpaniu nie nadaje się do dalszego użytkowania
b. wtórne - można je regenerowad przez ładowanie
c. paliwowe - reagenty są w sposób ciągły doprowadzane z zewnątrz w czasie pracy ogniwa
np. ogniwo wodorowo- tlenowe
półogniwo - układ składający się z elektrody wraz z otaczającym ją roztworem elektrolitu Podział:
1. metalowe faza metaliczna bierze udział w reakcji elektrodowej: Cu
0
= Cu
2+
+ 2e
Zn
2+
+ 2e = Zn
0
2. redoks faza metaliczna nie bierze udziału w reakcji elektrodowej: 2I
-
= I
2
+ 2e
Fe
3+
+ e = Fe
2+
Siła elektromotoryczna SEM - różnica między potencjałami elektrod ogniwa. SEM ogniw, w których reakcje
są w stanie równowagi, wynosi 0 V (wyczerpana bateria).
SEM = E
VK
– E
VA
E
VK
- potencjał katody
E
VA
– potencjał anody
Reakcje elektrodowe w procesach SEM:
1. utlenianie - zachodzi na anodzie (-)
2. redukcja - zachodzi na katodzie (+)
równania Nernsta: Dla innych warunków niż standardowe przybliżoną wartośd potencjału półogniwa E
V
oblicza się z :
Szereg napięciowy metali
Na podstawie szeregu napięciowego można przewidzied kierunek reakcji redoks:
1. metal o ujemnej wartości E
0
redukuje jony wodorowe w roztworze: Zn + HNO
3
= Zn(NO
3
)
2
+ H
2
↑

2. im bardziej ujemny jest potencjał metalu, tym większa jest jego zdolnośd redukująca z tej
właściwości szeregu wynika cementacja
3. metale o dodatniej wartości E
0
nie mogą redukowad jonów wodorowych i wydzielad gazowego
wodoru z roztworu kwasu: Cu + 4HNO
3(st)
= Cu(NO
3
)
2
+ 2NO
2
+ 2H
2
O często z powodu bardzo
powolnego przebiegu reakcji lub tworzenia się ochronnej warstewki tlenku (np. pasywacja)
Elektroliza - zespół przemian chemicznych zachodzących na elektrodach pod wpływem prądu
elektrycznego przepływającego przez elektrolit
Elektrody
1. anoda (+) dążą do niej aniony . O
2
, reszta kwasów beztlenowych np. Cl
2
, I
2
2. katoda (-) dążą do niej kationy. H
2
, metale ciężkie np. Zn, Cu
Napięcie rozkładowe - najniższa wartośd napięcia , po przekroczeniu którego proces elektrolizy się
rozpoczyna
Zastosowanie elektrolizy w przemyśle –
1. do otrzymywanie niektórych pierwiastków i związków chemicznych
2. do oczyszczania niektórych metali – elektrorafinacja Cu:
3. do procesów galwanotechnicznych, np. wytwarzania powłok ochronnych lub dekoracyjnych
Prawo Faradaya :
Korozja - niszczenie materiałów pod wpływem otaczającego środowiska.
Czynniki wpływające:
1. obecnośd zanieczyszczeo
2. odczyn środowiska
3. zmiany temperatury i ciśnienia
4. naprężenia materiału
5. struktura krystaliczna materiału
Ochrona przed korozją:
1. niemetaliczne powłoki ochronne
2. metaliczne powłoki ochronne o niższym od żelaza potencjale
3. metaliczne powłoki ochronne o wyższym od żelaza potencjale
4. ochrona katodowa - podłączenie metalu chronionego do ujemnego bieguna źródła prądu stałego o
niewielkim napięciu 2 V
5. ochrona protektorowa - polega na połączeniu chronionego metalu z metalem bardziej aktywnym
6. dodawanie inhibitorów - dodawanie w niewielkich ilościach substancji blokujących dostęp jonów
wodorowych
Podział:
1. chemiczna - reakcje zachodzące na powierzchniach tworzyw pod wpływem niektórych substancji
chemicznych (tlenu, chloru, siarki, NO
x
) bez udziału wody. przyklady. utlenianie żelaza do jego
tlenków tlenem z powietrza. czernienie przedmiotów srebrnych na powietrzu - związki siarki
zawarte w powietrzu tworzą siarczek srebra (I) pasywacja glinu – na powierzchni glinu pod
wpływem kontaktu z tlenem atmosferycznym tworzy się zwarta cienka powłoka Al
2
O
3
2. elektrochemiczna - reakcje zachodzące na granicy faz: metal – roztwór elektrolitu, prowadzące do
wytworzenia ogniw o schemacie: metal ulegający korozji│przewodnik jonowy│czynnik wywołujący
korozję . przykłady: rdzewienie stali w wilgotnym powietrzu: Fe│H
2
O, OH
-
│O
2
,grafit lub cementyt
zawarty w stali tworzy elektrodę dodatnią: 2H
2
O + O
2
+ 4e = 4OH
-
Rdzewienie - korozja żelaza. dotyczy metali i stopów, tworzyw niemetalowych, ceramicznych i sztucznych
Rdza - uwodniony tlenek żelaza (III) o wzorze 2Fe
2
O
3
.
xH
2
O
Symbole pierwiastków i wartościowości(Główne pogrubione i na czerwono):
wodór
H
1
rod
Rh
2,
3
,4,5,6
hel
He
0
lit
Li
1
iryd
Ir
2,
3,
4,5,6
neon
Ne
0
sód
Na
1
nikiel
Ni
2,
3
argon
Ar
0
potas
K
1
pallad
Pd
2,
4
krypton
Kr
2
rubid
Rb
1
platyna
Pt
2,
4,
6
ksenon
Xe
2,4,6,8
cez
Cs
1
miedz
Cu
1,
2
,3
radon
Rn
2
frans
Fr
1
srebro
Ag
1,
2,3
lantan
La
3
beryl
Be
2
złoto
Au
1,
3
aktyn
Ac
3
magnez
Mg
2
cynk
Zn
2
cer
Ce
3,
4
wapo
Ca
2
kadm
Cd
2
tor
Th
4
stron
Sr
2
rtęd
Hg
1,
2
prazeodym
Pr
3,
4
bar
Ba
2
bor
B
3
protaktyn
Pa
4
,5
rad
Ra
2
glin
Al.
3
neodym
Nd
3
skand
Sc
3
gal
Ga
3
uran
U
3,4,5,
6
Itr
Y
3
ind
In
1,
3
promet
Pm
3
tytan
Ti
3,
4
tal
Tl
1,
3
neptun
Np. 3,4,
5,
6,7
cyrkon
Zr
4
węgiel
C
2,
4
samar
Sm
2
,3
hafn
Hf
4
krzem
Si
4
pluton
Pu
3,
4,
5,6
rutherford
Rf
4
german
Ge
2,
4
europ
Eu
2,3
wanad
V
2,3,4,
5
cyna
Sn
2,
4
ameryk
Am
3,
4,5,6
niob
Nb
3,4,
5
ołów
Pb
2,
4
gadolin
Gd
3
tantal
Ta
3,4,
5
azot
N
2,3,4,
5
ciur
Cm
3,4
dubn
Db
5
fosfor
P
3,
5
terb
Tb
3,
4
chrom
Cr
2,
3
,6
arsen
As
3,
5
berkel
Bk
3,
4
molibden
Mo
2,3,4,5,
6
antymon
Sb
3,
5
dysproz
Dy
3
wolfran
W
2,3,4,5,
6
bizmut
Bi
3
,5
kaliforn
Cf
2,
3,
4
seaborg
Sg
6
tlen
O
2
holm
Ho
3
mangan
Mn
2
,3,4,6,7
siarka
S
2,4
,6
einstein
Es
2
,3
technet
Tc
2,4,
7
selen
Se
2,
4,
6
erb
Er
3
ren
Re
2,3,
4
,6,
7
tellur
Te
2,
4,
6
ferm
Fm
2
,3
bohr
Bh
7
polon
Po
2,
4,
6
mendelew
Md
2
,3
żelazo
Fe
2,
3
,6
fluor
F
1
iterb
Yb
2,
3
ruten
Ru
2,3,
4
,6,8
chlor
Cl
1,
3,5,7
nobel
No
2,
3
has
Hs
7
brom
Br
1,
3,5,7
lutet
Lu
3
kobalt
Co
2,
3
jod
I
1,
3,5,7
lorens
Lr
3
osm
Os
3,
4,
6,8
astat
At
1,
3,5,7
Metale w stanie rodzimym: Siarka, Srebro, Złoto,
Metale ciężkie: Mangan, Nikiel, Złoto,
Metale reaktywne: Sód, potas, aluminium, glin
Stopy Żelaza: getyt, hematyt, kaolnit
Stopy Aluminium: znal, brąz, awional

Minerały:
1. Cynk: smitsonit, sfaleryt
2. Rtęd: cynobr, kalomel
3. Sód/soda: mirabilit, tenardyt, halit
4. Potas: kainit, sylwin, karnalit
5. Magnez: karnalit, dolomit, kizeryt,
6. Wapno: kalcyt, gips, apatyt
7. Aluminium: boksyt, kriolit, albit
8. Cyna: kasyteryt, stannin
9. Ołów: galena, anglezyt, cerusyt
10. Miedź: malachit, kowelin, chalkopiryt
11. Żelazo: magnetyt, syderyt, limonit,
Zastosowania i właściwości:
1. Potas (srebrzystobiały, miękki i lekki metal, lżejszy od wody): katalizator w chemii organicznej,
nawozy potasowe, silny reduktor w metalurgii, produkcja szkła i ceramiki
2. Magnez (najlżejszy z metali, srebrzystobiały, lśniący): wyrób sztucznych ogni i rakiet świetlnych,
produkcja cementu Sorela, w lecznictwie – środek przeczyszczający
3. Wapo (srebrzystobiały, stosunkowo lekki metal z połyskiem): w budownictwie jako materiały
wiążące (gips, wapno, cement), reduktor przy otrzymywaniu innych metali: Cu, Zr, Cr, V, Th, U, Fe i
stali
4. Glin/Aluminium (srebrzystobiały, lekki, kowalny): w przemyśle: elektrotechnicznym, chemicznym,
spożywczym, samochodowym, lotniczym. w budownictwie, w transporcie, do produkcji opakowao
5. Cyna (ciągliwy, kowalny, srebrzystobiały metal): główny materiał wyrobów użytkowych i
artystycznych (naczyo kuchennych), do produkcji materiałów ceramicznych i w przemyśle
szklarskim
6. Ołów (błyszczący metal o niebieskawym odcieniu, miękki i kowalny): na ekrany zabezpieczające
przed promieniowaniem γ i rentgenowskim, pojemniki do przechowywania i transportu nuklidów
promieniotwórczych, do wyrobu śrutu myśliwskiego i naboi, składnik farb antykorozyjnych, dodatek
do benzyn, do produkcji stopów
7. Tytan (stalowoszary lekki, twardy, wytrzymały mechanicznie metal): przemysł motoryzacyjny,
przemysł chemiczny i energetyczny, przemysł morski, lotnictwo, medycyna
8. Wanad (srebrzystoszary, kowalny, ciągliwy, twardy metal): katalizator stosowany w reakcjach
utleniania substancji organicznych i nieorganicznych, przy wytwarzaniu farb i lakierów, w
fotografice, do produkcji specjalnych gatunków szkieł, do wyrobu aparatury dla przemysłu
chemicznego
9. Chrom (srebrzystobiały metal o niebieskawym odcieniu, dobrze przewodzi ciepło i prąd
elektryczny): w garbarstwie i fotografice, do produkcji taśm magnetofonowych i
magnetowidowych, pigmenty do farb malarskich (żółty i zielony), do barwienia szkła, glazury i
porcelany, materiał do wytwarzania powłok ochronno- dekoracyjnych
10. Mangan (twardy srebrzystobiały metal o lekko różowawym połysku, reaktywny chemicznie):
dodatek do otrzymywania stali, do odbarwiania żelazistych szkieł, w pochłaniaczu masek
przeciwgazowych jako katalizator służący do oczyszczania powietrza z CO, w produkcji ogniw
galwanicznych, w lecznictwie jako antyseptyk i do dezynfekcji

11. Żelazo (srebrzystobiały, miękki, kowalny i ciągliwy metal, aktywny chemicznie) : tworzywo
konstrukcyjne w budownictwie, przemyśle maszynowym, samochodowym, chemicznym,
zbrojeniowym, w aero- i astronautyce, w przemyśle jądrowym, do budowy linii kolejowych i taboru
kolejowego, narzędzi
12. Kobalt (srebrzystobiały, ciągliwy, kowalny, miękki metal o różowawym odcieniu): w przemyśle
szklarskim i ceramicznym, wchodzi w skład witaminy B12, izotop
60
Co jest stosowany jako źródło
promieni γ w zwalczaniu nowotworów i w defektoskopii
13. Platyna (srebrzystobiały kowalny i ciągliwy metal, ma zdolnośd pochłaniania gazów, ulega
jedynie działaniu wody królewskiej): katalizatory, do celów jubilerskich i dentystycznych, w
fotografice, do wyrobu elektrod, tygli, parownic elementów grzewczych, termoogniw i
termometrów oporowych
14. Nikiel (srebrzystobiały metal o żółtawym odcieniu, dośd miękki, ciągliwy, dobrze spawalny,
wykazuje właściwości ferromagnetyczne): na elektrody lamp elektronowych i tygle, katalizator
(procesy utwardzania olejów roślinnych), na podzespoły w lotnictwie i kosmonautyce, do produkcji
akumulatorów niklowych Edisona
15. Miedź (czerwonobrązowy, kowalny i ciągliwy metal, bardzo dobrze przewodzi prąd elektryczny i
ciepło): do produkcji przewodów elektrycznych i trakcyjnych, do wyrobu silników, prądnic, taśm,
rur, osprzętu instalacji wodociągowej i kanalizacyjnej, składnik pigmentów do wyrobu farb, w
hutnictwie szkła i materiałów ceramicznych, dodatek stopowy oraz osnowa licznych stopów
16. Srebro (biały, kowalny i ciągliwy metal, bardzo dobrze przewodzi prąd i ciepło, jest najlepszym
przewodnikiem metalicznym): jubilerstwo, medal za drugie miejsce, w instrumentach muzycznych,
w dentystyce do wypełnieo, do produkcji monet
17. Złoto (żółty, błyszczący, miękki, kowalny i ciągliwy metal najbardziej kowalny i ciągliwy ze
wszystkich metali): do barwienia szkła i porcelany oraz złocenia, w technice fotograficznej i
stomatologii, do wyrobu przedmiotów ozdobnych i biżuterii
18. Cynk (metal niebieskawoszary, kruchy i niezbyt twardy): do produkcji blachy cynkowej, ogniw
suchych i kubków bateryjnych, do wykonywania form drukarskich, w malarstwie (biel cynkowa), w
lecznictwie (maśd cynkowa), ochrona wyrobów żelaznych i stalowych
19. Kadm (srebrzystobiały z lekkim odcieniem niebieskim, ciężki metal nieszlachetny, kowalny i
ciągliwy): pigmenty (żółcieo i oranż kadmowa) do celów artystycznych, używany w samoczynnych
gaśnicach i tryskaczach, przeciwpożarowych, do produkcji akumulatorów niklowo-kadmowowych
20. Rtęd (srebrzystobiały lśniący metal, ciekły w temperaturze pokojowej): w technologii chemicznej
oraz analizie chemicznej, w dentystyce, medium w termometrach i barometrach, przy wytwarzaniu
pestycydów, w medycynie
21. Wodór (bezbarwny, bezwonny i pozbawiony smaku gaz): do napędu silników rakietowych, do
utwardzania tłuszczów – przekształcanie tłuszczów ciekłych w stałe (margaryny), płyn kriogeniczny,
do napełniania balonów meteorologicznych
22. Węgiel (ciało stałe, czarny kolor, nierozpuszczalny w wodzie, brak smaku i zapachu): datowanie
znalezisk archeologicznych, do produkcji materiałów wybuchowych, wielu związków organicznych,
amoniaku i nawozów sztucznych, podstawowe źródło energii w przemyśle, tani środek redukujący
przy otrzymywaniu niektórych metali:
23. Krzem (kruche, twarde stalowoszare, krystaliczne ciało stałe z metalicznym połyskiem, niemetal):
produkcja półprzewodników (tranzystory, układy scalone i procesory), wytwarzanie silikonów (do
impregnacji tkanin, powłoki ochronne na wyrobach szklanych, smary i środki przeciwprzyczepne),
produkcja szkła i materiałów ceramicznych

24. Azot (gaz bezwonny i bezbarwny): surowiec wyjściowy do produkcji NH
3
, HNO
3
, nawozów
sztucznych: saletra amonowa, wapniowa, potasowa, sodowa, do napełniania żarówek, w kriogenice
25. Fosfor(niemetal, aktywny chemicznie, nie przewodzi prądu): fosfor biały - do produkcji
czerwonego fosforu, środków do deratyzacji oraz związków fosforowych – głównie nawozów, fosfor
czerwony - w produkcji zapałek, ogni sztucznych, do produkcji bomb zapalających i wytwarzania
zasłon dymnych
26. Tlen (bezbarwny, bezwonny, pozbawiony smaku gaz): niezbędny do życia (oddychanie), w
medycynie do ułatwienia oddychania ciężko chorym, aparaty tlenowe (kosmonauci i lotnicy,
alpiniści, nurkowie), do napędu silników rakietowych
27. Siarka (niemetal, źle przewodzi ciepło, nie przewodzi prądu elektrycznego): do produkcji H
2
SO
4
,
celulozy, barwników, tworzyw sztucznych, ogni sztucznych, zapałek, akumulatorów
samochodowych, w wulkanizacji kauczuku, w medycynie przy chorobach skóry, środek do
zwalczania pasożytów roślinnych
28. Chlor (zielonożółty gaz o ostrej woni, silnie toksyczny, bardzo reaktywny): do syntez organicznych,
środek bielący w przemyśle włókienniczym i celulozowym, środek dezynfekujący do odkażania wody
do picia oraz w basenach, w produkcji rozpuszczalników, barwników i tworzyw sztucznych
29. Argon (gaz szlachetny, praktycznie niereaktywny, bezbarwny, bezwonny): do napełniania
żarówek, do celów iluminacyjnych i reklamowych, jako gazy ochronne w operacjach spawania i
cięcia metali
Gęstości:
1. Cynk – 7,14 g/cm
3
2. Potas – 0,86 g/cm
3
3. Chrom – 7,17 g/cm
3
4. Miedź – 8,95 g/cm
3
Otrzymywanie metali w procesach:
1. Zawiesinowych: Miedź, Krofta,
2. Wielopiecowych: Żelazo, Pidera
3. ISP: parkesa, srebro
4. DOWNA: Sód
Dokoocz reakcje:
AL(OH)
3
+NaOHNaAlO
2
+2H
2
O
NaAlO
2
+2H
2
OAl(OH)
3
+NaOH
2Al(OH)
3
Al
2
O
3
+3H
2
O
Fe
2
O
3
+CO2Fe
3
O
4
+CO
2
SnO
2
+2CSn+2CO
Temperatura w której zachodzi proces elektrolizy Al
2
O
3
: 950*C
Wapno palone: CaCO
3
CaO+CO
2
Wapno gaszone: CaO+H
2
OCa(OH)
2
Reakcje zachodzące w katodzie roztworów wodnych:
MgCl
2
Sól przechodzi w wodorotlenek
KCl
A: Cl
2
A: Cl
2
K: H
2
K: H
2
Podaj co wydziela się na anodzie i katodzie:
Związek
CuCl
2
ZnSO
4
KNO
3
AgNO
3
MgCl
2
Anoda
Cl
2
O
2
O
2
Cl
2
Cl
2
Katoda
Cu
Zn
H
2
Ag
H
2

Metoda Downsa - elektroliza drobnokrystalicznej mieszaniny NaCl z CaCl
2.
.ze względu na swą dużą
aktywnośd chemiczną wydzielający się sód na żelaznej katodzie musi byd starannie chroniony przed
zetknięciem się z powietrzem jak i chlorem powstającym na grafitowej anodzie
1. Reakcja sumaryczna - 2NaCl→2Na(I)+Cl
2
(g)
2. Reakcja katodowa - Na
+
+e→Na(I)
3. Reakcja anodowa - 2Cl
-
-2e→Cl
2
(g)
Aluminotermia - proces metalurgiczny otrzymywania metali poprzez redukcję ich tlenków sproszkowanym
lub zgranulowanym aluminium. substraty tworzą mieszankę termitową, która reaguje z wydzieleniem
dużych ilości ciepła, na skutek czego jej temperatura dochodzi do 3000 K
otrzymywanie tytanu - proces Krolla - proces skomplikowany i bardzo drogi. chlor jest przepuszczany
poprzez gorący rutyl albo ilmenit w obecności węgla w celu otrzymania TiO
2
+ 2Cl
2
+ 2C → TiCl
4
+ 2CO
otrzymany chlorek jest skraplany, oczyszczany poprzez destylację frakcyjną i redukowany w temperaturze
800 °C magnezem w atmosferze argonu 2Mg + TiCl
4
→ 2MgCl
2
(l) + Ti
Metoda Parkesa - metoda wydzielania srebra z rud ołowiu zawierających jego domieszki
Piana srebronośna – półprodukt w procesie rafinacji ołowiu
Wyszukiwarka
Podobne podstrony:
sciagaCHEMIA2, Chemia, sciaga chemia
Chemia 2 ściąga (klasówka aldehydy alkohole estry kw karb ?nole)
CHEMIA-Sciaga
chemia sciaga, politechnika, IVsemestr
chemia ŚCIĄGA
chemia ściaga
chemia ściąga, Budownictwo Studia, Rok 1, chemia
Chemia - ściąga - alkohole, Chemia, 3 gimnazjum, Alkohole
chemia chemia sciaga
chemia, sciaga-egz-test b, 1
chemia, sciaga-egz-test b, 1
chemia ściąga
chemia sciaga kolo I, Studia PG, Semestr 02, Chemia, Koło
chemia sciąga, Chemia, Chemia(1)
chemia sciaga, studia, PK - WIŚ -UCZ, Semestr I, Chemia
chemia sciąga, Chemia, Chemia(1)
Chemia ściąga test K
Chemia ściąga test K
więcej podobnych podstron