IMIĘ I NAZWISKO
Mariusz Kijak |
Ćwiczenie C - 4
WYZNACZANIE WARTOŚCI CLEMENSA - DESOMESA |
||
ROK I KIERUNEK
Fizyka Medyczna
rok I
|
|
||
|
OCENA |
OCENA |
OCENA |
PROWADZĄCY
prof. Krzesińska
|
DATA
PODPIS |
DATA
PODPIS |
DATA
PODPIS
|
1. Cel Ćwiczenia
Wyznaczenie wartości κ dla powietrza metodą Clemensa - Desormesa
2. Część Teoretyczna
W ćwiczeniu, które przeprowadziłem należało wyznaczyć stosunek ciepła właściwego przy stałym ciśnieniu do ciepła właściwego przy stałej objętości. Zależność ta jest w skrócie nazywana grecką literą kappa - κ. Pomiar ten przeprowadzałem przez poddanie gazu o ciśnieniu p = ciśnieniu atmosferycznemu o temperaturze t = temp. otoczenia, który znajdował się w naczyniu zamkniętym trzem kolejnym przemianom:
Pierwsza przemiana - izotermiczna - zmieniam ciśnienie p gazu na ciśnienie p + h, za pomocą pompki, pozostawiając stałą temperaturę t. Objętość jest równa V.
Przemiana izotermiczna - przemiana termodynamiczna zachodząca przy stałej temperaturze ( T = const).
Prawo Boyle'a - Mariotte'a - prawo przemiany izotermicznej dla gazu doskonałego:
W izotermicznej przemianie stałej masy gazu iloczyn jego ciśnienia p i objętości V jest stały:
![]()
Mogę też powiedzieć, że ciśnienie gazu jest odwrotnie proporcjonalne do jego objętości. Wykres tej zależności nazywa się izotermą (jest nią w układzie (p,V) hiperbola):
Kolejna przemiana - adiabatyczna - otwieram kurek i przez około 2 sekundy naczynie jest połączone z atmosferą. Gaz rozprężając się do ciśnienia p wykonuje pracę, a jego temperatura t zmienia się o ∆t. Następuje również zmiana objętości z V do objętości V'
Przemiana adiabatyczna - przemiana termodynamiczna, która przebiega bez przepływu ciepła (Q = 0) i materii (m = const) między układem a otoczeniem.
Równanie przemiany adiabatycznej (Równanie Poissona):
Równanie opisujące zależność między objętością V gazu doskonałego, a jego ciśnieniem p w przemianie adiabatycznej:
![]()
κ - jest stosunkiem ciepła właściewego gazu pod stałym ciśnieniem cp do ciepła właściwego gazu przy stałej objętości cv :

Kappa dla gazów wynosi:
dla gazów jednoatomowych c = 5/3
dla gazów dwuatomowych κ = 7/5
dla gazów wieloatomowych κ = 4/3.
Wykresem przemiany adiabatycznej w układzie (p,V) jest adiabata:
Trzecia przemiana - izochoryczna - po zamknięciu kurka gaz, objętość gazu pozostaje stała V' = const. Temperatura gazu zmienia się do temperatury otoczenia, która jest wyższa nią temp. gazu. Natomiast ciśnienie wzrasta do p + h'
Przemiana izochoryczna - przemiana termodynamiczna zachodząca przy stałej objętości (V = cosnt).
Prawo Charles'a - prawo przemiany izochorycznej gazu doskonałego:
W izochorycznej przemianie stałej masy gazu ciśnienie jest wprost proporcjonalne do jego temperatury bezwzględnej:
![]()
![]()
p - ciśnienie stałej masy gazu w temperaturze t wyrażonej w skali Celsjusza
p0 - ciśnienie tego gazu w 0˚C
β = (273,15˚C)-1 - współczynnik termicznej prężności gazu,
Wykres tej zależności nazywa się izochorą (jest nią w układzie (p,T) linia prosta przechodząca przez początek układu):
Trzy kolejne stany gazowe charakteryzuję następujące wielkości:
I stan:
p + h - ciśnienie
V - objętość
t - temperatura
II stan:
p - ciśnienie
V' - objętość
t - ∆t - temperatura
III stan:
p + h' - ciśnienie
V' - objętość
t - temperatura
Ponieważ gaz posiada tę samą temperaturę w stanie pierwszym jak i w trzecim, związek pomiędzy początkową i końcową objętością oraz ciśnieniem można wyrazić za pomocą prawa Boyle'a i Mariotte'a
![]()
Przemiana adiabatyczna przebiega zgodnie z prawem Poissona
![]()
Wzór pierwszy zapisuję w następującej postaci:
![]()
Drugi w postaci:

Po wykonaniu podstawień otrzymuję:

Po logarytmowaniu i wykonaniu prostych obliczeń otrzymuję:
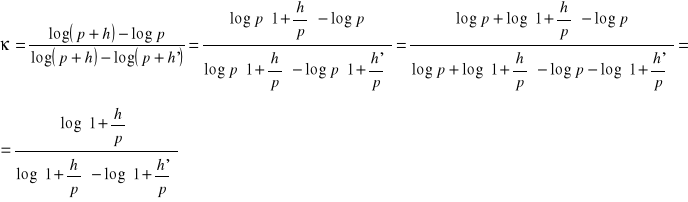
Na podstawie definicji, że dla małych wartości x log(1+x) = x mogę zapisać w moim przypadku, że 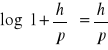
oraz 
Otrzymuję:

![]()
3. Przyrządy pomiarowe
Naczynie zamknięte (butla) połączone z pompką przy pomocy kurka
Manometr cieczowy
4. Przebieg ćwiczenia
Ustawiam kurek w takim położeniu aby butla była połączona z pompką i wypompowuje pewną ilość powietrza, a następnie zamykam kran.
Odczekuje chwilę, aby temperatura gazu zrównała się z temperaturą otoczenia, a następnie odczytuje różnicę poziomów h cieczy w manometrze
Na krótką chwilę ustawiam kurek w takim położeniu aby butla połączona była z atmosferą. Gdy ciśnienie spadnie do wartości ciśnienia atmosferycznego, zamykam kran i odczekuję chwilę, aż powietrze podgrzeje się do temperatury otoczenia, a następnie odczytuję wskazanie manometru h'
Powtarzam pomiary z punktów 1 - 3 dziesięć razy.
Wyniki pomiarów przedstawiam w tabelce
Dla każdego pomiaru obliczam κ
Obliczam średnią wartość κ i odchylenie standardowe średniej arytmetycznej
Obliczam niepewność ∆κ zakładając poziom ufności ά = 0.95 według rozkładu Studenta - Fishera
5. Wyniki pomiarów
L.p. |
Zmiana ciśnienia h [cm] |
Zmiana ciśnienia h' [cm] |
Stosunek Cp do Cv κ |
1 |
10.3 |
2.9 |
1.39 |
2 |
10.5 |
3.4 |
1.48 |
3 |
9.2 |
2.5 |
1.34 |
4 |
9 |
2.7 |
1.43 |
5 |
9 |
2.6 |
1.41 |
6 |
9 |
2.7 |
1.39 |
7 |
7 |
1.6 |
1.30 |
8 |
7 |
1.5 |
1.27 |
9 |
9.3 |
3.1 |
1.39 |
10 |
9.9 |
3.1 |
1.45 |
6. Obliczenia
Obliczyłem κ dla każdego pomiaru ze wzoru ![]()
Obliczam średnią wartość κ ze wzoru 
![]()
![]()
Obliczam odchylenie standardowe metodą Studenta Fishera dla założonego poziomu ufności ά = 0.95


![]()
![]()
Współczynnik Studenta Fishera dla założonego poziomu ufności ά = 0.95 i dziesięciu pomiarów n = 10 wynosi tά = 2.3
Wykonuje obliczenia
![]()
Wartość κ jest równa:
![]()
7. Wnioski
Tablicowa wartość κ wynosi 1.40.
Wynik, który otrzymałem jest bliski wartości tablicowej.
κ jest wielkością niemianowaną.
Sądzę, że doświadczenie zostało wykonane w sposób prawidłowy i że otrzymane wyniki są zadowalające.
![]()
Wyszukiwarka
Podobne podstrony:
Cw 20 - Wyznaczanie stosunku cp-cv dla powietrza metoda Clementa-Desormesa, Studia, Budownictwo UTP,
27 wyznaczanie wartości kappa dla powietrza
Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa De
10 WYZNACZANIE STOSUNKU Cp Cv DLA POWIETRZA METODĄ CLEMENTA DESORMESA(1)
Wyznaczanie stosunku Cp,Cv dla powietrza metodą Clemensa Desormesa
Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa Desormesa
6 Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa Desormesa
Wyznaczanie stosunku CpCv dla powietrza metodą, POLITECHNIKA CZ˙STOCHOWSKA
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
Cw20-2 - Wyznaczanie stosunku cp-cv dla powietrza metoda Cle, PRENTKI PIOTR
106, LAB106M(1), ˙w.nr.106 Temat: Wyznaczanie stosunku H=Cp/Cv dla powietrza metod˙
Wyznaczenie stosunku Cp Cv dla powietrza metod Clementa Desormesa
Współczynnika Kappa dla powietrza 2, fff, dużo
Współczynnika Kappa dla powietrza, fff, dużo
C4 Wyznaczanie kappa metodą Clementa Desormesa
Wyznaczanie stosunku CP do CV dla powietrza i dwutlenku węgla metodą akustyczną, Numer ćwiczenia
więcej podobnych podstron
