Grupa 34 Zespół 10 |
Ćwiczenie nr 2 |
Data: 08 11 2000 |
Kijowska Lilla Kołton Monika Kapelko Tomasz |
Temat: Wyznaczanie stałej szybkości reakcji zmydlania estru metodą konduktometryczną. |
Ocena : |
Wstęp teoretyczny.
Hydroliza estrów jest reakcją katalizowaną kwasami lub zasadami. Reakcja katalizowana kwasami jest odwracalna, w obecności kwasów prowadzi się przecież syntezę estrów z kwasów i alkoholi. Natomiast zasady nie tylko katalizują hydrolizę, ale w ilościach stechiometrycznych są zużywane w reakcji.
CH3COOC2H5 + KOH = CH3COOK + C2H5OH
Podczas reakcji ilość jonów w roztworze jest stała. Jony OH- zastępowane są przez jony octanowe. Te dwa rodzaje jonów różnią się ruchliwością. Jony OH- wykazują bardzo wysoką ruchliwość. Zastąpienie ich jonami octanowymi powoduje znaczne zmniejszenie przewodnictwa elektrycznego r-ru. Stanowi to podstawę metody pomiaru wykorzystywanej w ćwiczeniu.
O przewodnictwie elektrycznym r-ru decyduje obecność jonów. Na początku reakcji w mieszaninie będą tylko jony OH- i K+ w stężeniu równym początkowym stężeniom.
Przewodnictwo właściwe κ będzie równe:
![]()
gdzie:
λ - przewodnictwo graniczne,
C0 - stężenie początkowe.
Zadania do wykonania.
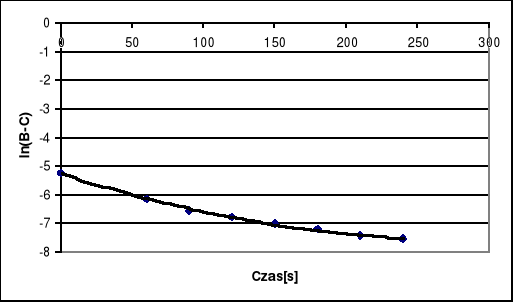
Sporządzić wykres1/(B-C), gdzie B - przewodnictwo właściwe w czasie t, C - przewodnictwo właściwe w czasie t = ∞.
Wyznaczyć stałą szybkości reakcji.
Wykonanie ćwiczenia.
W zadanej temperaturze T = 308K za pomocą konduktometru dokonujemy pomiaru przewodnictwa mieszaniny reakcyjnej.
W obliczeniach stosujemy wzór:
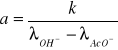
gdzie:
k - stała szybkości reakcji,
a - współczynnik kierunkowy prostej (a = tg α)
α - kąt nachylenia prostej do osi x.
Obliczenia i pomiary.
T = 308 [K]
λOH- - 0.02382 [m2/Ω⋅mol]
λAcO- - 0.0056 [m2/Ω⋅mol]
C0,ZASADY - 0.24 [mol/dm3]
C0,ESTRU - 0.24 [mol/dm3]
Lp. |
Przewodnictwo właściwe (B) [1/Ω⋅m] |
Czas [s] |
1/(B-C) |
ln (B-C) |
1 |
0.01150 |
0 |
189 |
-5.24 |
2 |
0.00836 |
60 |
469 |
-6.15 |
3 |
0.00765 |
90 |
704 |
-6.56 |
4 |
0.00736 |
120 |
884 |
-6.78 |
5 |
0.00713 |
150 |
1111 |
-7.01 |
6 |
0.00696 |
180 |
1370 |
-7.22 |
7 |
0.00683 |
210 |
1667 |
-7.42 |
8 |
0.00675 |
240 |
1923 |
-7.56 |
9 |
0.00623 (C) |
1620 |
- |
- |
10 |
0.00623 (C) |
1920 |
- |
- |
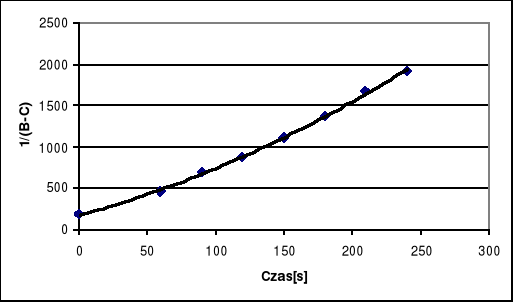
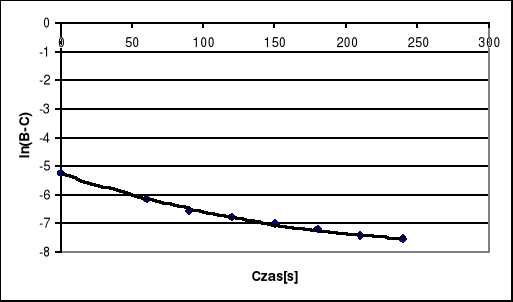
Wykres ln(B-C) = f (t).
Stała szybkości drugorzędowej reakcji reakcji zmydlania estru wynosi: k = 0.5606.
Wnioski.
Po wykreśleniu funkcji ![]()
nie otrzymujemy żądanej linii prostej lecz funkcję wykładniczą, również wykres ![]()
nie stanowi prostej co potwierdza przypuszczenia iż badana reakcja nie jest pierwszorzędowa. Jeżeli badana reakcja byłaby rzeczywiście drugorzędowa to pierwszy wykres powinien stanowić linę prostą. Wobec tak różniącego się wykresu wnioskujemy, że na jego przebieg miała wpływ temperatura. Początkowo punkty przybierały wartości prawidłowe dla przebiegu prostej lecz po upływie blisko 2000 [s] ciecz wytermostatowana do temperatury 308 [K] uległa stopniowemu ochłodzeniu w temperaturze otoczenia wynoszącej około 291 [K], co spowodowało odchylanie się punktów na wykresie, a tym samym wywołało jego wykładniczy przebieg.
Wyszukiwarka
Podobne podstrony:
4766
4766
4766
4766
4766
4766
4766
4766
4766
4766
praca-licencjacka-b7-4766, Dokumenty(8)
a lot of various circuits index 6628613 25 4766
1332098497 4766 TS 590 TX modification
więcej podobnych podstron