Tromboliza - leczenia świeżego zawału serca poza ośrodkami referencyjnymi
Drukuj
Opublikowane: 2005-01-17 w kardiolog.pl
Słowa kluczowe: zawał serca angioplastyka choroba wieńcowa angiografia wieńcowa aspiryna morfina Tromboliza markery ostrych zespołów wieńcowych troponiny kinaza kreatyninowa r-TPA streptokinaza alteplaza
Dziedzina : kardiologia kardiologia interwencyjna
W tym temacie
zawał serca , angioplastyka , choroba wieńcowa , angiografia wieńcowa , aspiryna , morfina , Tromboliza , markery ostrych zespołów wieńcowych , troponiny , kinaza kreatyninowa , r-TPA , streptokinaza , alteplaza
W ciągu ostatnich 30 lat obserwuje się stały spadek umieralności z powodu choroby niedokrwiennej serca na podłożu miażdżycy. Ocenia się, że w USA liczba zgonów z powodu choroby wieńcowej zmniejszyła się o połowę od 1970 roku. Mimo tej tendencji jest ona wciąż najczęstszą przyczyną zgonów w krajach uprzemysłowionych. Wśród osób z chorobą wieńcową pacjenci po zawale stanowią podgrupę wysokiego ryzyka zgonu, które ocenia się na 20% w ciągu trzech lat.
Najnowsze dane wskazują, że obserwowana w ostatnich latach poprawa wskaźników umieralności z powodu choroby wieńcowej nie wynika ze zmniejszenia zapadalności, ale głównie z udoskonalenia metod leczenia świeżego zawału oraz większego nacisku na prewencję wtórną. W latach 50-tych i 60-tych, dzięki dużym badaniom kohortowym nad chorobą wieńcową wyodrębniono grupę najważniejszych nabytych czynników ryzyka choroby wieńcowej (a także zawału serca), do których należą między innymi: nadciśnienie tętnicze, hiperlipidemia, palenie tytoniu, cukrzyca.
W Polsce każdego roku na zawał mięśnia sercowego zapada około 100 tysięcy osób i pomimo istotnego postępu w leczeniu, śmiertelność w zawale mięśnia serca pozostaje nadal wysoka. W okresie przedszpitalnym umiera 23-35% chorych, w czasie hospitalizacji 7-15% i w okresie następnych 12 miesięcy ok. 5-10% - zależnie od stosowanych metod leczenia.
Dlatego wielokrotnie podkreśla się jak ważne jest właściwe monitorowanie choroby sercowo-naczyniowej w populacji. Umożliwia to bowiem badaczom analizę potencjalnych czynników przyczynowych i ocenę skuteczności różnych interwencji profilaktycznych, takich jak zmiana diety czy stylu życia oraz skuteczności leków. Zapadalność na zawał serca i częstość występowania zawałów dokonanych są ważnymi wskaźnikami epidemiologicznymi. Wprowadzenie w ostatnich latach nowych, czulszych kryteriów diagnostycznych zawału serca spowoduje wzrost liczby rejestrowanych zawałów serca i zmniejszenie częstości zgonów.
Według wytycznych Światowej Organizacji Zdrowia (WHO) zawał mięśnia sercowego rozpoznajemy w przypadku wystąpienia 2 z 3 następujących cech: typowych objawów podmiotowych (dyskomfortu w klatce piersiowej), wzrostu aktywności określonych enzymów w osoczu oraz typowych zmian w elektrokardiogramie (EKG), obejmujących pojawienie się załamków Q.
Obecność i rozmiar uszkodzenia mięśnia sercowego spowodowanego długotrwałym niedokrwieniem, można ocenić za pomocą różnych metod, w tym badania anatomopatologicznego, oznaczeń białek mięśnia sercowego we krwi, EKG (zmian ST-T i załamków Q), czy technik obrazowania, takich jak scyntygrafia perfuzyjna mięśnia sercowego, echokardiografia i wentrykulografia kontrastowa.
Powstająca w wyniku zawału serca martwica prowadzi do pojawienia się we krwi różnych białek uwalnianych z uszkodzonych miocytów, takich jak mioglobina, troponiny sercowe T i I, kinaza kreatynowa, dehydrogenaza mleczanowa i wiele innych, na podstawie których można rozpoznać świeży zawał mięśnia sercowego (i jego martwicę). Zawał serca rozpoznajemy, gdy stężenia we krwi czułych i swoistych markerów, takich jak troponina sercowa i frakcja MB kinazy kreatynowej (CK-MB), są zwiększone w obecności klinicznych objawów ostrego niedokrwienia. Markery te odzwierciedlają uszkodzenie mięśnia sercowego, ale nie mówią nic o jego mechanizmie. Jeżeli więc zwiększonym wartościom tych markerów nie towarzyszą kliniczne symptomy niedokrwienia, należy szukać innych przyczyn uszkodzenia serca, na przykład zapalenia mięśnia sercowego.
Obecnie preferowanym biochemicznym markerem uszkodzenia mięśnia sercowego jest sercowa troponina I lub T, którą charakteryzuje prawie całkowita swoistość dla kardiomiocytów oraz duża czułość (powyżej 90%), dzięki czemu można wykryć nawet mikroskopijne ogniska martwicy.
Zgodnie z wytycznymi ESC/ACC/WHO biochemicznymi wskaźnikami martwicy mięśnia sercowego są:
- maksymalne stężenie troponiny T lub I przekraczające granicę decyzyjną (99. percentyl wartości w referencyjnej grupie kontrolnej) w co najmniej jednej próbce krwi w czasie 24 godzin po incydencie klinicznym.
- stężenie CK-MB powyżej 99. percentyla wartości w referencyjnej grupie kontrolnej w 2 kolejnych próbkach krwi, lub maksymalna wartość przekraczająca 2-krotnie górną granicę normy dla danego laboratorium w jednej próbce krwi podczas pierwszych godzin po incydencie klinicznym. Wartości CK-MB powinny wzrastać i spadać; utrzymujące się bez zmian zwiększone wartości CK-MB prawie nigdy nie są wynikiem zawału serca.
- w przypadku niedostępności testów do oznaczania troponiny lub CK-MB można oznaczać całkowitą aktywność CK (>2-krotny wzrost ponad górną granicę przedziału referencyjnego) lub frakcję B CK, ale markery te są znacznie mniej wiarygodne niż CK-MB.
- do diagnostyki zawału (uszkodzenia) serca nie powinno się wykorzystywać oznaczeń aminotransferazy asparaginianowej (AST), dehydrogenazy mleczanowej ani jej izoenzymów.
EKG może ujawnić cechy typowe dla niedokrwienia mięśnia sercowego, czyli charakterystyczne zmiany odcinka ST i załamka T, jak również cechy martwicy mięśnia sercowego, charakteryzujące się zmianami zespołu QRS.
Według aktualnie obowiązujących wytycznych świeży lub będący w fazie ewolucji zawał serca rozpoznajemy na podstawie standardowego 12 odprowadzeniowego EKG w przypadku stwierdzenia następujących zmian EKG:
- uniesienie odcinków ST: świeże lub przypuszczalnie świeże uniesienie odcinka ST w punkcie J co najmniej w 2 sąsiednich odprowadzeniach: o &ge0,2 mV w odprowadzeniach V1, V2 lub V3 i &ge0,1 mV w pozostałych (odprowadzenia sąsiednie w płaszczyźnie czołowej to kolejno: aVL, I, odwrócone aVR, II, aVF, III).
- brak uniesienia odcinków ST: obniżenie odcinków ST w poszczególnych odprowadzeniach lub tylko nieprawidłowe załamki T.
Techniki obrazowania stosuje się w celu wykluczenia lub potwierdzenia świeżego zawału lub niedokrwienia w oddziale pomocy doraźnej; wykrycia pozaniedokrwiennych przyczyn bólu w klatce piersiowej; ustalenia rokowania krótkoterminowego i odległego; wykrycia mechanicznych powikłań zawału.
Jedną z głównych zalet echokardiografii jest możliwość wykrycia większości pozaniedokrwiennych przyczyn ostrego bólu w klatce piersiowej, takich jak zapalenie mięśnia sercowego i osierdzia, zastawkowa choroba serca, zatorowość płucna i choroby aorty (np. rozwarstwienie). Badania izotopowe umożliwiają lekarzowi ocenę perfuzji przy przyjęciu chorego. Odznaczają się one dużą dokładnością, pod warunkiem interpretacji wyników przez osoby doświadczone. Ponadto jednocześnie uzyskuje się informacje o perfuzji i czynności mięśnia sercowego.
W diagnostyce świeżego zawału serca przydatna bywa echokardiografia dwuwymiarowa, ponieważ umożliwia wykrycie odcinkowych zaburzeń ruchomości ściany serca (akineza, dyskineza, hipokineza) w ciągu kilku minut od wystąpienia uszkodzenia niedokrwiennego. Dzięki niej można określić zarówno lokalizację, jak i rozległość zawału. Echokardiografia lub scyntygrafia wykonana we wczesnym okresie po wystąpieniu objawów podmiotowych jest bardzo pomocna w ocenie chorych z podejrzeniem świeżego zawału serca i EKG niediagnostycznym lub trudnym do interpretacji. W przypadku wczesnej diagnostyki obrazowej u takich chorych, prawidłowy wynik echokardiografii lub spoczynkowej scyntygrafii perfuzyjnej (SPECT) z użyciem technetu 99m pozwala wykluczyć świeży zawał, ponieważ wartość predykcyjna wyniku ujemnego, oceniana względem CK-MB jako "złotego standardu" wynosi odpowiednio 95% do 98%.
Często największe zagrożenie dla pacjentów z zawałem serca stanowi okres przedszpitalny. W ciągu pierwszych dwóch godzin od początku bólu zawałowego występuje około 30% wszystkich zgonów. Większość chorych umiera z powodu migotania komór. Osoby te można byłoby uratować, gdyby w momencie wystąpienia tej arytmii znajdowali się w szpitalu lub chociażby w karetce reanimacyjnej. Niezmiernie ważne jest, aby nie zwlekać z wezwaniem pogotowia, gdy ból wieńcowy trwa długo i nie mija po nitroglicerynie. Od szybkiego dotarcia pacjenta do szpitala zależy bowiem jego życie i przyszłe zdrowie, ponieważ tylko szybka interwencja lecznicza stwarza szansę ograniczenia strefy zawału.
W okresie przedszpitalnym ważne jest, aby włączyć właściwe postępowanie mające na celu opanowanie bólu, duszności i lęku oraz wczesne rozpoczęcie leczenia reperfuzyjnego.
Według najnowszych wytycznych ESC (2003) należy postępować zgodnie z poniższym schematem:
- opioidy dożylnie (4-8 mg morfiny i dodatkowe dawki po 2 mg w odstępach 5-minutowych),
- tlen (2-4 l/min) w razie duszności lub niewydolności serca,
- kwas acetylosalicylowy (ASA)
- należy rozważyć dożylne podanie beta-blokerów lub azotanów, jeśli opioidy nie uśmierzyły bólu,
- pomocne mogą być leki uspokajające.
Chory ze świeżym zawałem serca powinien być hospitalizowany na oddziale reanimacyjnym. W oddziale pacjent nadal powinien oddychać powietrzem wzbogaconym w tlen, należy także prowadzić dalszą walkę z bólem. Zwalczanie bólu jest bardzo ważnym elementem terapii, bowiem jest on czynnikiem wstrząsorodnym, tzn. może się przyczynić do wystąpienia głębokiego spadku ciśnienia i nasilenia zaburzeń przepływu krwi przez narządy wewnętrzne, co może zadecydować o niepomyślnym przebiegu zawału. Pacjent musi być monitorowany - śledzony jest stale zapis EKG w celu uchwycenia zaburzeń rytmu, mierzone jest ciśnienie tętnicze i ciśnienie parcjalne tlenu we krwi włośniczkowej.
W trybie pilnym, po zebraniu wywiadu od chorego i wykluczeniu przeciwwskazań, wdrażane jest leczenie fibrynolityczne (trombolityczne). Korzyści z zastosowania terapii trombolitycznej są tym większe, im wcześniej zostanie ona wdrożona, licząc od momentu wystąpienia bólu w klatce piersiowej. Największe korzyści obserwuje się w ciągu 1-2 godzin od początku objawów. Leki trombolityczne obniżają śmiertelność o 30%, jeśli podane są w ciągu pierwszych 6 godzin od wystąpienia objawów zawału i aż o 44-50%, jeśli zdążymy je podać w ciągu 1-2 godzin od początku bólu zawałowego. Na podstawie przeprowadzonych badań z leczeniem trombolitycznym wywnioskowano, że jego wdrożenie może przynosić korzyści do około 12 godzin od pierwszych objawów zawału. Przed wprowadzeniem leczenia fibrynolitycznego należy uwzględnić przeciwwskazania do stosowania tej grupy leków.
W leczeniu trombolitycznym najszersze jak dotąd zastosowanie znalazła streptokinaza. Streptokinaza oraz APSAC (acylowany kompleks streptokinazy z plazminogenem) należą do leków fibrynolitycznych pierwszej generacji. Stosowany rzadziej lek trombolityczny drugiej generacji - tkankowy aktywator plazminogenu (t-PA, alteplaza) charakteryzuje się większym powinowactwem do fibryny w porównaniu ze streptokinazą. W związku z tym dochodzi do lokalnego nagromadzenia enzymu i substratu w miejscu występowania zakrzepu, co sprzyja powstawaniu plazminy. Obecnie t-PA otrzymywany jest drogą inżynierii genetycznej. Wyodrębnienie na chromosomie 8 genu odpowiedzialnego za syntezę ludzkiego t-PA i wprowadzenie go do komórki Escherichia coli umożliwiło otrzymanie rekombinowanego tPA (rt-PA). Niestety, jego cena kilkakrotnie przewyższa cenę streptokinazy.
Wciąż trwają poszukiwania nowych leków fibrynolitycznych - bardziej skutecznych, bezpieczniejszych (mniej powikłań krwotocznych) i prostszych w stosowaniu. Leki te ma charakteryzować większe powinowactwo do fibryny, odporność na działanie inhibitorów oraz dłuższy okres półtrwania. Do nowych preparatów trombolitycznych tzw. trzeciej generacji, będących często dalszym udoskonaleniem i modelowaniem cząsteczki tkankowego aktywatora plazminogenu, należą tenekteplaza, reteplaza, lanoteplaza oraz anistreplaza. Poszczególne leki trombolityczne najnowszej generacji różnią się między sobą stopniem specyficzności względem fibryny, skutecznością trombolityczną wyrażoną obserwowaną zdolnością do reperfuzji oraz opornością na inaktywujące działanie inhibitora aktywatora plazminogenu typu 1.
Porównując poszczególne grupy leków trombolitycznych, ani w badaniu GISSI-2 (The second Global Use of Strategies to Open Occluded Coronary Arteries study) ani w ISIS 3 (Third International Study of Infarct Survival) nie wykazano różnicy umieralności między chorymi leczonymi streptokinazą, a leczonymi t-PA lub anistreplazą. Jednak w badaniu GUSTO I (First Global Utilisation of Streptokinase and Tissue Plasminogen Activator for occluded coronary arteries), w którym wykorzystano przyśpieszony schemat podawania t-PA (w ciągu 90 minut), wykazano, że leczenie alteplazą zmniejszało o 14,6% względne ryzyko zgonu oceniane w 30 dniu po zawale w stosunku do stosowanej standardowo streptokinazy. Podobne wyniki zaobserwowano w dwóch podobnych badaniach: INJECT (International Joint Efficacy Comparison of Thrombolysis) oraz GUSTO III (The third Global Use of Strategies to Open Occluded Coronary Arteries study).
W wielu badaniach porównywano zastosowanie odmian t-PA. Zaobserwowano m.in., że wstrzyknięcie rPA (reteplazy) nie wykazuje przewagi nad przyśpieszonym leczeniem t-PA, podobne wyniki osiągnięto w badaniach z zastosowaniem innych leków trombolitycznych trzeciej generacji. W związku z tym wybór leku fibrynolitycznego zależy od indywidualnej oceny ryzyka i korzyści oraz od takich czynników jak dostępność i koszt.
Na podstawie licznych zgromadzonych dotąd danych można jednoznacznie stwierdzić, że natychmiastowe leczenie świeżego zawału serca lekami fibrynolitycznymi i ASA - lekami, których efekty sumują się - przynosi niewątpliwą korzyść w zakresie chorobowości i umieralności.
Według ESC leki trombolityczne należy stosować zgodnie z następującymi schematami:
- streptokinaza (SK) - 1,5 mln j. w 100 ml 5% r-ru glukozy lub 0,9% NaCl dożylnie w ciągu 30-60 min.
- alteplaza (t-PA) - 15 mg i.v. (0,75 mg/kg i.v. w ciągu 30 min., następnie 0,5 mg/kg i.v. w ciągu 60 min.). Łączna dawka nie może przekraczać 100 mg
- reteplaza (r-PA) - 10 j. + 10 j. we wstrzyknięciu i.v. w odstępie 30 min.
- tenekteplaza - pojedyncze wstrzyknięcie i.v. - 30 mg u chorych o mc. <60 kg, 35 mg u chorych o mc. od 60 do 70 kg (<70), 40 mg u chorych o mc. od 70 do 80 kg, 45 mg u chorych o mc. do 80 do 90 kg i 50 mg u chorych o mc. ≥ 90 kg
- w przypadku każdego schematu leczenia fibrynolitycznego stosuje się równoczesne leczenie antytrombinowe (heparyna i.v. przez 24-48 h)
Beta-adrenolityki w leczeniu ostrych zespołów wieńcowych
Drukuj
Opublikowane: 2006-03-12 w kardiolog.pl
Słowa kluczowe: zawał serca NSTEMI ostry zespół wieńcowy Beta-blokery
Dziedzina : kardiologia
W tym temacie
Beta-adrenolityki (LBA) stosowane są w wielu chorobach sercowo-naczyniowych. Uważa się, że ich przyjmowanie jest bezpieczne przy przestrzeganiu odpowiedniego dawkowania i przy wcześniejszym wykluczeniu przeciwwskazań dla LBA. Zakończenie przyjmowania LBA powinno następować powoli i stopniowo, aby uniknąć objawów wynikających z odstawienia leku.
Świeży zawał serca (acute myocardial infarction - AMI)
U każdego chorego z ostrym zespołem wieńcowym z przetrwałym uniesieniem odcinka ST i bez przeciwwskazań zaleca się szybkie zastosowanie doustnych LBA [klasa zaleceń I, stopień wiarygodności danych A] [1]. W przypadku obecnego jednego z objawów: niedokrwienia opornego na opioidy, nawracającego niedokrwienia, nadciśnienia tętniczego, tachykardii lub tachyarytmii można podać LBA dożylnie (Tabela 1).
LBA zmniejszają obszar mięśnia sercowego objętego zawałem, ograniczają częstość zagrażających życiu zaburzeń rytmu serca, łagodzą uczucie bólu i zmniejszają umieralność (włączając nagłe zgony sercowe).
W badaniu ISIS-1 (First International Study of Infarct Survival) chorych z trwającą do 12 godzin ewolucją zawału serca, przydzielano w sposób losowy do grupy, otrzymującej atenolol dożylnie, a następnie doustnie w ciągu 7 dniu oraz do grupy przyjmującej leczenie standardowe. W wynikach uzyskano istotną redukcję umieralności w ciągu 7 dni (3.7% vs 4.6%) głównie poprzez zmniejszenie częstości pęknięć serca [2]. Natomiast w metaanalizie obejmującej wyniki 28 badań nad zastosowaniem LBA w AMI odnotowano istotną redukcję zgonów z 4.3% do 3.7% w obserwacji krótkoterminowej [3].
Analiza post hoc badania GUSTO-I (Global Utilization of Streptokinase and t-PA for Occluded coronary arteries) nie potwierdziła potrzeby rutynowego stosowania LBA drogą dożylną [4].
Badanie PAMI (Primary Angioplasty in AMI) jest próbą oceny korzyści, wynikających ze stosowania LBA przed angioplastyką tętnic wieńcowych (PCI) u chorych z AMI [5]. W badaniu tym zanalizowano 2 442 chorych i w obserwacji 6-miesięcznej wykazano większą redukcję śmiertelności w grupie osób otrzymujących LBA przed PCI w stosunku do grupy nieprzyjmującej LBA. Największe korzyści ze stosowania tej grupy leków odnieśli chorzy z frakcją wyrzutową <50% lub chorobą wielonaczyniową serca.
Prewencja wtórna po zawale mięśnia sercowego
U chorych po przebytym zawale mięśnia sercowego i bez przeciwwskazań do stosowania LBA zaleca się doustne przyjmowanie tej grupy leków do końca życia [klasa zaleceń I, stopień wiarygodności danych A] [1].
W najnowszych wytycznych europejskich, dotyczących leczenia świeżego zawału serca, przytoczono wyniki kilku dużych, długoterminowych badań, obejmujących grupę ponad 35 000 chorych po przebytym zawale mięśnia sercowego [1]. Wynika z nich, że stosowanie LBA u chorych po zawale mięśnia sercowego redukuje częstość zgonów i ponownych zawałów. Zmniejszenie obu powikłań przekłada się na wzrost przeżywalności o 20-25% u chorych otrzymujących LBA. Badania te wykazały korzyści (w porównaniu z placebo) ze stosowania takich LBA jak: propranolol, metoprolol, tymolol, acebutolol i karwedilol.
W metaanalizie 82 randomizowanych badań udowodniono skuteczność LBA w zmniejszaniu chorobowości i umieralności w prewencji wtórnej chorób sercowo-naczyniowych [6]. W 31 zanalizowanych, długoterminowych badaniach odnotowano 23% redukcję zgonów. Natomiast w obserwacji krótkoterminowej redukcja ta wyniosła 4%. Korzyści z otrzymywania LBA uzyskano w przypadkach jednoczesnego przyjmowania kwasu acetylosalicylowego, leku fibrynolitycznego lub inhibitora konwertazy angiotensyny (ACE-I).
W badaniu CAPRICORN (Carvedilol Post Infarct Survival Control in Left Ventricular Dysfunction) 1959 pacjentów z udokumentowanym zawałem 40%≤mięśnia sercowego oraz frakcją wyrzutową lewej komory zrandomizowano do dwóch grup, przyjmujących karwedilol lub placebo. W grupie karwedilolu wykazano istotną redukcję umieralności w porównaniu z grupą placebo (12% vs 15%) [7]. Korzyści ze stosowania karwedilolu były niezależne od równoległego przyjmowania przez chorych leku z grupy ACE-I.
Największe korzyści ze stosowania LBA uzyskują chorzy po zawale serca obciążeni dużym ryzykiem. Wykazano także, że leczenie LBA odnosi pozytywny skutek u chorych z cukrzycą insulinozależną, przewlekłą obturacyjną chorobą płuc, zaawansowaną chorobą tętnic obwodowych, umiarkowaną niewydolnością lewej komory serca oraz odstępem PR ≤0.24 sekundy. Jednak u tych chorych przyjmowanie LBA wymaga dodatkowego monitorowania w kierunku ewentualnego wystąpienia działań niepożądanych [8].
Ostry zespół wieńcowy bez uniesienia odcinka ST (non-ST elevation acute coronary syndrome-NSTE-ACS)
Chorzy z NSTE-ACSi bez przeciwwskazań dla LBA powinni jak najwcześniej otrzymać leki z tej grupy tak, aby maksymalnie ograniczyć niedokrwienie i zredukować prawdopodobieństwo wystąpienia świeżego lub ponownego zawału mięśnia sercowego [klasa zaleceń I, stopień wiarygodności danych B]. Podawanie dożylne LBA należy rozważać w przypadku chorych obciążonych dużym ryzykiem [klasa zaleceń II, stopień wiarygodności danych B] [9].
Wiadomości oceniające skuteczność wynikającą z zastosowania LBA u chorych z niestabilną chorobą wieńcową oparte są na niewielkiej liczbie randomizowanych badań oraz wykorzystaniu wiedzy uzyskanej ze stosowania LBA u chorych ze stabilną chorobą wieńcową oraz zawałem mięśnia sercowego. W NSTE-ACS korzyści ze stosowania LBA wynikają przede wszystkim ze zmniejszenia zapotrzebowania mięśnia sercowego na tlen.
W metaanalizie badań, porównujących LBA do placebo u chorych z niestabilną chorobą wieńcową, w pierwszej grupie wykazano 13% redukcję ryzyka progresji do zawału mięśnia sercowego [10]. Niestety nie udowodniono w tych mało liczebnych badaniach wpływu LBA na zmniejszenie częstości zgonów jako konsekwencji niestabilnej choroby wieńcowej.
Jak do tej pory brak jest dowodów dostarczających informacji o większych korzyściach stosowania konkretnego LBA w stosunku do innych lekami z tej grupy. Rozpoczęcie przyjmowania LBA wymaga monitorowania czynności życiowych pacjenta wraz ze stałą kontrolą EKG. Leczenie LBA drogą doustną powinno doprowadzić do osiągnięcia rytmu serca w granicach 50-60/min [9].
Podsumowanie
Stosowanie beta-adrenolityków należy wdrożyć u każdego chorego bez przeciwwskazań w ostrej fazie zawału mięśnia sercowego i następnie w prewencji wtórnej powikłań sercowo-naczyniowych. Mimo, że brak jest wielu dowodów, potwierdzających skuteczność LBA u chorych z ostrym zespołem wieńcowym bez uniesienia odcinka ST, należy dążyć do jak najszybszego podania tych leków.
Największych korzyści, wynikających z przewlekłego otrzymywania LBA, należy spodziewać się u chorych po przebytym zawale serca obciążonych dużym ryzykiem.
Porównanie skuteczności angioplastyki z leczeniem fibrynolitycznym w chorobie niedokrwiennej serca
Drukuj
Opublikowane: 2005-01-13 w kardiolog.pl
Słowa kluczowe: zawał serca angioplastyka choroba wieńcowa choroba niedokrwienna serca angiografia wieńcowa Udar mózgu DANAMI
Dziedzina : kardiologia kardiologia interwencyjna
W tym temacie
zawał serca , angioplastyka , choroba wieńcowa , choroba niedokrwienna serca , angiografia wieńcowa , Udar mózgu , DANAMI
Najbardziej optymalny sposób leczenia ostrego zawału serca jest wciąż wyzwaniem dla naukowców. Obecnie należy opowiedzieć się za jedną z dwóch podstawowych metod leczniczych: trombolizą lub przezskórną wewnątrznaczyniową angioplastyką wieńcową (PTCA), a decyzja, którą z metod wybrać, zależy nie tylko od czynników medycznych.
Porównując skuteczność obu metod w wielu randomizowanych badaniach wykazano, że najskuteczniejszym sposobem leczenia świeżego zawału serca jest pierwotna angioplastyka wieńcowa, ale wybór tej metody ograniczony jest możliwościami technicznymi i środkami finansowymi.
Jedno z pierwszych badań porównujących pierwotne przezskórne interwencje wieńcowe do leczenia fibrynolitycznego ukazało się w 1986 roku. Małe, randomizowane badanie, w którym wzięło udział 56 pacjentów sugerowało wyższość przezskórnych interwencji na naczyniach wieńcowych nad terapią streptokinazą, w poprawie funkcji lewej komory serca. [1]. W 1997 roku opublikowano w JAMA metaanalizę, ukazujących się od 1985 roku do 1996 roku, 10 badań. Analiza objęła 2606 pacjentów i porównywała leczenie streptokinazą lub tkankowym aktywatorem plazminogenu, z pierwotną przezskórną wewnątrznaczyniową angioplastyką wieńcową. Udowodniono znaczącą redukcją ponownych zawałów (o 47%) , śmiertelności (o 34%) i udarów krwotocznych w przeciągu 30 dni [2]. Pierwotna angioplastyka wieńcowa w porównaniu z leczeniem fibrynolitycznym pozwala uratować dodatkowo 21 chorych (w przeliczeniu na każde 1000 osób poddanych zabiegowi) i uniknąć poważnych powikłań trombolizy takich jak ponowne zawały i krwawienia [3].
CAPTIM badanie porównujące dwie najlepsze strategie udrażniania naczyń wieńcowych to prospektywne, randomizowane badanie obejmujące 1200 pacjentów rekrutowanych przez 2 lata, zaczęło się w 1997 roku [4]. Nie stwierdzono różnic w częstości występowania powikłań takich jak zgon, ponowny zawał lub udar mózgu pomiędzy grupami pacjentów leczonych przedszpitalną trombolizą (stwarzającą szansę wcześniejszego uzyskania reperfuzji) z następującą angioplastyką w szpitalu (najczęściej wcześniej zaplanowaną) a grupą pacjentów, u których wykonano pierwotną angioplastykę. Natomiast PCI jest metodą skuteczniejszą niż fibrynoliza szczególnie, gdy dolegliwości trwają więcej niż 2-3 godziny [5].
PCI jest najskuteczniejszą metodą reperfuzji naczyń wieńcowych w ostrym zawale mięśnia sercowego wykazało wieloośrodkowe, randomizowane badanie PRAGUE-2. Do badania włączono 850 pacjentów z objawami świeżego zawału serca, z uniesieniem odcinka ST, trwającymi <12 godzin. Pacjenci byli transportowani do najbliższego ośrodka podstawowego, gdzie stosowano leczenie fibrynolityczne lub do szpitala, gdzie poddawani byli PCI.
Obserwowano liczbę zgonów, ponowne zawały, udary, w przeciągu 30 dni oraz śmiertelność wśród pacjentów leczonych w pierwszych 3 godzinach i w czasie od 3 do 12 godzin od początku wystąpienia objawów. Udowodniono, że długa droga dojazdu (w badaniu maksymalnie -120km) do ośrodka referencyjnego, pacjenta ze świeżym zawałem serca jest bezpieczna. Takie postępowanie zmniejsza śmiertelność wśród pacjentów, u których objawy trwają dłużej niż 3 godziny. Długoterminowe rezultaty trombolizy są podobne jak PCI, jeśli zastosowano ją w ciągu pierwszych trzech godzin od wystąpienia objawów [6].
W 2003 roku opublikowano szerokie duńskie randomizowane badanie DANAMI-2 porównujące leczenie inwazyjne, podczas ostrego zawału serca, z leczeniem fibrynolitycznym. Do badania włączono 1572 chorych ze świeżym zawałem serca z uniesiem ST, z 29 duńskich ośrodków, obejmujących opieką 62% społeczeństwa Danii. U 782 chorych zastosowano fibrynolizę podając tkankowy aktywator plazminogenu, a 790 chorych poddano angioplastyce. U pacjentów po angioplastyce zdarzenia takie jak: ponowny zawał serca, zgon, udar prowadzący do niepełnosprawności, w czasie 30 dni, wystąpiły w 8,5%, a u pacjentów po leczeniu fibrynolitycznym w 14,2%.
Leczenie inwazyjne ograniczyło przede wszystkim liczbę ponownych zawałów, natomiast różnica w częstości występowania udarów i śmiertelności nie była znacząca pomiędzy grupami [7].
Keeley i wsp. dokonali przeglądu badań z randomizacją, w których porównywano skuteczność PTCA i leczenia fibrynolitycznego u chorych z ostrym zawałem serca z uniesieniem odcinka ST. Artykuł ukazał się w 2003 roku w The Lancet. Metaanalizą objęto 23 badania, w tym 13 nowych (min. CAPTIM, PRAGUE-2, DANAMI-2), w których uczestniczyło 7739 chorych. 3872 pacjentów poddanych było PTCA, a 3867 osób leczonych było trombolitycznie. W grupie osób po leczeniu inwazyjnym stwierdzono mniejsze ryzyko zgonu, ponownego zawału serca, udaru mózgu, krwotocznego udaru mózgu i występowania tych incydentów łącznie. Angioplastyka zmniejszyła najbardziej częstość występowania ponownych zawałów serca natomiast stwarzała ryzyko poważnych krwawień. Mimo to korzystne efekty PTCA przeważały i utrzymywały się w krótkotrwałej (4-6 tyg.) i długoterminowej (6-18 mies.) obserwacji [8,9].
Jednak znaczna część chorych z ostrym zespołem wieńcowym z uniesieniem ST, kwalifikująca się do leczenia reperfuzyjnego, takiego leczenia nie otrzymuje. W Polsce występuje duża nierównomierność leczenia inwazyjnego z powodu ograniczonego dostępu do ośrodków z pracowniami hemodynamicznymi.
Również w innych krajach, nie wszyscy pacjenci mogą mieć wykonaną natychmiastowe leczenie zabiegowe, co Khouzam R i wsp. opisali w swoim w artykule “Initial therapy for acute myocardial infarction: socioeconomic implications and limitations”. Podsumowali doświadczenia małego szpitala w Tucson/Arizona położonego blisko granicy z Meksykiem, gdzie jedynym natychmiastowym leczeniem ostrego zawału serca jest tromboliza.
Obserwowano 42 pacjentów, u których zastosowano leczenie fibrynolityczne z powodu świeżego zawału serca z uniesieniem odcinka ST. Obniżenie odcinka ST wystąpiło u 30 pacjentów (71,4%) [kompletne obniżenie u 25 pacjentów (59,5%) a niekompletne u 5 pacjentów (1,9%)], komplikacja leczenia w formie dużego krwawienia, wystąpiła u 1 pacjenta (2,38%). Po uzyskaniu stabilizacji 28 pacjentów (66,6%) wymagało PCI [10].
Wyniki badania SIAM III dotyczące leczenia pacjentów ze świeżym zawałem serca, w szpitalach opieki podstawowej, opublikowane zostały w Journal of the American College of Cardiology w sierpniu 2003 roku. 163 chorych po leczeniu trombolitycznym przydzielono do dwóch grup transportowanych do ośrodków z pracownią hemodynamiczną. Pierwsza grupa transportowana była natychmiast, druga z dwu-tygodniowym opóźnieniem. Natychmiastowy transport chorych na lecznie inwazyjne znacznie redukował zgony, ponowne incydenty niedokrwienne i zawały serca. Korzyści związane były przede wszystkim z ograniczeniem częstości występowania nawracającego niedokrwienia.
Badanie SIAM III wykazało, że w grupie pacjentów, u których zastosowano niezwłocznie PCI, średni czas do leczenia trombolitycznego wyniósł 3,2-3,6 godziny, a średni czas do wykonania angiografii 6,7 godziny, co przekracza normy czasowe aktualnych zaleceń. Leczenie trombolityczne z PCI wykonanym z opóźnieniem, związany był z większą śmiertelnością i częstymi ponownymi zawałami serca w obserwacji 30-dniowej [11].
Powołana przez Zarząd Główny Polskiego Towarzystwa Kardiologicznego grupa ekspertów ustaliła polskie rekomendacje postępowania w ostrych zespołach zespołach wieńcowych. Zgodnie z tymi rekomendacjami chorzy z ostrymi zespołami wieńcowymi z uniesieniem odcinka ST powinni jak najszybciej poddani być pierwotnej angioplastyce wieńcowej.
Według ekspertów leczenie inwazyjne zmniejszając ryzyko wczesnych i późnych powikłań sercowo-naczyniowych jest korzystniejsze niż leczenie fibrynolityczne. Ogranicza śmiertelność, liczbę ponownych zawałów, potrzebę powtórnej angioplastyki i zabiegu chirurgicznego naczyń wieńcowych. PTK zaleca wykonanie pierwotnej angioplastyki do 12 godzin od początku wystąpienia objawów świeżego zawału serca i do 90 minut od pierwszego kontaktu z personelem medycznym. Gdy czas ten przekracza 90 minut należy zastosować leczenie fibrynolityczne.
Leczenie fibrynolityczne jest jednoznacznie przeciwwskazane u chorych z ostrym zespołem wieńcowym bez uniesienia ST [12].
W przypadku ostrego zawału zdecydowanie najskuteczniejsze jest wykonanie pierwotnej angioplastyki wieńcowej wraz z implantacją stentu. Leczenie takie okazało się również korzystne w przypadku chorych z niestabilną chorobą wieńcową (ostrym zespołem wieńcowym bez uniesienia odcinka ST) [13].
Angioplastyka jest metodą obarczoną mniejszym ryzykiem powikłań, niż podanie leków trombolitycznych, które często wiąże się z wystąpieniem krwawień, łącznie z niebezpiecznym krwawieniem do OUN. Powinno się dążyć do poprawy dostępności inwazyjnego i kardiochirurgicznego leczenia dla chorych ze świeżym zawałem serca oraz jej równomierności w skali całego kraju.
Połączenie stosowania heparyn drobnocząsteczkowych z lekami przeciwpłytkowymi w ostrych zespołach wieńcowych
Drukuj
Opublikowane: 2004-12-14 w kardiolog.pl
Słowa kluczowe: abciximab bloker GP IIb/IIIa zawał serca choroba wieńcowa aspiryna heparyna GUSTO Enoxaparyna SYNERGY ACUTE INTERACT TETAMI
Dziedzina : chirurgia kardiochirurgia kardiologia
W tym temacie
abciximab , bloker GP IIb/IIIa , zawał serca , choroba wieńcowa , aspiryna , heparyna , GUSTO , Enoxaparyna , SYNERGY , ACUTE , INTERACT , TETAMI
U podłoża ostrych zespołów wieńcowych (ACS) leży najczęściej pęknięcie blaszki miażdżycowej. Powoduje to uszkodzenie śródbłonka naczyniowego, odsłonięcie błony podstawnej, uwolnienie czynników trombogennych, co uruchamia kaskadę układu krzepnięcia oraz aktywuje płytki krwi. Aktywacja płytek stymulowana jest czynnikami mechanicznymi oraz chemicznymi (kolagen, ADP, trombina). W efekcie dochodzi do uaktywnienia receptora płytkowego, glikoproteiny GP IIb/IIIa, co umożliwia połączenie płytek krwi z fibrynogenem i czynnikiem von Willebranda. Ostatecznie dochodzi do zamknięcia lub zwężenia naczynia i upośledzenia zaopatrzenia komórek mięśnia sercowego w krew.
Logicznym zatem wydaje się więc stosowanie w ACS leków hamujących układ krzepnięcia oraz przeciwpłytkowych (kwas acetylosalicylowy, tiklopidyna, klopidogrel). W ostatnich latach pojawiły się też leki blokujące jedno z ostatnich ogniw aktywacji płytek krwi - receptor płytkowy IIb/IIIa.
Połączenie heparyn drobnocząsteczkowych i inhibitorów glikoproteiny IIb/IIIa nie jest jeszcze tak dobrze udokumentowane jak stosowanie tych leków osobno. We wszystkich dużych pracach inhibitory GP IIb/IIIa stosowane były samodzielnie lub w połączeniu z heparyną niefrakcjonowaną (UFH). Badanie ACUTE I (Anti-thrombotic combination using tirofiban and enoxaparin) wykazało, że enoksaparyna nie wpływa niekorzystnie na farmakodynamikę tirofibanu i połączenie to jest bezpieczne. Kolejna praca, badanie ACUTE II porównuje dwa sposoby terapii: tirofiban w połączeniu z heparyną i tirofiban w połączeniu z enoksaparyną u pacjentów z ostrymi zespołami wieńcowymi bez uniesienia odcinka ST. Na grupie 525 chorych wykazano, że połączenie enoksaparyny i tirofibanu jest tak samo skuteczne jak połączenie heparyny i tirofibanu oraz co najmniej tak samo bezpieczne. Liczba zgonów i ponownego zawału serca po 30 dniach nie różniła się istotnie, natomiast w grupie tirofibanu z enoksaparyną było istotnie mniej nawrotów niewydolności wieńcowej, czy kolejnych hospitalizacji z powodu ACS. Rzadziej występowała konieczność wykonania koronarografii i rewaskularyzacji wieńcowej.
Jeszcze bardziej interesujące są wyniki badania INTERACT (the INTegrillin and Enoxaparin Randomized Assessment of acute Coronary syndrome Treatment trial), ogłoszone na kongresie ACC/AHA w marcu 2002. Do badania włączono 720 chorych. Wszyscy pacjenci otrzymywali eptifibatyd oraz heparynę niefrakcjonowaną lub enoksaparynę. Okazało się, że połączenie eptifibatydu z LMWH było bezpieczniejsze niż z heparyną niefrakcjonowaną (znacząco mniej dużych krwawień) i w sposób istotny statystycznie skuteczniejsze w zmniejszeniu częstości występowania zgonów i zawałów serca. Badanie NICE-3 porównywało skuteczność enoksaparyny w połączeniu z trzema dożylnymi antagonistami glikoproteiny IIb/IIIa: abciximabem, eptifibatydem i integriliną u chorych z ostrymi zespołami wieńcowymi poddawanych zabiegom PTCA. Wyniki we wszystkich grupach były porównywalne oraz nie gorsze niż znane z piśmiennictwa dane dotyczące łączenia UFH z wymienionymi trzema lekami.
W badaniu TETAMI (The safety and efficacy of subcutaneous enoxaparin versus intravenous unfractionated heparin and of tirofiban versus placebo in the treatment of acute myocardial infarction) porównuje się tirofiban wobec placebo w połączeniu z enoksaparyną vs heparyna niefrakcjonowana u pacjentów z ACS z uniesieniem odcinka ST, nie kwalifikujących się do fibrynolizy z powodu opóźnienia hospitalizacji czy innych przeciwwskazań. Do badania mogą być włączani pacjenci, u których nie planuje się rewaskularyzacji w ciągu 48 godzin od rozpoczęcia infuzji leków. Wyniki programu pozwolą na optymalizację postępowania przede wszystkim u tych chorych, którzy mają z różnych przyczyn opóźnioną hospitalizację i nie kwalifikują się do leczenia fibrynolitycznego lub pilnej rewaskularyzacji.
W badaniu A do Z stosowany jest tirofiban oraz heparyna niefrakcjonowana lub enoksaparyna u pacjentów z ostrymi zespołami wieńcowymi bez uniesienia odcinka ST. Wyniki badania opublikowano w lipcu tego roku.
Wykazano, że enoksaparyna jest właściwą alternatywą dla UFH w leczeniu pacjentów z ACS bez uniesienia odcinka ST, którzy otrzymują tirofiban i aspirynę. Enoksaparyna wykazuje skuteczność nie mniejszą niż UFH, zapewniając 12% względne zmniejszenie oraz 1% bezwzględne zmniejszenie głównego złożonego punktu końcowego, obejmującego zgon, zawał serca niezakończony zgonem oraz niedokrwienie niereagujące na leczenie. Wyniki te są zgodne z badaniami przeprowadzonymi bez udziału inhibitorów GP IIb/IIIa. Częstość krwawień i przetoczeń krwi była niewielka, nawet w przypadku stosowania agresywnych metod leczenia, cewnikowania serca i PCI, co potwierdza bezpieczeństwo połączenia enoksaparyny i tirofibanu.
Badanie A to Z było pierwszym, w którym stopień wstępnego leczenia przeciwzakrzepowego był tak widoczny. Badanie A to Z okazało się prekursorem dla innych późniejszych badań, m.in. próby SYNERGY, w której aż 75% pacjentów otrzymywało wstępne leczenie przeciwzakrzepowe. W badaniu tym ekspozycja na działanie różnych postaci heparyny po randomizacji była powszechniejsza dla tych osób, które otrzymywały enoksaparynę, w porównaniu do tych, którzy stosowali UFH. W badaniu SYNERGY wyniki były pomieszane przez wstępne leczenie antykoagulantami i zmianę z jednego leku na inny w momencie randomizacji (wyniki skuteczności), oraz dużą częstość nierównych krzyżowych zmian stosowania leku w okresie po randomizacji (wyniki bezpieczeństwa).
Wstępna analiza 5637 pacjentów, u których nie zmieniono leczenia, wykazała podobną częstość krwawienia dla enoksaparyny i UFH oraz wysoce znamienne korzyści dotyczące skuteczności (p = 0,0029; 17,9% względne zmniejszenie ryzyka zgonu/MI po 30 dniach) u tych pacjentów, którzy rozpoczęli lub pozostali na leczeniu enoksaparyną (tzw. stała grupa leczenia).
Warto zauważyć, że wszystkie wymienione badania dotyczą łączenia inhibitorów receptora GP IIb/IIIa i enoksaparyny. Jednym z nielicznych badań dotyczących połączenia innych heparyn drobnocząsteczkowych z inhibitorami GP IIb/IIIa jest doniesienie podgrupy skandynawskiej badania GUSTO IV ACS. Porównywano wyniki podawania u chorych z niestabilną chorobą wieńcową lub z zawałem serca bez uniesienia ST dalteparyny w skojarzeniu z abciximabem albo dalteparyny z placebo w stosunku do wariantu leczenia stosowanego w tym badaniu w innych krajach: abciximab + UFH albo placebo + UFH. Obserwowano zbliżone częstości zgonów lub zawałów w obserwacji 30-dniowej w podgrupach z abciximabem oraz UFH albo heparyną drobnocząsteczkową (LMWH) oraz tendencję do przewagi UFH w grupie bez abciximabu. Połączenie abciximabu z dalteparyną powodowało dwukrotnie mniejszą częstość występowania małopłytkowości niż połączenie z UFH.
Standardy amerykańskie (2002), uaktualnione zaledwie po dwóch latach, wnoszą dużo zmian do farmakologicznej terapii ostrych zespołów wieńcowych bez uniesienia ST. Uwzględniono opisane wyżej wyniki badań klinicznych. Leki przeciwpłytkowe (inhibitory receptora GP IIb/IIIa), rekomendowane do tej pory do stosowania wyłącznie z UFH, dopuszczono do stosowania również z LMWH. Dotyczy to zarówno pacjentów, u których planuje się przezskórną rewaskularyzację, jak i tych, których wstępnie kwalifikujemy do leczenia zachowawczego. Nie odnosi się to jednak do abciximabu, który nie powinien być stosowany w OZW, bez uniesienia ST, kiedy nie planuje się rewaskularyzacji przezskórnej. Po raz pierwszy zaleca się stosowanie enoksaparyny zamiast UFH w terapii ostrych zespołów wieńcowych, wyróżniając w ten sposób enoksaparynę spośród innych heparyn drobnocząsteczkowych.
Reasumując heparyny drobnocząsteczkowe, a w szczególności enoksaparyna, powinny być standardem leczenia ACS. Zaleca się, aby do terapii dołączać inhibitory GP IIb/IIIa (tirofiban i eptifibatyd), zanim rozważy się wszystkie za i przeciw leczenia inwazyjnego. Połączenie tych dwóch grup leków można uznać za bezpie
Połączenie stosowania heparyn drobnocząsteczkowych z lekami przeciwpłytkowymi w ostrych zespołach wieńcowych
Drukuj
Opublikowane: 2004-12-14 w kardiolog.pl
Słowa kluczowe: abciximab bloker GP IIb/IIIa zawał serca choroba wieńcowa aspiryna heparyna GUSTO Enoxaparyna SYNERGY ACUTE INTERACT TETAMI
Dziedzina : chirurgia kardiochirurgia kardiologia
W tym temacie
abciximab , bloker GP IIb/IIIa , zawał serca , choroba wieńcowa , aspiryna , heparyna , GUSTO , Enoxaparyna , SYNERGY , ACUTE , INTERACT , TETAMI
U podłoża ostrych zespołów wieńcowych (ACS) leży najczęściej pęknięcie blaszki miażdżycowej. Powoduje to uszkodzenie śródbłonka naczyniowego, odsłonięcie błony podstawnej, uwolnienie czynników trombogennych, co uruchamia kaskadę układu krzepnięcia oraz aktywuje płytki krwi. Aktywacja płytek stymulowana jest czynnikami mechanicznymi oraz chemicznymi (kolagen, ADP, trombina). W efekcie dochodzi do uaktywnienia receptora płytkowego, glikoproteiny GP IIb/IIIa, co umożliwia połączenie płytek krwi z fibrynogenem i czynnikiem von Willebranda. Ostatecznie dochodzi do zamknięcia lub zwężenia naczynia i upośledzenia zaopatrzenia komórek mięśnia sercowego w krew.
Logicznym zatem wydaje się więc stosowanie w ACS leków hamujących układ krzepnięcia oraz przeciwpłytkowych (kwas acetylosalicylowy, tiklopidyna, klopidogrel). W ostatnich latach pojawiły się też leki blokujące jedno z ostatnich ogniw aktywacji płytek krwi - receptor płytkowy IIb/IIIa.
Połączenie heparyn drobnocząsteczkowych i inhibitorów glikoproteiny IIb/IIIa nie jest jeszcze tak dobrze udokumentowane jak stosowanie tych leków osobno. We wszystkich dużych pracach inhibitory GP IIb/IIIa stosowane były samodzielnie lub w połączeniu z heparyną niefrakcjonowaną (UFH). Badanie ACUTE I (Anti-thrombotic combination using tirofiban and enoxaparin) wykazało, że enoksaparyna nie wpływa niekorzystnie na farmakodynamikę tirofibanu i połączenie to jest bezpieczne. Kolejna praca, badanie ACUTE II porównuje dwa sposoby terapii: tirofiban w połączeniu z heparyną i tirofiban w połączeniu z enoksaparyną u pacjentów z ostrymi zespołami wieńcowymi bez uniesienia odcinka ST. Na grupie 525 chorych wykazano, że połączenie enoksaparyny i tirofibanu jest tak samo skuteczne jak połączenie heparyny i tirofibanu oraz co najmniej tak samo bezpieczne. Liczba zgonów i ponownego zawału serca po 30 dniach nie różniła się istotnie, natomiast w grupie tirofibanu z enoksaparyną było istotnie mniej nawrotów niewydolności wieńcowej, czy kolejnych hospitalizacji z powodu ACS. Rzadziej występowała konieczność wykonania koronarografii i rewaskularyzacji wieńcowej.
Jeszcze bardziej interesujące są wyniki badania INTERACT (the INTegrillin and Enoxaparin Randomized Assessment of acute Coronary syndrome Treatment trial), ogłoszone na kongresie ACC/AHA w marcu 2002. Do badania włączono 720 chorych. Wszyscy pacjenci otrzymywali eptifibatyd oraz heparynę niefrakcjonowaną lub enoksaparynę. Okazało się, że połączenie eptifibatydu z LMWH było bezpieczniejsze niż z heparyną niefrakcjonowaną (znacząco mniej dużych krwawień) i w sposób istotny statystycznie skuteczniejsze w zmniejszeniu częstości występowania zgonów i zawałów serca. Badanie NICE-3 porównywało skuteczność enoksaparyny w połączeniu z trzema dożylnymi antagonistami glikoproteiny IIb/IIIa: abciximabem, eptifibatydem i integriliną u chorych z ostrymi zespołami wieńcowymi poddawanych zabiegom PTCA. Wyniki we wszystkich grupach były porównywalne oraz nie gorsze niż znane z piśmiennictwa dane dotyczące łączenia UFH z wymienionymi trzema lekami.
W badaniu TETAMI (The safety and efficacy of subcutaneous enoxaparin versus intravenous unfractionated heparin and of tirofiban versus placebo in the treatment of acute myocardial infarction) porównuje się tirofiban wobec placebo w połączeniu z enoksaparyną vs heparyna niefrakcjonowana u pacjentów z ACS z uniesieniem odcinka ST, nie kwalifikujących się do fibrynolizy z powodu opóźnienia hospitalizacji czy innych przeciwwskazań. Do badania mogą być włączani pacjenci, u których nie planuje się rewaskularyzacji w ciągu 48 godzin od rozpoczęcia infuzji leków. Wyniki programu pozwolą na optymalizację postępowania przede wszystkim u tych chorych, którzy mają z różnych przyczyn opóźnioną hospitalizację i nie kwalifikują się do leczenia fibrynolitycznego lub pilnej rewaskularyzacji.
W badaniu A do Z stosowany jest tirofiban oraz heparyna niefrakcjonowana lub enoksaparyna u pacjentów z ostrymi zespołami wieńcowymi bez uniesienia odcinka ST. Wyniki badania opublikowano w lipcu tego roku.
Wykazano, że enoksaparyna jest właściwą alternatywą dla UFH w leczeniu pacjentów z ACS bez uniesienia odcinka ST, którzy otrzymują tirofiban i aspirynę. Enoksaparyna wykazuje skuteczność nie mniejszą niż UFH, zapewniając 12% względne zmniejszenie oraz 1% bezwzględne zmniejszenie głównego złożonego punktu końcowego, obejmującego zgon, zawał serca niezakończony zgonem oraz niedokrwienie niereagujące na leczenie. Wyniki te są zgodne z badaniami przeprowadzonymi bez udziału inhibitorów GP IIb/IIIa. Częstość krwawień i przetoczeń krwi była niewielka, nawet w przypadku stosowania agresywnych metod leczenia, cewnikowania serca i PCI, co potwierdza bezpieczeństwo połączenia enoksaparyny i tirofibanu.
Badanie A to Z było pierwszym, w którym stopień wstępnego leczenia przeciwzakrzepowego był tak widoczny. Badanie A to Z okazało się prekursorem dla innych późniejszych badań, m.in. próby SYNERGY, w której aż 75% pacjentów otrzymywało wstępne leczenie przeciwzakrzepowe. W badaniu tym ekspozycja na działanie różnych postaci heparyny po randomizacji była powszechniejsza dla tych osób, które otrzymywały enoksaparynę, w porównaniu do tych, którzy stosowali UFH. W badaniu SYNERGY wyniki były pomieszane przez wstępne leczenie antykoagulantami i zmianę z jednego leku na inny w momencie randomizacji (wyniki skuteczności), oraz dużą częstość nierównych krzyżowych zmian stosowania leku w okresie po randomizacji (wyniki bezpieczeństwa).
Wstępna analiza 5637 pacjentów, u których nie zmieniono leczenia, wykazała podobną częstość krwawienia dla enoksaparyny i UFH oraz wysoce znamienne korzyści dotyczące skuteczności (p = 0,0029; 17,9% względne zmniejszenie ryzyka zgonu/MI po 30 dniach) u tych pacjentów, którzy rozpoczęli lub pozostali na leczeniu enoksaparyną (tzw. stała grupa leczenia).
Warto zauważyć, że wszystkie wymienione badania dotyczą łączenia inhibitorów receptora GP IIb/IIIa i enoksaparyny. Jednym z nielicznych badań dotyczących połączenia innych heparyn drobnocząsteczkowych z inhibitorami GP IIb/IIIa jest doniesienie podgrupy skandynawskiej badania GUSTO IV ACS. Porównywano wyniki podawania u chorych z niestabilną chorobą wieńcową lub z zawałem serca bez uniesienia ST dalteparyny w skojarzeniu z abciximabem albo dalteparyny z placebo w stosunku do wariantu leczenia stosowanego w tym badaniu w innych krajach: abciximab + UFH albo placebo + UFH. Obserwowano zbliżone częstości zgonów lub zawałów w obserwacji 30-dniowej w podgrupach z abciximabem oraz UFH albo heparyną drobnocząsteczkową (LMWH) oraz tendencję do przewagi UFH w grupie bez abciximabu. Połączenie abciximabu z dalteparyną powodowało dwukrotnie mniejszą częstość występowania małopłytkowości niż połączenie z UFH.
Standardy amerykańskie (2002), uaktualnione zaledwie po dwóch latach, wnoszą dużo zmian do farmakologicznej terapii ostrych zespołów wieńcowych bez uniesienia ST. Uwzględniono opisane wyżej wyniki badań klinicznych. Leki przeciwpłytkowe (inhibitory receptora GP IIb/IIIa), rekomendowane do tej pory do stosowania wyłącznie z UFH, dopuszczono do stosowania również z LMWH. Dotyczy to zarówno pacjentów, u których planuje się przezskórną rewaskularyzację, jak i tych, których wstępnie kwalifikujemy do leczenia zachowawczego. Nie odnosi się to jednak do abciximabu, który nie powinien być stosowany w OZW, bez uniesienia ST, kiedy nie planuje się rewaskularyzacji przezskórnej. Po raz pierwszy zaleca się stosowanie enoksaparyny zamiast UFH w terapii ostrych zespołów wieńcowych, wyróżniając w ten sposób enoksaparynę spośród innych heparyn drobnocząsteczkowych.
Reasumując heparyny drobnocząsteczkowe, a w szczególności enoksaparyna, powinny być standardem leczenia ACS. Zaleca się, aby do terapii dołączać inhibitory GP IIb/IIIa (tirofiban i eptifibatyd), zanim rozważy się wszystkie za i przeciw leczenia inwazyjnego. Połączenie tych dwóch grup leków można uznać za bezpie
Zalecane postępowanie w przypadku ostrego zespołu wieńcowego bez uniesienia odcinka ST (NSTE-ACS)
Drukuj
Opublikowane: 2007-09-03 w kardiolog.pl
Słowa kluczowe: rewaskularyzacja aspiryna klopidogrel statyny antykoagulanty leczenie hipolipemizujące antagoniści receptora angiotensyny II inhibitory konwertazy angiotensyny ostry zespół wieńcowy inhibitory glikoproteiny IIb/IIIa Beta-blokery doustne leki przeciwzakrzepowe antagonista aldosteronu
Dziedzina : kardiologia
W tym temacie
rewaskularyzacja , aspiryna , klopidogrel , statyny , antykoagulanty , leczenie hipolipemizujące , antagoniści receptora angiotensyny II , inhibitory konwertazy angiotensyny , ostry zespół wieńcowy , inhibitory glikoproteiny IIb/IIIa , Beta-blokery , doustne leki przeciwzakrzepowe , antagonista aldosteronu
Streszczenie
Strategie postepowania w przypadku ostrego zespołu wieńcowego bez uniesienia odcinka ST (NSTE-ACS) obejmują 5 etapów. Pierwszy etap to wstępna ocena dotycząca charakteu bólu w klatce piersiowej i innych objawów, oszacowanie ryzyka wystąpienia choroby niedokrwiennej serca ( wiek, czynniki ryzyka, przebyty zawał serca, CABG, PCI), ocena EKG (odchylenia odcinka ST i inne nieprawidłowości zapisu. Drugi etap to potwierdzenie diagnozy (poprzez określenie poziomu troponin i innych markerów, poprzez ciągłe monitorowanie odcinka ST, oraz na podstawie EKG, MRI i CT a także odpowiedzi na leczenie przeciwdławicowe) i oszacowanie ryzyka niedokrwienia i ryzyka krwawienia. Trzeci etap to podjęcie strategii leczniczej: 1) strategia zachowawcza: w sytuacjach gdy ból w klatce piersiowej nie nawraca, gdy nie ma objawów niewydolności serca, gdy brak jest nieprawidłowości w EKG wykonanym w czasie przybycia do szpitala i po 6-12h oraz gdy brak jest podwyższenia poziomu troponin w czasie przybycia do szpitala i w ciągu 6-12h, 2) pilna inwazyjna strategia: gdy występuje oporna dławica lub nawracająca dławica mimo intensywnego leczenia przeciwdławicowego albo gdy występują zagrażające zyciu arytmie, 3) wczesna inwazyjna strategia (<72h): gdy podwyższone poziomy troponin, gdy zmiany ST-T >0,5mm, gdy obecna cukrzyca, gdy upośledzenie czynności nerek (GFR<60ml/min), gdy spadek LVEF<40%, gdy pacjent przebył już zawał, gdy PCI w ciągu ostatnich 6 miesięcy lub przebyty zabieg CABG. Czwarty etap to rodzaje rewaskularyzacji: w przypadku choroby jednego naczynia- PCI i stentowanie, w przypadku choroby wielonaczyniowej- PCI/CABG. Piąty etap to wypis ze szpitala i postępowanie po wypisaniu.
Leki przeciwniedokrwienne:
-beta-blokery(BB) - zalecane w przypadku braku przeciwwskazań, szczególnie u pacjentów z nadciśnieniem (NT) lub tachyarytmią
-i.v. lub p.o. stosowane nitraty są skuteczne w leczeniu ostrych epizodów dławicy powodując objawową ulgę
-blokery kanału wapniowego(CCB) dostarczają objawowej ulgi pacjentom otrzymującym nitraty i BB; są użyteczne u pacjentów z przeciwwskazaniami do BB i z dławicą naczynioskurczową
-nifedypina lub inne dihydropirydyny nie powinny być stosowane jeśli nie są połączone z BB
Antykoagulanty:
-antykoagulacja jest zalecana u wszystkich pacjentów dodatkowo z terapią przeciwpłytkową i powinna być dobierana według ryzyka zarówno niedokrwienia jak i epizodów krwawienia
-dostępnych jest kilka antykoagulantów: heparyna niefrakcjonowana, drobnocząsteczkowa, fondaparinuks i biwalirudyna;
-w naglącej inwazyjnej strategii terapii heparyna niefrakcjonowana, enoksaparyna, lub biwalirudyna powinny być niezwłocznie zastosowane
-w przypadku nie naglącej sytuacji, tak długo jak decyzja pomiędzy wczesną terapią inwazyjną a zachowawczą strategią jest nierozstrzygnięta:
--fondaparinuks jest zalecany z powodu najkorzystniejszej skuteczności/bezpieczeństwa
--enoksaparyna z mniej skutecznym profilem skuteczności/bezpieczeństwa niż fondaparinuks powinna być stosowana tylko jeśli ryzyko krwawienia jest niskie
--ponieważ profil skuteczności/bezpieczeństwa heparyn drobnocząsteczkowych ( z wyjątkiem enoksaparyny) i niefrakcjonowanych nie jest znany, nie jest zalecane stosowanie ich jako nadrzędnych nad fondaparinuksem
--w czasie przezskórnych interwencji wieńcowych (PCI) początkowa antykoagulacja powinna być utrzymana podczas procedury bez względu czy jest to heparyna niefrakcjonowana, enoksaparyna czy biwalirudyna, natomiast dodatkowo heparyna niefrakcjonowana w standardowej dawce 50-100UI/kg bolus jest niezbędna w przypadku antykoagulacji fondaparinuksem
--antykoagulacja może być przerwana w ciągu 24 h po wykonaniu inwazyjnych interwencji; w strategii zachowawczej, fondaparinuks, enoksaparyna lub inne heparyny drobnocząsteczkowe mogą być utrzymane do wypisu ze szpitala
Doustne leki przeciwpłytkowe:
-aspiryna (ASA) jest zalecana u wszystkich pacjentów z NSTE-ACS bez przeciwwskazań w początkowej dawce 160-325mg, następnie w dawce podtrzymującej 75-100mg długoterminowo
-wszystkim pacjentom zalecana jest niezwłocznie nasycająca dawka klopidogrelu (300mg), a następnie 75 mg klopidogrelu dziennie; klopidogrel powinien być utrzymywany przez 12 miesięcy jeśli nie będzie nadmiernego ryzyka krwawienia
-u pacjentów u których rozważane jest leczenie inwazyjne dawka nasycająca w ilości 600mg klopidogrelu może być stosowana do osiągnięcia szybszego zahamowania funkcji płytek
Inhibitory receptora GPIIb/IIIa:
- u pacjentów średniego do wysokiego ryzyka, szczególnie z podwyższonym poziomem troponin, obniżeniem odcinka ST lub cukrzycą, zalecana jest zarówno eptifibatydyna jak i tirofiban w początkowym leczeniu w dodatku do doustnych leków przeciwpłytkowych
-wybór kombinacji leków przeciwpłytkowych z antykoagulantami powinien być dokonany z uwzględnieniem ryzyka niedokrwienia i krwawienia
-pacjenci , otrzymujący początkową terapię eptifibatydyną lub tirofibanem przed angiografią powinni być utrzymywani na tych samych lekach podczas i po PCI
-u pacjentów wysokiego ryzyka nie leczonych inhibitorami receptora GP IIb/IIIa przed PCI, zalecany jest abciksimab niezwłocznie po angiografii; zastosowanie eptifibatydyny lub tirofibanu w tej sytuacji jest gorzej ustalone
-inhibitory receptora GP IIb/IIIa muszą być stosowane w połączeniu z anykoagulantem
-biwalirudyna może być alternatywa do inhibitora GPIIb/IIIa łączonego z heparyną niefrakcjonowaną lub drobnocząsteczkową
-jeśli PCI jest planowany w ciągu 24 h z inhibitorem GPIIb/IIIa, najbezpieczniej jest zastosować abciksimab
Zalecenia w przypadku oporności na leki przeciwpłytkowe:
-niesteroidowe leki przeciwzapalne nie powinny być podawane w kombinacji z ASA lub klopidogrelem
-klopidogrel może być podawany ze wszystkimi statynami
Zalecenia dotyczące inwazyjnej oceny i rewaskularyzacji:
-pilna koronarografia jest zalecana u pacjentów z oporną lub nawracająca dławicą z dynamicznymi odchyleniami odcinka ST, niewydolnością serca, zagrażającymi życiu arytmiami lub niestabilnością hemodynamiczną
-wczesna(<72h) angiografia z następczą rewaskularyzacją (PCI lub CABG) jest zalecana u pacjentów z cechami średniego do wysokiego ryzyka
-rutynowa inwazyjna ocena u pacjentów bez cech średniego do wysokiego ryzyka nie jest zalecana, ale nieinwazyjna ocena wzbudzenia niedokrwienia jest wskazana
-PCI nie jest zalecane w przypadku braku istotnych zwężeń
Zalecenia dotyczące terapii obniżającej poziom lipidów:
-statyny są zalecane u wszystkich pacjentów z NSTE-ACS ( w przypadku braku przeciwwskazań) niezależnie od poziomu cholesterolu
Beta-blokery powinny być podane wszystkim pacjentom z upośledzona funkcją lewej komory
ACE inhibitory są wskazane w terapii długoterminowej u wszystkich pacjentów z frakcją wyrzutową lewej komory <40% oraz u pacjentów z cukrzycą, NT lub niewydolnością nerek, jeśli nie ma przeciwwskazań
ACE inhibitory powinny być rozważone u wszystkich pacjentów w celu zapobiegania nawrotom epizodów niedokrwiennych
Blokery receptora angiotensyny powinny być rozważone u pacjentów którzy nie tolerują inhibitorów ACE albo/i którzy mają niewydolność serca lub zawał serca z frakcją wyrzutową <40%
Bloker receptora aldosteronu powinien być rozważony u pacjentów po zawale mięśnia serca, którzy są leczeni inhibitorami ACE i BB oraz mają LVEF<40% albo cukrzycę lub niewydolność serca bez znaczącej dysfunkcji nerek czy hiperkaliemii.
Bibliografia
Jean-Pierre Bassand, Christian W. Hamm, Diego Ardissino , Eric Boersma , Andrzej Budaj, Francisco Fernandez-Aviles, Keith A.A. Fox, David Hasdai,E. Magnus Ohman, Lars Wallentin, William WijnsNon-ST-segment Elevation Acute Coronary Syndromes (Guidelines for the Diagnosis and
Zawał mięśnia sercowego jest to martwica komórek mięśniowych określonego obszaru serca, wywołana zamknięciem światła naczynia wieńcowego najczęściej w wyniku pęknięcia blaszki miażdżycowej.
Zawał serca może wystąpić w każdym obszarze mięśnia sercowego, najczęściej występuje w obrębie ściany lewej komory. Zawał może obejmować całą grubość mięśnia (zawał pełnościenny) lub warstwę podwsierdziową (zawał niepełnościenny - zawał bez załamka Q w zapisie EKG).
Ponad 90% zawałów mięśnia sercowego spowodowanych jest całkowitym zamknięciem światła tętnicy wieńcowej przez zakrzep powstały w wyniku pęknięcia blaszki miażdżycowej zwężającej tętnicę.
Do innych przyczyn mogących spowodować zawał serca należą:
* kurcz tętnicy wieńcowej;
* wrodzona wada naczyń wieńcowych;
* zmiany zatorowo-zakrzepowe w tętnicach wieńcowych;
* kardiomiopatia przerostowa
* wady zastawek serca
* zatrucie czadem,przedawkowanie narkotyków (np.amfetaminy);
* inne.
Zawał serca występuje u pacjentów z dławicą piersiową (angina pectoris, dusznica bolesna), może także być jej pierwszym objawem choroby niedokrwiennej u ludzi dotychczas zdrowych. W bardzo rzadkich przypadkach jest spowodowany przez inną przyczynę. Zawał serca (atak serca) objawia się przede wszystkim bardzo silnym; długotrwałym (z reguły ponad 20 min.) bólem zamostkowym. Pacjent opisuje ten ból jako rozpierający, ściskający, duszący. Wystąpienie zawału często jest sprowokowane dużym wysiłkiem fizycznym (ciężka praca fizyczna, szybkie chodzenie, wchodzenie po schodach itp.) lub sytuacją stresową.
Ból zawałowy z reguły nie ustępuje po zaprzestaniu wysiłku lub zażyciu nitrogliceryny w sprayu lub tabletce podjęzykowej. Charakter bólu jest tępy, rozpierający, rozrywający, ściskający, duszący, rwący, palący. Lokalizacja bólu: zwykle za mostkiem lub po lewej stronie klatki piersiowej (w bardzo rzadkich przypadkach z prawej). Ból zawałowy często promieniuje (rozchodzi się) do lewego barku, ramienia, stawu łokciowego, dłoni, do szyi, gardła, żuchwy lub pleców. U niektórych pacjentów dolegliwości mają charakter nietypowy i trudno je rozpoznać - zwłaszcza przy zawale dolnej ściany serca, w którym często jedynymi dolegliwościami są: ból brzucha, nudności, wymioty, złe samopoczucie.
Zamiast bólu można również odczuwać duszność ("subiektywne uczucie braku tchu") i uczucie ciężaru na klatce piersiowej. Zawałowi często towarzyszy znaczne osłabienie, które może prowadzić do zasłabnięcia i utraty przytomności. Większość chorych odczuwają silny lęk i są "zlani" zimnym potem. Ciśnienie tętnicze krwi może być normalne, niskie lub podwyższone. Tętno z reguły jest przyśpieszone, może być jednak zwolnione
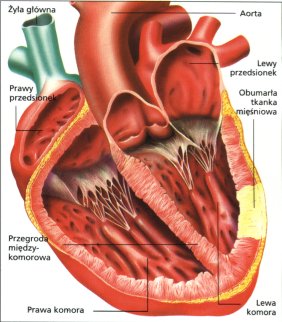
Porównanie heparyny drobnocząsteczkowej z niefrakcjonowaną
Drukuj
Opublikowane: 2005-05-28 w kardiolog.pl
Słowa kluczowe: abciximab bloker GP IIb/IIIa aspiryna heparyna leki przeciwkrzepliwe antykoagulanty heparyny drobnocząsteczkowe heparyna niefrakcjonowana Enoxaparyna enoksaparyna dalteparyny
Dziedzina : kardiologia
W tym temacie
abciximab , bloker GP IIb/IIIa , aspiryna , heparyna , leki przeciwkrzepliwe , antykoagulanty , heparyny drobnocząsteczkowe , heparyna niefrakcjonowana , Enoxaparyna , enoksaparyna , dalteparyny
Streszczenie:
Od wielu lat trwa dyskusja na temat skutecznego leczenia przeciwkrzepliwego u chorych w niestabilnej chorobie wieńcowej. Liczne dostępne badania kliniczne wykazały jednoznacznie, że stosowanie LMWH jest dużo wygodniejsze, a terapia bardziej przewidywalna i stabilna. Mniej jest także działań niepożądanych, choć liczba poważnych krwawień jest porównywalna, zaś krwawień drobnych - nawet większa. Pierwszym badaniem, w którym wykazano skuteczność LMWH - dalteparyny w porównaniu z placebo przy współistniejącej terapii ASA było badanie FRISC. Najistotniejszymi próbami z zastosowaniem enoksaparyny były natomiast badania: ESSENCE, A to Z, SYNERGY, TIMI 11B, ACUTE II i INTERACT.
Wstęp
Od wielu lat trwa dyskusja na temat skutecznego leczenia przeciwkrzepliwego u chorych w niestabilnej chorobie wieńcowej. Już badanie GUSTO I (Global Utilization of Streptokinase, and Tissue Plasminogen Activator for Occluded Coronary Arteries) wykazało, że heparyny drobnocząsteczkowa (LMWH - Low Molecular Weight Heparin) podawana podskórnie, skojarzona ze streptokinazą daje zbliżone efekty do połączenia streptokinaza + UFH i.v. (heparyna niefrakcjonowana).
Liczne dostępne badania kliniczne wykazały jednoznacznie, że stosowanie LMWH jest dużo wygodniejsze, a terapia bardziej przewidywalna i stabilna. Mniej jest także działań niepożądanych, choć liczba poważnych krwawień jest porównywalna, zaś krwawień drobnych - nawet większa.
Porównanie badań klinicznych
Pierwszym badaniem, w którym wykazano skuteczność LMWH w porównaniu z placebo przy współistniejącej terapii ASA było badanie FRISC (Fragmin during Instability in Coronary Artery Disease). Podawana podskórnie dalteparyna w dawce 120 j.m./kg masy ciała dwa razy dziennie znamiennie obniżała częstość zawałów serca i zgonów (po 6 dniach redukcja 63%, p=0,001) oraz konieczność rewaskularyzacji. Lek podawano przez 6 dni we wspomnianej wyżej dawce, a następnie przez 35-45 dni w dawce 7,5 tys. j.m. raz dziennie. Efekt utrzymywał się przez około 40 dni, ale już po 4-5 miesiącach nie było istotnej różnicy w częstości incydentów wieńcowych. Wyniki tego badania były na tyle przekonujące, że nie było sensu przeprowadzać kolejnych badań porównujących heparyny drobnocząsteczkowe z placebo.
Kolejnym etapem były badania porównujące stosowanie LMWH z heparyną niefrakcjonowaną. W badaniu FRIC (Fragmin in Unstable Coronary Artery Disease) (z dalteparyną) nie stwierdzono istotnych różnic w częstości zgonów i zawałów serca niezakończonych zgonem tak po 6 dniach, jak po 30 dniach od incydentu wieńcowego. Dodatkowych korzyści nie przyniosło również podawanie dalteparyny do 40 dnia po incydencie wieńcowym w dawce 7,5 tys. j.m. raz dziennie. W próbie klinicznej FRAX.I.S. (FRAxiparine in Ischaemic Syndrome) porównywano skuteczność LMWH (w dawce 86 IU/kg m.c. dwa razy dziennie przez 6 dni) w stosunku do UFH. Nie stwierdzono istotnych różnic pomiędzy grupami chorych tak w obserwacji kilkudniowej, jak i kilkumiesięcznej. Przedłużone stosowanie LMWH (nadroparyny) - do 14 dni po incydencie wieńcowym - nie przyniosło dodatkowych korzyści.
Następnie rozpoczęto duże, wieloośrodkowe badania kliniczne z enoksaparyną. W badaniu ESSENCE (1997) wykazano istotną statystycznie wyższość stosowanej LMWH nad UFH po 14 i 30 dniach, a efekt ten obserwowano przez rok. W badaniu TIMI 11B (1999) (Thrombolysis In Myocardial Infarction) enoksaparyna podawana najpierw w bolusie dożylnym, a potem podskórnie, istotnie redukowała po 8 dniach złożony punkt końcowy: zgon, zawał serca i konieczność rewaskularyzacji. Badanie NICE-3 (National Investigators Collaborating on Enoxaparin) porównywało skuteczność enoksaparyny w połączeniu z dwoma dożylnymi antagonistami glikoproteiny IIb/IIIa: abciximabem i eptifibatydem u chorych z ostrymi zespołami wieńcowymi poddawanych zabiegom PTCA. Wyniki we wszystkich grupach były porównywalne oraz nie gorsze niż znane z piśmiennictwa dane dotyczące łączenia UFH z wymienionymi lekami.
Badania ESSENCE oraz TIMI 11B przeprowadzono w erze dominującego postępowania zachowawczego w przypadku pacjentów z ACS i wykazano istotne zmniejszenie częstości złożonego punktu końcowego, obejmującego zgon lub MI, w wyniku stosowania enoksaparyny, w porównaniu z UFH. Późniejsze badania przeprowadzono w kontekście bardziej agresywnego leczenia. Badania A to Z (2003) i SYNERGY (Superior Yield of the New Strategy of Enoxaparin, Revascularization and Glycoprotein IIb/IIIa Inhibitors) (2004) wykazały statystycznie nieistotną tendencję do zmniejszenia częstości występowania złożonego punktu końcowego, obejmującego zgon i MI oraz tendencję do wzrostu częstości krwawień w przypadku stosowania enoksaparyny w porównaniu do UFH. W obu powyższych badaniach wykazano większa redukcję epizodów niedokrwienia u pacjentów nieleczonych lekami przeciwzakrzepowymi przed randomizacją (około 25% chorych). Różnice wyników wcześniejszych prób oraz najnowszych badań nasuwają pytania o równowagę między ryzykiem a korzyściami stosowania enoksaparyny i UFH u pacjentów z NSTE ACS. Odpowiedzi na te pytania dostarcza metaanaliza Petersena i wsp (2004), którą objęto sześć randomizowanych, kontrolowanych badań, w których porównywano enoksaparynę do UFH u pacjentów z NSTE ACS (N = 21,946): ESSENCE, A to Z, SYNERGY, TIMI 11B, ACUTE II (Antithrombotic Combination Using Tirofiban and Enoxaparin) i INTERACT (Integrilin and Enoxaparin Randomized Assessment of Acute Coronary Syndrome Treatment).
Na podstawie uzyskanych wyników wykazano: (1) istotne zmniejszenie złożonego punktu końcowego obejmującego zgon lub MI przy leczeniu enoksaparyną, (2) obniżenie śmiertelności na korzyść enoksaparyny (w porównaniu do UFH), (3) silne i znaczące zmniejszenie złożonego punktu końcowego obejmującego zgon lub MI przy leczeniu enoksaparyną oraz (4) umiarkowane, ale istotne zmniejszenie częstości poważnych krwawień przy leczeniu enoksaparyną. Autorzy badania konkludują, że wyniki przedstawionego przeglądu jednoznacznie wykazują, że enoksaparyna lepiej od UFH zapobiegała zgonom lub MI niezakończonym zgonem w przebiegu NSTE ACS, natomiast poważne krwawienia i przetoczenia krwi do 7 dnia badania występowały z podobną częstością w obu grupach leczniczych.
Podobną metaanalizę przeprowadzili Das P i Moliterno DJ (2004). Autorzy krótko przedstawili wyniki systematycznego przeglądu pięciu dużych randomizowanych badań, ze szczególnym zwróceniem uwagi na badania A to Z oraz SYNERGY, próbując ustalić właściwy pogląd na rolę enoksaparyny w praktyce lekarskiej, uwzględniając stosowanie inhibitorów GP IIb/IIIa, nowych leków przeciwpłytkowych oraz wczesnego leczenia inwazyjnego.
Badania A to Z, SYNEGRY oraz niniejsza metaanaliza dostarczają licznych nowych danych, które różnią się od dotychczasowych interpretacji. Udowadniają one bowiem, że enoksaparyna pozostaje racjonalną alternatywą dla UFH we współczesnym leczeniu ACS. Autorzy zastanawiają się, czy wyniki ostatnich badań będą miały wpływ na częstsze stosowanie enoksaparyny oraz na formułowanie kolejnych wytycznych postępowania u chorych z NSTE ACS. Aby pomóc w interpretacji badania SYNERGY oraz odczytywać jego wyniki we właściwym kontekście, autorzy dokonali systematycznego przeglądu pięciu wcześniejszych, randomizowanych badań kontrolowanych porównujących enoksaparynę z UFH w leczeniu NSTEMI ACS. Celem było stwierdzenie jakichkolwiek stałych różnic działania pomiędzy enoksaparyną a UFH w czasie oraz wypracowanie jak najskuteczniejszej strategii leczenia. Na podstawie uzyskanych wyników analizy autorzy stwierdzili pewne niespójności w dotychczas przeprowadzonych badaniach, stwierdzając jednak, że enoksaparyna była lepsza od heparyny niefrakcjonowanej w zapobieganiu ostrym zespołom wieńcowym i ich powikłaniom do 30 dni, natomiast pod względem częstości poważnych krwawień i przetoczeń krwi wykazywała profil bezpieczeństwa podobny do UFH.
Podsumowanie
Reasumując, dostępne wyniki badań klinicznych wskazują, że enoksaparyna (heparyny drobnocząsteczkowe) stanowią skuteczną alternatywę dla heparyny niefrakcjonowanej w prewencji incydentom zakrzepowo-zatorowym u chorych z ostrym zespołem wieńcowym bez uniesienia ST. Wciąż czekamy na wyniki kilku kolejnych ważnych badań klinicznych, które być może jednoznacznie pomogą odpowiedzieć na pytania odnośnie roli LMWH w postępowaniu z tą grupą chorych.
Piśmiennictwo
1. Goodman SG, Fitchett D, Armstrong PW, Tan M, Langer A; Integrilin and Enoxaparin Randomized Assessment of Acute Coronary Syndrome Treatment (INTERACT) Trial Investigators. Randomized evaluation of the safety and efficacy of enoxaparin versus unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes receiving the glycoprotein IIb/IIIa inhibitor eptifibatide. Circulation. 2003 Jan 21;107(2):238-44.
2. Mark D.B. i wsp.: Economic assessment of low-molecular-weight heparin (enoxaparin) versus unfractionated heparin in acute coronary syndrome patients: results from the ESSENCE randomized trial. Circulation. 1998, 97: 1702-7.
3. Fragmin during Instability in Coronary Artery Disease (FRISC) Study Group. Low-molecular-weight heparin during instability in coronary artery disease. Lancet 1996, 347: 561-8.
4. FRISC II Investigators. Long-term low-molecular-weight heparin in unstable coronary-artery disease: FRISC II prospective randomised multicentre study. Lancet 1999, 354: 701-7.
5. Comparison of two treatment durations (6 days and 14 days) of low molecular weight heparin with a 6-day treatment of unfractioned heparin in the initial management of unstable angina or non Q wave myocardial infarction: FRAX.I.S. (FRAxiparine in Ischaemic Syndrome). The FRAX.I.S. Study Group. Eur. Heart J. 1999, 20: 1553-62.
6. Cohen M, Theroux P, Borzak S, Frey MJ, White HD, Van Mieghem W, Senatore F, Lis J, Mukherjee R, Harris K, Bigonzi F; ACUTE II Investigators. Randomized double-blind safety study of enoxaparin versus unfractionated heparin in patients with non-ST-segment elevation acute coronary syndromes treated with tirofiban and aspirin: the ACUTE II study. The Antithrombotic Combination Using Tirofiban and Enoxaparin. Am Heart J. 2002 Sep;144(3):470-7.
7. Petersen JL, Califf RM I wsp., JAMA 2004 Lipiec;292(1):89-96
8. Ferguson JJ, Califf RM, Antman EM, Cohen M, Grines CL, Goodman S, Kereiakes DJ, Langer A, Mahaffey KW, Nessel CC, Armstrong PW, Avezum A, Aylward P, Becker RC, Biasucci L, Borzak S, Col J, Frey MJ, Fry E, Gulba DC, Guneri S, Gurfinkel E, Harrington R, Hochman JS, Kleiman NS, Leon MB, Lopez-Sendon JL, Pepine CJ, Ruzyllo W, Steinhubl SR, Teirstein PS, Toro-Figueroa L, White H; SYNERGY Trial Investigators. Enoxaparin vs unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial. JAMA. 2004 Jul 7;292(1):45-54.
9. Kiliszek M, Stolarz P, Opolski G. Low molecular weight heparin in acute coronary syndromes. T
Zawał serca
artykuł lek. med. Barbary Zalewskiej z Warszawskiego Centrum Osteoporozy "Osteomed", napisany w maju 2000 dla serwisu RES MEDICA
Patofizjologia zawału serca
Ograniczenie przepływu o 50-60% to niedokrwienie tolerowane. Przez długi czas zapasy substancji magazynującej energię komórkową (ATP) są prawidłowe i nie dochodzi do martwicy komórek, jednak mięsień nie kurczy się. Mówi się, że mięsień sercowy jest "zamrożony". Poprawa przepływu krwi w tym obszarze prowadzi do przywrócenia kurczliwości mięśnia. Ograniczenie przepływu wieńcowego o 60-80% można określić jako niedokrwienie krytyczne. W tym stanie zawartość substancji magazynującej energię (ATP) maleje proporcjonalnie do czasu trwania niedokrwienia. Poprawa przepływu nie później niż w 1.-2. godzinie niedokrwienia w przypadku ograniczenia przepływu o 80%, zaś przy przepływie ograniczonym o 60% nie później niż w 6.-12. godzinie zapobiega dalszej utracie ATP i martwicy mięśnia serca.
Zmniejszenie przepływu w tętnicy wieńcowej do 0-20% wartości normalnych to niedokrwienie letalne (śmiertelne) dla komórek tego obszaru. W ciągu kilkudziesięciu minut stężenie ATP spada do bardzo niskich wartości i rozwija się martwica mięśnia sercowego - zwykle obumieranie komórek rozpoczyna się w około 20 minut od początku niedokrwienia i narasta przez kolejne minuty, godziny.
Objawy zawału serca
Typowe objawy zawału serca to ból w klatce piersiowej, najczęściej zamostkowy, duszność, poty, uczucie lęku, nudności. Ból może promieniować do żuchwy, pleców, barków, nadbrzusza. Ważnym kryterium, sugerującym zawałowe pochodzenie bólu, jest czas jego trwania - ból zawałowy trwa przeważnie nie krócej niż 20 minut, często kilka, kilkanaście godzin. Około 25% zawałów serca daje nietypowe, niewielkie dolegliwości lub przebiega zupełnie bezbólowo. Najczęściej zawały bezbólowe występują u osób chorych na cukrzycę, u których neuropatia cukrzycowa jest przyczyną zmniejszonej percepcji bólu.
Zdarza się, że zawał serca objawia się w sposób najbardziej dramatyczny - zatrzymaniem krążenia i nagłym zgonem.
Diagnostyka zawału serca
W rozpoznaniu zawału serca poza objawami klinicznymi, przede wszystkim długotrwałym silnym bólem w klatce piersiowej, zasadnicze znaczenie ma badanie elektrokardiograficzne. Typowe zmiany w zapisie EKG, spowodowane niedokrwieniem, a następnie martwicą fragmentu mięśnia serca, pozwalają postawić pewne rozpoznanie u około 80% chorych.
Elektrokardiogram umożliwia ponadto rozpoznanie lokalizacji martwicy mięśnia serca i zorientowanie się, która tętnica wieńcowa uległa krytycznemu zwężeniu.
I tak zawał ściany dolnej lub tylnej sugeruje, że zwężona jest prawa tętnica wieńcowa, zawał ściany przedniej - że za martwicę odpowiedzialna jest gałąź zstępująca lewej tętnicy wieńcowej, a w przypadku zawału ściany bocznej - jej gałąź okalająca. Rozległe zawały obejmujące ścianę przednią i boczną są często spowodowane zamknięciem wspólnego pnia lewej tętnicy wieńcowej. Ze względu na rozległość są one szczególnie niebezpieczne. Rzadziej dochodzi do zawału fragmentu prawej komory i zwykle występuje on z zawałem ściany dolnej lub tylnej lewej komory.
EKG ma znaczenie nie tylko w rozpoznaniu zawału, ale także ocenie różnych, związanych z nim powikłań, ściśle mówiąc - zaburzeń rytmu i przewodzenia (tzw. bloków), co jest szczególnie istotne w leczeniu pacjenta.
U około 20% zapis EKG jest prawidłowy lub niecharakterystyczny. Pomocne w rozpoznaniu może być porównanie zapisów wykonanych w kilku- lub kilkunastogodzinnych odstępach, wtedy bowiem można wykazać dynamikę zmian w krzywej, która ułatwia postawienie prawidłowego rozpoznania.
Ponieważ z leczeniem nie można czekać, pomocne w takiej sytuacji są inne badania, wykonywane rutynowo u chorych z podejrzeniem świeżego zawału serca, m.in. poziomy różnych enzymów. Najbardziej charakterystyczny dla zawału serca jest wzrost we krwi poziomu CK-MB, czyli pochodzącej z mięśnia serca frakcji kinazy kreatynowej. Uwalnia się ona z uszkodzonych komórek mięśnia serca i jest dobrym markerem jego martwicy. Jej podwyższony poziom można stwierdzić już po 6 godzinach od początku bólu zawałowego, a najwyższy poziom - po dobie. Po 2-4 dobach poziom CK-MB normalizuje się. Mniej swoiste dla mięśnia sercowego, ale często wykonywane jako tańsze, jest oznaczenie poziomu transaminaz. Ich wzrost zaczyna się po dobie, a szczyt występuje po dwóch, trzech dobach od początku objawów.
Cennym badaniem jest też echokardiografia, zwłaszcza gdy konieczne jest różnicowanie zawału serca z innymi chorobami powodującymi bóle w klatce piersiowej (np. tętniakiem rozwarstwiającym aorty), a obraz EKG jest niejednoznaczny. Badanie echokardiograficzne jest też niezbędne w diagnostyce powikłań zawału, takich jak: tętniak pozawałowy serca, pęknięcie nici ścięgnistej, mięśnia brodawkowatego czy przegrody komorowej, podejrzeniu pęknięcia wolnej ściany lewej komory i obecności krwi w worku osierdziowym. Na szczęście powikłania te nie są częste i badanie echokardiograficzne jest wykonywane rutynowo dla oceny rozległości zawału.
Zawał serca pełnościenny i niepełnościenny
Te dwa typy zawałów rozróżniano kiedyś w oparciu o badanie EKG. Obecnie nie mówimy "zawał pełnościenny", tylko "zawał z załamkiem Q", a o zawale niepełnościennym - "zawał bez załamka Q". Badania anatomopatologiczne wykazują, że zawał serca u osób bez patologicznego załamka Q w EKG obejmuje często całą grubość ściany komory, czyli jest w gruncie rzeczy pełnościenny - stąd zmiana nazewnictwa.
Zawały z załamkiem Q stanowią około 60-70%, postać bez załamka Q - około 30-40% wszystkich zawałów serca. Przebieg kliniczny zawałów bez załamka Q jest na ogół lżejszy, rzadziej pojawia się niewydolność krążenia i krócej trwa hospitalizacja pacjenta. Jednak rokowanie odległe wcale nie jest lepsze niż w zawale z załamkiem Q. Śmiertelność po 3 latach jest w obu typach zawałów taka sama. Ponad połowa chorych, którzy przebyli zawał bez załamka Q, ma istotne zmiany w 2 lub 3 tętnicach wieńcowych. Dlatego wielu klinicystów uważa, że osoby, które przebyły zawał serca bez załamka Q, powinny mieć wykonaną pilnie koronarografię.
Leczenie zawału serca
Postępowanie w okresie przedszpitalnym
Okres przedszpitalny stanowi często największe zagrożenie. W ciągu pierwszych 2 godzin od początku bólu zawałowego występuje około 50% wszystkich zgonów zawałowych. Większość chorych umiera z powodu migotania komór. Można by tych ludzi uratować, gdyby w momencie wystąpienia tej arytmii znajdowali się w szpitalu, czy choćby w karetce reanimacyjnej. Niezmiernie ważne jest, o czym pacjenci z chorobą wieńcową nie chcą pamiętać, by nie zwlekać z wezwaniem pogotowia, gdy ból wieńcowy nie mija po 2-3 tabletkach nitrogliceryny. Ból trwający dłużej niż 20 minut nasuwa podejrzenie, iż jest objawem zawału i naprawdę nie ma co dłużej czekać, w nadziei, że sam minie. Od szybkiego dotarcia pacjenta do szpitala zależy jego życie i przyszłe zdrowie, ponieważ tylko szybka interwencja lecznicza stwarza szansę ograniczenia strefy zawału.
Czasem chory ma szczęście - gdy przypadkowa osoba będąca w pobliżu ma jakieś pojęcie o reanimacji, dzięki czemu może mu uratować życie, gdy w okresie przedszpitalnym wystąpi zatrzymanie krążenia. Gdyby wiedza o podstawowych zabiegach reanimacyjnych (oddech "usta-usta" i masaż zewnętrzny serca) była w naszym społeczeństwie bardziej rozpowszechniona, mniej osób ginęłoby w ostrej fazie zawału serca. Ten niedostatek umiejętności udzielania pierwszej pomocy jest tym bardziej przykry, że z powodu zatrzymania krążenia umiera często człowiek z niedużym zawałem serca, który nie uczyniłby go inwalidą, nie przekreślił szans na normalne życie, gdyby w porę udzielono mu skutecznej pomocy.
Jeżeli do chorego z zawałem serca przyjeżdża karetka pogotowia, lekarz nie zawsze ma możliwość wykonania EKG w domu pacjenta. Rozpoznanie zawału serca musi oprzeć na objawach klinicznych, które zresztą są decydujące dla podjęcia decyzji o hospitalizacji pacjenta. Pacjent z zawałem serca lub podejrzeniem zawału powinien być przewieziony do szpitala karetkę "R", która zapewnia warunki do prowadzenia postępowania reanimacyjnego, jeśli wystąpi taka konieczność. Lekarz pogotowia podaje pacjentowi niewielką dawkę aspiryny, gdyż wykazano, że takie postępowanie poprawia rokowanie (zwiększa szansę przeżycia zawału), co wynika z jej przeciwkrzepliwego działania, ułatwiającego udrożnienie naczynia, które zostało zamknięte przez skrzeplinę. W karetce możliwe jest też podawanie nitrogliceryny, o ile chory nie ma zbyt niskiego ciśnienia. Rutynowo podaje się też choremu tlen do oddychania i leki przeciwbólowe. Bardzo ważne jest unikanie domięśniowego wstrzykiwania środków przeciwbólowych, ponieważ może to uniemożliwić stosowanie w szpitalu leków fibrynolitycznych.
Postępowanie w szpitalu
Chory ze świeżym zawałem serca powinien być hospitalizowany na oddziale reanimacyjnym. Jeśli wcześniej nie było badania EKG, wykonuje się je w izbie przyjęć szpitala. W oddziale pacjent nadal oddycha powietrzem wzbogaconym w tlen i nadal prowadzona jest walka z bólem. Zwalczanie bólu jest bardzo ważnym elementem terapii, bowiem jest on czynnikiem wstrząsorodnym, tzn. przyczynia się do wystąpienia głębokiego spadku ciśnienia i nasilenia zaburzeń przepływu krwi przez narządy wewnętrzne, co może zadecydować o niepomyślnym przebiegu zawału. Stosowane są narkotyczne leki przeciwbólowe (najczęściej morfina lub mieszanka neuroleptoanalgetyczna), które podaje się dożylnie. Pacjent musi być monitorowany - śledzony jest stale zapis EKG w celu uchwycenia zaburzeń rytmu, mierzone jest ciśnienie tętnicze i ciśnienie parcjalne tlenu we krwi włośniczkowej. Wszystkie te pomiary zapewnia wielofunkcyjny monitor stojący przy łóżku pacjenta. Ponieważ leczenie ostrej fazy zawału to wyścig z czasem, wiele czynności przy pacjencie wykonywanych jest jednocześnie przez 2-3 pielęgniarki.
W trybie pilnym, po zebraniu wywiadu od chorego i wykluczeniu przeciwwskazań, wdrażane jest leczenie fibrynolityczne. Najczęściej podawanym lekiem "rozpuszczającym" skrzeplinę, która zatkała tętnicę wieńcową, jest streptokinaza. Rzadziej (z powodu kosztów) podaje się aktywator tkankowy plazminogenu. Jest też preparat będący kompleksem streptokinazy i aktywatora plazminogenu, tzw. APSAC i urokinaza, otrzymywana z moczu ludzkiego.
Lek fibrynolityczny może w krótkim czasie doprowadzić do tzw. reperfuzji, czyli przywrócenia drożności tętnicy wieńcowej i zapewnienia ukrwienia odpowiedniego fragmentu mięśnia serca. W optymalnych warunkach bardzo wczesne udrożnienie tętnicy może zapobiec martwicy mięśnia serca, czyli zawałowi. Jeżeli obumieranie komórek już się rozpoczęło, wczesne przywrócenie ukrwienia mięśnia może zmniejszyć strefę martwicy. Komórki, które jeszcze nie obumarły, ale wskutek niedokrwienia były w stanie "zamrożenia", mogą odzyskać pełną żywotność i kurczliwość. Im wcześniej zostanie wdrożone leczenie, tym większa szansa na nieduży zawał, a więc na mniejsze uszkodzenie serca.
Korzyści z leczenia fibrynolitycznego wykazało wiele badań klinicznych. Stwierdzono obniżenie śmiertelności, poprawę funkcji lewej komory, rzadsze występowanie zaburzeń rytmu serca i lepsze rokowanie odległe. Dzięki leczeniu fibrynolitycznemu można udrożnić prawie 80% tętnic zamkniętych przez skrzeplinę, ale niestety w około 20% przypadków następuje ich ponowne zamknięcie. W celu zapobiegania ponownej niedrożności podaje się aspirynę i heparynę. Najlepsze wyniki leczenia streptokinazą daje leczenie włączone przed upływem 6 godzin od początku bólu zawałowego, ale nawet leczenie wdrożone po 12 godzinach ma pozytywne efekty.
Nie zawsze można zastosować leczenie fibrynolityczne. Niektórzy chorzy mają przeciwwskazania do tego leczenia, ponieważ współistniejące schorzenia stwarzają ryzyko powikłań krwotocznych. Są to np. osoby, które niedawno (w ciągu ostatniego tygodnia) przebyły zabieg chirurgiczny lub uraz, są po udarze mózgowym czy mają wysokie nadciśnienie tętnicze.
Przeciwwskazań bezwzględnych lub względnych do leczenia fibrynolitycznego jest więcej. Zdarza się też uczulenie na streptokinazę - wtedy chory może być leczony aktywatorem plazminogenu.
Poza przedstawionym tu leczeniem farmakologicznym powrót przepływu krwi przez niedokrwiony mięsień sercowy można uzyskać, udrażniając tętnicę metodą przezskórnej koronaroplastyki (PTCA, inaczej balonikowanie) z ew. założeniem do tętnicy stentu zapobiegającego ponownemu zwężeniu, lub też metodą kardiochirurgiczną - pomostowaniem aortalno-wieńcowym (tzw. by-pass). Leczenie takie jest w naszych warunkach rzadko dostępne w trybie natychmiastowym. Jest to zresztą nie tylko polski problem. W USA na przykład tylko 18% szpitali może wykonać PTCA na dyżurze. Chociaż, jak wykazano, leczenie zawału przy pomocy PTCA jest skuteczne i bezpieczne, zabieg ten nie może być wykorzystany, jeśli nie można wykonać go szybko.
Poza leczeniem fibrynolitycznym w zawale serca prawie obowiązujące jest leczenie lekiem z grupy beta-blokerów. Leki te, blokujące receptory beta współczulnego układu nerwowego, zmniejszają zapotrzebowanie mięśnia serca na tlen, a przez to zmniejszają deficyt energetyczny mięśnia sercowego. Stosuje się je dla poprawy tolerancji wysiłku w chorobie wieńcowej. U chorego z zawałem serca włącza się to leczenie możliwie jak najszybciej, zwykle w pierwszych godzinach zawału i kontynuuje przez wiele lat po zawale. W dużych badaniach klinicznych wykazano korzystne działanie tych leków, polegające na zmniejszeniu umieralności po zawale serca. Różnica rokowania osób leczonych beta-blokerem w porównaniu z otrzymującymi placebo była tak istotna, że powinno się zalecić choremu po zawale beta-bloker, jeśli tylko nie ma przeciwwskazań do tego leczenia.
Większość chorych otrzymuje dożylnie wlew ciągły z nitrogliceryny, w celu zmniejszenia zapotrzebowania serca na tlen i ograniczenia strefy martwicy.
Inne leki są stosowane w zawale w zależności od sytuacji klinicznej, możliwych powikłań w ostrej fazie choroby i w czasie rehabilitacji szpitalnej.
Dość często podaje się lek moczopędny, ponieważ większość chorych demonstruje w pierwszych dniach zawału objawy niewydolności krążenia. Czasami konieczne jest podawanie leków antyarytmicznych, dla wytłumienia licznych komorowych skurczów dodatkowych, zwłaszcza gdy zakłócają pracę serca w znacznym stopniu i mogą nasilać niewydolność krążenia. Chorzy we wstrząsie zawałowym są leczeni katecholaminami, np. dobutaminą lub dopaminą, podnoszącymi ciśnienie tętnicze i poprawiającymi przepływ przez ważne dla życia narządy wewnętrzne, przede wszystkim mózg serce i nerki. Często serce po wstępnym załamaniu hemodynamicznym adaptuje się do nowej sytuacji, w której odpowiednią ilość krwi musi przepompować mniejsza masa mięśnia serca. Na to liczymy, włączając intensywne leczenie objawowe. Po pewnym czasie - godzinach lub dobach - można stopniowo odstawić leki poprawiające kurczliwość mięśnia serca. Jeśli się to nie udaje, wyjściem z sytuacji jest przeszczep serca, co niestety też nie jest łatwo osiągalne.
Powyższe przykłady nie wyczerpują wszystkich posunięć terapeutycznych przy chorym na zawał serca. U części chorych istnieje konieczność przejściowej stymulacji serca, ponieważ zawał uszkadza układ bodźcoprzewodzący serca i występują różnego rodzaju bloki przewodzenia, które są groźne dla życia. Większość pacjentów ma powikłania infekcyjne, przede wszystkim zapalenie płuc, sprzyja bowiem temu niewydolność lewej komory powodująca zastój krwi w płucach.
Prawie wszyscy mają lęki i zaburzenia snu. Prawidłowa rehabilitacja szpitalna pacjenta po zawale serca powinna zatem uwzględniać nie tylko jego stopniowe uruchomienie umożliwiające normalne chodzenie i wykonywanie codziennych czynności, ale także pomoc psychologa.
Właśnie rehabilitacja pozawałowa jest ważnym elementem terapii chorego. Dobrze jest, jeżeli może być potem kontynuowana przez kilka tygodni w warunkach ambulatoryjnych lub sanatorium.
Powrót pacjenta do pracy zależy od tego, w jaki stopniu zawał serca uszkodził lewą komorę. Większość chorych podejmuje pracę zawodową w ciągu 3 miesięcy. Powinni być objęci ambulatoryjną opieką kardiologiczną, zapewniającą im tzw. prewencję wtórną, czyli leczenie zapobiegające ponownemu zawałowi serca.
Powikłania zawału serca
Poza wymienionymi wcześniej komplikacjami, które nie zmieniają w szczególny sposób losu chorego, mogą co najwyżej wydłużyć czas hospitalizacji, zdarzają się poważne powikłania zawału, niektóre z nich śmiertelne.
Jednym z najgroźniejszych jest pęknięcie wolnej ściany lewej komory, które najczęściej kończy się szybkim zgonem pacjenta. Zdarzają się jednak przypadki zakończone pomyślnie, nawet nie zawsze wymagające leczenia operacyjnego w okresie ostrym. W sercu może też pęknąć przegroda komorowa - powstaje wtedy przeciek między lewą a prawą komorą, wymagający naprawy chirurgicznej. Zdarza się także pęknięcie mięśnia brodawkowatego lub nici ścięgnistych utrzymujących płatek zastawki mitralnej. Skutkiem takiego powikłania jest ostra niedomykalność zastawki mitralnej, która często ma bardzo dramatyczny przebieg, z ciężką niewydolnością lewej komory i nie poddającym się leczeniu obrzękiem płuc.
Częstszym następstwem zawału serca jest tętniak wolnej ściany lewej komory. Wbrew obawom pacjentów nie grozi on pęknięciem, ale upośledza funkcję lewej komory, czyli powoduje objawy niewydolności krążenia. U wielu chorych tętniak prowokuje uporczywe komorowe zaburzenia rytmu. Zagraża też powstawaniem skrzeplin w jego obrębie; mogą one stać się źródłem niebezpiecznych zatorów, np. mózgowych. Część pacjentów z tętniakiem pozawałowym wymaga leczenia operacyjnego.
U chorych po zawale serca występuje czasami zapalenie osierdzia będące odczynem immunologicznym na zmienioną martwiczo tkankę mięśnia sercowego. Jest to tzw. zespół Dresslera, pojawiający się po kilku dniach lub tygodniach od początku zawału i charakteryzujący się gorączką, wysiękiem w osierdziu i - często - także w jamach opłucnych. Nie jest to stan zagrażający życiu, o ile w osierdziu nie zgromadzi się zbyt duża ilość płynu, zagrażająca tamponadą serca, czyli uciśnięciem serca przez płyn uniemożliwiającym napełnianie się jam serca krwią. Zespół Dresslera leczy się sterydami, często przez wiele tygodni, ponieważ wysięk w osierdziu często nawraca.
Do powikłań zawału należy też zaliczyć trwałe zaburzenia przewodzenia prądu w sercu, ze zwolnieniem tętna zmuszającym do wszczepienia pacjentowi na stałe układu stymulującego serce.
Jak widać, zawał serca, będąc jedną jednostką chorobową, ma wiele postaci klinicznych i bardzo różnorodny przebieg. Dlatego każdy chory musi być traktowany indywidualnie, mimo że istnieje wiele pieczołowicie opracowanych standardów postępowania z pacjentem, u którego wystąpił zawał serca.
Zawał mięśnia sercowego jest to martwica komórek mięśniowych określonego obszaru serca, wywołana zamknięciem światła naczynia wieńcowego najczęściej w wyniku pęknięcia blaszki miażdżycowej. Zawał serca może wystąpić w każdym obszarze mięśnia sercowego, najczęściej występuje w obrębie ściany lewej komory. Zawał może obejmować całą grubość mięśnia (zawał pełnościenny) lub warstwę podwsierdziową (zawał niepełnościenny - zawał bez załamka Q w zapisie EKG).
Zawał serca - choroba XXI wieku. Jak rozpoznać zawał serca? Co zrobić w przypadku bólu w klatce piersiowej? |
2005-11-15 |
Szacuje się, że w Polsce około milion osób ma zdiagnozowaną chorobę wieńcową. Około 100 tysięcy osób rocznie ma zawał serca. W 2000 roku zarejestrowano wśród mężczyzn ponad 30 tysięcy, a u kobiet blisko 25 tysięcy zgonów z powodu choroby wieńcowej. Zawał serca jest często pierwszym objawem choroby serca. Ograniczenie śmiertelności z powodu zawałów serca można osiągnąć poprzez zwalczanie czynników ryzyka choroby wieńcowej (profilaktyka) oraz wczesne rozpoznanie zawału i szybkie wdrożenie nowoczesnego leczenia. Kluczowe znaczenie ma znajomość wczesnych objawów wskazujących na zawał serca, a także przedstawienie właściwego działania w przypadku podejrzenia zawału. Jakie są objawy zawału serca?
Najczęstszym i najważniejszym objawem zawału jest ból w klatce piersiowej. Ból zlokalizowany jest w okolicy mostka lub rzadziej, w okolicy serca. Czasami oprócz tego może być obecny ból, drętwienie, mrowienie rąk, szczęki oraz pleców. Ból jest bardzo silny, piekący, dławiący, ściskający, lub gniotący. Zmiana pozycji ciała ( np. położenie się) nie przynosi ulgi. Ważną cechą bólu zawałowego jest jego czas trwania. Jako charakterystyczny przyjmuje się trwający dłużej niż 20 minut. Co zrobić, gdy wystąpi ból w klatce piersiowej? Jeżeli ból wystąpił podczas wysiłku należy przerwać wysiłek i odpocząć. Po zaprzestaniu pracy ból, który nie jest bólem związanym z zawałem ustępuje w ciągu kilku minut. Jeżeli pacjent leczył się wcześniej na chorobę wieńcową i ma przy sobie przepisane przez lekarza preparaty nitrogliceryny (w tabletkach podjęzykowych lub w aerozolu) powinien przyjąć lek. Ból powinien ustąpić po maksymalnie 5 minutach. Jeżeli nadal nie ustępuje można wziąć kolejną dawkę leku i odczekać kolejne pięć minut. Jeżeli po tym czasie ból nadal występuje należy wezwać pogotowie ratunkowe. Maksymalny czas od początku bólu w klatce piersiowej do wezwania pogotowia nie powinien być dłuższy niż 20 minut. Jeśli nawet ból ustąpił wcześniej, często nawraca należy skontaktować się z lekarzem. Czy wzywać pogotowie od razu, czy poczekać, aż "samo przejdzie"? Duża cześć pacjentów wzywa pomoc zbyt późno. Wynika to z niepewności, co do przyczyn bólu i złego samopoczucia oraz złudnej nadziei, że ból ustąpi za "jakiś czas". Tymczasem czas decyduje nie tylko o szansach na przeżycie, ale także o późniejszym stanie zdrowia, sprawności w codziennym życiu i w pracy i długości życia u osób, które zawał serca przeżyły. Dlatego nie wolno zwlekać zbyt długo - maksymalnie 20 minut wliczając w to czas na podanie dwóch dawek nitrogliceryny. Trzeba pamiętać, że w przebiegu zawału może dojść do zatrzymania pracy serca (prowadzi do utraty przytomności), które może wystąpić nagle i znacznie pogarsza szanse przeżycia, jeśli wystąpiło poza szpitalem. Jeżeli zatrzymanie pracy serca nastąpiło przed przyjazdem pogotowia trzeba, jak najszybciej rozpocząć pierwszą pomoc (sztuczne oddychanie i zewnętrzny masaż serca). Co zrobić po wezwaniu pogotowia ratunkowego? Wezwanie pogotowia powinno być pierwszą czynnością podjętą w przypadku podejrzenia zawału serca. Należy jasno powiedzieć, że wzywa się pogotowie do osoby, która prawdopodobnie ma zawał serca. Informowanie rodziny, czy sąsiadów nie może opóźniać wezwania pomocy lekarskiej. Dopiero później można zaalarmować znajomych, którzy mogą ułatwić znalezienie przez zespól ratunkowy właściwego adresu (wyjść przed klatkę schodową, dom, na ulicę). Jeżeli w domowej apteczce jest kwas acetylosalicylowy, czyli aspiryna lub inne jego preparaty można wziąć 300 mg (najczęściej jest to od 2 do 4 tzw. "małych" tabletek po 75-80 mg, które należy rozgryźć). W żadnym jednak wypadku poszukiwanie tych tabletek lub obliczanie właściwej dawki nie może poprzedzać wezwania pogotowia. Czy można wezwać najpierw lekarza rodzinnego, bądź iść do przychodni? Nie. Jeżeli podejrzewamy zawał, tzn. mamy silny ból w klatce piersiowej, który nie ustępuje ciągu 20 minut, właściwą pomoc medyczną otrzymamy jedynie w szpitalu. Czy chorego może zawieść do szpitala ktoś ze znajomych? Jest to dopuszczalne tylko w sytuacji, gdy odległość do szpitala jest bardzo mała, a osoba dysponująca samochodem jest bezpośrednio przy nas. W żadnym wypadku nie wolno najpierw poszukiwać osoby, która zawiezie nas do szpitala, a dopiero gdy to się nie uda - dzwonić po pogotowie. Co można jeszcze zrobić? Rozpoznanie i właściwą terapię może przyśpieszyć porównanie zapisu EKG w trakcie bólu z zapisami poprzednimi. Dlatego dobrze jest mieć przy sobie zapis EKG. Jeżeli takiego nie mamy, można poprosić o jego wykonanie przy okazji najbliższej wizyty w przychodni. Ważne jest również kompletowanie pełnej dokumentacji medycznej (karty wypisowe ze szpitala, spis aktualnie przyjmowanych leków itp.) w określonym miejscu, o którym wiedzą domownicy i dostarczenie jej w jak najkrótszym czasie do szpitala. Jak to zapamiętać? Ponieważ w chwilach stresu można wiele rzeczy zapomnieć, przydatne jest przygotowanie własnego "planu ratunkowego" i zapisanie typowych objawów, czasu - jaki możemy odczekać, numeru telefonu pogotowia ratunkowego, leków, jakie aktualnie są stosowane i na jakie ewentualnie jesteśmy uczuleni. Podsumowanie
1. Podstawowym objawem zawału serca jest silny ból w klatce piersiowej, nieustępujący po odpoczynku lub przyjęciu nitrogliceryny.
Opracował:
Program "Pamiętaj o Sercu" jest programem edukacji zdrowotnej i ma na celu dotarcie do możliwie najszerszych kręgów społeczeństwa z wiedzą o przyczynach powstawania i możliwościach zapobiegania chorobom układu sercowo-naczyniowego poprzez odpowiednią profilaktykę. Program "Pamiętaj o Sercu" jest finansowany ze środków Ministerstwa Zdrowia, a prowadzony pod merytorycznym patronatem Polskiego Towarzystwa Kardiologicznego i Instytutu Kardiologii. Zachęcamy także do odwiedzenia strony internetowej Programu: www.pamietajosercu.pl.
Więcej informacji:
- Koordynator Programu "Pamiętaj o Sercu": prof. dr hab. med. Wojciech Drygas z Instytutu Kardiologii w Warszawie, Dyrektor Programu CINDI Światowej Organizacji Zdrowia w Polsce
|
Wyszukiwarka
Podobne podstrony:
Kardiotokografia 2
Wstrząs kardiogenny – patomechanizm i postępowanie ratownicze ppt
Najnowsze osiągnięcia współczesnej kardiologii
Kardiomiopatia restrykcyjna
wyklad z kardiologii 30 11 2011
Kardiologia wyklad 03 11 2011
ALGORYTM WSTRZĄS KARDIOGENNY
hejka, IV rok, IV rok CM UMK, Kardiologia, giełdy, part I
Krekora-pytania-nadcisnienie, medycyna, giełdy, interna1, interna j, Interna, kardiologia, giełda ka
pytania grupa 8, kardiologia
dusznica bolesna stabilna - ktostam - 4 rok - am bydgoszcz, IV rok Lekarski CM UMK, Kardiologia, Ćwi
Ostre stany kardiologiczne w przebiegu nadciśnienia tętniczego(1), różne, ►Medycyna-Fizykoterapia,Ps
Piestrzeniewicz-pytania z wad, medycyna, giełdy, interna1, interna j, Interna, kardiologia, giełda k
więcej podobnych podstron