Wydział: metali nieżelaznych |
Data wykonania ćwiczenia:16.11.2012 |
||
KIERUNEK:metalurgia |
NR ĆWICZENIA: 3 |
||
TYTUŁ ĆWICZENIA: Otrzymywanie cynku poprzez elektrolizę ZnSO4 |
|||
Grupa nr: 1. Beata Kozak 2. Monika Kulczyk 3. Miron Smętek
|
Data oddania sprawozdania:30.11.2012 |
Data zaliczenia sprawozdania: |
|
|
Data oddania sprawozdania do poprawy: |
Data zaliczenia ćwiczenia: |
|
Wprowadzenie.
Procesem elektrolizy nazywa się reakcje elektrochemiczne zachodzące na granicy faz metal elektrolit pod wpływem przepływu prądu z zewnętrznego źródła. Przepływ prądu przez elektrolit wymusza ruch jonów: kationów w kierunku katody oraz anionów w kierunku anody. Jednocześnie na elektrodach zachodzą reakcje: redukcji - na katodzie i utleniania - na anodzie. W zależności od rodzaju anody oraz składu elektrolitu podczas elektrolizy mogą zachodzić rożne procesy. W przypadku anody roztwarzalnej następuje utlenianie metalu elektrody, natomiast zastosowanie anody nieroztwarzalnej prowadzi do utleniania składnika elektrolitu. Na katodzie zachodzą natomiast procesy redukcji składników elektrolitu (np. osadzanie metali, wydzielanie wodoru).
W wyniku dysocjacji elektrolitycznej zachodzącej w elektrolicie ZnSO4 :
ZnSO4 + H2O = H2SO4 '+ Zn0 + ½ O2
na katodzie i anodzie zachodzą następujące reakcje:
Ilościowy związek pomiędzy masą produktów elektrolizy a czasem trwania procesu i natężeniem prądu opisuje prawo Faradaya. Zależność tę przedstawia równanie:
m = k· I · t
gdzie:
m - masa produktu reakcji elektrodowej, g
I - natężenie prądu, A
t - czas trwania elektrolizy, s
k - równoważnik elektrochemiczny reagenta biorącego udział w reakcji elektrodowej:
M - masa molowa rozpatrywanego produktu reakcji; g・mol-1
z - liczba elektronow biorących udział w elementarnej reakcji elektrodowej
F - stała Faradaya (96 500 C・mol-1)
Miarą używaną w procesie elektrolizy jest wydajność prądowa ηP. Jest to stosunek masy wydzielonego produktu mw do masy wynikającej z prawa Faradaya m:
p (mw /m)*100%
Szereg napięciowy metali to zestawienie pierwiastków chemicznych o właściwościach metalicznych, według ich potencjału standardowego E0. Punktem odniesienia dla tego zestawienia jest elektroda wodorowa, której potencjał standardowy przyjmuje się umownie za zero. Każdy metal o niższym potencjale normalnym wypiera z roztworu soli metal o wyższym potencjale.
Nadnapięcia wydzielania wodoru to różnica między potencjałem, przy którym zachodzi wydzielanie wodoru zależy a potencjałem równowagowym elektrody wodorowej.
Przebieg:
Na wstępie wlaliśmy do zlewek 3 przygotowane roztwory elektrolitów, zawierające kolejno:
100 [ g/dm3 ] Zn i 30 [ g/dm3 ] H2SO4
100 [ g/dm3 ] Zn i 60 [ g/dm3 ] H2SO4
100 [ g/dm3 ] Zn i 120 [ g/dm3 ] H2SO4
Oczyszczone aluminiowe katody zważyliśmy na wadze analitycznej. Następnie umieściliśmy katody w elektrolizerze.
Pomiar wykonywaliśmy kolejno dla natężenia prądu: 1[A], 1,5[A] i 2[A]. W każdym z tych przypadków czas trwania pomiaru to: 15min, natomiast odczyt wyników odbywał się co 5 min.
Po każdym pomiarze oczyszczaliśmy katody w wodzie destylowanej i alkoholu. Następnie suszyliśmy je w ciepłym strumieniu powietrza i ponownie ważyliśmy w celu obliczenia zmiany masy.
Obliczenia.
Przykładowe obliczenia
mteoret. = k*I*t
mteoret = 0.000339*1*900 = 0.31[g]
k - równoważnik elektrochemiczny pierwiastka
k = ![]()
η - wydajność prądowa:
η = 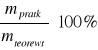
η = ![]()
![]()
Q - zużycie energii:
Q = (U*I*t)/mprakt.
Q = (3,2775· 1 · 0.25 ·/0,531 = 10543
Tabele wyników.
Wykresy.
Wnioski.
Z pierwszego wykresu możemy odczytać, że wydajność prądowa elektrolizy wraz ze wzrostem stężenia kwasu siarkowego maleje. Im wyższe było natężenie prądu, tym wydajność procesu była mniejsza. Na wykresie funkcje dla natężenia 1,5 oraz 2 A są do siebie bardzo zbliżone. Różnica pomiędzy wykresami dla ich funkcji powinna być większa, mogło to być spowodowane niedokładnym wysuszeniem próbki przez co jej masa była wyższa. Dla gęstości prądu 1 [A/dm2] wydajność prądowa procesu wyniosła prawie 200%. Taki wynik nie jest możliwy, zatem został gdzieś popełniony błąd. Mogło to być spowodowane złym wysuszeniem próbki, przez co jej masa była wyższa niż w rzeczywistości. Najbardziej energooszczędne jest zastosowanie niższego natężenia prądu przy jak najwyższym stężeniu kwasu siarkowego. Napięcie maleje wraz ze wzrostem stężenia kwasu siarkowego.