Zadania do tematu 4
16,18,19,20,22,24/151; 26,27,29/152
![]()
16/151
pcH = ? roztworu H2S o stężeniu ck = 0,10 mol/dm3.
I = 1A, pKa1 = 6,90, pKa2 = 13,48; Ka1 = 1,26∙10-7, Ka2 = 3,31∙10-14
H2S ↔ H+ + HS-
HS- ↔ H+ + S2-
Bilans stężeń:
[H+] = [H]1 + [H]2
[HS-] = [H]1 - [H]2
[S2-] = [H+]2
[H2S] = ck - [H+]1
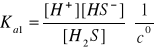
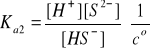
Założenia
Ponieważ Ka1 >>> Ka2 (siedem rzędów różnicy), to:
[H+]1 >> [H+]2
[H+] = [H+]1
[HS-] = [H+]1
oraz ck >> [H+]1
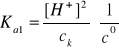
![]()
![]()
![]()
Przyjęte założenia są spełnione,
Zatem pcH = 4 - log 1,12 = 3.95
18/152
Roztwór H2SeO3, ck = ?, pcH = 3,00, d = 1,11 g/cm3
I = 3B, pKa1 = 2,58, pKa2 = 8,00; Ka1 = 2,63∙10-3, , Ka2 = 1,00∙10-8
H2SeO3 ↔ H+ + HSeO3-
HSeO3- ↔ H+ + SeO32-
Bilans stężeń:
[H+] = [H]1 + [H]2 = 1,0∙10-3 mol/dm3
[HSeO3-] = [H]1 - [H]2
[SeO32-] = [H+]2
[H2SeO3] = ck - [H+]1
Założenia
Ponieważ Ka1 >>> Ka2 (pięć rzędów różnicy), to:
[H+]1 >> [H+]2
[H+] = [H+]1
[HSeO3-] = [H+]1
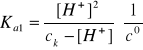
![]()
![]()
Zatem przyjęte założenia są spełnione, stąd:
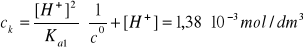
V ≡ 1dm3, MH2SeO3 = 128,97 g/mol
![]()
20/151
Roztwór H2SeO3, ck = 0,010 mol/dm3.
[H+] = ?, [HSeO3-] = ? [SeO32-] = ?
I = 3B, pKa1 = 2,58, pKa2 = 8,00; Ka1 = 2,63∙10-3, , Ka2 = 1,00∙10-8
H2SeO3 ↔ H+ + HSeO3-
HSeO3- ↔ H+ + SeO32-
Bilans stężeń:
[H+] = [H]1 + [H]2
[HSeO3-] = [H]1 - [H]2
[SeO32-] = [H+]2
[H2SeO3] = ck - [H+]1
Założenia
Ponieważ Ka1 >>> Ka2 (pięć rzędów różnicy), to:
[H+]1 >> [H+]2
[H+] = [H+]1
[HSeO3-] = [H+]1
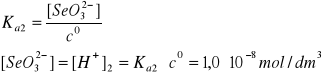
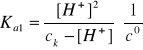
Stężenie jonów wodorowych obliczamy z wyrażenia na Ka1 i nie stosujemy wzoru uproszczonego, ponieważ:
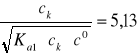
[H+]2 + Ka1[H+] - Ka1ck = 0
[H+]2 + 2,63∙10-3[H+] - 2,63∙10-5 = 0
Δ = 1,121169∙10-4
![]()
[H+] = 4,00∙10-3 mol/dm3
P
Przyjęte założenia są spełnione, zatem:
[H+] = 4,0∙10-3 mol/dm3
[HSeO3-] = 4,0∙10-3 mol/dm3
[SeO32-] = 1,0∙10-8 mol/dm3
22/151
Roztwór H3PO4, ck = 0,010 mol/dm3
I = 1B, pKa1 = 1,68, pKa2 = 6,34, pKa2 = 11,3
Ka1 = 2,09∙10-2; Ka1= 4,57∙10-7; Ka3 = 5,0∙10-12
[H+] = ?, [H2PO4-] = ?, [HPO42-] = ?, [PO43-] = ?
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
H2PO4- ↔ H+ + PO43-
Bilans stężenia jonów wodorowych:
[H+] = [H+]1 + [H+]2 + [H+]3
Ponieważ kolejne stałe dysocjacji różnią się o pięć rzędów, tzn. Ka1 >>> Ka2 >>> Ka3, to:
[H+]1 >> [H+]2 >> [H+]3, zatem [H+] = [H+]1 oblicza się z wyrażenia na Ka1 i nie stosuje się wzoru uproszczonego, bowiem ![]()
= 0,7
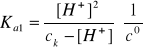
[H+]2 + Ka1[H+] - Ka1ck = 0
[H+]2 + 0,0209[H+] - 2,09∙10-4 = 0
Δ = 12,7281∙10-4
![]()
3,56765∙10-2
[H+] = 7,4∙10-3 mol/dm3
Bilans stężeń pozostałych jonów z dokładnością do dwóch cyfr znaczących:
[H2PO4-] = [H+] = 7,4∙10-3 mol/dm3
[H2PO4-] = Ka2∙c0 = 4,6∙10-7 mol/dm3
W celu obliczenia anionów PO43- obliczymy z wyrażenia na kumulatywną stałą dysocjacji K = Ka1∙Ka2∙Ka3 = 4,79∙10-20 :
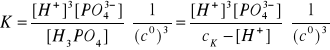
![]()
![]()
23/151
Kwas węglowy H2CO3
I = 1A, pKa1 = 6,04, pKa2 = 9,57
Ka1 = 9,12∙10-7, Ka2 = 2,69∙10-10
H2CO3 ↔ H+ + HCO3-
HCO3- ↔ H+ + CO32-
Ponieważ Ka1 >>> Ka2,
to [H+]1 >>> [H+]2 i [CO32-] = Ka2∙c0
α1 = ? , α2 = 3,3∙10-5
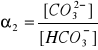
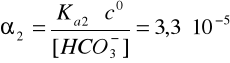
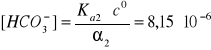
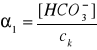
![]()
![]()
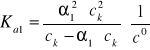
Dla uproszczenia w dalszych równaniach c0 będzie pominięte.
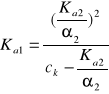
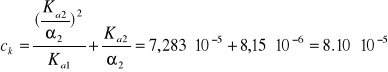
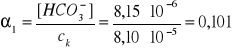
Zdokładnością do dwóch cyfr znaczących α1 = 10%.
24/151
Roztwór H2SO4, p[%]k = 2,0%, d = 1,075 g/cm3.
I = 1A, pKa2 = 1,12, Ka2 = 0,0759, MH2SO4 = 98,08 g/mol
pcH = ? [SO42-]1 = ?
R = 10x, [SO42-]2 =?, [SO42-]1/[SO42-]2 = ?
Analityczne stężenie kwasu, ck , obliczamy ze wzoru:
![]()
H2SO4, mocny kwas dwuzasadowy dysocjuje w dwóch etapach:
H2SO4 → H+ + HSO4-, pierwszy etap
HSO4- ↔ H+ + SO42-, drugi etap
Anion HSO4- jest kwasem średniej mocy, dlatego w drugim etapie dysocjacji H2SO4 ustala się stan równowagi ze stałą dysocjacji Ka2:
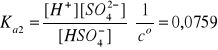
Bilans stężeń w stanie równowagi:
[H+]1 = ck
[H+]2 = [SO42-]
[H+] = [H+]1 + [H+]2 = ck + [H+]2
[HSO4-] = ck - [H+]2
Aby w roztworze H2SO4 obliczyć całkowite stężenie jonów wodorowych należy najpierw obliczyć z wyrażenia na Ka2 stężenie jonów wodorowych [H+]2 z drugiego etapu dysocjacji:
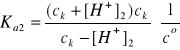
Po odpowiednim przekształceniu ostatniego wyrażenia uzyskuje się równanie kwadratowe zupełne względem [H+]2:
![]()
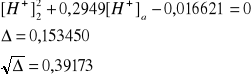
[H+]2 = [SO42-] = 0,0484 mol/dm3
[SO42-]1 = 0,048 mol/dm3 (dwie cyfry znaczące)
[H+] = ck + [H+]2 = 0,219 + 0,0484 = 0,27 mol/dm3 (z dokładnością do dwóch cyfr znaczących!)
pcH = 0,57
ck' = ck/10 = 0,0219 mol/dm3
Ponownie rozwiązujemy równanie kwadratowe zupełne:
([H+]2')2 + 0,0978[H+]2' - 1, 66221∙10-3 = 0
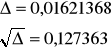
[H+]2' = [SO42-]2 = 0,0148 mol/dm3
[SO42-]1/[SO42-]2 = 0,0484/0,0148 = 3,3
26/152
0,10 M H2S, [S2-] = 2,6∙10-19 mol/dm3
I = 1A, pKa1 = 6,90, pKa2 = 13,48
H2S ↔ H+ + HS-
HS- ↔ H+ + S2-
0,10 M H2S odpowiada nasyconemu roztworowi siarkowodoru. Jest to tak słaby kwas, że w praktyce posługujemy się tzw. iloczynem jonowym siarkowodoru:
[H+]2[S2-]/(c0)2 = Ka1∙Ka2∙cH2S = 4,17∙10-22
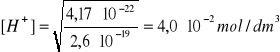
pcH = 1,60
Wyszukiwarka
Podobne podstrony:
Zadania do tematu 3, PWr, chemia nieorganiczna ćwiczenia
Zadania do tematu 1, PWr, chemia nieorganiczna ćwiczenia
Zadania do tematu 2, PWr, chemia nieorganiczna ćwiczenia
Wyklad 3, PWr, chemia nieorganiczna ćwiczenia
Rozwiązania zadań - temat 11, PWr, chemia nieorganiczna ćwiczenia
Rozwiązania zadań -t. 6, PWr, chemia nieorganiczna ćwiczenia
Wyklad 5, PWr, chemia nieorganiczna ćwiczenia
Wyklad 10, PWr, chemia nieorganiczna ćwiczenia
chemia nieorganiczna ćwiczenia
zadania do tematu rynek, mikroekonomia
zadania do pierwszego kolokwium, Surowce nieorganiczne
chemia nieorganiczna ćwiczenia
aniony, farmacja I i II, chemia nieorganiczna, ćwiczenia
Zadania rachunkowe do tematu kwasy i zasady, Farmacja, Chemia ogólna i nieorganiczna
więcej podobnych podstron