Zadania do tematu 3
1,2,6,8,9,11, 12/150;13,14/151
1/150
V = 100 cm3 roztworu amoniaku (NH4OH) o stężeniu cb = 0,10 mol/dm3
mNaOH = 2,0 g
MNAOH = 40,01 g/mol
I = 1A, pKb = 4,33, Kb = 4,68∙10-5; pcNH4 = ?
Objętość roztworu nie zmienia się po dodaniu stałego NaOH, zatem V = 100 cm3 = 0,100 dm3
nNaOH = mNaOH/ MNAOH = 2,0/40,01 = 0,0500 mol
cNaOH = nNaOH/V = 0,0500/0,100 = 0,500 mol/dm3
NH4OH ↔ NH4+ + OH-
NaOH → Na+ + OH-
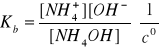
[NH4+] = [OH-]NH4OH
[OH-] = cNaOH + [OH-]NH4OH = cNaOH + [NH4+]
[NH4OH] = cb - [[OH-]NH4OH = cb - [NH4+]
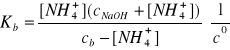
Założenie:
cNaOH >> [NH4+]
cb >> [NH4+]![]()
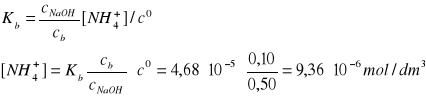
Z dokładnością do dwóch cyfr znaczących [NH4+] = 9,4∙10-6 mol/dm3. Ponieważ obydwa założenia są świetnie spełnione, zatem:
pcNH4 = 5,03
2/150
Kwas octowy (HA), V1 = 200 cm3, cHA = 1,00 mol/dm3
+ V2 = 1,0 cm3 kwasu solnego, cHCl = 0,60 mol/dm3
I = 1A, pKa = 4,55, Ka = 2,82∙10-5
Obliczyć ΔpcH = pcH1 - pcH2
pcH1 dotyczy sytuacji przed dodaniem HCl, tzn. wtedy gdy kwas octowy występuje w roztworze sam:
HA ↔ H+ + A-
Ponieważ
[H+] = [A-]
[HA] = cHA - [H+]1, to
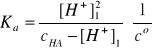
Założenie cHA >> [H+]1 jest spełnione, ponieważ ![]()
= 188,3.
Stąd [H+]1 = 5,31∙10-3 mol/dm3 oraz pcH1 = 2,27
pcH2 odnosi się do mieszaniny kwasów o objętości V = V1 + V2 = 201 cm3. Stężenia obydwu kwasów w tej mieszaninie są następujące:
![]()
![]()
HA ↔ H+ + A-
HCl → H+ + Cl-
[H+]HA = [A-]
[H+]2 = c'HCl + [H+]HA
[HA] = c'HA - [H+]HA
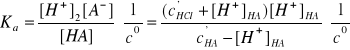
Obecnie można przyjąć tylko jedno założenie, mianowicie c'HA >> [H+]HA, co prowadzi do równania kwadratowego zupełnego:
![]()
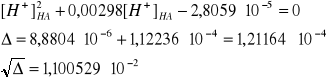
[H+]HA = 4,01∙10-3 mol/dm3
[H+]2 = c'HCl + [H+]HA = 2,98∙10-3 + 4,01∙10-3 = 7,0∙10-3 mol/dm3
pcH2 = 2,15
ΔpcH = pcH1 - pcH2 = 0,12 (z dokładnością do dwóch cyfr znaczących)
6/150
Kwas cyjanowodorowy HCN, dalej HA, V1 = 500 cm3, cHA = 0,0090 mol/dm3
+ V2 = 1,00 cm kwasu solnego, cHCl = 0,50 mol/dm3.
I = 2A, pKa = 8,52, pK2 = 3,02∙10-9.
Obliczyć ile razy zmieni się stopień dysocjacji HCN, tzn. obliczyć stosunek α1/α2.
α1 jest stopniem dysocjacji HCN przed dodaniem kwasu solnego:
HA ↔ H+ + A-
Ponieważ
[H+]1 = [A-]
[HA] = cHA - [H+]1, to
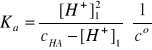
Założenie cHA >> [H+] jest spełnione, ponieważ ![]()
= 1727. Stąd
[H+]1 = 5,2∙10-6 mol/dm3
α1 = [H+]1/cHA = 5,8∙10-4
α1 = 0,058%
α2 jest stopniem dysocjacji HCN w obecności kwasu solnego. Objętość mieszaniny kwasów:
V = V1 + V2 = 501 cm3
Stężenia obydwu kwasów w tej mieszaninie są następujące:
![]()
![]()
HA ↔ H+ + A-
HCl → H+ + Cl-
[H+]HA = [A-]
[H+]2 = c'HCl + [H+]HA
[HA] = c'HA - [H+]HA
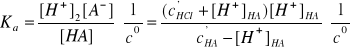
Założenia:
c'HA >> [H+]HA
c'HCl >> [H+]HA
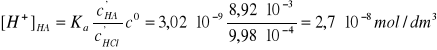
Założenia są bardzo dobrze spełnione. Zatem
α2 = H+]HA/ H+]HA = 3,0∙10-6
α2 = 0,00030%
α1/α2 = 193. Końcowy wynik należy jednak podać z dokładnością do dwóch cyfr znaczących, wobec tego:
α1/α2 = 1,9∙102.
9/150
V = 1,00 dm3 roztworu amoniaku (NH4OH), cNH4OH = 0,025 mol/dm3. Obliczyć masę stałego KOH, aby po dodaniu do roztworu (objętość V pozostaje stała) stężenie jonów NH4+ zmalało 10x.
I = 1A, pKb = 4,33, Kb = 4,68∙10-5
MKOH = 56,11g/mol
mKOH = ?
[NH4+]2 = [NH4+]1/10
Przed dodaniem KOH:
NH4OH ↔ NH4+ + OH-
[NH4+]1 = [OH-]
[NH4OH] = cNH4OH - [NH4+]
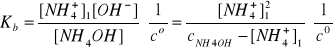
Do obliczenia stężenia jonów amonowych nie stosujemy wzoru uproszczonego, ponieważ:
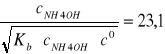
![]()
![]()
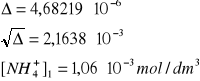
Po dodaniu KOH:
NH4OH ↔ NH4+ + OH-
KOH → K+ + OH-
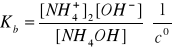
[NH4+]2 = [NH4+]1/10 = 1,06∙10-4 mol/dm3
[OH-] = cKOH + [NH4+]2
[NH4OH] = cNH4OH - [NH4+]2
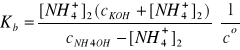
Po przekształceniu otrzymujemy:
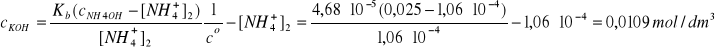
nKOH = V∙cKOH
mKOH = V∙cKOH∙MKOH = 0,0109∙56,11 = 0,61g KOH (dwie cyfry znaczące)
11/150
Mocny kwas HX, c1 = 2,5∙10-3 mol/dm3, pcH1 = ?
R = 5000, c2 = c1/R = 2,5∙10-3/5000 = 5,0∙10-7 mol/dm3, pcH2 = ?
ΔpcH = pcH2 - pcH2
I = 1A, pKw = 13,80; Kw = 1,58∙10-14
Przed rozcieńczeniem
HX → H+ + X-
[H+]1 = c1 = 2,5∙10-3 mol/dm3
pcH1 = 3 - log 2,5 = 2,60
Po rozcieńczeniu
Stężenie HX, c2 = 5,0∙10-7 mol/dm3 jest w obszarze stężenia granicznego, dlatego:
HX → H+ + X-
H2O ↔ H+ + OH-
[H+] = c2 + [H+]w
[H+]w = [OH-]
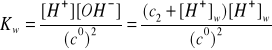
![]()
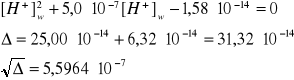
[H+]w = 2,98∙10-8 mol/dm3
[H+]2 = c2 + [H+]w = 5,0∙10-7 + 2,98∙10-8 = 5,3∙10-7
pcH2 = 7 - log 5,3 = 6,28
ΔpcH = pcH2 - pcH2 = 3.68 (odpowiedź podana w skrypcie 3,67).
12/150
V1 = 20,0 cm3 r-ru KOH, c1 = 0,020 mol/dm3 dodano do V2 = 1,50 m3 = 1,50∙106 cm3 roztworu NaClO4. UWAGA: NaClO4 reguluje siłę jonową (I = 1A) uzyskanego roztworu KOH o stężeniu c2 = 2,67∙10-7 mol/dm3, które jest w obszarze stężeń granicznych.
pKw = 13,80, pKw =1,58∙10-14. Obliczyć zmianę ΔpcH = pcH1 - pcH2.
Przed rozcieńczeniem
KOH → K+ + OH-
[OH-]1 = c1 = 0,020 mol/dm3
pcOH1 = 2 - log 2 = 1,70
pcH1 = pKw - pcOH1 = 13,80 - 1,70 = 12,10
Po rozcieńczeniu
KOH → K+ + OH-
H2O ↔ H+ + OH-
[OH-]2 = c2 + [OH-]w
[H+] = [OH-]w
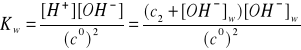
![]()
![]()
Δ = 7,1289∙10-14 + 6,3200∙10-14 = 13,4489∙10-14
![]()
[OH-]w = 4,99∙10-8 mol/dm3
[OH-]2 = 2,67∙10-7 + 4,99∙10-8 = 3,2∙10-7 mol/dm3
pcOH2 = 7 - log 3,2 = 6,50
pcH2 = pKw - pcOH2 = 13,80 - 6,50 = 7,30
ΔpcH = pcH1 - pcH2 = 4,80
Wyszukiwarka
Podobne podstrony:
Zadania do tematu 1, PWr, chemia nieorganiczna ćwiczenia
Zadania do tematu 2, PWr, chemia nieorganiczna ćwiczenia
Zadania do tematu 4, PWr, chemia nieorganiczna ćwiczenia
Wyklad 3, PWr, chemia nieorganiczna ćwiczenia
Rozwiązania zadań - temat 11, PWr, chemia nieorganiczna ćwiczenia
Rozwiązania zadań -t. 6, PWr, chemia nieorganiczna ćwiczenia
Wyklad 5, PWr, chemia nieorganiczna ćwiczenia
Wyklad 10, PWr, chemia nieorganiczna ćwiczenia
chemia nieorganiczna ćwiczenia
zadania do tematu rynek, mikroekonomia
zadania do pierwszego kolokwium, Surowce nieorganiczne
chemia nieorganiczna ćwiczenia
aniony, farmacja I i II, chemia nieorganiczna, ćwiczenia
Zadania rachunkowe do tematu kwasy i zasady, Farmacja, Chemia ogólna i nieorganiczna
więcej podobnych podstron