Zakład Chemii Fizycznej
Laboratorium Studenckie
ĆWICZENIE 24
TEMAT:WYZNACZANIE POWIERZCHNI WŁAŚCIWEJ
WĘGLA AKTYWNEGO.
SPORZĄDZILI:
Anna Gałka
Justyna Klimach
Grupa I Rok II
WSTĘP.
Zjawisko występujące na granicy dwóch faz , polegające na powstawaniu różnic pomiędzy przeciętnym składem wnętrza faz , a składem warstw przylegających do powierzchni rozdziału , nazywamy adsorpcją. Zachodzi ono prawie zawsze w przypadku zetknięcia się gazów lub cieczy (adsorbat) z fazą stałą. W wyniku procesu adsorpcji cząsteczki adsorbentu na powierzchni ciała stałego zwanego adsorbentem tracą swobodę ruchu. W zależności od sił działających na cząsteczki fazy ciekłej lub gazowej w warstwie przylegającej do adsorbentu , adsorpcja może mieć charakter fizyczny lub chemiczny.
Adsorpcja fizyczna jest wynikiem oddziaływań międzycząsteczkowych typu van der Waalsa między cząsteczkami adsorbatu i powierzchniowymi cząsteczkami adsorbentu. Jest ona procesem odwracalnym i cechuje ją niewielki efekt cieplny (kilkadziesiąt kJ/mol). Cząsteczki substancji zaadsorbowanej mogą tworzyć w tym przypadku warstwę o grubości odpowiadającej kilku średnicom cząsteczek adsorbatu.
Adsorpcja chemiczna jest wynikiem tworzenia się wiązań chemicznych między cząsteczkami adsorbatu i cząsteczkami powierzchniowymi adsorbentu. Wymaga ono energii aktywacji i charakteryzuje ją z reguły jednocząsteczkowe pokrycie powierzchni adsorbenta energia towarzysząca chemisorpcji jest porównywalna z energią reakcji chemicznych i wynosi ok. 102 kJ/mol. W zależności od rodzaju adsorbatu wiązania chemisorpcyjne mogą być jonowe lub koordynacyjne.
Proces adsorpcji kończy się wraz z ustaleniem stanu równowagi dynamicznej. Opis stanu równowagi układu adsorbent - adsorbat wymaga znajomości trzech wielkości: temperatury, ilości substancji zaadsorbowanej oraz stężenia adsorbatu w fazie ciekłej lub gazowej. W praktyce równowagę adsorpcji bada się przy ustaleniu jednego z parametrów najczęściej temperatury. Zależność ilości zaadsorbowanej od stężenia równowagowego fazy ciekłej lub gazowej w stałej temperaturze przedstawia się w postaci równania lub graficznie; nazywamy ją izotermą adsorpcji.
Oprócz izoterm adsorpcji (stała temperatura) znane są izobary adsorpcji (stałe ciśnienie) i izostery adsorpcji (stała ilość substancji zaadsorbowanej). Po zetknięci się gazu z powierzchnią adsorbentu ustala się równowaga, zwana równowagą adsorpcyjną. Proces adsorpcji w takiej równowadze można zapisać w formie ogólnego równania f(a,p,T) = 0, w którym a - ilość substancji zaadsorbowanej, czyli ilość substancji w warstwie powierzchniowej 1g adsorbentu (mol/g), p - ciśnienie równowagowe gazu w formie objętościowej (ciśnienie równowagowe), określając stan równowagi. Mamy zatem następujące funkcje:
izotermy adsorpcji T = const
aA = f(p)T
izobara adsorpcji p = const
aA = f(T)p
izostera adsorpcji aA = const
p = f(T)aA
Według modelu adsorpcji Langmuira szybkość procesu adsorpcji można wyrazić następująco
![]()
![]()
(1)
a szybkość desorpcji
![]()
(2)
Z równania (1) wynika , że szybkość adsorpcji zależy od niepokrytej (wolnej) powierzchni (1-Θ) i od ciśnienia gazu p (lub stężenia). W stanie równowagi następuje zrównanie się szybkości va = vd , czyli że
![]()
(3)
a stąd po przekształceniu
![]()
(4)
gdzie K = ka/kd jest określany jako współczynnik adsorpcji.
Wyrażenie (4) jest równaniem izotermy adsorpcji Langmuira. W przypadku adsorpcji z roztworu równanie izotermy Langmuira przyjmuje postać:
![]()
(5)
Równanie izotermy adsorpcji Langmuira można sprowadzić do postaci liniowej
![]()
(6)
Jeżeli stopień pokrycia wyrazimy ilością moli adsorbatu odniesioną do 1 g adsorbentu
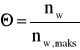
(7)
to równanie izotermy adsorpcji przyjmie postać
![]()
![]()
![]()
(8)
lub po przekształceniu
![]()
(9)
Zależność (9) jest równaniem prostej o parametrach 1/nw,maks i 1/(nw,maksK). Za pomocą tego równania można wyznaczyć stałe K i nw,maks ze współczynnika kierunkowego prostej 1/nw,maks i z rzędnej 1/(nw,maksK). Znając wartość nw,maks możemy wyliczyć powierzchnię właściwą przypadającą na określoną ilość adsorbenta A , jeżeli znana jest powierzchnia S zajmowana przez cząsteczką w monowarstwie
![]()
(10)
OPRACOWANIE WYNIKÓW
1.Zestawienie danych doświadczalnych :
L.P. |
Stężenie 50 cm3 kw. octowego przed adsorpcją [mol/dm3] |
Objętość 0,1 molowego NaOH zużytego do miareczkowania [cm3] |
1. |
0,15 |
29,2 |
2. |
0,12 |
23,9 |
3. |
0,09 |
22,4 |
4. |
0,06 |
15,4 |
5. |
0,03 |
9,9 |
6. |
0,015 |
4,3 |
Do obliczenia liczby moli kw. octowego zawartych w 50 cm3 roztworu przed adsorpcją korzysta się z zależności :
n1 = ckw. octowego Vkw. octowego
0,15 ⋅ 0,05 = 0,0075 [mol]
Do obliczenia liczby moli kw. octowego zawartych w 50 cm3 roztworu po adsorpcji korzysta się z zależności :
n2 = cNaOH VNaOH⋅K
n2=0,1⋅0,0292⋅2,5 = 0,0073 [mol]
K- jest współczynnikiem zależnym od objętości próbki pobranej do miareczkowania, dla dwóch pierwszych próbek K = 2,5 dla pozostałych K = 2
Obliczenie stężenia równowagowego kwasu octowego: c = n2/(0,05)
c = 0,0073/(0,05) = 0,146 [mol/dm3]
Obliczenie całkowitej ilości moli kwasu octowego, która uległa zaadsorbowaniu:
n = n1 - n2
n = 0,0075 - 0,0073 = 0,0002 [mol]
Obliczenie ilości moli kwasu octowego, która została zaadsorbowana na 1g wegla aktywnego:
nw = n/m
nw = 0,0002/0,9908 = 0,000201 [mol/g]
2.Zestawienie wyników obliczeń w tabeli :
Ilość moli kw. octowego w 50 cm3 r-ru przed adsorpcją n1[mol] |
Ilość gramów użytego węgla aktywnego m[g] |
Ilość moli kw. octowego w 50 cm3 r-ru po adsorpcji n2[mol] |
Stężenie równowagowe kw. octowego c[mol/dm3] |
Całkowita ilość moli kw. octowego która uległa zaadsorbowaniu n=n1-n2[mol] |
Ilość moli kw. octowego która została zaadsorbowana na 1g węgla aktywnego nw=n/m[mol/g] |
0,0075 |
0,9908 |
0,0073 |
0,146 |
0,0002 |
0,000201 |
0,006 |
0,9946 |
0,005975 |
0,1195 |
0,000025 |
0,0000251 |
0,0045 |
0,9947 |
0,00448 |
0,0896 |
0,00002 |
0,0000201 |
0,003 |
0,9936 |
0,00308 |
0,0616 |
-0,00008 |
-0,0000805 |
0,0015 |
0,9935 |
0,00198 |
0,0396 |
-0,00048 |
-0,00048 |
0,00075 |
0,9919 |
0,00086 |
0,0172 |
-0,00011 |
-0,00011 |
3. Wykreślenie krzywej izotermy adsorpcji :
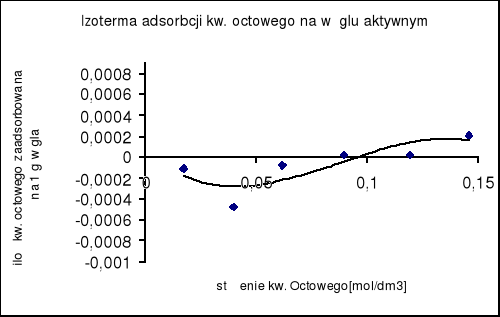
4. Na podstawie równania (9) wykreślono zależność c/nw = f(c)
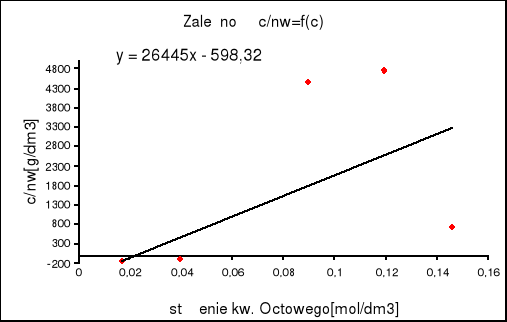
Zależność c/nw jest to stosunek równowagowego stężenia kwasu octowego do ilości tego kwasu zaadsorbowanego na 1 g węgla aktywnego [nw]
Obliczono liczbę moli kw. octowego potrzebną do pokrycia powierzchni 1 g węgla aktywnego monomolekularną warstewką ( nw,maks). Wyznaczenie tej wartości sprowadza się do wyznaczenia współczynnika kierunkowego wykreślonej uprzednio prostej b = 1 / nw,maks
a) metoda graficzna
korzystamy z wyznaczonego już na wykresie współczynnika kierunkowego
b = -598,32
nw,maks = 1 /-598,32 = -1,671*10-3 [mol/g]
b) metoda najmniejszych kwadratów
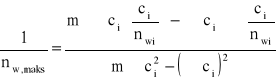
c/nw |
c·(c/nw) |
c |
c2 |
726,368 |
106,0497 |
0,146 |
0,021316 |
4760,956 |
568,934 |
0,1195 |
0,01428025 |
4457,711 |
399,411 |
0,0896 |
0,00802816 |
-765,217 |
-47,137 |
0,0616 |
0,00379456 |
-82,5 |
-3,267 |
0,0396 |
0,00156816 |
-156,363 |
-2,689 |
0,0172 |
0,00029584 |
8940,955 |
1021,301 |
0,4735 |
0,049283 |
suma
(∑ci)2 = 0,224
liczba pomiarów m = 6
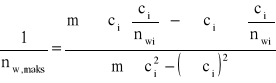
nw,max = 3,774*10-5
5. Zakładając , że S = 21·10-20 obliczamy za pomocą równania (10) powierzchnię właściwą węgla aktywnego A :
A = nw,maksNAS = 3,774*10-5·6,025·1023·21·10-20 = 4,775 [m2/g]
5
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
chemfiz.24, Studia, Politechnika
więcej podobnych podstron