Sacharydy
To grupa związków chemicznie zbudowanych z atomów pierwiastków C, H i O.
Wzór ogólny to Cx(H2O)x stąd też wzięła się nazwa: początkowo - wodziany węgla a obecnie - weglowodany.
Wszystkie posiadają grupy funkcyjne:
-C=O (grupa karbonylowa)
-OH (wodorotlenowa; Polialkohole)
Z właściwości fizycznych: są rozpuszczalne w H2O (mono- i disacharydy) natomiast nierozpuszczalne w powszechnie stosowanych rozpuszczalnikach organicznych (alkohol, eter).
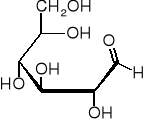
Najważniejszym sacharydem jest glukoza.
Powstaje w reakcji fotosyntezy
czyli przekształcania wody i dwutlenku węgla w glukozę i tlen z wykorzystaniem energii światła słonecznego.
Podział
Klasyfikacja jest prowadzona na podstawie:
- liczby atomów węgla w łańcuchu węglowodorowym
- stereochemii
- lokalizacji grupy C=O
- liczby monomerów (w przypadku wielocukrów)
Ze względu na powstające w cząsteczce wiązanie dzielimy je na hemiacetale i acetale.
Monosacharydy - triozy, tetrozy, pentozy, heksozy, heptozy, oktoza
Disacharydy - maltoza, sacharoza
Oligosacharydy - 2-10 podjednostek monosacharydowych - maltotrioza
Polisacharydy - ponad 10 podjednostek monosacharydowych - skrobia, celuloza, glikogen
Stereoizomery
To związki o tym samym wzorze strukturalnym ale o odmiennej konformacji przestrzennej. Posiadają w swej cząsteczce asymetryczne atomy, tzw. centra chiralności.
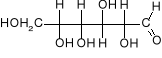
GLUKOZA z 4 asymetrycznymi atomami węgla ma 16 izomerów.
Typy izomerów:
1. Izomery konfiguracyjne D i L
2. Piranozowe i furanozowe formy pierścieniowe
3. Anomery α i β
4. Epimery (mannoza i galaktoza - epimery glukozy)
5. Izomery konstytucyjne (aldozy i ketozy)
Izomery konfiguracyjne D- i L-
Klasyfikuje się je na podstawie porównania do aldehydu (+)-glicerynowego.
Naturalne monosacharydy wykorzystywane przez organizmy żywe,najczęściej należą do szeregu D-.
Izomery glukozy
Alex altruista glinę macza
Gucio inteligent galon tacza
pH zasadowe
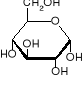
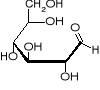
D-glukopiranoza pH kwasowe
Obecność grupy aldehydowej nadaje cząsteczce dwie ważne właściwości: pozwala na powstanie wiązania koordynującego strukturę pierścieniową, a także determinuje jej właściwości redukujące.
Hemiacetale i acetale
CUKRY: wewnątrzcząsteczkowa addycja grupy hydroksylowej do gr. aldehydowej lub ketonowej. Powstaje
wiązanie hemiacetalowe (półacetalowe), które umożliwia powstanie
pierścienia heterocyklicznego.
Hemiacetale- nietrwałe związki powstające w reakcji aldehydu z bezwodnym alkoholem, maja właściwości zarówno alkoholu jak i eteru. W obecności kwasu hemiacetal reaguje dalej z alkoholem i daje acetal
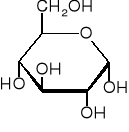
Piranozowe i furanozowe formy pierścieniowe
Jeżeli reakcja zachodzi pomiędzy grupami w glukozie (aldoza) to powstaje pierścień piranozowy, a jeżeli pomiędzy grupami w fruktozie (ketoza) to powstaje pierścień furanozowy.
Anomery α i β
Konsekwencją powstawania formy pierścieniowej glukozy, jest fakt, iż węgiel C1 staje się asymetryczny. W zależności od położenia grupy hydroksylowej wokół tego atomu wyróżniamy dwa anomery α lub β.
Konformacje piranu
Dwie możliwe: krzesła (bardziej korzystna energetycznie) i łódki, występują jako dodatkowa komplikacja struktury pierścieniowej.
Właściwości redukcyjne cukrów
Wynikają z obecności w cząsteczce wolnej grupy aldehydowej. Glukoza utlenia się do kwasu glukonowego.
Ketozy także są cukrami redukującymi, ponieważ tworzą tautomery (tautometria keto-enodiolowa) i przechodzą w formy aldoz: Ketoza - enodiol - aldoza
Fruktoza - enodiol - glukoza lub mannoza
Podsumowując:
każdy cukier będący hemiacetalem jest cukrem redukującym
cukry redukujące - zawierają grupę aldehydową i łatwo utleniają się do kwasów karboksylowych
aby zaszło utlenienie, pierścień formy cyklicznej musi otworzyć się, dając reaktywną grupę aldehydową
wszystkie monosacharydy oraz większość disacharydów (np. maltoza, laktoza) są cukrami redukującymi
Glikozydy jako acetale (ketale) są cukrami nieredukującymi
Dla polisacharydów można powiedzieć, że:
Cukier redukujący
ma co najmniej jeden węgiel anomeryczny nie bierze udziału w tworzeniu wiązania glikozydowego
Cukier nieredukujący
wszystkie węgle anomeryczne tworzą wiązania glikozydowe.
Epimery glukozy
Izomery powstające wokół innych niż 1 i 5 atom węgla w cząsteczce glukozy:
mannoza wokół węgla C2
galaktoza wokół węgla C4
Izomery konstytucyjne (aldozy i ketozy)
Wyróżnia się w zależności od obecności w cząsteczce grupy aldehydowej bądź ketonowej.
Rozrózniane na podstawie obecności w cząsteczce grup aldehydowej bądź ketonowej.
Cukry modyfikowane
Proteoglikan =
Glikozaminoglikany (mukopolisacharydy)+ białka
Glikozaminoglikany tworzą łańcuchy węglowodanów złożonych z dodatkiem aminocukrów i kwasów uronowych. Przykłady : siarczan chondroityny, kwas hialuronowy, heparyna.
Cukry budują rozmaite struktury komórkowe, łącznie z ta najważniejszą to znaczy kwasami nukleinowymi.
Wchodzą też w skład glikolipidów i glikoprotein. Te ostatnie dzielimy na N- i O-glikany, które rozróżnia się na podstawie wiązania jakim przyczepione są do struktury białka.
Glikolipidy
W kwasach rybonukleinowym i deoksyrybonuleinowym
N- i O- glikany
Disacharydy
W ich cząsteczce występuje
wiązanie glikozydowe - wiązanie kowalencyjne pomiędzy węglem C1 jednego monosacharydu i węglem C4 drugiego monosacharydu. Wiązania takie powstają pomiędzy monocukrami przez KONDENSACJĘ.
Sacharoza - zbudowana z jednego monomeru glukozy i jednego monomeru fruktozy, wiązanie α (1-2)
β-maltoza - występuje w kiełkujących nasionach, wiązanie α (1-4) pomiędzy dwoma monomerami glukozy
Celobioza - wiązanie β (1-4) pomiędzy dwoma monomerami glukozy, brak enzymu hydrolizującego to wiązanie
Laktoza - wiązanie β (1-4) pomiędzy galaktozą i glukozą
Polisacharydy
Można je podzielić na :
- zapasowe (skrobia, glikogen)
- strukturalne (celuloza)
Są polimerami glukozy, a wiązania glikozydowe pomiędzy jednostkami powstają pomiędzy węglem C1 jednej i C4 drugiej.
Skrobia - pochodzenie roślinne, substancja zapasowa, magazynowana w cytoplaźmie komórek roślinnych,
- struktura otwartej helisy,
- mieszanina wielocukrów :
•amylozy - nierozgałęziona, wiązania α(1-4)
•amylopektyny - rozgałęziona, wiązania α(1-4) i α(1-6)
Celuloza - pochodzenie roślinne, buduje ściany komórek roślinnych, polimer nierozgałęziony
- wiązania β(1-4)
każda reszta w łańcuchu obrócona jest w stosunku do sąsiedniej o 180º wiązania wodorowe zwiększają wytrzymałość struktury włóknistej na rozciąganie.
Glikogen - pochodzenia zwierzęcego, substancja zapasowa magazynowana w komórkach wątroby i w mięśniach, podobny do skrobi, lecz tworzy dłuższe i bardziej rozgałęzione łańcuchy
wiązania α(1-4) i α(1-6)
struktura otwartej helisy.
Analiza jakościowa
•Rozróżnienie pomiędzy pentozami a heksozami
•Rozróżnienie pomiędzy ketoheksozami i aldoheksozami
•Rozróżnienie pomiędzy mono-, di- i polisacharydami
•Rozróżnienie pomiędzy redukującymi i nieredukującymi mono- i disacharydami
•Identyfikacja nieznanego cukrowca
Reakcja Molisha -
Charakterystyczna dla cukrów
Do próbki cukrowej dodaje się roztworu α-naftolu i podwarstwia stężonym kwasem siarkowym. Na styku kwasu z resztą roztworu powstaje czerwono-fioletowa barwa.
W podobnej reakcji z tymolem roztwór ma barwę czerwoną.
Test Seliwanowa -
aldoheksozy i ketoheksozy
-Kondensacja z rezorcyną
Aldo- i ketoheksozy tworzą taki sam produkt
Aldoheksozy reagują dużo wolniej niż ketoheksozy
•Dla ketoheksoz - czerwony kolor w ciągu 1 minuty
•Dla aldoheksoz - czerwony kolor w ciągu 2 - 5 minut
•Reakcja ujemna - brak zmiany w ciagu 5 minut i dłużej
Pentozy - reakcja ujemna
Disacharydy - mogą dawać reakcje dodatnią, ale szybkość reakcji dużo wolniejsza
Próba Tollensa -
aldehydy
Cukry redukujące
Konwersja fruktozy do glukozy w warunkach alkalicznych
Reakcja redoks - jony Ag+ reagują z OH- wody amoniakalnej i tworzy się brązowy osad Ag2O, który rozpuszcza się w nadmiarze wody amoniakalnej tworząc rozpuszczalny kompleks diaminowy srebra [Ag(NH3)2]+. Kompleks redukowany jest przez glukozę do metalicznego srebra; glukoza utlenia się do kwasu glukonowego.
Test Fehlinga
- cukry redukujace,
Tautomeryzacja keto-enolowa,
Kompleks miedź-winian
Reakcja redoks
Tworzy się ceglasto-czerwony osad (reakcja dodatnia)
Aldozy łatwo utleniają się do kwasów karboksylowych.
Jon miedzi skompleksowany z winianem redukuje się do tlenku miedzi (I).
•Najpierw w niebieskim roztworze tworzy się zielonkawy osad. Tworzy się żółto-czerwony osad. Ostatecznie mulisto - zielona zawiesina daje ceglasto - czerwony osad. Fruktoza reaguje szybciej niż glukoza.
•Sacharoza nie reaguje z odczynnikiem Fehlinga.
Sacharoza jest disacharydem glukozy i fruktozy - jest cukrem nieredukujacym, bo anomeryczny wegiel glukozy zaangażowany jest w wiązanie z fruktozą.
Test Benedicta
cukry redukujące
Reakcja redoks
Cu2+ redukuje się do Cu+
Pojawienie się ceglastoczerwonego tlenku miedzi (I) dla cukru redukującego
zarówno ketozy, jak i aldozy mogą być cukrami redukującymi.
Cukry nieredukujące nie reagują.
Test Barfoeda
cukry redukujące
Bardziej czuły niż test Benedicta
Rozróżnia redukujące mono- i disacharydy
Reakcja redoks, jak w teście Benedicta
- Cu2+ redukuje się do Cu+
Monosacharydy reagują szybciej niż disacharydy
Test Taubera - rozróżnienie pentoz i heksoz
- kondensacja z benzydyną
- pentozy: czerwony kolor
- heksozy: żółty lub brunatny kolor
Test Biala - rozróżnienie pentoz i heksoz
reakcja z orcyną
Pentozy
•Niebiesko-zielony kolor
•Reakcja zachodzi szybko
Heksozy
•czerwonawo-brązowy kolor
•Reakcja zachodzi wolniej niż dla pentoz
Disacharydy - reakcja dodatnia (obecność pentoz lub heksoz)
Analiza ilościowa
Metody kolorymetryczne
Metoda antronowa - dla cukrów redukujących i nieredukujących
- Cukry reagują z antronem w środowisku kwaśnym dając niebiesko-zielony kolor.
- Próbkę miesza się z odczynnikiem antronowym (antron rozpuszczony w kwasie siarkowym) i gotuje. Po ochłodzeniu mierzy się absorbancję przy λ = 600 nm.
- Metoda niestechiometryczna - trzeba sporządzić krzywą kalibracyjną.
Metoda fenol / kwas siarkowy - cukry redukujące i nieredukujące
Do próbki cukrowej dodaje się fenol i kwas siarkowy. W obecności fenolu cukry przybierają barwę żółto-pomarańczową. Mierzy się absorbancję przy λ = 490 nm.
Kwas siarkowy jest silnym utleniaczem i przeprowadza cukry nieredukujące w redukujące.
- Metoda niestechiometryczna - trzeba sporządzić krzywą kalibracyjną.
1
Polisacharydy
Oligosacharydy
Ketozy
Aldozy
Cukry złożone
(wielocukry)
Cukry proste
(monocukry,monosacharydy)
Sacharydy
(węglowodany, cukry)
CH2OH
H
H
H
H
HO
OH
OH
HO
CHO
CH2OH
H
H
H
H
HO
OH
OH
OH
CHO
CH2OH
H
H
H
H
OH
OH
OH
HO
CHO
CH2OH
H
H
H
H
OH
OH
OH
OH
CHO
CH2OH
H
H
H
H
HO
HO
HO
CHO
CH2OH
H
H
H
H
HO
HO
OH
OH
CHO
CH2OH
H
H
H
H
OH
HO
OH
HO
CHO
CH2OH
H
H
H
H
OH
HO
OH
OH
CHO
OH
D-(+)-taloza
D-(+)-galaktoza
D-(-)-idoza
D-(+)-guloza
D-(+)-mannoza
D-(+)-glukoza
D-(+)-altroza
D-(+)-alloza
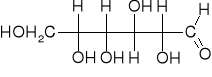
D-glukoza
Wyszukiwarka
Podobne podstrony:
Izomeria monosacharydów, Ratownicto Medyczne, BIOCHEMIA
Monosacharydy - triozy, Notatki AWF, Biochemia
Laboratorium 8 MONOSACHARYDY, II rok, II rok CM UMK, Biochemia
biochemia skrót
biochemia sciaga monosacharydy
skrĂłt z polisacharydĂłw, Weterynaria, BIOCHEMIA, Materialy
11 BIOCHEMIA horyzontalny transfer genów
asm skrot prezentacji
Biochemia z biofizyką Seminarium 2
Podstawy biochemii
08 BIOCHEMIA mechanizmy adaptac mikroor ANG 2id 7389 ppt
BIOCHEMICZNE EFEKTY STRESU (2B)
Biochemia, ATP
biochemia krwi 45
więcej podobnych podstron