1. Zastosowania antrachinonu i jego pochodnych.
a) Barwniki
Istnieje wiele pochodnych antrachinonu, które służą jako środki barwiące np. do materiałów tekstylnych, wyrobów polimerowych czy tkanin. Bardzo popularną i od dawna znaną pochodną jest alizaryna. Alizaryna przedstawia się wzorem:
Jak widać jest to dihydroksypochodna. Barwnik ten był już znany w starożytności i otrzymywany z korzeni marzanny barwierskiej. Obecnie uzyskuje się go w reakcji stapiania zasady sodowej z kwasem antrachinono-2-sulfonowym. Jest to pierwszy barwnik naturalny uzyskany drogą syntezy chemicznej. Alizaryna używana jest jako barwnik materiałów biologicznych w celu wykrycia w nich złogów wapnia. Sól sodowa sulfonowanej alizaryny używana jest jako wskaźnik kwasowo-zasadowy w chemii analitycznej, do wykrywania jonów glinu. Inne pochodne również mogą być wykorzystywane do kompleksowania, co daje nam szeroką gamę odczynników mających zastosowanie w oznaczaniu kationów wielu różnych metali.
Pochodne antrachinonu mogą być również wbudowane w strukturę polimeru co sprawia, że jest on barwny. Przykładem może być modyfikowany poliuretan, który w swym łańcuchu posiada wbudowane monomery 1,4-bis-(jodopropionyloksy)-9,10-antrachinonu. Barwnik ten nie zmienia właściwości polimeru takich jak odporność termiczna czy chemiczna, a także co ważne w przypadku poliuretanów - elastyczności (wytrzymałość na rozciąganie). Zdyspergowany barwiony poliuretan może być stosowany do specjalnego rodzaju farb, np. do zabezpieczania betonu. Można barwić także inne polimery, między innymi poliamid-6,6 popularnie znany jako nylon.
Wiele pochodnych antrachinonu jest wytwarzanych przez organizmy żywe. Rośliny, które zawierają takie związki to m.in.: rabarbar, senna, niektóre grzyby (np. muchomor czerwony), porosty i owady. Wyciągi z roślin zawierających pochodne antrachinonu są stosowane w leczeniu niektórych schorzeń. Na przykład wyciąg z rabarbaru jest stosowany jako środek przeczyszczający.
Ciekawym barwnikiem jest koszelina, uzyskiwana ze zmielonych, wysuszonych owadów z gatunku czerwca kaktusowego. Jego cząsteczka wygląda następująco:
Jest jednym z nielicznych naturalnych barwników rozpuszczalnych w wodzie, przy czym nie ulega degradacji z biegiem czasu. Jest najbardziej odporny na temperaturę, działanie światła i utlenianie spośród wszystkich barwników naturalnych. Stosowana jest do barwienia cieni do powiek, szamponów, tuszów do rzęs, a także napoi alkoholowych, jogurtów, wyrobów piekarniczych i sosów.
Właściwości barwiące cząsteczek antrachinonu i jego pochodnych wynikają z obecności ugrupowań chromoforowych. Układ chromoforowy to taki układ w którym energia potrzebna do przeniesienia elektronu między orbitalami jest dostępna w zakresie światła widzialnego. Absorbowanie energii fali świetlnej powoduje przeniesienie elektronu ze stanu podstawowego do wzbudzonego. Najczęściej układy chromoforowi tworzą sprzężone układy orbitali π lub związki kompleksowe metali.
b) Medycyna
Pochodne antrachinonu są składnikami wielu ważnych leków:
-leki przeczyszczające takie jak dantron czy emodin
-leki antymalaryczne (rufigallol)
-leki wykorzystywane w leczeniu raka (mitoksantron).
Poniżej struktura mitoksantronu:
Trwają również badania nad lekami przeciwdziałającymi postępowaniu choroby Alzheimera, na razie prowadzone są jednak testy na zwierzętach.
Długotrwałe stosowanie leków przeczyszczających opartych na pochodnych antrachinonu może prowadzić do melanozy okrężnicy (przebarwienia wewnętrznej ściany okrężnicy), która nie ma jednak znaczenia klinicznego (przynajmniej do tej pory takiego nie stwierdzono).
Ciekawym zastosowaniem pochodnych jest wykorzystanie ich w badaniach na temat rozpadów, syntezy i struktury łańcuchów DNA, a także wpływu na jego strukturę niektórych czynników teratogennych i mutagennych.
c) Inne zastosowania
2-etylo-9,10-antrachinon jest wykorzystywany w produkcji nadtlenku wodoru. Początkowo 2-etylo-9,10-dihydroksyantracen jest utleniany tlenem do 2-etylo-9,10-antrachinonu przy czym wydziela się nadtlenek wodoru, a następnie pochodna antrachinonu jest redukowana wodorem i zawracana do fazy pierwszej. Schemat:
Ciekawym zastosowaniem jest używanie antrachinonu do odstraszania ptaków na polach uprawnych.
Antrachinon jest wykorzystywany do generowania gazu wypełniającego balony satelitarne (specjalnego typu balony, umieszczone na orbicie ziemskiej głównie w celach badawczych)
Wykorzystywanie do produkcji ścieru drzewnego (półproduktu w procesie wytwórczym papieru). Antrachinon jest w tym procesie katalizatorem redoks. Reakcja może opierać się na mechanizmie SET (Single Electron Transfer). Antrachinon utlenia zredukowane końce łańcuchów polisacharydów np. celulozy i hemicelulozy i w ten sposób zabezpiecz przed rozpadem pod wpływem zasady obecnej w środowisku reakcyjnym. Antrachinon jest redukowany do 9,10-dihydroksyantracenu, który reaguje z ligniną. Lignina rozpada się i zwiększa się jej rozpuszczalność w wodzie, w ten sposób może zostać wymyta z mieszaniny reakcyjnej. W międzyczasie antrachinon jest regenerowany. Antrachinon zwiększa wydajnośc procesu otrzymywania ścieru i zmniejsza w niej ilość ligniny (papier zawierający ligninę szybko żółknie i staje się słaby a co za tym idzie łatwo ulega przedarciom).
W procesie Becher'a pochodna antrachinonu (sól sodowa kwasu 9,10-antrachinono-2,6-disulfonowego) wykorzystywana jest jako katalizator podczas napowietrzania. Pozwala to na uzyskanie lepszych wydajności w procesie i możliwości łatwej regeneracji katalizatora poprzez elektrolizę. W procesie tym otrzymuje się z ilmenitu magnetyt oraz tlenek tytanu (w postaci tzw. „syntetycznego rutylu”). Tlenek tytanu otrzymywany w tej produkcji może być wykorzystywany jako biały barwnik, stosowany głównie w farbach.
Niektóre pochodne tworzą z wieloma metalami kompleksy chylatowe, co pozwala na użycie tych pochodnych do analizy spektrofotometrycznej w celu oznaczenia zawartości tych metali w roztworach.
Wykorzystywany jest w sensorach badających poziom tlenu oraz wartości pH roztworów (faza badań).
Osadzanie jonów uranylowych na nadrukowanych warstwach antrachinonowych na jonowym polimerze.
Polepszanie właściwości super kondensatorów węglowych
Regenerowane baterie słoneczne.
Posiada właściwości bakteriobójcze.
Pochodne wykorzystywane są w wytwarzaniu niektórych membran jonoselektywnych
Pochodne są niekiedy wykorzystywane jako faza unieruchomiona w chromatografii.
Modyfikacje powierzchni elektrod
2. Stopnie utlenienia i zabarwienie związków manganu i chromu.
Chrom |
Stopień utlenienia |
Barwa |
|
+II |
niebieska |
|
+III |
Zielona, niebieska |
|
+VI |
Żółta (dichromiany- pomarańczowe) |
Mangan |
+II |
różowoczerwona |
|
+III |
ciemnozielona |
|
+IV |
szaroczarna |
|
+VI |
zielona |
|
+VII |
fioletowa |
3. Teoretyczna wydajność reakcji
m=kIt, gdzie:
m-masa związku wydzielonego na elektrodzie
I- natężenie prądu
t-czas trwania elektrolizy
k- równoważnik elektrochemiczny wprost proporcjonalny do masy molowej związku a odwrotnie do stałej Faraday'a i ilości elektronów wymienanych na elektrodzie
![]()
![]()
Jest to ilość antrachinonu która teoretycznie powinna wydzielić się podczas przeprowadzanej przez nas elektrolizy.
4. Reakcje połówkowe i sumaryczna.
Anoda:
Ce3+ Ce4+ + e-
Katoda:
2H+ + 2e- H2
Utlenianie antracenu do antrachinonu:
Redukcja ceru:
Ce4+ + e- Ce3+
Sumarycznie:
Sumarycznie dla całego procesu:
5. Ładunek teoretyczny
![]()
6. Ładunek rzeczywisty
![]()
7. Wydajność reakcji

8. Wynik pomiaru temperatury topnienia produktu:
tt=(209-211)⁰C
Wartość literaturowa: 286⁰C
Wniosek:
Produkt jest silnie zanieczyszczony, źle przechowywany(zawilgocony) ponieważ jego temperatura topnienia znacznie odbiega od wartości literaturowej.
9. Czy użyto wystarczającej ilości jonów ceru do utlenienia antracenu?
(zakładając, że ich nie regenerujemy)
Ilość moli ceru w rozworze i ilość moli antracenu:
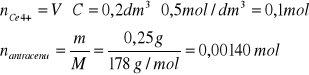
Potrzebna ilość moli jonów ceru
![]()
Jak widać teoretyczna ilość Ce4+ potrzebna do przeprowadzenia tej ilości antracenu w antrachinon jest znacznie mniejsza od tej, która była obecna w roztworze.
Literatura:
The application of anthraquinone redox catalysts for accelerating
the aeration step in the becher process
Warren J. Bruckard a, Carmen Calle a, Stephen Fletcher b, Michael D. Horne a,
Graham J. Sparrow a,*, Andew J. Urban b
CSIRO Division of Minerals, Box 312, Clayton South, Victoria 3169, Australia
Department of Chemistry, Loughborough University, Epinal Way, Loughborough, Leicestershire LE11 3TU, UK
Received 16 May 2003; received in revised form 3 September 2003; accepted 8 September 2003
Synthesis of polyetherurethane cationomers with anthraquinone structure
Emil C. Buruiana *, Tinca Buruiana
``P. Poni'' Institute of Macromolecular Chemistry, Romanian Academy, Aleea Gr. Ghica Voda 41 A, 6600 Iasi, Romania
Received 5 July 2000; accepted 26 April 2001
ANTHRAQUINONES SENSITIZE TUMOR CELLS TO ARSENIC CYTOTOXICITY
IN VITRO AND IN VIVO VIA REACTIVE OXYGEN SPECIES-MEDIATED
DUAL REGULATION OF APOPTOSIS
Jie Yang,* Hui Li,* Yu-Ying Chen,* Xiao-Jing Wang,* Gui-Ying Shi,* Qing-Shen Hu,*
Xun-Lei Kang,* Yang Lu,y Xue-Ming Tang,* Qiang-Su Guo,z and Jing Yi*
*Department of Cell Biology, yDepartment of Chemistry, and zDepartment of Histology and Embryology,
Shanghai Second Medical University, Shanghai 200025, China
(Received 19 July 2004; Accepted 17 September 2004)
Available online 13 October 2004
Wyszukiwarka
Podobne podstrony:
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
Sprawko z ropy, Technologia chemiczna PG, Technologia Chemiczna PG, Technologia Organiczna dr Skwier
Pomiary absorbcji przy dl fali 550nm, Technologia chemiczna PG, Technologia Chemiczna PG, Technologi
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
sprawko leki, Technologia chemiczna PG, Technologia Chemiczna PG, Technologia Organiczna dr Skwieraw
PODCHLORYN, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok, Sprawozdania
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
ogniwa-i-akumulatory, Technologia Chemiczna PG
powierzchniowoczynne, Technologia chemiczna PG, Technologia Chemiczna PG, Technologia Organiczna dr
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
do sprawozdania siarczany alkilowe, Technologia chemiczna PG, Technologia Chemiczna PG, Technologia
Projekt wymmiennik ciepła inżynieria chemiczna pg, Technologia Chemiczna PG
Sprawozdanie ChiTMB UV-VIS, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok,
więcej podobnych podstron