
Wykonał: Jacek Teresko Szczecin 15.12.98r.
POLITECHNIKA SZCZECIŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z wykonania ćwiczenia nr 21:
„Kinetyka autokatalitycznej reakcji jodowania acetonu.”
APARATURA: - termostat
termometr cyfrowy
dwie kolby miarowe 250 cm3
dwie probówki
cztery kolby stożkowe 250 cm3
pipeta 25 cm3
biureta
ODCZYNNIKI: - 0,01n roztwór Na2S2O3
0,1n roztwór NaHCO3
1n roztwór HCl
4% roztwór KI
roztwór skrobi
WYKONANIE:
Kinetyka zajmuje się zmiennością w czasie reagujących układów. Badania kinetyczne dostarczają informacji o przebiegu reakcji chemicznych, oraz stanowią podstawę technologicznego projektowania reaktorów.
Wyniki pomiarów kinetycznych opisywane są równaniami, które w większości przypadków wyrażają zależność szybkości reakcji ![]()
od stężeń reagentów i od temperatury. Aby zrozumieć związek równań kinetycznych z molekularnym przebiegiem reakcji, należy poznać mechanizm tejże reakcji. Przez pojęcie mechanizm reakcji rozumie się najczęściej, ustalenie sekwencji aktów elementarnych i identyfikację nietrwałych produktów pośrednich, a rzadziej wyjaśnienie zmian struktury zachodzących w czasie aktu elementarnego.
Według Boudarta celem podstawowych badań kinetycznych jest:
ustalenie schematu reakcji
zaproponowanie sekwencji aktów elementarnych
wyjaśnienie przebiegu elementarnego.
Szybkość reakcji chemicznej ![]()
definiowana jest jako zmiana stężenia ![]()
w czasie ![]()
:
![]()
i jest ona wielkością intensywną. W przypadku gdy stężenie ![]()
odnosi się do substratów w równaniu tym należy dopisać znak minus.
Centralnym problemem kinetyki chemicznej jest znalezienie równanie kinetycznego:
![]()
gdzie ![]()
jest temperaturą bezwzględną, a ![]()
stężeniami poszczególnych reagentów po określonym czasie. Szybkość nieodwracalnej reakcji chemicznej ![]()
, wyraża się wzorem:
![]()
gdzie współczynnik ![]()
, zwany stałą szybkości reakcji, jest niezależny od stężeń reagentów, zależy natomiast od temperatury. W pewnych przypadkach funkcja ![]()
może też zależeć od temperatury.
Funkcja ![]()
ma postać:
![]()
gdzie iloczyn rozciąga się na wszystkie składniki układu, a λi jest rzędem reakcji względem składnika ![]()
. Rząd reakcji zawarty jest zwykle w granicach ![]()
. W szczególnym wypadku może on być równy zero. Równanie kinetyczne jest zależnością czysto empiryczną, którą można się bezpiecznie posługiwać tylko w warunkach, dla których została wyznaczona.
Stała szybkości reakcji zależy wykładniczo od temperatury:
![]()
gdzie: ![]()
- stała gazowa
![]()
- energia aktywacji
![]()
- czynnik przedwykładniczy.
Szybkość pewnych reakcji jest większa w obecności katalizatora. Katalizatory są to substancje przyspieszające reakcje chemiczne, pozostające w niezmienionej ilości po zakończeniu reakcji. Katalizator nie zmienia stanu równowagi termodynamicznej reakcji, tzn. jeżeli dana substancja katalizuje reakcję odwracalną w jednym kierunku to katalizuje także reakcję odwrotną. W przypadku katalizy jednorodnej, substrat reakcji tworzy połączenie przejściowe z katalizatorem. Działanie substancji katalitycznej sprowadza się do obniżenia energii aktywacji. Szybkość reakcji zależy od stężenia katalizatora. Ponieważ jednak stężenie katalizatora nie zmienia się w czasie, można je włączyć w eksperymentalnie wyznaczoną stałą szybkości reakcji. Efekty takie noszą nazwę katalizy kwasowo-zasadowej. Stałe szybkości reakcji katalizowanych jednocześnie przez kwasy i zasady zależą liniowo od stężeń wszystkich kwasów i zasad obecnych w układzie.
![]()
gdzie ![]()
jest stałą szybkości reakcji przebiegającej bez udziału katalizatora, a stałe ![]()
i ![]()
noszą nazwę stałych katalitycznych.
Celem ćwiczenia było wyznaczenie stałej szybkości reakcji jodowania acetonu w oparciu o pomiary stężeń jodu w funkcji czasu podczas jodowania acetonu w środowisku kwaśnym. Stężenie jodu wyznacza się metodą miareczkowania tiosiarczanem sodowym, który ma własności redukujące jod. Reakcja przebiega zgodnie z równaniem:
2 Na2S2O3 + I2 → Na2S4O6 + NaI
1. ![]()
TABELA POMIAROWA
Lp. |
Czas trwania reakcji [min] |
Objętość Na2S2O3 |
Stężenie jodu
|
Ubytek stężenia acetonu
|
|
1. |
2,7 |
9,92 |
0,0501 |
2,5 ⋅ 10-4 |
0,212 |
2. |
14,7 |
9,45 |
0,04725 |
2,6 ⋅ 10-3 |
0,198 |
3. |
29,85 |
8,7 |
0,0435 |
6,35 10-3 |
0,181 |
4. |
44,42 |
7,95 |
0,03975 |
0,0101 |
0,164 |
5. |
60,5 |
7,17 |
0,03585 |
0,014 |
0,146 |
2. ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
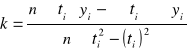
![]()
![]()
![]()
![]()
![]()
![]()
5