Wykonał: Jacek Teresko Szczecin 20.01.99r.
POLITECHNIKA SZCZECIŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z wykonania ćwiczenia nr 16:
„Wyznaczanie składu stechiometrycznego związków kompleksowych.”
APARATURA: - spektrofotometr „Spekol”
statyw z probówkami
dwie pipety wielowymiarowe 10 cm3
ODCZYNNIKI: - 0.05m CuSO4
0.05m roztwór 1,2 - diaminoetanu
WYKONANIE:
Teoria pola ligandów zakłada, że jon centralny - najczęściej kation - otoczony jest przez podstawniki tzw. ligandy, związane z nim wiązaniem koordynacyjnym. Przykładem związków kompleksowych mogą być połączenia miedzi. Zewnętrzną strukturę elektronową miedzi w stanie podstawowym można zapisać: 3d10 4s1, a jonu miedzi Cu2+: 3d9. Stosowana w ćwiczeniu etylenodiamina ma dwie grupy funkcyjne i tworzy z miedzią połączenia chelatowe, czyli takie, gdzie ligand zajmuje przy atomie centralnym dwa lub więcej miejsc.
Przy określaniu składu stechiometrycznego związków kompleksowych zakłada się, że z wyjściowych substancji M i L, przy różnych stosunkach molowych, powstaje kompleks MLn zgodnie z reakcją:
M + nL = MLn
Jedną z metod wyznaczania składu związków kompleksowych jest metoda zmian ciągłych Joba. W metodzie tej mierzy się ekstynkcję (lub inną wielkość fizykochemiczną) serii roztworów substancji M i L, w których całkowita suma stężeń obu składników jest stała, czyli cM + cL = cK, przy czym stosunek stężeń zmienia się:
![]()
gdzie: x - ułamek molowy składnika M.
Jeżeli w roztworze tworzy się tylko jeden kompleks, stosunek ![]()
jest liczbą całkowitą i wartość ![]()
dla różnych długości fali nie zmienia się. Im kompleks trwalszy, tym maksimum jest ostrzejsze.
Zgodnie z powyższym przygotowano w probówkach, według podanej tabeli, dziesięć roztworów CuSO4 i 1,2-diaminoetanu (DAE) o stałej objętości i zmiennych zawartościach obu składników. Dokonano pomiaru ekstynkcji wszystkich roztworów dla podanych długości fal. Wyniki pomiarów wpisano do tabeli i na ich podstawie sporządzono rodzinę krzywych z zależności:
![]()
dla każdej krzywej z osobna. Następnie należało znaleźć minimalną ekstynkcję dla roztworu CuSO4. Ekstynkcja ta jest równa 0, przy długości fali λ = 550nm (pomiarów dokonano w zakresie 550 ÷ 610nm). Nierówność![]()
gdzie ![]()
to ekstynkcje roztworów przy długości fali 550nm.
Korzystając ze wzoru:
![]()
gdzie: ![]()
- ułamek molowy CuSO4 w roztworze
![]()
- minimalna ekstynkcja czystego roztworu CuSO4 przy λ=550nm
![]()
obliczono ekstynkcję kompleksu ![]()
.
Następnie obliczono wszystkie ![]()
kompleksów dla tej samej długości fali λ i wykreślono zależność:
![]()
z, której odczytano stężenie w postaci ułamka molowego ![]()
, któremu odpowiada maksymalna ekstynkcja. Ostatnie obliczenie polegało na znalezieniu tzw. liczby cząstek diaminoetanu, czyli liczby ligandów otaczających jon miedzi. Korzystano tutaj ze wzoru:
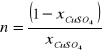
Na podstawie znalezionych danych o tym kompleksie należało ustalić wzór związku kompleksowego.
TABELA POMIAROWA
Lp. |
Objętość roztworu [ml] |
|
Ekstynkcja roztworu |
|||||||
|
|
|
Długość fali [nm] |
|||||||
|
CuSO4 |
DAE |
|
550 |
560 |
570 |
580 |
590 |
600 |
610 |
1. |
1 |
9 |
0,1 |
0,52 |
0,54 |
0,51 |
0,50 |
0,47 |
0,42 |
0,38 |
2. |
2 |
8 |
0,2 |
0,75 |
0,77 |
0,55 |
0,70 |
0,66 |
0,61 |
0,53 |
3. |
3 |
7 |
0,3 |
1,40 |
1,45 |
1,30 |
1,10 |
0,96 |
0,88 |
0,77 |
4. |
4 |
6 |
0,4 |
0,71 |
0,80 |
0,82 |
0,83 |
0,87 |
0,79 |
0,83 |
5. |
5 |
5 |
0,5 |
0,38 |
0,49 |
0,56 |
0,64 |
0,72 |
0,79 |
0,82 |
6. |
6 |
4 |
0,6 |
0,26 |
0,39 |
0,43 |
0,50 |
0,58 |
0,67 |
0,75 |
7. |
7 |
3 |
0,7 |
0,16 |
0,26 |
0,32 |
0,39 |
0,45 |
0,52 |
0,56 |
8. |
8 |
2 |
0,8 |
0,085 |
0,16 |
0,20 |
0,25 |
0,30 |
0,35 |
0,38 |
9. |
9 |
1 |
0,9 |
0,025 |
0,09 |
0,11 |
0,14 |
0,16 |
0,19 |
0,22 |
10. |
10 |
0 |
1,0 |
0,00 |
0,015 |
0,02 |
0,02 |
0,035 |
0,05 |
0,07 |
3
Wyszukiwarka
Podobne podstrony:
Chemia fizyczn - nr 10, Studia, Politechnika
Chemia fizyczna - nr 22, Studia, Politechnika
Chemia fizyczna - nr 21, Studia, Politechnika
Współczynnik podziału -16 wykres, Biotechnologia PWR, Semestr 3, Chemia fizyczna - Laboratorium, 16.
16 obliczenia + wnioski, chemia fizyczna laboratorium, 16
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
sprawozdanie nr 2 (2), II rok, chemia fizyczna
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
Ćw. 16, chemia fizyczna, Nowy folder
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Kolokwium zaliczeniowe, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Kolokwium nr 2, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
inż 16, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
ćwiczenie 16, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
ĆWICZENIE NR 31, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
ćwiczenie nr 10 moje, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
sprawozdanie nr 1, II rok, chemia fizyczna
więcej podobnych podstron