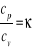Temat: Wyznaczanie stosunku Cp do Cv dla powietrza
metodą Clement - Desermes`a
I. PODSTAWY TEORETYCZNE
Ciepłem właściwym określamy ilość ciepła potrzebną do podwyższenia temperatury ciała o jeden kelwin przy stałym ciśnieniu lub stałej objętości. Stosunek tych wartości jest wielkością charakterystyczną dla danego gazu i jest ona zależna od liczby i charakteru stopni swobody cząsteczki gazu. Liczbą stopni swobody układu mechanicznego nazywamy liczbę niezależnych wielkości, za pomocą których może być opisane położenie układu. Ze względu na charakter wyróżnia się stopnie swobody postępowe (translacyjne), obrotowe (rotacyjne), oraz drganiowe (oscylacyjne). Wpływ liczby stopni na wartość stosunku ![]()
wyraża się wzorem
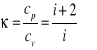
gdzie i to liczba stopni swobody.
W czasie doświadczenia gaz jest poddawany trzem procesom, a mianowicie przemianom izotermicznej, adiabatycznej i izochorycznej.
Każda z tych przemian ma pewną właściwość. Przemiana izotermiczne charakteryzuje się tym, że w czasie jej przebiegu nie zmienia się temperatura badanego gazu, natomiast pozostałe parametry opisujące stan gazu (ciśnienie i objętość) zmieniają się według zależności ![]()
(równanie Clapeyrona). Przemiana izochoryczna charakteryzuje się tym, że przebiega przy niezmiennej objętości gazu. Podobnie jak w przypadku przemiany izotermicznej obowiązuje tutaj równanie Clapeyrona.
W przypadku przemiany adiabatycznej sytuacja jest nieco odmienna. Ta przemiana charakteryzuje się brakiem wymiany ciepła pomiędzy gazem a otoczeniem. Zależności występujące w czasie tej przemiany opisują dwa równania adiabaty:
1. ![]()
2. ![]()
- jest to tzw. równanie Poissona.
Ważną zależnością jest I zasada termodynamiki, która mówi o tym, że w układzie odosobnionym, w którym zachodzą dowolne zjawiska mechaniczne, cieplne, elektryczne itd. Nie można w żaden sposób zmienić całkowitej energii układu. Matematycznie zasadę tę opisuje równanie ![]()
, gdzie ![]()
jest całkowitą energią układu, ![]()
ciepłem dostarczonym do układu, a ![]()
pracą wykonaną nad układem. Dostarczone ciepło jest zależne od różnicy temperatur gazu i określa się równaniem ![]()
. W przypadku przemiany izotermicznej dostarczone ciepło jest równe zero, gdyż nie zmienia się temperatura układu. Praca wykonana nad układem ma postać ![]()
więc dla przemiany izochorycznej praca jest równa zero.
Celem naszego ćwiczenia jest wyznaczenie stosunku ![]()
dla powietrza w tym celu posługujemy się zestawem pomiarowym przedstawionym na poniższym rysunku.
II. SCHEMAT UKŁADU POMIAROWEGO
III. WYPROWADZENIE WZORU ROBOCZEGO
![]()
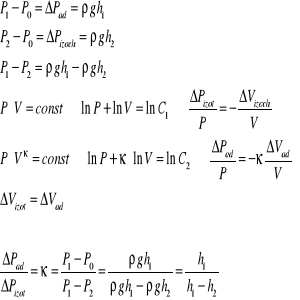
![]()
IV. OBLICZENIA I NIEPEWNOŚCI POMIARU
lp |
wys. l1 [m] |
wys. p1 [m] |
wys. l2 [m] |
wys. p2 [m] |
h1=l1-p1 |
h2=l2-p2 |
|
1 |
1,82 |
1,719 |
1,785 |
1,757 |
0,101 |
0,028 |
1,383562 |
2 |
1,818 |
1,721 |
1,785 |
1,757 |
0,097 |
0,028 |
1,405797 |
3 |
1,806 |
1,734 |
1,781 |
1,761 |
0,072 |
0,02 |
1,384615 |
4 |
1,8 |
1,741 |
1,78 |
1,763 |
0,059 |
0,017 |
1,404762 |
5 |
1,819 |
1,722 |
1,785 |
1,757 |
0,097 |
0,028 |
1,405797 |
6 |
1,804 |
1,736 |
1,783 |
1,754 |
0,068 |
0,029 |
1,74359 |
7 |
1,807 |
1,735 |
1,782 |
1,763 |
0,072 |
0,019 |
1,358491 |
8 |
1,805 |
1,737 |
1,78 |
1,762 |
0,068 |
0,018 |
1,36 |
9 |
1,808 |
1,735 |
1,781 |
1,763 |
0,073 |
0,018 |
1,327273 |
10 |
1,788 |
1,755 |
1,777 |
1,768 |
0,033 |
0,009 |
1,375 |
Lp. |
|
|
1 |
0,031327 |
0,000981 |
2 |
0,009092 |
8,27E-05 |
3 |
0,030273 |
0,000916 |
4 |
0,010127 |
0,000103 |
5 |
0,009092 |
8,27E-05 |
6 |
-0,3287 |
0,108044 |
7 |
0,056398 |
0,003181 |
8 |
0,054889 |
0,003013 |
9 |
0,087616 |
0,007677 |
10 |
0,039889 |
0,001591 |
|
|
|
![]()
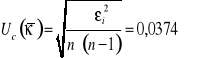
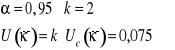
![]()
![]()
V. WNIOSKI
- teoretycznie wartość stosunku ၫ dla powietrza wynosi 1,4. Związane jest to z procentową zawartością pierwiastków w powietrzu. Powietrze zawiera w głównej mierze mieszaninę gazów dwuatomowych azotu (N2) i tlenu (O2) (ponad 90%). Dlatego też traktuje się powietrze praktycznie jako gaz dwuatomowy.
- Pomiar stosunku ![]()
metodą Clement-Desormesa wymaga od układu pomiarowego braku wymiany ciepła z otoczeniem (ścianki adiabatyczne) jednak w praktyce jest to bardzo trudne do zrealizowania. W badanym układzie rolę izolatora cieplnego spełnia styropian. Dodatkowy problem stanowi czas rozprężania adiabatycznego, który powinien być jak najkrótszy. Uzyskanie równych czasów rozprężania jest badanym układzie niemożliwe, dlatego też nie można wyznaczyć stosunku ciepła właściwego przy stałym ciśnieniu do ciepła właściwego przy stałej objętości z dużą dokładnością.
Wyszukiwarka
Podobne podstrony:
Wyznaczanie stosunku CP do CV dla powietrza i dwutlenku węgla metodą akustyczną, Numer ćwiczenia
STOSUNEK CP DO CV DOC
CP do CV THE END MOTHERFUCKER
cp do cv
Cp do Cv
Sprawozdanie 8 cp do cv
Cw 20 - Wyznaczanie stosunku cp-cv dla powietrza metoda Clementa-Desormesa, Studia, Budownictwo UTP,
95wyznaczanie stosunku cp-cv, Uczelnia, sem I, fiza, LABORATORIUM
106, 106A, Temat : Wyznaczanie stosunku Cp/Cv metod˙ Clementa - Desormesa
102, 102, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa De
115, #115A, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
10 WYZNACZANIE STOSUNKU Cp Cv DLA POWIETRZA METODĄ CLEMENTA DESORMESA(1)
417, 417(1), Temat : Wyznaczanie stosunku Cp/Cv metod˙ Clementa - Desormesa
więcej podobnych podstron