Jony możemy podzielić na dodatnie (kationy) np. H+ oraz ujemne (aniony) np.jony reszt kwasowych (S![]()
).
Wojskowa Akademia Techniczna
im. Jarosława Dąbrowskiego
Laboratorium Fizyki Ogólnej
Sprawozdanie z ćwiczenia laboratoryjnego
Nr 23
Tytuł: Wyznaczanie elektrochemicznego równoważnika miedzi oraz stałej Faradaya
Wykonał: Michał Trzaska
Grupa: E04D8
WSTĘP TEORETYCZNY
Elektrolity to substancje , w których występują wiązania jonowe. Są to roztwory soli, kwasów i zasad w wodzie lub innych rozpuszczalnikach, stopione sole oraz wodorotlenki metali alkalicznych.
Dysocjacja to proces rozerwania wiązania jonowego i utworzenie swobodnych elektronów. Swobodne jony zdolne są do przewodzenia prądu. Nośnikami prądu w elektrolitach są jony o dużej masie.
Jony możemy podzielić na dodatnie (kationy) np. H+ oraz ujemne (aniony) np.jony reszt kwasowych (S![]()
).
Przykład procesu dysocjacji:
NaCl![]()
Procesem odwrotnym do dysocjacji jest rekombinacja.
Stosunek ![]()
liczby cząsteczek zdysocjowanych ND do ogólnej liczby cząstek rozpuszczonych wynosi:
![]()
i nazywany jest stopniem dysocjacji.
Dla mocnych elektrolitów 0,8<![]()
<1
Dla średnich elektrolitów ![]()
=0,5
Dla słabych elektrolitów ![]()
<0,01
Gdy zanurzymy w roztworze dwie elektrody połączone ze sobą źródłem napięcia, na jony działają siły elektrostatyczne. Kationy zmierzają więc do KATODY (elektrody o potencjale ujemnym) a aniony do ANODY (elektrody o potencjale dodatnim). W elektrolicie płynie prąd. Za kierunek prądu przyjmujemy ruch kationów.
Elektroliza to całość zjawisk zachodzących przy przepływie prądy elektrycznego przez elektrolity.
W wyniku elektrolizy siarczanu miedzi:
gdy elektrody są węglowe lub platynowe na katodzie wydziela się miedź metaliczna, a na anodzie - tlen
gdy elektrody są miedziane na katodzie wydziela się miedź metaliczna, a na anodzie - nowa drobina ![]()
Prawa Faradaya określają ilość substancji wydzielających się w czasie elektrolizy na elektrodach.
I prawo Faradaya:
M=kQ lub m=kIt ,
Gdzie:
I - natężenie prądu;
T - czas
K - równoważnik elektromechaniczny
Wielkość wydzielanej masy na elektrodach jest wprost proporcjonalna do ładunku Q, który przepłynął przez elektrolit.
Jeżeli :
![]()
-ładunek jonu
![]()
-liczba wydzielonych jonów
![]()
- masa pojedynczego jonu
to:
m=![]()
oraz ![]()
z czego wynika, że:
m=![]()
i wówczas:
K=![]()
![]()
![]()
![]()
Wielkość masy pojedynczego jonu można obliczyć wiedząc, że liczba Avoogadra jonów waży tyle gramów, ile wynosi ciężar atomowy (bądź cząsteczkowy) jonu:
![]()
gdzie: M - masa molowa jonu
Stwierdzamy więc, że jony o wartościowości równej w (w=1,2,3,...) posiadają ładunek elektryczny dodatni lub ujemny, równy co do wielkości ładunkowi w elektronów, tzn.:
![]()
( jest to sens II prawa Faradaya)
Na podstawie powyższych zależności zapisujemy:
![]()
![]()
- gramorównoważnik
![]()
-stała Faradaya
![]()
![]()
![]()
I i II prawo Faradaya
więc: ![]()
W ćwiczeniu wyznaczam równoważnik elektrochemiczny miedzi i stałą Faradaya, przeprowadzając elektrolizę wodnego roztworu ![]()
.
Mierząc natężenie prądu i czas trwania elektrolizy, a następnie określając ilość wydzielonej miedzi (poprzez zważenie elektrody przed i po wykonaniu doświadczenia), można po podstawieniu tych wartości do odpowiednich wzorów (znajdujących się powyżej) uzyskać szukane wartości liczbowe dla równoważnika elektrochemicznego miedzi oraz stałej Faradaya .
Do przeprowadzenia elektrolizy wykorzystujemy układ elektryczny składający się z elektrolizera, amperomierza prądu stałego, klucza do zamykania i przerywania prądu , źródła prądu stałego (zasilacza) oraz rezystora suwakowego do regulacji natężenia prądu w obwodzie.
Elektrolizer to prostopadłościenne naczynie szklane, w którym elektrodami są płaskie blachy miedziane. Obie elektrody zanurzone są w roztworze ![]()
.
II. WYNIKI POMIARÓW I OBLICZEŃ
Waga elektrody przed elektrolizą m1 = 82,1 g
Waga elektrody po elektrolizie m2 = 82,3 g
Czas t = 30 minut
Δm=0,1 g
ΔI = 0,01 [A]
I1 [A] |
I2 [A] |
I3 [A] |
I4 [A] |
I5 [A] |
I6 [A] |
I7 [A] |
ΔI [A] |
0,195 |
0,196 |
0,199 |
0,198 |
0,198 |
0,199 |
0,200 |
0,197 |
Obliczam ilość substancji wydzielonej na elektrodzie podczas elektrolizy:
m= m2-m1
m1 = 82,1 g
m2 = 82,3 g
m =82,3 g -82,1 g
m = 0,2g
Obliczam ładunek Q, który przepłynął przez elektrolit:
Q=It
![]()
I=0,197A
t=30 minut =30 60s = 1800 s
![]()
![]()
Q =0,197 1800= 356 C
Obliczam współczynnik k (równoważnik elektromechaniczny)
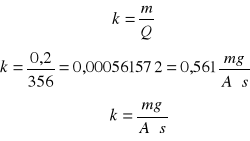
m=kQ
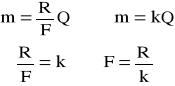
Obliczam stałą Faradaya:
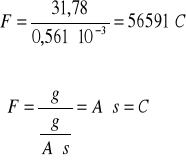
Obliczam błąd m, I, t:
m=m1+m2 czyli m=0,01+0,01=0,02g;
I=0,1A;
t=1s;
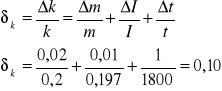
Obliczam graniczny błąd względny i bezwzględny równoważnika elektromechaniczny:
- błąd względny
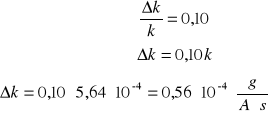
- błąd bezwzględny
Obliczam graniczny błąd względny i bezwzględny stałej Faradaya F:
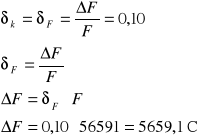
- błąd względny
- błąd bezwzględny
III. WNIOSKI
W danym ćwiczeniu laboratoryjnym mieliśmy za zadanie wyznaczyć wielkości
równoważnika elektromechanicznego miedzi
stałej Faradaya.
Powyższe wielkości otrzymaliśmy za pomocą I i II prawa Faradaya, oraz masy wydzielonej na elektrodach, natężenia prądu i czasu trwania elektrolizy.
W roztworze wodnym siarczanu miedzi (CuSO4) na skutek dysocjacji rozpada się na dwa jony : dodatni Cu++ i jony ujemne reszty kwasowej SO4--. Pod wpływem pola elektrycznego , które wytwarza się pomiędzy katodą i anodą, kationy Cu++ wędrują do katody i osadzają się na niej, aniony SO4-- odpowiednio do anody.
![]()
Błędy pomiarowe nie wpłynęły znacząco na wynik:
równoważnika elektromechanicznego miedzi , a wartość
![]()
tablicowa jest równa 0,329 . Błąd względny jest równy aż 70% równoważnika
elektromechanicznego.
![]()
stałej Faradaya , a wartość tablicowa jest równa 96484 [C/gramorównoważnik]. Błąd względny jest równy blisko 41% stałej Faradaya.
Po wykonaniu ćwiczenia możemy stwierdzić, że popełnione błędy, które są błędami spowodowanymi niedoskonałością aparatury, jak również niedokładnością odczytu spowodowały bardzo duże odstępstwa od stałych tablicowych.
![]()
![]()
![]()
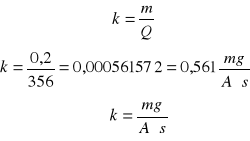
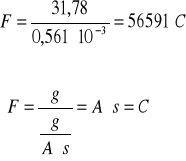
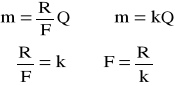
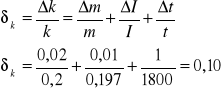
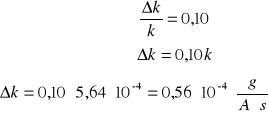
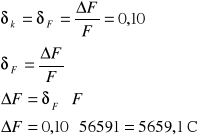
![]()
![]()
![]()