Robert Maniura
Sprawozdanie z ćwiczenia nr 1: Siła elektromotoryczna ogniwa galwanicznego.
Wyniki ćwiczenia:
nr |
Rodzaj ogniwa |
SEM ogniwa [V] |
1 |
|
1,046 |
2 |
|
0,051 |
3 |
|
1,098 |
4 |
|
1,111 |
5 |
|
1,079 |
6 |
|
1,095 |
7 |
|
0,012 |
8 |
|
-0,014 |
9 |
|
-0,020 |
10 |
|
-0,034 |
11 |
|
-0,044 |
12 |
|
-0,055 |
Wstęp teoretyczny:
Układ utworzony przez połączenie dwóch elektrod za pomocą przewodnika elektrolitycznego nosi nazwę ogniwa elektrochemicznego.
Zbudujmy ogniwo składające się z dwóch elektrod, przy czym na jednej z tych elektrod zachodzi wydzielanie kationów:
![]()
a na drugiej - przechodzenia jonów metalu do roztworu:
![]()
Sumaryczna reakcja w ogniwie w stanie równowagi będzie następująca:
![]()
Potencjały poszczególnych elektrod, zgodnie z równaniem Nernsta, wynoszą:
![]()
oraz ![]()
W przypadku roztworów rozcieńczonych aktywności jonów można zastąpić stężeniem molowym i po uproszczeniu równania te przybierają postać:
![]()
oraz ![]()
Siła elektromotoryczna ![]()
powstałego ogniwa będzie równa różnicy potencjałów elektrod:
![]()
a zatem:
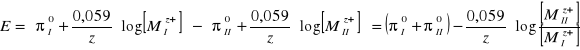
Różnica potencjałów standardowych elektrod ![]()
jest dla danego ogniwa stała. Nazwano ją standardową siłą elektromotoryczną ogniwa i oznaczono symbolem ![]()
![]()
Konwencja elektrochemiczna.
W 1953 r w Sztokholmie została przyjęta międzynarodowa konwencja ustaleń stosowanych w zapisie schematów ogniw elektrochemicznych i oznaczenia siły elektromotorycznej (SEM). Według tej konwencji SEM danego ogniwa jest dodatnia wtedy, gdy reakcja w ogniwie przebiega samorzutnie, oraz ujemna, gdy jest wymuszona.
Rozpatrzymy ogniwo Daniella, w którym zachodzą procesy:
Katoda: ![]()
Anoda: ![]()
Proces sumaryczny w stanie równowagi chemicznej:
![]()
Ogniwo Daniella składa się z dwóch naczyń zawierających roztwory ZnSO4 i CuSO4, z zanurzonymi w nich płytkami metalowymi: Zn i Cu. Roztwory te połączone są kluczem elektrolitycznym, który stanowi nasycony roztwór KCl. Jaką rolę w ogniwie spełnia właściwie klucz elektrolityczny?
Otóż, jeśli zetkną się ze sobą roztwory o różnym stężeniu, to na granicy styku tych roztworów wystąpi pewna różnica potencjałów, zwana potencjałem dyfuzyjnym. Potencjał ten wystąpi tylko wówczas, gdy liczby przenoszenia kationów i anionów stykających się elektrolitów będą różne.
Istnieją jednak pewne elektrolity, dla których liczby przenoszenia jonów są równe. Należą do nich np.: KCl, NH4NO3, KNO3. dla roztworów tych substancji potencjał dyfuzyjny będzie prawie równy zeru.
Gdybyśmy bezpośrednio zetknęli ze sobą roztwory ZnSO4 i CuSO4, to w ogniwie wystąpiłby znaczny potencjał dyfuzyjny; umieszczenie między nimi klucza elektrolitycznego eliminuje ten potencjał. Konstrukcje kluczy mogą być rozmaite. Według konwencji sztokholmskiej schemat ogniwa Daniella zapisujemy jako:
![]()
gdzie ![]()
- oznacza klucz elektrolityczny.
Siłę elektromotoryczną SEM ogniwa można bezpośrednio za pomocą czułego miliwoltomierza bądź metodą kompensacyjną Poggendorffa. Schemat pomiarowy stosowany w metodzie Poggendorffa pokazano na poniższym rysunku.
Zasada pomiaru jest następująca: najpierw włącza się do obwodu ogniwo badane o nie znanej sile elektromotorycznej ![]()
i styk przesuwa się wzdłuż drutu oporowego do punktu ![]()
, aż galwanometr nie będzie wskazywał przepływu prądu. Do tego położenia spełniony jest warunek: ![]()
. Następnie podobny pomiar wykonuje się po zastąpieniu tego ogniwa ogniwem wzorcowym o znanej sile elektromotorycznej ![]()
. Wówczas kompensacja zajdzie przy innym położeniu styku na drucie oporowym, np. w punkcie ![]()
. Spełniona jest wtedy równość: ![]()
. Z tych zależności wynika, że
![]()
uwzględniając wzory: ![]()
i ![]()
otrzymamy ostatecznie:
![]()
Określenie siły elektromotorycznej ogniwa ![]()
wymaga zatem tylko pomiaru długości odcinków drutu oporowego w warunkach kompensacji w przypadku ogniwa badanego i wzorcowego.
Opracowanie wyników:
Wykorzystując wzór ![]()
oraz dane doświadczalne obliczam potencjały normalne elektrod ![]()
, obliczam błąd procentowy. Do obliczenia SEM ogniwa w tabeli poniżej wykorzystałem następujące daną: ![]()
.
nr |
Rodzaj elektrody |
Potencjał normalny (obliczony) [V] |
Potencjał normalny (tablicowy) [V] |
Błąd procentowy |
1 |
|
-0,7668 |
-0,761 |
4,57 % |
2 |
|
-0,7798 |
-0,7905 |
1,35 % |
3 |
|
0,3312 |
0,339 |
2,30 % |
4 |
|
0,3122 |
0,3095 |
8,50 % |
5 |
|
0,2832 |
0,2800 |
1,14 % |
6 |
|
0,2502 |
0,2505 |
0,12 % |
7 |
|
0,2262 |
0,2210 |
2,35 % |
8 |
|
0,1912 |
0,1915 |
0,16 % |
9 |
|
0,1652 |
0,1620 |
1,97 % |
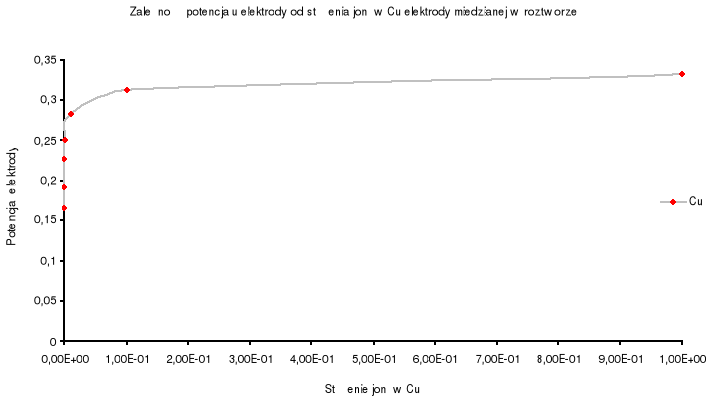
Wyznaczam zależność potencjału elektrody od stężenia jonów ![]()
elektrody w roztworze.
4. Wnioski:
Ponieważ źródła podają różne wartości potencjałów normalnych dla elektrod typu ![]()
, dlatego błędy dla ![]()
i ![]()
są znaczące. Nie zważając jednak na te błędy to w przypadku elektrod z rozcieńczeniami są raz znaczące, raz mniej znaczące. Wszystkie te błędy spowodowane są przede wszystkim niedokładnym dokonaniem rozcieńczeń jak również zbyt krótkim czasem oczekiwania na ustalenie się stanu równowagi w zmontowywanych ogniwach galwanicznych.
Z wykresu zależności potencjału elektrody od stężenia jonów ![]()
elektrody w roztworze wynika, że wraz ze wzrostem stężenia jonów metalu w roztworze potencjał elektrody wzrasta, co spowodowane jest zmniejszającą się aktywnością jonów w roztworze.
Literatura:
Kazimierz Gumiński „Wykłady z chemii fizycznej”;
Wiesław Karpiński „Chemia fizyczna dla techników chemicznych”
Peter William Atkins „Podstawy chemii fizycznej”
1
Wyszukiwarka
Podobne podstrony:
Siła elektromotoryczna ogniwa galwanicznego
OGNIWA GALWANICZNE SIŁA ELEKTROMOTORYCZNA OGNIW GALWANICZNY
SIŁA ELEKTROMOTORYCZNA OGNIW GALWANICZNYCH
galwanotechnika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Galwanotechni
Chemiczne źródła energii elektrycznej Ogniwa galwaniczne
Siła elektromotoryczna ogniwa
Siła elektromotoryczna ogniwa
Podstawy elektroniki - informatyka - program - gablota, Politechnika Lubelska, Studia, Studia, sem V
Napięcie rozkładowe elektrolitu, Studia, Politechnika
Pomiar siły elektromotorycznej i oporu wewnętrznego ogniwa metodą kompensacji, Politechnika Częstoch
Ręczna spawanie łukowe elektrodami otulonymi, studia, studia Politechnika Poznańska - BMiZ - Mechatr
elektrotechnika ćw2 - pomiary RLC, Politechnika Lubelska, Studia, Studia, Elektrotechnika - laborato
Przewodnictwo równoważnikowe elektrolitów, Studia, Politechnika
Elektrotechnika ćwiczenie 13 - sprawozdanie, Politechnika Lubelska, Studia, Elektrotechnika, ELEKTRO
ćw. 3 - spawanie elektrodą otuloną, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 s
Elektronika - 1 Jednofazowy falownik prądu, Politechnika Lubelska, Studia, semestr 5, Semest V, od g
Wyznaczanie stałej balistycznej galwanometru balistycznego, Politechnika Lubelska, Studia, Studia, s
Ogniwa galwaniczne, chemia, elektrochemia
więcej podobnych podstron