Monika Marek-Swędzioł
Anita Pędziwiatr
Patryk Mieszczanin
POTENCJOMETRIA I KONDUKTOMETRIA -
SPRAWOZDANIE POPRAWA
Wstęp teoretyczny:
Potencjometria jest jedną z najstarszych metod instrumentalnych w analizie chemicznej. Wykorzystuje się w niej pomiar siły elektromotorycznej (SEM) ogniwa zbudowanego z dwóch elektrod zanurzonych w badanym roztworze. Wartość SEM ogniwa zależy od potencjałów elektrod, a potencjały te zależą od aktywności jonów w roztworze elektrolitu i od charakteru procesów elektrodowych.
Konduktometria jest metodą analityczną polegającą na pomiarze przewodnictwa roztworu między dwoma identycznymi elektrodami obojętnymi, do których przykładany jest prąd zmienny. Wartość natężenia prądu przepływającego przez roztwór elektrolitu jest związana z liczbą i ruchliwością wolnych jonów w roztworze.
Zgodnie z prawem Ohma natężenie prądu płynącego przez warstwę elektrolitu jest odwrotnie proporcjonalne do oporu elektrycznego:
G = 1/ R [ 1 S = 1Ω-1], gdzie G - konduktancja elektrolityczna, R - rezystancja.
Podstawą metod konduktometrycznych jest zależność mierzonej konduktancji elektrolitycznej G badanego roztworu od stężenia elektrolitu: G= κ · A / L = κ · 1/ Θ, w którym κ = (Λ · c) / 1000, gdzie κ - konduktywność elektrolityczna, Θ stała naczyńka konduktometrycznego wielkość stała dla danego naczyńka konduktometrycznego, c stężenie molowe, Λ konduktywność molowa,
W bardzo rozcieńczonych roztworach Λ zbliża się do granicznej konduktywności molowej i roztworze jest równa sumie granicznych konduktywności jonów obecnych w elektrolicie
Konduktywność elektrolityczna roztworu zależy od rodzaju jonów, ich stężenia oraz temperatury; tylko w początkowym przedziale stężeń istnieje liniowa zależność konduktywności od stężenia, co jest wykorzystywane do pomiarów ilościowych. Pomiarów kondunktancji elektrolitycznej dokonuje się w konduktometrach, umieszczając elektrolit w naczyńku konduktometrycznym. Każde naczyńko posiada stałą naczyńka konduktometrycznego Θ, którą wyznaczamy mierząc konduktancję elektrolityczną G roztworu wzorcowego o określonym stężeniu i znanej konduktywności elektrolitycznej κ, wówczas Θ = κ / G.
W konduktometrii przeprowadza się pomiary bezpośrednie lub miareczkowanie konduktometryczne polegające na pomiarze konduktancji elektrolitycznej w czasie dodawania titranta, np. w metodach alkacymetrycznych.
Część doświadczalna:
Wyznaczanie charakterystyki elektrody szklanej
Nachylenie charakterystyki przy kalibracji - 101,8%
Pomiary:
pH wzorcowe buforu |
pH zmierzone |
SEM ogniwa [mV] |
∆E |
∆pH |
k=∆E/∆pH zm. |
1 |
1,03 |
340,5 |
67,7 |
1,15 |
58,87 |
2 |
2,18 |
272,8 |
45,9 |
0,78 |
58,85 |
3 |
2,96 |
226,9 |
59,3 |
1 |
59,3 |
4 |
3,96 |
167,6 |
56,2 |
0,95 |
59,16 |
5 |
4,91 |
111,4 |
48,9 |
0,83 |
58,92 |
6 |
5,74 |
62,5 |
68,2 |
1,14 |
59,82 |
7 |
6,88 |
-5,7 |
53,2 |
0,9 |
59,11 |
8 |
7,78 |
-58,9 |
49,7 |
0,84 |
59,17 |
9 |
8,62 |
-108,6 |
45,6 |
0,77 |
59,22 |
10 |
9,39 |
-154,2 |
|
|
|
kśr = 59,16 [mV/pH]
Wykres obrazujący zależność SEM=f(pHzm)
k = 59,22 [mV/pH]
Punkt zerowy elektrody przy pH≈6,79
Wnioski: Równanie Nernsta, opisujące zachowanie się idealnej elektrody szklanej,
przewiduje prostoliniową zależność potencjału elektrody pomiarowej od pH oraz skok
potencjału k równy: 58,2mV w T=20ºC; 59,1mV w T=25ºC. Wykres sporządzony na podstawie naszych wyników przedstawia jednoznacznie liniową zależność potencjału elektrody pomiarowej od pH. Obliczyliśmy wartość kąta nachylenia charakterystyki wykorzystując zależność (k=tg α = ∆E/∆pHzm ). Otrzymaliśmy wartość k=59,16 [mV/pH]. Następnie wyznaczyliśmy metodą regresji liniowej wartość kąta nachylenia charakterystyki k, która w tym przypadku wynosi 59,22 [mV/pH]. Średnia wartość k (59,19 [mV/pH]) jest zbliżona do wartości skoku potencjału w temperaturze 25ºC, która wynosi 59,1 mV.
Potencjometryczne oznaczanie mieszaniny kwasu solnego i octowego
Podczas miareczkowania mieszaniny kwasów w obecności acetonu zachodzi reakcja z titrantem:
1) HCl + NaOH → NaCl + H2O
2) CH3COOH + NaOH → CH3COONa + H2O
Otrzymana w wyniku miareczkowania krzywa wykazuje dwa wyraźne skoki, co umożliwia wyznaczenie dla każdego z kwasów punktu końcowego (PK) miareczkowania, a na tej podstawie obliczenia ich zawartości w badanym roztworze.
Opracowanie wyników:
VNaOH [mL] |
pH |
∆pH |
∆ VNaOH |
∆ pH/∆ VNaOH |
0 |
2,42 |
- |
- |
- |
0,5 |
2,55 |
0,13 |
0,5 |
0,26 |
1 |
2,69 |
0,14 |
0,5 |
0,28 |
1,2 |
2,81 |
0,12 |
0,2 |
0,6 |
1,4 |
2,91 |
0,1 |
0,2 |
0,5 |
1,6 |
3,12 |
0,21 |
0,2 |
1,05 |
1,8 |
3,4 |
0,28 |
0,2 |
1,4 |
2 |
3,89 |
0,49 |
0,2 |
2,45 |
2,2 |
4,49 |
0,6 |
0,2 |
3 |
2,4 |
4,77 |
0,28 |
0,2 |
1,4 |
2,6 |
4,92 |
0,15 |
0,2 |
0,75 |
2,8 |
5,07 |
0,15 |
0,2 |
0,75 |
3 |
5,19 |
0,12 |
0,2 |
0,6 |
4 |
5,52 |
0,33 |
1 |
0,33 |
5 |
5,8 |
0,28 |
1 |
0,28 |
6 |
6,04 |
0,24 |
1 |
0,24 |
7 |
6,31 |
0,27 |
1 |
0,27 |
7,2 |
6,38 |
0,07 |
0,2 |
0,35 |
7,4 |
6,47 |
0,09 |
0,2 |
0,45 |
7,6 |
6,55 |
0,08 |
0,2 |
0,4 |
7,8 |
6,62 |
0,07 |
0,2 |
0,35 |
8 |
6,73 |
0,11 |
0,2 |
0,55 |
8,2 |
6,86 |
0,13 |
0,2 |
0,65 |
8,4 |
7,05 |
0,19 |
0,2 |
0,95 |
8,6 |
7,32 |
0,27 |
0,2 |
1,35 |
8,8 |
8,13 |
0,81 |
0,2 |
4,05 |
9 |
11,15 |
3,02 |
0,2 |
15,1 |
9,2 |
11,69 |
0,54 |
0,2 |
2,7 |
9,4 |
11,95 |
0,26 |
0,2 |
1,3 |
9,6 |
12,1 |
0,15 |
0,2 |
0,75 |
Krzywa miareczkowania w układzie pH = f (VNaOH):
( załączony wykres)
Wartości VPK1 i VPK2 wyznaczone metodą graficzną (środkowych stycznych):
VPK1 = 2,05 mL
VPK2 = 8,90 mL
Wykres ∆ pH/∆ VNaOH = f (VNaOH):
( załączony wykres)
Wartości VPK1 i VPK2 wyznaczone metodą pierwszej pochodnej:
VPK1 = 2,10 mL
VPK2 = 8,90 mL
VPK1, śr = 2,075 mL
VPK2, śr = 8,90 mL
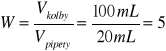
Zawartości kwasów w badanym roztworze :
![]()
![]()
Zawartość kwasu solnego: 0,0756g
Zawartość kwasu octowego: 0,4099g
Oznaczanie stopnia czystości wody metodą konduktometryczną
![]()
Stała naczyńka = 0,457
Dane:
Rodzaj wody |
|
Ultra czysta |
0,112 |
Dejonizowana |
0,457 |
Destylowana |
142,1 |
Deszczówka |
157 |
Do Instalacji grzewczej |
181 |
Wodociągowa |
221,2 |
Kropla Beskidu |
352 |
NaCl |
1184 |
Muszyna |
1262 |
Skład Kropli Beskidu i Muszyny:
Kropla Beskidu |
|
Kationy |
Zawartość [mg/l] |
Wapń |
44,09 |
Magnez |
17,01 |
Sód |
11,1 |
Potas |
1 |
Aniony |
Zawartość [mg/l] |
Wodorowęglanowy |
186,7 |
Siarczanowy |
43,62 |
Chlorkowy |
3,19 |
Muszyna |
|
Kationy |
Zawartość [mg/l] |
Wapń |
318,7 |
Magnez |
32,3 |
Sód |
11,6 |
Potas |
2,89 |
Aniony |
Zawartość [mg/l] |
Wodorowęglanowy |
1154 |
Siarczanowy |
11,9 |
Chlorkowy |
8,5 |
Fluorowy |
0,198 |
Wnioski:
Jak widać przewodność wzrasta wraz liczbą jonów w roztworze. Na przykładzie Kropli Beskidu i Muszyny widać jak się zmienia przewodność wraz zawartością jonów w roztworze.
Woda deszczowa wykazywała małe przewodnictwo elektryczne zbliżone do wody destylacyjnej co świadczy o małej obecności jonów.
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Sprawozdania z analizy instrumentalnej, MP, Miareczkowanie potencjometryczne
Chromatografia, Technologia chemiczna, Analiza instrumentalna
drzewiecka niektore pytania, Analiza instrumentalna
Analiza instrumentów pochodnych
Opracowania pytań na analizę instrumentalną
Analiza Instrumentalna Miareczkowanie spektrofotometryczne Sprawozdanie 3 x
1(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Techniki Fluorescencji w Analizie instrumentalnej, Analityka medyczna, Analiza instrumentalna
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
spektrofotomeria - sprawozdanie, studia, studia I rok, chemiczna analiza instrumentalna, spr
Cw9, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Wyznaczanie charakterystyki elektrody szklanej, analiza instrumentalna
tabelka do sprawozdań, far, II rok III sem, analiza instrumentalna
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Sprawozdanie 1 kam
analiza instrumentalna test
EGZAMIN ANALIZA INSTRUMENTALNA
więcej podobnych podstron