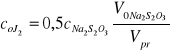
Sprawozdanie z laboratorium
Ćwiczenie nr 21
Kinetyka autokatalitycznej reakcji jodowania acetonu
Reakcja jodowania acetonu jest przykładem reakcji autokatalitycznej, jeden z produktów reakcji - jodowodór , który - jako mocny kwas - przyspiesza enolizację acetonu - spełnia rolę katalizatora.
Do przeprowadzenie ćwiczenia używamy takiej aparatury jak:
- termostat, termometr cyfrowy, 2 kolby miarowe o poj. 250 cm3, dwie próbówki, 4 kolby stożkowe o poj. 250 cm3, biureta, pipeta 25 cm3
Odczynniki potrzebne do ćwiczenia to:
4 % roztwór KJ
1n roztwór HCl
0,1n roztwór NaHCO3
0,01n roztwór Na2S2O3
roztwór skrobi
Do dwóch kolb miarowych o pojemności 250 cm3 wprowadzam po 25 cm3 0,1m roztworu jodu w 4 % KJ. Do każdej z kolb dodaję po 25 cm3 1n roztworu HCl i tyle wody, aby do kreski miarowej kolby pozostało około 20 cm3. Kolby z roztworem umieszczam w termostacie w temperaturze 30°C. W termostacie umieszczam także dwie próbówki, zawierające po 2 cm3 acetonu.
Podczas termostatowania próbek wykonuje tzw. „ślepą próbę” , w celu wyznaczenia stężenia początkowego jodu. W tym celu do kolby miarowej o pojemności 50 cm3 wprowadzam 5 cm3 roztworu jodu o stężeniu takim samym jak jod używany do reakcji, dopełniam wodą destylowana do kreski. Z tak przyrządzonego roztworu pobieram do analizy próbkę 10 cm3 i miareczkuje mianowanym roztworem tiosiarczanu sodowego.
Gdy miareczkowany roztwór zrobi się lekko żółty (początkowo jest ciemno brązowy) dodaję kilka kropel skrobi, w wyniku czego roztwór staje się granatowy. Miareczkuje dalej aż do zupełnego odbarwienia się roztworu. Objętość zużytego na miareczkowanie tiosiarczanu oznaczam przez V0 Na2S2O3.
Wartość ta będzie nam potrzebna do obliczenia stężenia początkowego jodu c0J2.
Po 10-15 minutach termostatowania wlewam się aceton do roztworu jodu, notuję czas dodania jako moment rozpoczęcia reakcji (t=0), uzupełniam kolby wodą destylowaną do kreski miarowej i mieszam. Następnie pobieram do analizy próbki o objętości 10 cm 3 i wprowadzam je do kolbek z wlanymi wcześniej 10 cm3 porcjami 0,1n roztworu NaHCO3, notując czas przerwania reakcji t1 i miareczkuje próbki 0,01 n roztworem tiosiarczanu sodowego w obecności skrobi. Następne próbki roztworu pobieram do analizy w odstępach 15 minutowych i miareczkuje podobnie jak poprzednio
Dane:
V0 Na2S2O3 = 10,5 cm3
t0 = 935
Vpr = 10 cm3
I. Obliczam stężenie początkowe jodu c0J2
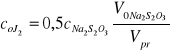
gdzie: CNa2S2O3 - stężenie roztworu Na2S2O3 [gR/dm3]
VoNa2S2O3 - objętość roztworu Na2S2O3 zużytego na analizę ślepej próby [cm3]
Vpr - objętość próbki wziętej do analizy [cm3]
![]()
n
II. Obliczam aktualne stężenie jodu cJ2
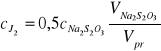
pomiar 1
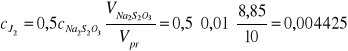
n
pomiar 2
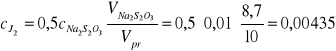
n
pomiar 3
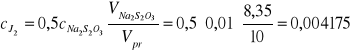
n
pomiar 4
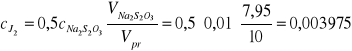
n
pomiar 5
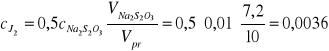
n
III. Obliczam zmianę stężenia jodu po czasie t, równa ubytkowi stężenia acetonu x
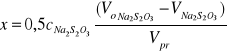
pomiar 1
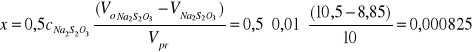
pomiar 2
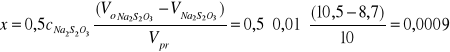
pomiar 3
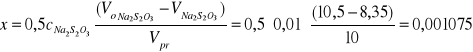
pomiar 4
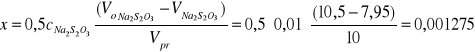
pomiar 5
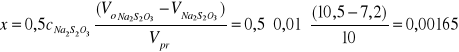
IV. Obliczam stężenie początkowe acetonu c0ac
![]()
[mol/dm3]
gdzie: Vac - objętość acetonu wziętego do reakcji [cm2] 2 cm3
ρac - gęstość acetonu [cm3] 0,79 g/cm3
Mac - masa cząsteczkowa acetonu [ g/mol] 58 g/mol
Vkol - objętość mieszaniny reakcyjnej (kolby) [cm3] 250 cm3
![]()
n
V. Obliczamy stężenie jonów wodorowych cokw , wynikające z ilości kwasu solnego dodanego do reakcji
![]()
[mol/dm3]
gdzie: VHCl - objętość dodanego kwasu solnego [cm3] 25 cm3
CHCl - stężenie roztworu kwasu solnego [mol/dm3] 1 mol/dm3
Vkol - objętość kolby [cm3] 250 cm3
![]()
[mol/dm3]
VI. Obliczam wartość y w różnych momentach czasowych pobieranych próbek
![]()
dla t1
![]()
dla t2
![]()
dla t3
![]()
dla t4
![]()
dla t5
![]()
VII. Wyznaczam współczynnik kierunkowy prostej y=f(t)
![]()
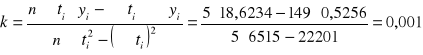
![]()
![]()
![]()
VIII. Wszystkie wyniki zestawiono w tabeli
Nr pomiaru
|
Godzina pomiaru |
Czas trwania reakcji [min] |
Objętość Na2S2O3 |
Stężenie jodu CJ2 |
Ubytek stężenia acetonu x |
y |
1 |
935 |
t1=1 |
|
|
|
|
2 |
950 |
t2=16 |
|
|
|
|
3 |
1005 |
t3=29 |
|
|
|
|
4 |
1020 |
t4=44 |
|
|
|
|
5 |
1035 |
t5=59 |
|
|
|
|