Sprawozdanie z ćwiczenia nr 24: Entalpia parowania.
Wyniki ćwiczenia:
nr |
masa suchej kolby |
masa pełnej kolby |
masa kondensatu |
czas |
napięcie |
natężenie |
1 |
84,3498 |
90,01978 |
5,66998 |
300 |
90 |
0,93 |
2 |
68,8002 |
78,55014 |
9,74994 |
300 |
104,8 |
1,08 |
3 |
83,23976 |
97,64974 |
14,40998 |
300 |
119,9 |
1,232 |
4 |
67,72964 |
87,58036 |
19,85072 |
300 |
135,5 |
1,39 |
5 |
79,6405 |
103,65 |
24,00948 |
300 |
150,1 |
1,535 |
2. Wstęp teoretyczny:
Parowanie cieczy jest procesem polegającym na przechodzeniu cząstek cieczy z jej swobodnej powierzchni w stan gazowy. Jeżeli proces ten odbywa się w naczyniu zamkniętym , częściowo wypełnionym tylko cieczą , to w każdej temperaturze ustala się stan równowagi , w którym liczba cząsteczek przechodzących w stan pary staje się równa liczbie cząsteczek skraplających się ponownie . Para w tych warunkach jest parą nasyconą , a jej ciśnienie nosi nazwę prężności pary nasyconej . Prężność pary nasyconej jest w danej temperaturze różna dla różnych cieczy charakteryzuje ich lotność . Woda jest cieczą nielotną i posiada małą prężność pary nasyconej .
Ze wzrostem temperatury prężność pary nasyconej rośnie , ze względu na występujące w tych warunkach zwiększenie liczby cząsteczek zdolny do opuszczenia powierzchni cieczy oraz równoczesne zwiększenie energii kinetycznej cząsteczek będących już w stanie pary . Zwiększenie to ma charakter krzywoliniowy i przebiega podobnie dla wszystkich cieczy , tzn. w niskich temperaturach jest niewielkie , a w wyższych znaczne .
Ćwiczenie polega na pomiarze energii elektrycznej potrzebnej do odparowania n moli cieczy w kontrolowanych warunkach .
W tym celu wykorzystuje się równanie: ![]()
, gdzie: Hpar - szukana entalpia parowania, ![]()
[ J/s ] - stała określająca straty cieplne w aparaturze ( k=7.8[J/s] ). Powyższe równania wyrażają : ![]()
[ J/s ] gdzie : Q oznacza energię elektryczną dostarczaną do grzałki w ciągu 1 sekundy ![]()
[ J ]. Wyraża wielkość energii źródła prądu zamienionego na energię cieplną podczas przepływu o natężeniu i w czasie t przez urządzenie , na którego końcach różnica potencjałów wynosi U, ![]()
[ mol/s ] gdzie: n - liczba moli odparowanej cieczy, t - czas [ s ] potrzebny do odparowania n moli cieczy
Po przekształceniu otrzymujemy następujący wzór na entalpię parowania : ![]()
którego jednostka jest następująca : ![]()
Opracowanie wyników:
nr |
masa suchej kolby |
masa pełnej kolby |
masa kondensatu |
czas |
napięcie |
natężenie |
liczba moli |
|
1 |
84,3498 |
90,01978 |
5,66998 |
300 |
90 |
0,93 |
0,314731 |
25,110 |
2 |
68,8002 |
78,55014 |
9,74994 |
300 |
104,8 |
1,08 |
0,541202 |
33,9552 |
3 |
83,23976 |
97,64974 |
14,40998 |
300 |
119,9 |
1,232 |
0,799873 |
44,31504 |
4 |
67,72964 |
87,58036 |
19,85072 |
300 |
135,5 |
1,39 |
1,101879 |
56,5035 |
5 |
79,6405 |
103,65 |
24,00948 |
300 |
150,1 |
1,535 |
1,332724 |
69,12105 |
Wykres zależności pobranej energii od masy kondensatu:
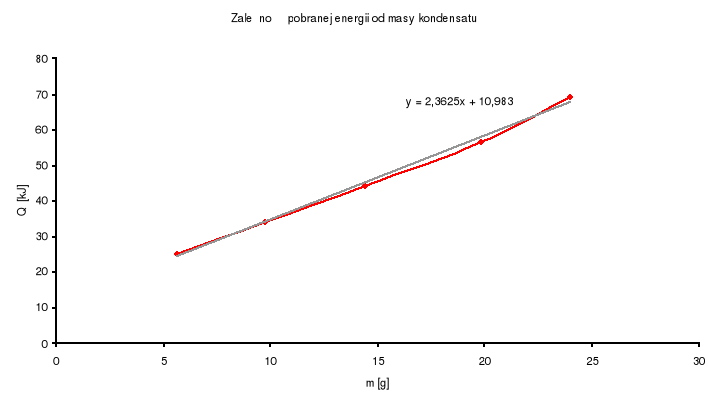
Obliczam Hśrc→g korzystając ze współczynnika kierunkowego regresji liniowej otrzymanego na podstawie wykresu zależności pobranej energii od masy kondensatu.
Hśrc→g = B * M
gdzie : B=2,3625 - współczynnik kierunkowy
M=18,01534 [g/mol] - masa molowa wody
Hśrc→g = 42,56 [ kJ/mol ]
Błąd pomiarowy wynosi 1,9 obliczony na podstawie wykresu
Molowa entalpia parowania wynosi 42,56 1,9 [ kJ/mol ]
3.1. Zestawienie otrzymanych wielkości z danymi literaturowymi :
Dane literaturowe dla 375,15 K |
Wielkości doświadczalne w [ kJ/mol ] |
Hpar= 40.66 [kJ/mol] |
Hśrc→g 42,56 1,9 |
4. Wnioski:
Entalpia parowania wody destylowanej ( dla napięcia w przedziale 90 - 150,1 ) jest równa Hpar = 42,56 1,9 [ kJ/mol ]. Przyrost energii warunkuje wzrost temperatury co powoduje zwiększenie liczby cząsteczek zdolnych do opuszczenia powierzchni cieczy
( w tym samym czasie ). Tak więc szybkość parowania cieczy jest wprost proporcjonalna do napięcia elektrycznego ( „przyłożonej” energii ). Zwiększenie energii elektrycznej powoduje wzrost szybkości parowania cieczy.
Błąd procentowy wynosi 4,67 %.
3
Wyszukiwarka
Podobne podstrony:
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
HCOOH, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entropia mieszania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Badanie lepkości cieczy metodą Hopplera, studia, chemia, chemia fizyczna, sprawozdania, sprawka
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Energia aktywacji przepływu lepkiego, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Ciepło rozpuszczania soli jonowej, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Dyspersja współczynnika załamania światła, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl i HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Jonity1, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Izoterma adsorpcji 1, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Grupy symetrii, studia, chemia, chemia fizyczna, sprawozdania, sprawka
ester KK, studia, chemia, chemia fizyczna, sprawozdania, sprawka
więcej podobnych podstron