Akademia Bydgoska im. Kazimierza Wielkiego
Wydział Matematyki Techniki i Nauk Przyrodniczych
Sprawozdanie z laboratorium materiałoznawstwa metali
Temat ćwiczenia:
Wykres równowagi faz z eutektyką z brakiem rozpuszczalności w stanie stałym.
Wykonali:
Marek Mastalerski
Adam Mikołajczak
Sławomir Nowicki
II rok WT gr. E
BYDGOSZCZ 2001
Spis treści:
1. Wprowadzenie teoretyczne............................3
Układ równ. faz 4
3.Wykres .............................................................6
4. Stop I 7
5. Stop II 8
6. Stop III 9
Wprowadzenie teoretyczne
Przeprowadzając analizę cieplną czystego metalu i kilku stopów tych metali otrzymamy krzywe chłodzenia i wykres równowagi fazowej stopów. Połączone oddzielnie punkty początków krzepnięcia i oddzielnie punkty końca krzepnięcia, dają linie początków krzepnięcia, zwaną likwidus i linie końców krzepnięcia, zwana solidus. Otrzymujemy w ten sposób podwójny układ równowagi fazowej dwóch metali, które rozpuszczają się w sobie całkowicie w stanie stałym.
Ponad linią likwidusu istnieje jedna faza - roztwór ciekły dwóch metali, pomiędzy liniami likwidusu i solidusu - roztwór stały i roztwór ciekły, a poniżej linii solidus - roztwór stały.
2.Układ równowagi fazowej
Pod pojęciem fazy rozumie się jednorodna fizycznie część układu, oddzieloną od reszty układu powierzchnią rozdziału. Jednorodność fizyczna fazy wyraża się w tym, że jeśli jakąkolwiek najdrobniejszą część tej fazy oddzieli się mechanicznie od reszty, będzie ona taka sama jak reszta fazy pod względem własności, struktury i składu chemicznego ( z dopuszczalną w pewnych granicach niejednorodnością).
Reguła faz wprowadzona przez J.W. Gibbsa w r. 1876 dotyczy układów wieloskładnikowych i wielofazowych znajdujących się w stanie równowagi termodynamicznej ( np. stopów metalu) i wyraża matematyczną zależność pomiędzy liczbą stopni swobody S układu a liczba występujących składników n, liczbą reakcji chemicznych c oraz liczbą parametrów p ( czynników wpływających na równowagę):
S = n - c -f + p.
W ogólnym pojęciu czynnikami wpływającymi na równowagę, czyli parametrami układu, jest temperatura i ciśnienie.
W układach, w których nie występuje stan gazowy, a tylko ciekły i stały, w tzw. stanach skondensowanych, niewielkie zmiany ciśnienia nie wpływają w sposób istotny na ich stan równowagi. Dopiero zastosowanie bardzo wysokich ciśnień wpływa na zmianę stanu takiego układu. Metale maja na ogół temperatury wrzenia wysokie, toteż ich stopy można uważać za układy skondensowane, ( co pozwala na pominięcie czynnika ciśnienia ( p = 1)). Dalszego uproszczenia reguły faz dla stopów można dokonać, dlatego, że w stopach w stanie stałym na ogół nie zachodzą reakcje chemiczne, ( czyli można przyjąć c = 0). Reguła faz Gibbsa ma, więc w zastosowaniu do stopów metali uproszczoną formę:
S = n - f +1
Pod pojęciem liczby stopni swobody S rozumie się liczbę czynników, które można zmieniać niezależnie od siebie bez zmiany stanu równowagi układu; czynnikami takimi dla stopów są temperatura i stężenie poszczególnych faz. Z równowagi reguły faz wynika, że z chwilą pojawienia się w układzie nowej fazy, liczba stopni swobody zmniejsza się o 1.
Nie można zmienić temperatury układy, w którym podczas krzepnięcia współistnieją fazy ciekłego i stałego metalu.
Wnioski wypływające z reguły faz doskonale potwierdzają występowanie przystanków temperaturowych w krzywych stygnięcia układów metalicznych w czasie topnienia, czyli krzepnięcia w wyniku wydzielania się, względnie pobierania utajonego ciepła krzepnięcia.
Fazy znajdujące się ze sobą w stanie równowagi tworzą tzw. układ równowagi. Składniki stanowiące substancje proste lub złożone w określonych warunkach mogą tworzyć wszystkie fazy danego układu.
Składniki nie mogą przemieniać się jedna w drugą, ale mają możliwość przechodzenia z jednej fazy w drugą.
Składniki dzielimy na:
Niezależne; nie zachodzą między nimi reakcje chemiczne,
Zależne; zachodzą między nimi odwracalne reakcje chemiczne.
Najbardziej rozpowszechnioną metodą otrzymywania stopów jest metoda stapiania składników, a następnie chłodzenie, podczas którego następuje krystalizacja wszystkich faz danego stopu.
Aby stop po wykrystalizowaniu i ochłodzeniu do temperatury otoczenia był w równowadze termodynamicznej, chłodzenie musi zachodzić bardzo wolno. Podczas krzepnięcia stopu głównie chodzi nam o to, by jego struktura była ujednorodniona.
Ujednorodnienie stopu podczas krzepnięcia można uzyskać podczas bardzo powolnego chłodzenia. W praktyce nie stosuje się bardzo powolnego chłodzenia.
Najprostsza metodą wyznaczania układu równowagi fazowej jest analiza cieplna stopów, oparta na pomiarze zmian temperatury podczas równomiernego nagrzewania lub studzenia stopu.
Każdy podwójny układ równowagi fazowej składa się z oddzielnych pól ograniczonych liniami, z których każde przedstawia zakres istnienia w stanie równowagi określonych faz.
Połączone oddzielnie punkty początków krzepnięcia i oddzielnie punkty końca krzepnięcia, dają linie początków krzepnięcia, zwaną likwidus i linie końców krzepnięcia, zwane solidus. Otrzymujemy w ten sposób podwójny układ równowagi fazowej dwóch metali, które rozpuszczają się w sobie całkowicie w stanie stałym.
Ponad linia likwidus istnieje jedna faza - roztwór ciekły dwóch metali L, pomiędzy liniami likwidus i solidus - roztwór stały i roztwór ciekły L, a poniżej linii solidus - roztwór stały.
Dla każdego stopu można w każdej temperaturze wyznaczyć wagową zawartość poszczególnych faz za pomocą reguły dźwigni. W tym celu zakładamy, że odległość mierzona wg prostej poziomej między poszczególnymi fazami wynosi wagowo 100%. Wówczas poszczególne odcinki poziome, mierzone w tej samej skali mają się do siebie w stosunku odwrotnym do zawartości procentowej poszczególnych faz i składników.
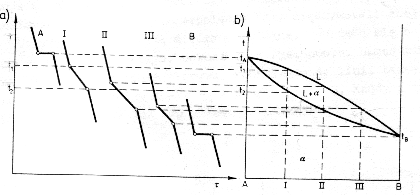
3.Wykres
4. Stop nr I
Powyżej linii likwidus AEB istnieje ciecz. Ochładzając stop I dochodzimy do punktu 1 odpowiadającemu temperaturze t1, w którym następuje wydzielenie się pierwszego kryształu A.
Od punktu 1 do punktu 3 następuje zwiększone wydzielanie się kryształków A. W zakresie temperatur od t1 do t3 skład cieczy zmienia się wzdłuż likwidus od punktu 1 do punktu E, a skład ciała stałego zmienia się wzdłuż solidus od punktu 1' do punktu 3'.
W temperaturze 650oC wydziela się eutektyka składająca się z drobnoziarnistych kryształów A i B. Poniżej temperatury 650oC żadne przemiany nie zachodzą. Skład chemiczny w punkcie 2 wynosi 12% metalu A i 88% metalu B.
W miarę chłodzenia w temperaturze t2 = 700oC chłodzą się dwie fazy: ciecz o składzie punktu 2'' oraz kryształy o składzie punktu 2'. Wzajemny stosunek ilościowy tych faz w punkcie 2 określić możemy zależnością:
![]()
Jest to ilościowy stosunek fazy ciekłej do fazy stałej.
5. Stop nr II
Powyżej linii likwidus AEB istnieje ciecz. Ochładzając stop II dochodzimy do punktu 1 odpowiadającemu temperaturze t1, w którym następuje wydzielenie się pierwszego kryształu B.
Od punktu 1 do punktu 3 następuje zwiększone wydzielanie się kryształków B. W zakresie temperatur od t1 do t3 skład cieczy zmienia się wzdłuż likwidus od punktu 1 do punktu E, a skład ciała stałego zmienia się wzdłuż solidus od punktu 1' do punktu 3'.
W temperaturze 650oC wydziela się eutektyka składająca się z drobnoziarnistych kryształów A i B. Poniżej temperatury 650oC żadne przemiany nie zachodzą. Skład chemiczny w punkcie 2 wynosi 69% metalu A i 31% metalu B.
W miarę chłodzenia w temperaturze t2 = 800oC chłodzą się dwie fazy: ciecz o składzie punktu 2'' oraz kryształy o składzie punktu 2'. Wzajemny stosunek ilościowy tych faz w punkcie 2 określić możemy zależnością:
![]()
Jest to ilościowy stosunek fazy ciekłej do fazy stałej.
6. Stop nr III
Powyżej linii likwidus AEB istnieje ciecz. Ochładzając stop III dochodzimy do punktu 1 odpowiadającemu temperaturze t1, w którym następuje wydzielenie się pierwszego kryształu B.
Od punktu 1 do punktu 3 następuje zwiększone wydzielanie się kryształków B. W zakresie temperatur od t1 do t3 skład cieczy zmienia się wzdłuż likwidus od punktu 1 do punktu E, a skład ciała stałego zmienia się wzdłuż solidus od punktu 1' do punktu 3'.
W temperaturze 650oC wydziela się eutektyka składająca się z drobnoziarnistych kryształów A i B. Poniżej temperatury 650oC żadne przemiany nie zachodzą. Skład chemiczny w punkcie 2 wynosi 91% metalu A i 9% metalu B.
W miarę chłodzenia w temperaturze t2 = 1000oC chłodzą się dwie fazy: ciecz o składzie punktu 2'' oraz kryształy o składzie punktu 2'. Wzajemny stosunek ilościowy tych faz w punkcie 2 określić możemy zależnością:
![]()
Jest to ilościowy stosunek fazy ciekłej do fazy stałej.
9
Wyszukiwarka
Podobne podstrony:
997
997
997
997
997
997
997
marche 997 p
997 0017
997 0005
BWV 997 Lute Suite Sarabande
BWV 997 Suite Lute No 2
997 0016
997 0006
Lute Suite No 2 BWV 997 3 Sarabande
akumulator do porsche 911 997 36 carrera 36 carrera 4 36 s 38
akumulator do porsche 911 targa 997 36
997 0009
więcej podobnych podstron