Choroby roślin warzywnych
Choroby wirusowe
Żółta karłowatość cebuli (onion yellow dwarf virus — OYDV)

Na liściach występują żółtawe lub jasnozielone smugi. W miarę postępów choroby liście spłaszczają się, wielokrotnie załamują, kędzierzawią i zwisają. Cebule chorych roślin mają zwykle zgrubiałe szyjki i nietypowy kształt, źle się przechowują i przedwcześnie wyrastają nowe liście. Pędy nasienne z porażonych cebul są żółto smugowane, zniekształcone i zahamowane we wzroście.
Wirus żółtej karłowatości poraża cebulę, szczypiorek i szalotkę. Zróżnicowana jest wrażliwość odmian cebuli. Nie jest przenoszony przez nasiona. Stosunkowo łatwo rozprzestrzenia się przy ocieraniu się roślin chorych o zdrowe oraz łatwo jest przenoszony przez liczne gatunki mszyc i przez skoczka sześciorka (Macrosteles laevis). Zakażone cebule są źródłem choroby w roku następnym.
Zwalczanie
Zwalczać mszyce na cebuliz siewu w początkowym okresieich migracji (czerwiec).
Usuwać chore rośliny w początkowym okresie pojawu choroby.
Cebulę nasienną i konsumpcyjną z dymki uprawiać w oddaleniu od plantacji siewu.
Fot. 1.Cebula porażona przez wirus
żółtej karłowatości cebuli
Na wysadki przeznaczać cebule pochodzące ze zdrowych plantacji.
Choroby bakteryjne
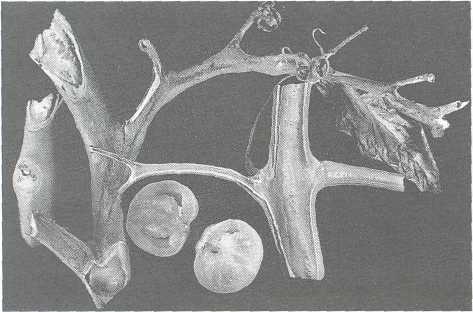
Rak bakteryjny pomidora (Corynebacterium michiganense [Smith] Jensen pv. michiganense Dye et Kemp; syn. Clavibacter michiganensis subsp. michiganensis [Smith] Davis et al)
Głównym objawem jest postępujące od dołu roślin więdnięcie
i zamieranie liści zwykle najpierw po jednej stronie ogonków i łodyg, wzdłuż najsilniej porażonej wiązki przewodzącej. Nad takimi wiązkami tworzą się żółtawe, z czasem brązowiejące smugi, a na ich powierzchni widoczne są miejscami rdzawe rysy — wąskie, lecz głębokie spękania, z których w wilgotnym środowisku wycieka
Fot. 2. Rak bakteryjny — objawy na pędach i owocach
żółty śluz z bakteriami. Zaschnięte liście pozostają na roślinie. Na przekroju silniej porażonych części pędów widoczne są rozległe, żółte lub brązowe przebarwienia wiązek i miejscami wyraźne szczeliny po częściowo zniszczonym miękiszu przylegającym do wiązek. Silnie ściskając jeszcze nie zwiędnięte części porażonych łodyg i ogonków liści uzyskuje się mazisty, żółty śluz i zmacerowaną tkankę oraz powoduje odstawanie miejscami kory, widoczne na świeżych przekrojach. Jest to — poza laboratorium — dobry sprawdzian diagnostyczny. Z porażonych wiązek pędów bakterie dostają się do owoców i zakażają nasiona. Zewnętrzne objawy wtórnych zakażeń na owocach występują sporadycznie, głównie w polu, bardzo rzadko zaś w szklarniach.
Zakażenie następuje przez uszkodzone włoski zawiązków owoców o średnicy do 2 cm oraz przez bakterie ze świeżych wysięków. Na skórce powstają wówczas srebrzystobiałe, najpierw pęcherzykowate, później płaskie plamki około 5 mm średnicy z nieco wzniesionym, brązowym środkiem, zwane ptasim oczkiem. Objawy te są mylone z pospolitą plamistością widmową, powstającą w następstwie nieudanej penetracji skórki owocu przez strzępki rostkowe zarodników grzyba Botrytis cinerea.
Patogenem jest bakteria Clavibacter michiganensis pv. michiganensis z rodziny Corynebacteriaceae w rzędzie Eubacteriales, nieurzęsiona, gramdodatnia pałeczka o zmiennych wymiarach. W Europie, w tym także w Polsce, jest obiektem kwarantanny, czyli podlega obowiązkowi zwalczania.
Infekcji dokonują bakterie znajdujące się w resztkach roślinnych, na powierzchni lub w glebie (do 3 lat), na sprzęcie i na nasionach. Chociaż tylko nieliczne nasiona bywają zakażone wewnętrznie (do 1% zakażeń), mają one dominujące znaczenie
w rozprzestrzenianiu patogena. Bakterie zakażają rośliny przez drobne uszkodzenia, rzadko przez szparki. Szybkiemu rozwojowi choroby sprzyja temperatura ponad 20°C, zwłaszcza gleby (optimum 25-28°C), duża wilgotność i przynajmniej obojętny odczyn podłoża. Na podłożach lekko kwaśnych jej rozwój jest powolny. W kraju występuje lokalnie, zagrażając okresami pomidorowi
i papryce uprawianym pod osłonami, w polu zaś tylko sporadycznie. Główna fala zakażeń występuje podczas produkcji rozsady
i sadzenia, gdy przy przyspieszonej uprawie pomidora jest jeszcze chłodno. W ciepłych okresach sprzyjających chorobie rośliny są już wyrośnięte i rzadko choroba osiąga wyniszczającą fazę. Wtórne ogniska choroby zwykle nie zdążą spowodować znaczących szkód. Przy opóźnionej uprawie szklarniowej, rozpoczynanej latem, może dojść do wczesnego porażenia i zniszczenia części roślin pomidora, nawet przed zawiązaniem owoców.
Zwalczanie
1.0 wykryciu ognisk choroby należy powiadomić najbliższy organ Państwowej Inspekcji Ochrony Roślin i wykonać jego polecenia.
2. Po wystąpieniu ognisk choroby obowiązuje 4-letnia przerwa w uprawie pomidora. Należy odkazić konstrukcje szklarni i sprzęt oraz podłoże zgodnie z Zaleceniami Instytutu Ochrony Roślin.
Nasiona powinny pochodzić wyłącznie ze zdrowych plantacji.
Kanciasta (lub bakteryjna kanciasta) plamistość ogórka (Pseudomonas syringae pv. lachrymans [Smith et Brayan] Young et al.)
Na powierzchni liści pojawiają się drobne przejaśnienia, a od spodu jakby tłuste, lekko przeświecające plamki, na których podczas wilgotnej pogody lub rosy występują kropelki mętnej zawiesiny bakteryjnej. Tkanka w miejscu porażonym szybko zamiera, wysycha i wykrusza się, wskutek czego powstają nieregularne dziurki o średnicy około 5 mm z szarą obwódką
z resztek zaschniętego wysięku na krawędzi pozostałej tkanki.

Nekrotyczne plamki, pokryte wyschniętym śluzem bakteryjnym, powstają także na owocach. Przez spękania wnikają wtórnie grzyby powodujące lokalne gnicie miąższu, sięgające do komór nasiennych. Stanowi to zagrożenie na plantacjach nasiennych.
Choroba występuje zwykle w postaci epifitozy, nasilając się przez okres zbioru, szczególnie podczas wilgotnej i cieplej pogody (optimum 24-27°C) lub obfitych ros. Wczesne wystąpienie epifitozy przed początkiem zbiorów powoduje przedwczesne zniszczenie części liści i osłabienie owocowania. Pod osłonami występuje sporadycznie.
Patogenem jest bakteria Pseudomonas syringae pv. lachrymans z rodziny Pseudomonadaceae w rzędzie Eubacteriales. Jest to krótka pałeczka, gramujemna, monotrichalnie urzęsiona. Bakteria przeżywa 1-2 lata
w resztkach roślinnych na powierzchni gleby i w nasionach.
Pierwsze plamy mogą wystąpić już na liścieniach. Bakterie, znajdujące się
w pierwotnych ogniskach i w wyciekach, są rozpryskiwane przez deszcz lub przenoszone podczas zbioru owoców z mokrych roślin.
Fot. 3. Kanciasta plamistość ogórka spowodowana przez bakterię Pseudomonas syringae pv. lachrymans
Zwalczanie
Stosować zmianowanie przynajmniej z dwuletnią przerwą w uprawie ogórka, dokładnie przyorywać resztki po sprzęcie.
Wskazanym jest wysiewanie nasion dopiero po 2 latach składowania lub starszych.
Opryskiwać rośliny fungicydami zgodnie z Zaleceniami Instytutu Ochrony Roślin, co około 7 dni
w okresie od fazy 3-5 liścia do początku plonowania. Wskazany jest dodatek zwilżacza do cieczy. Dwa pierwsze opryskiwania wykonać profilaktycznie, następne tylko w przypadkach rzeczywistej potrzeby, po stwierdzeniu gniazdowych porażeń.
Uprawiać odmiany odznaczające się tolerancją na tę chorobę.
Czarna zgnilizna kapustnych (Xanthomonas campestris pv. campestris [Pam-mel] Dowson)
Pierwszym objawem chorobowym na roślinach kapustnych i rzepowatych jest żółknięcie brzegów liści. Stopniowo rozszerza się ono i w końcu większa część liścia jest żółta z siatką poczerniałych nerwów. Na przekroju ogonka liściowego, na śladach po oderwanych liściach, jak również na przekroju głąba widać sczerniałe wiązki sitowo-naczyniowe. Z chorych wiązek wydzielają się śluzowate krople bakterii. Choroba może wystąpić we wszystkich fazach rozwoju kapusty i kalafiora. Często pozostaje jakby w stanie utajonym i objawia się dopiero w drugiej połowie okresu wegetacji, powodując zamieranie zewnętrznych liści. Obserwuje się zahamowanie wzrostu główek kapusty i porażenie róż kalafiora. Porażeniu ulegają również nasienniki kapusty. Bakterię mogą dostawać się przez pędy nasienne do łuszczyn i porażać nasiona zewnętrznie lub też wnikać do łupiny nasiennej.
Patogenem jest bakteria Xanthomonas campestris pv. campestris z rodziny Pseudomonadaceae, rzędu Eubacteriales. Jest gramujemna w kształcie pałeczki, z jedną rzęską na biegunie. Zimuje w resztkach pożniwnych lub w nasionach, które są źródłem infekcji. Bakterie zakażają rośliny przez hydatody na liścieniach lub przez uszkodzone korzenie. Przestworami międzykomórkowymi dostają się do naczyń, którymi rozprzestrzeniają się po całej roślinie. Rozpryskujące się krople deszczu przenoszą bakterie z chorych na zdrowe.
Choroba ta może wyrządzić duże straty podczas przechowywania kapusty przeznaczonej na nasienniki.
Zwalczanie
1. Stosować 2-3 letnie zmianowanie w uprawie warzyw kapustnych i rzepowatych.
Nasiona powinny pochodzić ze zdrowych plantacji.
Zaprawiać nasiona przez zanurzenie w wodzie o temp. 45°C na 25-35 minut bądź w temp. 50°C na 15-25 minut.
W Kanadzie opracowano zmodyfikowany sposób odkażania nasion w wodzie podgrzanej do 50°C z dodatkiem antybiotyku aureomycyny w ilości 0,5 g/l wody. Czas trwania zabiegu wynosi 25 minut.
4. Plantacje nasienne opryskiwać co 10-14 dni jednym z preparatów miedziowych.
Fot. Czarna zgnilizna kapustnych (Xanthomonas campestris pv. campestris) — pociemnienie nerwów liścia
Choroby grzybowe
Mączniak rzekomy cebuli (Peronospora destructor [Berk.] Casp.) Pierwszymi objawami na liściach lub pędach kwiatostanowych są jasnozielone lub żółtawe plamy, które stopniowo powiększają się i mogą objąć znaczną część powierzchni porażonego narządu. Wkrótce w środku tych plam pojawia się, powiększający się stale, szarawy, często z odcieniem fioletowym nalot (trzonki i zarodniki konidialne grzyba). W warunkach sprzyjających rozwojowi grzyba nalot ten tworzy się przed wystąpieniem przebarwień chorej tkanki. Zamierającą tkankę zasiedlają wtórnie grzyby saprofityczne z rodzaju Stemphylium i Alternaria tworzące czarny nalot trzonków i zarodników konidialnych.
Patogenem jest grzyb Peronospora destructor należący do rzędu wroślikowców (Peronosporales) w klasie lęgniowców (Oomycetes). Trzonki konidialne wyrastają ze szparek
w pęczkach lub pojedynczo, 4-6-krotnie dichotomicznie rozgałęzione. Zarodniki konidialne są podłużnie jajowate, czasem gruszkowate. Zarodnikowanie odbywa się w nocy przy obfitej rosie, gdy wilgotność powietrza osiąga 98-100%. Zakażenie odbywa się tylko przez szparki, a faza inkubacji trwa kilka dni.

Czasem grzybnia wytwarza w porażonych tkankach oospory, które jednak nie są w naszym kraju źródłem zakażeń w następnych latach. Zimuje grzybnia w mięsistych łuskach nielicznych cebul cebuli zwyczajnej, kartoflanki, szalotki, siedmiolatki i szczypiorku. Częstotliwość zakażenia cebul jest najczęściej na poziomie bardzo niskim, do 0,2% i tylko w latach o przedłużonym okresie wzrostu cebuli z siewu więcej jest zakażonych cebul osiągając
w wyjątkowych okolicznościach 1-10%. Cebule zakażone są podobne do zdrowych. Na wiosnę, po posadzeniu wysadków i cebul na przyśpieszony zbiór, zimująca grzybnia rozrasta się systemicznie razem ze wzrostem liści i pędów kwiatostanowych. Wyrośnięte rośliny, systemicznie porażone, pokrywają się na całej powierzchni trzonkami i zarodnikami, stając się pierwszym źródłem wtórnych zakażeń sąsiednich roślin.

Duże szkody powoduje choroba wówczas, gdy wystąpi wcześnie. Od terminu porażenia plantacji cebuli konsumpcyjnej i nasiennej zależy obniżka plonu cebul i nasion. Silne i wczesne porażenie może zmniejszyć plon poniżej opłacalnego.
Zwalczanie
Na wysadki przeznaczać cebule pochodzące ze zdrowych plantacji cebuli z siewu. Nie sadzić cebul z grubymi szyjkami,
w których większa jest częstotliwość wewnętrznych zakażeń.
W 3-4 tygodnie po posadzeniu cebul przeprowadzać kilkakrotnie lustracje i sukcesywnie usuwać systemicznie porażone rośliny.
Plantacje nasienne i cebuli z dymki opryskiwać od polowy maja do polowy czerwca co 7-10 dni, później według sygnalizacji wszystkie rodzaje upraw cebuli stosując fungicydy zgodnie z Zaleceniami Instytutu Ochrony Roślin. Do 2-3 pierwszych opryskiwań zalecane są preparaty dwuskładnikowe, później jednoskładnikowe o działaniu wyłącznie ochronnym.
W przypadku uprawy cebuli na tym samym polu przez dwa kolejne lata niszczyć wczesną wiosną odrosty po cebulach zimujących w glebie.
Mączniak rzekomy kapustnych (Peronospora parasitica [Pers.] Fr.)
Porażeniu ulegają rośliny we wszystkich fazach wzrostu, lecz w największym, szkodliwym nasileniu podczas produkcji rozsady,
a później w końcu okresu wegetacji. Na liścieniach i liściach powstają żółtoszare plamki, nieregularne w kształcie i wielkości.
W tych miejscach na dolnej stronie wyrastają przez szparki trzonki konidialne z zarodnikami w postaci szczoteczkowatego nalotu o zabarwieniu od białoszarego do stalowoszarego z odcieniem fioletowym. Silnie porażone siewki zamierają lub są znacznie osłabione. Niektóre siewki w fazie liścieni mogą być systematycznie zakażane. Wtedy zarodnikowanie występuje na całej powierzchni liścieni i hypokotylu. Takie siewki szarzeją i zamierają. Starsze rośliny ulegają porażeniu przede wszystkim w okresach deszczowych i podczas jesieni. Na zewnętrznych liściach powstają liczne, nieregularne, prawie czarne plamy, na których pojawia się skąpy nalot (w odróżnieniu od nalotu na roślinach młodych). Jeśli tak porażone liście ulegną infekcji przez inne mikroorganizmy, zwłaszcza grzyby z rodzaju Alternaria, to przedwcześnie zamierają i zasychają. Na różach i zaczątkach pędów kwiatowych kalafiorów powstają strefowe pociemnienia, później wtórne gnicie powodowane przez bakterie. Natomiast na różach brokułów zwykle brak wyraźnych zbrunatnień. Na rzodkiewce porażeniu ulega przede wszystkim nadziemna część korzenia spichrzowego; tworzą się nekrotyczne, rozległe plamy, spękania, czasem miąższ lokalnie brunatnieje lub wykazuje siatkowatą nekrozę.
Patogenem jest grzyb Peronospora parasitka należący do rzędu wroślikowców (Peronosporales)
w klasie lęgniowców (Oomycetes). Na drzewiasto rozgałęzionych trzonkach konidialnych powstają szerokoelipsoidalne zarodniki konidialne. Wewnątrz porażonych tkanek grzyb tworzy zarodniki przetrwalnikowe - oospory. Zimują oospory w resztkach roślin lub grzybnia w roślinach ozimych, np. w liściach rzepaku ozimego.
Infekcji i rozprzestrzenianiu się grzyba sprzyja przede wszystkim wysoką wilgotność na rozsadnikach w tunelach foliowych. Podczas podlewania zarodniki grzyba łatwo się rozprzestrzeniają, a wysoka wilgotność sprzyja ich kiełkowaniu i zakażeniu roślin. Okres infekcji trwa 4-5 godzin, a okres inkubacji 4-5 dni.
Zwalczanie
Dążyć do utrzymywania umiarkowanej wilgotności na rozsadnikach w tunelach foliowych.
Profilaktycznie opryskać rozsadę w fazie 2-3 liści jednym z aktualnie zalecanych preparatów grzybobójczych i jedynie
w przypadkach wykrycia pierwszych ognisk choroby zabieg powtórzyć 1-2 razy co 7-10 dni zgodnie z Zaleceniami Instytutu Ochrony Roślin.
Mączniak rzekomy dyniowatych (Pseudoperonospora cubensis [Berk et Curt.] Rostow.)
W początkowym okresie procesu inkubacji, po pierwszych zakażeniach występują sporadycznie na spodniej stronie liści ciemnozielone, jakby wodniste plamy o kanciastych konturach. Można je dostrzec zwykle rano, po wilgotnej nocy, później zanikają wraz z obniżeniem się wilgotności powietrza. Są to pierwsze objawy, dostrzegalne gołym okiem, świadczące o zakażeniu. Typowe objawy na liściach ogórka to jasnozielone, później żółte plamy o kanciastych konturach, ograniczonych użyłkowaniem blaszki liściowej. Na dolnej stronie wyrastają trzonki konidialne z zarodnikami w postaci szczoteczkowatego nalotu o zabarwieniu oliwkowobrązowym, lecz staje się on ciemnobrunatny w przypadkach intensywnego zarodnikowania. Silnie porażone liście zasychają. Innym objawem, raczej rzadko opisywanym w różnych opracowaniach, a stwarzającym trudności
w poprawnym rozpoznaniu choroby, jest równomierne żółknięcie całej blaszki liściowej z niemal jednolitą, jakby wodnistą powierzchnią na dolnej stronie liści i bardzo skąpym, gołym okiem niedostrzegalnym, zarodnikowaniem. Taki obraz objawów występuje zwykle w okresie przewlekłych opadów deszczu i świadczy o dużym nasileniu choroby.
Patogenem jest grzyb Pseudoperonospora cubensis, należący do rzędu wroślikowców (Peronosporales) w klasie lęgniowców (Oomycetes). Jest pasożytem bezwzględnym, biologicznie niejednolitym. Wyróżnia się 3 rasy o zróżnicowanej patogeniczności w stosunku do poszczególnych grup roślin dyniowatych. Europie występuje rasa o dużej patogeniczności tylko wobec rodzaju Cucumis (ogórek, melon), czym należy tłumaczyć sporadyczne przypadki łagodnych objawów zachorowań 
pozostałych roślin dyniowatych. Istnieje duże prawdopodobieństwo, że grzyb ten nie zimuje w naturalnych warunkach na obszarze Polski i krajów ościennych. Dociera w postaci zarodników niesionych przez wiatr z kierunku południowo-wschodniego, częściowo południowego, w okresie od drugiej połowy czerwca do połowy lipca, zależnie od pogody w poszczególnych latach.
Fot. Mączniak rzekomy dyniowatych — objawy na ogórku
Zarodnikowanie następuje przede wszystkim w godzinach nocnych (typowe dla grzybów z tej grupy) w warunkach wysokiej wilgotności, przy optymalnej temperaturze 15-20°C w ciągu około 6 godzin, zwykle między godziną 10 wieczorem i 4 rano. Na końcach rozgałęzionych trzonków konidialnych tworzą się zarodnie pływkowe, zwane też zarodnikami. W wodzie, na przykład w kroplach rosy, zaledwie po kilkunastu minutach rozpoczyna się proces wydostawania się z nich zarodników pływkowych, które po typowych dla tej grupy grzybów przeobrażeniach, kiełkują i przez szparki oddechowe wrastają do tkanki liści. Ten proces zakażenia następuje na obu stronach liścia, a jego tempo jest najszybsze, w ciągu 2-4 godzin, przy temperaturze w granicach 15-25°C. Zależności procesów zarodnikowania, żywotności zarodników i ich kiełkowania od warunków otoczenia determinują rozwój i.rozprzestrzenianie się choroby. Przyjmuje się, że okresy krytyczne przypadają przede wszystkim w następujących okolicznościach: wysoka wilgotność powietrza przynajmniej w godzinach od 10 wieczorem do 4 rano oraz utrzymujące się zwilżenie liści przez następne 4-6 godzin, przy temperaturze w granicach 15-25°C. Takie warunki zdarzają się przede wszystkim w okresach ciepłej pogody z przelotnymi opadami deszczu o charakterze burzowym. Właśnie wtedy choroba rozwija się gwałtownie. Od poziomu temperatury zależy też długość okresów inkubacji, np.: przy 13CC około 10 dni, przy 15°C — 7 dni, przy 19°C — 4 dni, przy temperaturze optymalnej 22-26°C ten okres może trwać tylko 2 dni. Choroba ta występuje powszechnie w polowej uprawie ogórka, a pod osłonami przede wszystkim w tunelach foliowych. W jesiennym cyklu uprawy ogórka w szklarniach też bywa dużym zagrożeniem. Na świecie, w tym także w naszym kraju, prowadzi się prace nad hodowlą odpornych odmian ogórka i melona. Całkowicie odpornych odmian dotychczas nie uzyskano, lecz coraz więcej jest tolerancyjnych, z ograniczoną wrażliwością.
Do chemicznego zwalczania przydatne są liczne preparaty grzybobójcze o działaniu ochronnym oraz wgłębnym i systemicznym. Coraz powszechniej są stosowane kompozycje fungicydów o zróżnicowanych właściwościach grzybobójczego działania. Notowane są, niestety coraz liczniejsze, przypadki odporności tego grzyba na niektóre fungicydy, obecnie przede wszystkim z grupy fenyloamidów. Stwarza to konieczność rozważnego posługiwania się chemiczną ochroną przed tą chorobą.
Zwalczanie
Uprawiać odporne (tolerancyjne) odmiany.
W polu, a przede wszystkim pod osłonami dążyć do ograniczania okresów zwilżenia liści ponad 4 godziny.
W okresach zagrożenia stosować profilaktyczną ochronę chemiczną zgodnie z Zaleceniami Instytutu Ochrony Roślin. Do pierwszych 2-3 opryskiwań preferowane są preparaty dwu- lub trójskładnikowe. Optymalna częstotliwość kolejnych opryskiwań zależy od kilku czynników, waha się od 7 do 10 dni.
Pod osłonami unikać stosowania preparatów, w których jednym ze składników są fungicydy z grupy fenyloamidów oraz fosetyl glinu. Ograniczona też może być skuteczność dimethomorfu.
Mączniak rzekomy sałaty (Bremia lactucae Regel)
Pierwszymi objawami choroby są białoszare, szczoteczkowate naloty zarodnikującej grzybni na dolnej stronie liści, czasem ograniczone grubszymi żyłkami. W tych miejscach tkanka żółknie w postaci rozległych plam. Silnie porażone liście tracą turgor, stopniowo zasychają podczas słonecznych dni.
Patogenem jest grzyb Bremia lactucae należący do rzędu wroślikoweów (Peronosporales) w klasie lęgniowców (Oomycetes). Jest to gatunek zbiorowy, tworzący liczne formy na różnych gatunkach roślin z rodziny złożonych (Compositae). Forma występująca na sałacie składa się z wielu ras fizjologicznych, przystosowanych do pasożytowania na odmianach sałaty
o różnym genotypie odporności. Drzewiasto rozgałęzione trzonki konidalne, zakończone zarodnikami; wyrastają pojedynczo, częściej po 2-3 ze szparek, zawsze w godzinach nocnych, w ciągu około 6 godzin, przy wilgotności powietrza ponad 95%,
w przedziale temperatur 4-20°C. Zarodniki konidalne kiełkują strzępką rostkową, która bezpośrednio przez kutykulę i epidermę, również przez szparki, wrasta do liści. Kiełkowanie odbywa się w przedziale temperatur 0-21°C. Przy optymalnej temperaturze na poziomie 10°C zakażenie występuje w ciągu 3 godzin. W zależności od temperatury i wrażliwości tkanki po 5-14 dniach następuje nowe zarodnikowanie. W porażonej tkance tworzą się zarodniki przetrwalnikowe, oospory. Obecność sałaty stymuluje ich kiełkowanie w glebie, gdzie czasem dochodzi do zakażenia przez korzenie.
W naszym kraju choroba ta występuje w umiarkowanym nasileniu, zarówno w uprawie pod osłonami jak też w polu, a to dzięki coraz powszechniejszej uprawie odpornych odmian. Czasem ta odporność ulega załamaniu na skutek powstania nowej rasy patogena.
Zwalczanie
1. Przede wszystkim uprawiać odporne odmiany. Jest to w absolutnej większości wystarczającym sposobem.
W przypadkach wystąpienia choroby w warunkach polowych usunąć resztki roślin po zakończonych zbiorach bądź głęboko przyorać i na tym miejscu nie uprawiać sałaty przez 2 lata, natomiast pod osłonami wskazanym jest odkażanie podłoża jednym ze standardowych sposobów.
Minimalizować długość okresów zwilżania roślin, szczególnie dolnych liści, przez odpowiednią technologię sadzenia, podlewania i wietrzenia.
Do chemicznej ochrony brak aktualnie w Polsce preparatów urzędowo dopuszczonych do stosowania, natomiast w niektórych krajach Europy i poza europejskich są polecane między innymi preparaty oparte na: propamokarbie i fosetylu glinu. Niektóre fungicydy ditiokarbaminianowe zalecane są do ochrony tylko młodych roślin w fazie rozety, przed początkiem tworzenia się główek.
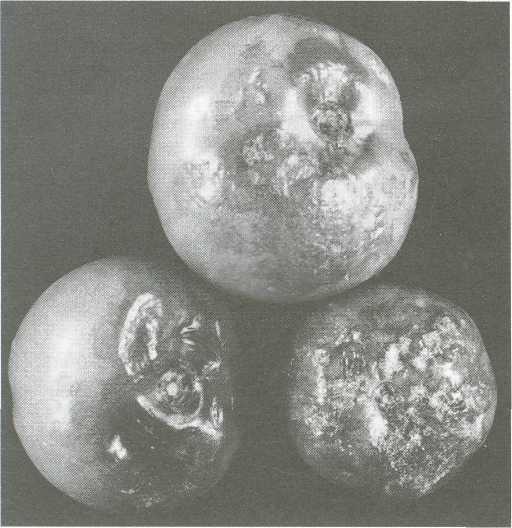
Zaraza ziemniaka na pomidorze (Phytophthora infestanst [Mont] de Bary)
W różnych fazach wzrostu owoców i po zbiorze powstają szarozielone, szybko powiększające się i brunatniejące, twarde plamy o lekko wyboistej powierzchni. Zbrunatnienie sięga w głąb miąższu i stopniowo obejmuje cały owoc, Na liściach, zwykle od brzegów, powstają brązowiejące plamy nekrotyczne. Pojawia się białawy nalot (zarodnikowanie grzyba) na dolnej stronie, zwykle w strefie przejściowej między martwą i żywą tkanką blaszki liściowej. Brązowe plamy nekrotyczne powstają też na ogonkach liściowych i łodygach.
Patogenem jest grzyb z rzędu wroślikowców (Peronosporales) w klasie lęgniowców (Oomycetes). Jego biologię
i epidemiologię opisano w rozdziale o chorobach ziemniaka. Jest to najgroźniejsza choroba pomidora w polu, powodująca co kilka lat duże, a czasem katastrofalne szkody.
Przez bardzo długi czas w większości rejonów uprawy ziemniaka i pomidora na świecie występował tylko jeden typ tego grzyba, charakteryzujący się zdolnością do wyłącznie wegetatywnego rozmnażania. Tylko grzybnia zimująca w bulwach ziemniaka była pierwotnym źródłem infekcji w początkowym okresie sezonu wegetacyjnego. Dopiero z porażonych roślin ziemniaka choroba rozprzestrzeniała się na pomidory. Te czynniki determinowały w Polsce sezonowość zarazy ziemniaka na pomidorach w uprawie polowej i pod osłonami. Dlatego też pierwsze objawy choroby pojawiały się około 10 lipca bądź dopiero w drugiej połowie lata po okresie pogody deszczowej i mglistych nocach.
W ciągu ostatniego 20-lecie obecnego wieku (XX wiek) rozprzestrzenił się na świecie, w tym także w Europie, drugi typ kojarzeniowy tego patogena. Bezpośredni kontakt obu typów w zakażonej tkance prowadzi do procesu płciowego, w wyniku którego powstają oospory o cechach zarodników przetrwalnikowych. Resztki pożniwne zawierające oospory, zarówno ziemniaków jak też pomidorów, mogą być źródłem pierwotnych zakażeń w następnym sezonie wegetacyjnym. W tym należy dopatrywać się jednej z głównych przyczyn, że coraz częściej notowane są przypadki występowania zarazy ziemniaka na pomidorze w wiosennym cyklu uprawy pod osłonami oraz wcześniejszych niż dotąd porażeń w warunkach polowych.
Zwalczanie
Stosować 3-4-letnią przerwę w polowej uprawie pomidora.
Unikać kompostowania resztek pożniwnych z upraw pomidorów pod osłonami bądź kompostować przynajmniej przez 4 lata.
Zakładać plantacje pomidora, jeśli tylko to możliwe, w dużej odległości, zwłaszcza od ziemniaków, uprawianych systemem przyśpieszonym na najwcześniejszy zbiór.
Stosować system uprawy wspomagający przyśpieszone dojrzewanie pomidorów oraz warunki do szybkiego obsychania roślin po deszczu i rosie. Dzięki temu można zmniejszyć sezonową ilość okresów krytycznych, sprzyjających zarodnikowaniu i zakażeniom.W polowej uprawie pomidora stosować zapobiegawczy program chemicznej ochrony, oparty na lokalnym systemie sygnalizacji lub po wystąpieniu choroby na ziemniakach co 10-14 dni,
a w okresach deszczowej pogody nieco częściej. Do opryskiwania używać fungicydów zgodnie
z Zaleceniami Instytutu Ochrony Roślin.
W uprawie pomidora pod osłonami należy dążyć do eliminowania dłuższych, kilku i wielogodzinnych okresów zwilżenia liści, co jest efektywnym sposobem przeciwko zakażeniom. Ponadto w okresach rzeczywistych zagrożeń można z powodzeniem stosować zapobiegawczy system chemicznej ochrony przy pomocy preparatów polecanych w warunkach polowej uprawy, aczkolwiek z wyłączeniem fenyloamidów. Szczególnie w jesiennym cyklu uprawy pod osłonami celowym bywa łączenie chemicznej ochrony przed zarazą ziemniaka z ochroną przed innymi chorobami, przez stosowanie odpowiednich kompozycji różnych preparatów.
Fot. Zaraza ziemniaka (Phytophthora infestans) na pomidorze
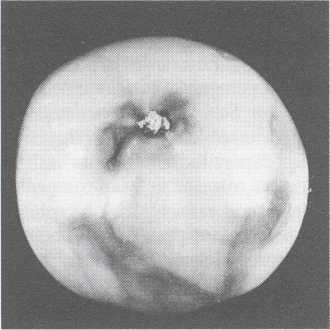
Zgnilizna pierścieniowa pomidora (Phytophthora nicotianae Breda de Haan var. nicotianae Waterh.)
Objawy chorobowe występują w postaci:
a — zgorzeli powschodowej siewek i młodych roślin w fazie rozsady,
b — zgorzelowej zgnilizny łodygi starszych roślin na dolnej części i u podstawy,
c - pierścieniowej zgnilizny owoców.
Cechą charakterystyczną jest nagle załamywanie się łodygi w miejscu porażenia. Na powierzchni porażonej tkanki pojawia się nikły nalot zarodnikującej grzybni, lecz tylko w warunkach wysokiej wilgotności. Zakażenia owoców zdarzają się rzadko, wyłącznie na najniższych gronach oraz owoców, które przypadkowo strącone znalazły się na powierzchni zakażonego podłoża. Tworzą się zbrunatnienia w postaci nieregularnych pierścieni. Na owocach, które leżą, te pierścieniowe zbrunatnienia są bardzo wyraziste od strony kontaktu z podłożem. Mokra zgnilizna wewnętrzna obejmująca całe owoce jest następstwem szybko postępującego procesu chorobowego.
Patogenem jest grzyb Phytophthora nicotianae var. nicotianae należący do rzędu wroślikowców (Peronosporales) w klasie lęgniowców (Oomycetes); w niektórych opracowaniach jest używana nazwa P. parasitica Dastur. Również w polskim nazewnictwie brak jednolitości, bowiem aktualnie są używane dwie nazwy „zaraza pierścieniowa pomidora" i „zgnilizna pierścieniowa pomidora". Nie jest wykluczone, że inne gatunki grzybów glebowych
z rodzaju Phytophthora mogą powodować podobne objawy chorobowe na pomidorach.
Aczkolwiek grzyb ten może być zaliczony do ciepłolubnych (optimum wzrostu grzybni jest na poziomie 25-28°C), to jego patogeniczność w podłożu wobec roślin pomidora jest podobna
w granicach 17-27°C, natomiast przy niższej temperaturze wyraźnie spada.
Fot. Zaraza pierścieniowa pomidora na owocu
W warunkach obniżonej temperatury podłoża proces chorobowy przebiega najczęściej bez wyraźnych objawów zewnętrznych i ogranicza się do zamierania niektórych korzeni. Może to jednak powodować osłabienie wzrostu roślin i obniżenie plonu do 15%. Prawdopodobnie takie stany nie są rzadkie podczas wiosennych cyklów uprawy pomidora pod osłonami. Diametralnie jest inaczej podczas jesiennych cyklów uprawy, w których sadzi się rozsadę w trzeciej dekadzie lipca do rozgrzanego podłoża. W tym okresie występują objawy nagłego zamierania roślin, przede wszystkim w ciągu pierwszych 2-3 tygodni po posadzeniu rozsady, czasem w klęskowym nasileniu.
Głównym źródłem pierwszych zakażeń jest podłoże, w którym grzyb ten może zachować żywotność przez kilka lat w postaci chlamidospor, natomiast grzybnia i zarodnie zamierają w krótkim czasie. Na powierzchni porażonej tkanki, w warunkach wysokiej wilgotności otoczenia, występuje zarodnikowanie w postaci zarodni pływkowych. W kroplach wody wydostają się
z nich zarodniki pływkowe, które powodują wtórne zakażenia w ciągu zaledwie kilku godzin, i po 4-6 dniach pojawiają się nowe objawy choroby.
W polowej uprawie pomidora choroba ta występuje sporadycznie i nie stanowi gospodarczego zagrożenia w polskich warunkach agroekologicznych.
Zwalczanie
1. Rozsadę produkować na podłożu wolnym od patogena, a w przypadkach wątpliwości stosować termiczne lub chemiczne odkażenie jednym ze standardowych sposobów.
2. Zapobiegawczo podlewać rozsadę cieczą grzybobójczą bezpośrednio przed sadzeniem bądź interwencyjnie dopiero po wystąpieniu pierwszych objawów choroby zgodnie z Zaleceniami Instytutu Ochrony Roślin.
Ograniczyć podlewanie przez 2-3 tygodnie po posadzeniu, unikając też rozpryskiwania cząstek podłoża na rośliny
.Na stanowiskach, na których choroba wystąpiła w znacznym nasileniu może być celowe odkażenie podłoża jednym z ogólnie używanych sposobów.
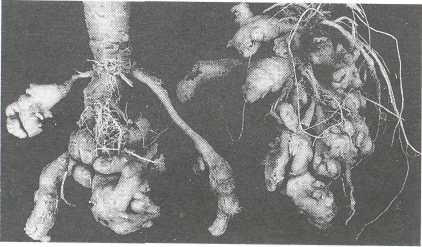
Kila kapusty (Plasmodiophora brassicae Woronin)
Zakażeniu mogą ulec rośliny uprawne i dziko rosnące z rodziny krzyżowych. Najczęściej choroba występuje na kapuście, kalarepie, kalafiorze, rzadziej na rzodkwi, rzodkiewce, brukwi i chrzanie we wszystkich fazach rozwoju. Powstają narośle na korzeniach, początkowo małe, jasnożółte i kruche, później powiększające się i ciemniejące. Często narośle na korzeniu głównym są duże i nieregularne, na korzeniach bocznych mniejsze, wrzecionowate i palczaste. Później pękają i gniją. Silnie porażone rośliny kapusty słabo rosną, więdną, czasem przedwcześnie zamierają. Porażone rośliny nie tworzą główek lub są one małe.
Patogenem jest grzyb Plasmodiophora brassicae z rzędu plazmodioforowców (Plasmodiophorales) w gromadzie śluzorośla pasożytnicze (Plasmodiophoromycota). Grzyb ten rozwija się wewnątrz komórek rośliny żywicielskiej, które wielokrotnie się powiększają. Końcowym etapem jest wytworzenie w komórkach narośli dużej ilości zarodników przetrwalnikowych. Po przetrwaniu w glebie lub w korzeniach okresów niekorzystnych (np. zimy) kiełkują w obecności korzeni roślin żywicielskich. Powstaje ameboidalny, 2-wiciowy, nagi zarodnik pływkowy, który przenika przez mikroszpary w ścianie komórki włośnika, gdzie przekształca się w wielojądrowe plazmodium. Następnie
Fot. Kila kapusty na korzeniach kapusty
przenika swymi wypustkami do sąsiednich komórek. Plazmodium dzieli się na jednojądrowe fragmenty, z których powstają letnie zarodnie pływkowe zawierające 4 lub 8 zarodników pływkowych. Niektóre zarodniki pływkowe wydostające się z zarodników przetrwalnikowych i niektóre powstałe w letnich zarodniach pływkowych zachowują się jak gamety, łączą się po dwa, dając 4-wiciową zygotę.
Z zygoty tej po kariogamii rozwija się diploidalne plazmodium, z którego po mejozie i kilkakrotnych podziałach mitotycznych powstają haploidalne zarodniki przetrwalnikowe szczelnie wypełniające komórki korzenia. Trwałość zarodników przetrwalnikowych zależy w dużym stopniu od pH gleby. W glebie o odczynie obojętnym i zasadowym zarodniki pozostają żywe do 7 lat i dłużej. Natomiast w środowisku kwaśnym kiełkują szybciej i po 3 latach gleba jest od nich wolna, aczkolwiek pod warunkiem, że w tym okresie nie rosły rośliny żywicielskie, na przykład chwasty z rodziny krzyżowych.
Plasmodiophora brassicae jest organizmem biologicznie niejednolitym. Istnieje kilka ras fizjologicznych. Na glebach kwaśnych i podmokłych, zawierających duże ilości zarodników patogena, zniszczeniu mogą ulec wszystkie rośliny.
Zwalczanie
1. Rozsadę produkować wyłącznie na stanowiskach bez kiły. Także plantacje należy lokalizować na polach niezakażonych.
2. Stosować 4-5-letnie zmianowanie w połączeniu z wapnowaniem przed ponowną uprawą roślin kapustnych i rzepowatych.
Niszczyć chwasty z rodziny krzyżowych.
W przypadkach sadzenia rozsady na stanowiskach nie całkiem wolnych od patogenna celowym jest zaprawianie korzeni
w papce gliny z torfem z dodatkiem fungicydu, zastępczo podlewać posadzoną rozsadę wodną zawiesiną fungicydu zgodnie
z Zaleceniami Instytutu Ochrony Roślin.
W miarę możliwości usuwać z pola więdnące egzemplarze oraz głąby z korzeniami po chorych roślinach, lecz przed gnilnym rozkładem narośli.
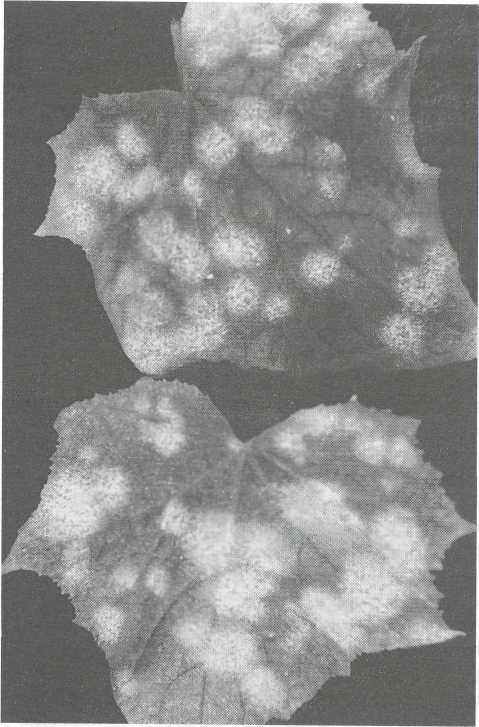
Mączniak prawdziwy dyniowatych (Erysiphe cichoracearum DC. i Sphaerotheca fuliginea [Schlecht] Poll.)
Objawy chorobowe występują na obu stronach liści oraz na ogonkach liściowych i łodygach. Na powierzchni tworzą się lokalnie białe plamy mączystego nalotu, składającego się ze strzępek płożącej się grzybni i trzonków konidialnych z zarodnikami. Silnie porażone liście stopniowo zasychają. Patogenami są dwa grzyby, mianowicie Erysiphe cichoracearum i Sphaerotheca fuliginea, należące do rzędu mączniaków prawdziwych (Erysiphales) w klasie jądrzaków (Pyrenomycetes). Na ogórku i innych roślinach dyniowatych występują w stadium konidialnym i tylko sporadycznie tworzą się kleistotecja z zarodnikami w workach, zwykle w końcu sezonu wegetacyjnego. Zbliżone są cechy morfologiczne i właściwości patogeniczne tych dwóch grzybów, co stanowi duże utrudnienie w poprawnym rozpoznawaniu, który z tych gatunków rzeczywiście występuje bądź przynajmniej dominuje na ogórkach w naszym kraju. Opinie na ten temat są ciągle podzielone. Jedną z subtelnych możliwości rozróżnienia jest różnica w kolorze nalotów w miarę upływu czasu. Przyjmuje się, że w przypadku porażenia przez S. fuliginea naloty grzybni ciemnieją, stąd nazwa mączniak sadzowaty, zaś przy E. cichoracearum pozostają cały czas białe. W przypadku E. cichoracearum zarodniki kiełkują i zakażają rośliny.
Szara pleśń na pomidorze (Botryotinia fuckeliana [de Bary] Whetzel, st. konid. Botrytis cinerea Pers.)
Na pomidorach w uprawie polowej szara pleśń występuje w małym nasileniu z nielicznymi wyjątkami, natomiast pod osłonami może stanowić duże zagrożenie. Dalszy tekst dotyczy tylko upraw pod osłonami.
Szara pleśń na sałacie (Botryotinia fuckeliana de Bary [Whetzel] st. konidialne Botrytis cinerea Pers.)
Młode rośliny więdną. Zwiędnięte liście leżą płasko na ziemi. Porażeniu ulega szyjka korzeniowa i dolna część łodygi, następnie liście. Porażone rośliny odrywają się łatwo od korzeni. U roślin zwijających już główki ulegają porażeniu przede wszystkim liście, które gniją. Powierzchnia porażonych części pokrywa się szarym, pylącym nalotem zarodnikującej grzybni, później tworzą się sklerocja w postaci czarnych grudek o średnicy około 3 mm.
Patogenem jest grzyb Botryotinia fuckeliana należący do rzędu helotkowców (Helotiales) w klasie miseczniaków (Discomycetes). W okresie wegetacji rozprzestrzenia się za pomocą zarodników konidiamych i kawałków grzybni. Zimuje grzybnia w resztkach roślin w glebie oraz skleroeja, z których na wiosnę wyrastają apotecja z workami i zarodnikami workowymi lub powstają trzonki konidialne z zarodnikami. Pospolitym źródłem choroby są też zakażone nasiona.
Rozwojowi choroby sprzyja osłabienie roślin wskutek niedostatku światła, zbyt wysokiej temperatury i wilgotności powietrza. Występuje powszechnie na sałacie uprawianej pod osłonami i w gruncie. Największym zagrożeniem jest na stanowiskach, na których często powtarza się uprawę sałaty lub innych roślin silnie porażonych oraz przy uprawie w nie ogrzewanych tunelach foliowych w jesiennym okresie.
Choroby występujące na różnych roślinach
Zgorzel siewek (Rhizoctonia spp., Pythium spp., Fusarium spp. i wiele innych grzybów).
Objawy na roślinach warzywnych można podzielić na trzy podstawowe grupy:
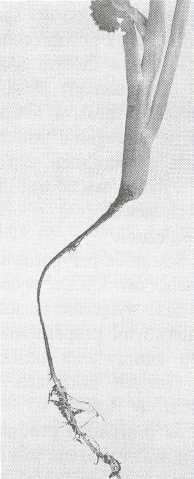
a — zgorzel przedwschodowa, b — zgorzel powschodowa, c — zgorzel rozsad i starszych roślin. Pierwotnymi źródłami są najczęściej: skażona gleba, ziemia kompostowa i inne podłoża oraz zakażone nasiona. Zgorzel przedwschodowa jest następstwem zamierania napęczniałych nasion oraz kiełków, zwykle w warunkach przewlekłego procesu kiełkowania. Powstają mniejsze lub większe puste miejsca. Natomiast zgorzel powschodowa charakteryzuje się przede wszystkim pociemnieniem szyjki korzeniowej i podliścieniowej części łodyżki w strefie kontaktu z powierzchnią gleby bądź innego podłoża. Chore siewki przewężają się w miejscu porażenia, przewracają się i zamierają, czasem uprzednio żółkną i więdną. Na roślinach w fazie rozsady oraz starszych objawy nagłego zamierania nie są powszechne. Najczęściej następuje lokalne porażenie niektórych korzeni oraz zewnętrznej tkanki w strefie szyjki korzeniowej i dolnej części łodygi. Zwykle takie rośliny nadal rosną i tylko niektóre więdną i zamierają z opóźnieniem.
Patogenami są różne gatunki grzybów, które występują pojedynczo lub powodują infekcje mieszane. W większości są to mikroorganizmy polifagiczne, powszechnie bytujące w środowisku glebowym.
Prawdopodobnie najpospolitszym sprawcą zgorzeli powschodowej jest Rhizoctonia solani Kühn, należący do grupy grzybni płonnych (Mycelia sterilia) w podgromadzie grzybów niedoskonałych (Deuteromycotina). Jest to powszechnie występujące stadium strzępkowe grzyba Thanatphorus cucumeris (Frank) Donk z rzędu Tulasnellales w klasie podstawkowych (Basidiomycetes). Opis grzyba — patrz „Choroby ziemniaka".
W warunkach wysokiej wilgotności, na przykład po obfitych deszczach, dominującymi sprawcami zgorzeli siewek stają się grzyby z rodzaju Pythium. W ekologicznych warunkach Europy Środkowej, w tym w Polsce, typowym i zarazem najczęstszym patogenem jest P. ultimum Trow, należący do rzędu wroślikowców (Peronosporales) w klasie lęgniowców. Przyjmuje się ostatnio, że jest synonimem nazwy
P. debaryanum Hesse oraz bardzo zbliżony do P. irregulare Buisman, tworząc wspólną grupę ultimum. Cechami wyróżniającymi tę grupę jest stosunkowo niski poziom optymalnej temperatury 10-15°C oraz kiełkowanie oospor strzępka. Po zimowej przerwie kiełkujące oospory są głównym źródłem ponownego rozprzestrzeniania się grzyba i pierwszych zakażeń.
W warunkach wysokiej wilgotności i przy optymalnej temperaturze wystarczy 1-2 dni do intensywnego rozmnożenia się grzyba, a następnie nasilonego przebiegu choroby. Patogen ten dominuje w okresie kiełkowania nasion, powodując zgorzel przedwschodową oraz podczas wschodów, a na ogórkach także jako typowa zgorzel powschodowa i zgorzel podstawy łodygi starszych roślin w uprawie pod osłonami. Wewnątrz zakażonych tkanek oraz na ich powierzchni rozrasta się grzybnia typu komórczakowego bez poprzecznych przegród. Na grzybni tworzą się zarodnie pływkowe i oospory, stając się źródłem nowych zakażeń. Sezonowo rolę tę spełniają także strzępki grzybni.
Sprawcami zgorzeli siewek są też różne gatunki z rodzaju Fusarium, należące do rzędu moniliowców (Moniliales) w klasie strzępczaków (Hyphomycetes). Dotyczy to przede wszystkim grochu i fasoli. Źródłami pierwotnych infekcji są zakażone nasiona i gleba.
Ponadto rozpoznano dotąd wiele innych grzybów jako sprawców zgorzeli siewek roślin warzywnych. Były to najczęściej różne gatunki z rodzajów Alternaria, Botrytis, Olpidium, Aphanomyces, Chalara syn. Thielaviopsis, Phytophthora.
Warunki środowiska determinują w dużym stopniu poziom szkód powodowanych przez zgorzele. Wilgotność jest czynnikiem najważniejszym. Dlatego też stosuje się różnorakie sposoby utrzymania powierzchni gleby w stanie obniżonej wilgotności przy jednoczesnym zachowaniu zadowalających warunków wodnych do szybkiego kiełkowania nasion i wzrostu siewek.
Ważnym czynnikiem jest też naświetlenie. Intensywne światło działa ograniczająco na wzrost większości sprawców zgorzeli, bowiem podwyższa się temperatura i tempo parowania z powierzchni gleby, a jednocześnie przyśpieszony jest wzrost roślin i skraca się okres, w którym zgorzele są zagrożeniem.
Zagęszczony siew, zlewna i zaskorupiająca się gleba, zachwaszczenie i kilka innych czynników również sprzyja występowaniu chorób zgorzelowych. Wydaje się, że na szczególne podkreślenie zasługuje znaczenie jakości nasion. Nasiona o wysokich parametrach żywotności są w mniejszym stopniu porażane przez patogeny i szybciej wschodzą. Wzrasta szansa uzyskania optymalnego zagęszczenia zdrowych siewek.
Zwalczanie
Starannie przygotować glebę przed siewem celem stworzenia warunków do szybkich wschodów. Unikać wysiewu nasion do gleby zbyt wilgotnej i zimnej.
Siać wyłącznie nasiona o wysokich parametrach żywotności, zaprawione aktualnie zalecanymi preparatami, na optymalną głębokość i w umiarkowanym zagęszczeniu. Do zaprawiania nasion stosować preparaty stanowiące kompozycje fungicydów o różnych zakresach grzybobójczego działania zgodnie z Zaleceniami Instytutu Ochrony Roślin.
3. W przypadku produkcji siewek, następnie rozsady pod osłonami (szklarnie, tunele foliowe) wskazane jest chemiczne odkażanie górnej warstwy gleby jednym z aktualnie zalecanych sposobów bądź zastosowanie świeżego podłoża, w którym można się spodziewać małego zagęszczenia patogenów zgorzelowych. Przy stosowaniu ziemi kompostowej jako podłoża wskazane jest uprzednie odkażenie na pryzmie według aktualnych zaleceń, lecz trzeba pamiętać, że ziemia z dodatkiem preparatów tiuramowych nie nadaje się do uprawy pomidorów.
4. W okresie wschodów bądź po sporadycznym wystąpieniu objawów zgorzeli można zastosować powierzchniowe podlanie siewek jednym z zalecanych do tego celu preparatów. W tym przypadku celowym jest diagnostyczne rozpoznanie sprawców choroby i dopiero na tej podstawie zastosować najodpowiedniejsze preparaty.
5. Podczas pikowania eliminować siewki z objawami chorobowymi w części podliścieniowej i na korzeniach.
Zgnilizna twardzikowa (Sclerotinia sclerotiorum [Lib.] de Bary, syn.. Whetzelinia sclerotiorum [Lib.] Korf et Dumont).
Grzyb ten jest polifagiem. Był notowany na wszystkich roślinach warzywnych, lecz we wzmożonym nasileniu występuje przede wszystkim na fasoli, pomidorze, ogórku i sałacie, a w okresie przechowania na pietruszce i marchwi.
Objawy chorobowe występują na wszystkich organach, lecz najczęściej na łodygach. W miejscach zakażenia pojawiają się szarobrunatne, stopniowo powiększające się plamy z białym, watowatym nalotem grzybni. Wewnątrz i na zewnątrz porażonych organów tworzą się czarne sklerocja o średnicy 2-5 mm. Porażone miejsca szybko gniją, a części rośliny ponad nimi więdną i zamierają. Na fasoli w warunkach polowej uprawy choroba występuje placowo, nieraz w klęskowym nasileniu. Natomiast pomidor i ogórek ulegają porażeniu niemal wyłącznie w uprawie pod osłonami. Patogen atakuje zazwyczaj łodygi w miejscach mechanicznych uszkodzeń po usuniętych liściach i bocznych pędach. Wiąże się to ze zdolnością infekcyjną tego grzyba w obecności substancji odżywczych ze zranionych tkanek bądź zasiedleniem w pierwszej kolejności martwych fragmentów. Na sałacie zgnilizna twardzikowa występuje pospolicie w odkrytym gruncie i pod osłonami, przy często powtarzanej uprawie na tym samym miejscu. Zakażenie następuje w strefie podstawy łodygi. Rośliny więdną i zamierają, a sklerocja tworzą się tym razem obficie.
W okresie przechowania choroba występuje przede wszystkim na warzywach korzeniowych, w największym nasileniu na pietruszce. Rozwija się ogniskowe Do przechowalni lub kopców grzyb dostaje się z ziemią i korzeniami zakażonymi wcześniej. Niesprzątnięte resztki po poprzednim sezonie przechowania stanowią również źródło zakażeń. Korzenie podwiędnięte są po-datniejsze na zakażenie.
Patogenem jest grzyb Sclerotinia sclerotiorum z rzędu helotkowców (Helotiales) w klasie miseczniaków (Discomycetes). Grzyb ten nie ma stadium konidialnego. Wytwarza grzybnię, a wśród niej ciemnoszare do czarnych sklerocja, z których po okresie spoczynku od kilku tygodni do kilku lat wyrastają na nóżce, 2-3 cm wysokiej i 1-2 mm grubej, jasnobrązowoceglaste, miseczkowate owocniki, apotecja, wypełnione workami z zarodnikami. W okresie wegetacji grzyb rozprzestrzenia się za pomocą fragmentów grzybni oraz zarodników workowych. Zimują sklerocja. Także grzybnia w zakażonych nasionach, na przykład fasoli, może stać się źródłem nowych zakażeń w następnym sezonie. Rozwojowi choroby sprzyja duża wilgotność gleby i powietrza.
Grzyb jest polifagiem, z roślin warzywnych najczęściej poraża fasolę, pomidory, ogórki, a w przechowalniach i kopcach - marchew, pietruszkę i buraki.
Objawy na fasoli - żółtobrunatne plamy na częściach nadziemnych rośliny, na których powstaje biały, watowaty nalot grzybni. Wewnątrz porażonych tkanek oraz wśród nalotu powstają czarne sklerocja grzyba.
Objawy na pomidorze - widoczne są na łodydze, która staje się jasnoszara, wiotczeje i pokrywa się białym nalotem. W miejscu porażenia powstają czarne sklerocja patogena. Choroba ta najczęściej występuje pod folią i w szklarniach, na początku dojrzewania .owoców pomidora. Wysoka wilgotność, zagęszczenie roślin oraz wszelkie zranienia sprzyjają rozwojowi choroby.
Objawy na warzywach korzeniowych - na powierzchni korzeni marchwi, pietruszki, selera i buraków tworzy się puszysty nalot, a wśród niego rozwijają się czarna sklerocja grzyba p średnicy 2-5 mm. Tkanki pod nalotem stają się. wodniste, gniją i odznaczają się nieprzyjemnym zapachem. Patogen do przechowalni dostaje się. wraz z zakażonymi korzeniami. Choroba rozwija się ogniskami przy stykaniu się korzeni zdrowych z chorymi.
Grzyb nie ma stadium niedoskonatego (konidialnego), a formą przetrwalnikową są sklerocja, na. których powstają (na nóżkach miseczkowatego kształtu) apotecja. W okresie wegetacji grzyb rozprzestrzenia się za pomocą fragmentów strzępek grzybni lub sklerocjów. Rozwojowi choroby sprzyja duża wilgotność gleby i powietrza.
Zwalczanie
Przynajmniej przez 3 lata nie uprawiać fasoli, sałaty i warzyw korzeniowych na zakażonym polu.
Celowym jest usunięcie resztek z porażonych roślin; spalić lub zakopać. Przeprowadzić głęboką orkę.
Na fasoli, po wykryciu pierwszych ognisk choroby, usunąć chore rośliny i niezwłocznie opryskać całą plantację jednym z fungicydów zgodnie z Zaleceniami Instytutu Ochrony Roślin. W okolicznościach wzmożonego zagrożenia zabieg powtórzyć po10-14 dniach. Zwykle przypada to w okresie kwitnienia fasoli.
Systematycznie kontrolować pomidory i ogórki w uprawie pod osłonami i usuwać chore egzemplarze. Łodygi z objawami lokalnych porażeń w początkowej fazie można leczyć: z powierzchni chorych miejsc usunąć nalot grzybni, zeskrobać górną warstwę porażonej tkanki i zapędzlować jednym z aktualnie zalecanych fungicydów.
Kilka dni po posadzeniu sałaty profilaktycznie opryskać rośliny i całą powierzchnię gleby (podłoża) jednym z preparatów według punktu 3. Zabieg powtórzyć po 10-14 dniach.
Inne zalecenia w rozdziale „Choroby w przechowalniach i kopcach".
Bielik, czyli biała rdza krzyżowych (Albugo candida [Pers. ex Fr.] O. Kuntze)
W polskich warunkach agroekologicznych bielik krzyżowych stanowi czasem tylko na chrzanie zagrożenie o wymiarze gospodarczym.
Na górnej stronie liści powstają jasnozielone, później czerwonawe, nieco wzniesione plamy, często powyżej 1 cm średnicy. Na dolnej stronie w miejscu plam tworzą się białe, błyszczące, pęcherzykowate skupienia zarodników konidialnych. Wzniesienia te, ułożone bezładnie lub kolisto zlewają się tworząc duże, nieregularne, popękane pęcherze. Przy silnym porażeniu plamy pokrywają większą część powierzchni blaszki liściowej, a niemal cała dolna strona jest biała. Tak silne porażenie powoduje zasychanie liści. Czasem zarodnikowanie występuje także na górnej stronie liści. Zdarzają się lokalne porażenia korzeni w górnej części. Powstają zgrubienia, tkanka wewnątrz brunatnieje, tworzą się podłużne spękania oraz wyrasta kępka bocznych korzeni. Po przezimowaniu wyrastają z takich korzeni skarłowaciałe liście systemicznie porażone.
Patogenem jest grzyb Albugo candida z rzędu wroślikowców (Peronosporales) w klasie lęgniowców (Oomycetes). Zarodniki konidialne powstają w łańcuszkach na krótkich trzonkach konidialnych, początkowo przykryte kutykulą. W porażonych tkankach grzyb tworzy zarodniki przetrwalnikowe — oospory. W okresie wegetacji rozprzestrzenia się za pomocą zarodników konidialnych, które w kroplach wody przekształcają się w zarodnie pływkowe. Znane są dwa sposoby zimowania grzyba,
w postaci grzybni w korzeniach oraz zarodników przetrwalnikowych, oospor, w resztkach porażonych liści. Ogniskami choroby
w okresie wiosennym są przede wszystkim rośliny systemicznie zakażone, wyrastające z chorych korzeni. Dokładnie nie wiadomo, w jakim stopniu oospory mogą być pierwotnym źródłem zakażeń w polskich warunkach ekologicznych. Na podstawie badań zagranicznych można sądzić, że mają one znaczenie drugorzędne.
Zwalczanie
Przestrzegać 3-4-letniej przerwy w uprawie chrzanu.
Liście chrzanu usuwać jesienią z plantacji, po wyschnięciu spalić.
Selekcjonować sadzonki odrzucając z objawami zakażenia.
W okresie wiosennym, zanim nastąpi pylenie zarodników, usuwać, następnie niszczyć rośliny chrzanu z objawami systemicznego zakażenia. Czynności te powtarzać kilka razy co 5-7 dni.
Kilkakrotnie opryskiwać plantacje chrzanu jednym z aktualnie zalecanych preparatów grzybobójczych co 7-10 dni w okresach deszczowej pogody.
Rdza grochu (Uromyces pisi /DC/ Otth.
Rdza ta poraża groch w czystym siewie i .w mieszankach. W lecie najpierw na liściach, później na -.łodygach, a niekiedy również na strąkach pojawiają się jasnobrunatne, o średnicy 1,5 mm, pylące, poduszeczkowate skupienia urediniospor. Pojawiają się one zazwyczaj na późnych zasiewach grochu. Jednocześnie lub nieco później obok urediniów występują prawie czarne, także pylące skupienia teliospor. Liście silnio porażone przedwcześnie zamierają i opadają.
Petogen, U r.o m y c e s p i s i, jest gatunkiem dwudornowym, Spermacja i zarodniki ognikowe rozwijają się na pędach wilczomlecza sosnki (Euphorbia cyparissias/ i wilczomlecza lancetowatego (E. esu1a). Na skutek porażenia wilczomlecz wytwarza wydłużone pędy, nie krzewi się i nie wydaje kwiatostanów.
Zimują teliospory, które po kiełkowaniu na wiosnę wykształcają zarodniki podstawkowe. Bazydiospory bardzo wcześnie zakażają pączki na pędach podziemnych wilczomleczu.
Zwalczanie
l. Wczesny i niezbyt gęsty siew grochu.
2. Niszczenie resztek roślinnych po zbiorze.
3. Usuwanie i niszczenie wraz z częściami podziemnymi wilczomlecza występującego w pobliżu plantacji.
Szara pleśń cebuli (Botrytis allii) Munn., (Botrytis byssoidea) Walj., (Botrytis sc|uamosa) Walk,
Jest to powszechnie spotykana choroba przechowalnicza cebuli, W latach wilgotnych pojawia się już na polu pod koniec okresu wegetacji. Na obumierających i leżących na ziemi liściach obserwuje się wówczas szary, pylący nalot. Po złożeniu cebuli do przechowalni choroba ujawnia się najpierw na szyjce, na której pojawiają się brunatne, lekko zagłębione plamy. Porażone tkanki stają się miękkie, wodniste i gniją. Zgnilizna obejmuje całą cebulę. W miarę postępu choroby w okolicy szyjki tworzy się obfity, szary, puszysty nalot, złożony z trzonków konidialnych i elipsoidalnych zarodników konidialnych. Po pewnym czasie na powierzchni cebuli i między łuskami pojawiają się najpierw białawe, potem czerniejące twarde grudki tworzące niekiedy jednolitą, szaroczarną skorupę na porażonych tkankach. Są to formy przetrwalnikowe grzyba - sklerocja. W końcowym stadium choroby cebula całkowicie zasycha. Choroba może również wystąpić na nasiennikach cebuli. Pędy kwiatostanowe i kwiatostany pokrywają, się wówczas szarym, pylącym nalotem. Nasiona mają mniejszą zdolność kiełkowania.
Grzyby będące sprawcami szarej pleśni cebuli zimują w postaci sklerocjów na przechowywanej cebuli. Po wysadzeniu zainfekowanych cebul ze sklerocjów rozwija się grzybnia, która żyje w okresie wegetacyjnym saprofitycznie na obumarłych łuskach cebuli w glebie. Stąd może wnikać do roślin przez uszkodzone korzenie. W odpowiednich warunkach na grzybni tworzą się drzewiasto i krótko rozgałęzione trzonki konidialne z owalnymi, jednokomórkowymi i bezbarwnymi zarodnikami konidialnymi. Konidia są przenoszone przez wiatr i deszcz na rośliny. Z porażonych liści grzyb przerasta do tkanek szyjki i dalej do wnętrza cebuli. Najczęściej jednak infekcja następuje po obcięciu szczypioru. Infekcjom sprzyja wysoka wilgotność powietrza i niedosuszenie cebul po zbiorze. szczególnie podatne na szarą pleśń są rośliny porażone przez mączniak rzekomy cebuli (Peronospora destruktor)
Zwa1czanie
1. Należy unikać stosowania wysokich dawek azotu.
2. Należy przeprowadzać zbiór cebuli w pełni dojrzałej; możliwie podczas suchej pogody. Po wyrwaniu cebulę należy podsuszyć
w polu przez 8-10 dni i dopiero obciąć szczypior. W razie potrzeby i w miarę możliwości cebulę powinno się podsuszać
w suszarni w temperaturze 37-480C, przy dobrym wietrzeniu.
3. Zapewnienie właściwych warunków przechowywania, a więc utrzymywanie w przechowalni temperatury 0-10C i wilgotności ok. 65%.
Chwościk buraka (Cercospora beticola) Sacc.
Choroba występuje powszechnie każdego roku wszędzie tam, gdzie uprawiane są buraki ćwikłowe, pastewne i cukrowe. Jest również spotykana na roślinach z innych rodzin, np. na grochu, lucernie, mniszku, szczawiu, babce.
Objawy chorobowe występują w postaci okrągłych plamek o średnicy 2-4 mm, barwy szarobrunatnej, otoczonych czerwonobrunatną obwódką. Plamki te pojawiają się najczęściej na liściach zewnętrznych okółków od końca czerwca. Przy dużym nasileniu choroby obserwuje się występowanie podobnych., plam również na ogonkach liściowych oraz na pędach nasiennych. Tkanka liścia w obrębie plam wysycha i wykrusza się. W sprzyjających warunkach (obfite opady, rosy i mgły oraz przelotne opady przy cieplej pogodzie) ilość plam bardzo szybko wzrasta, liście żółkną, brunatnieją i zamierają. Zainfekowane rośliny w miarę obumierania liści wytwarzają wciąż nowe ich okółki kosztem materiałów zapasowych zgromadzonych w korzeniu, wskutek czego środkowa część głowy buraka przybiera kształt stożkowaty, a wzrost korzenia ulega zahamowaniu.
Patogenem jest grzyb Cercospora. beticola, który wytwarza na powierzchni porażonych organów pęczki krótkich i brunatnych trzonków konidialnych oraz bezbarwne, wydłużone, wielokomórkowe konidia o wymiarach 12-30x3-5µm.W tkankach porażonych organów mogą tworzyć się ponadto skupienia grzybni o charakterze przetrwalników.
Źródłem infekcji są kłębki nasienne i sadzonki, na których zimują zarodniki konidialne, zachowujące swą żywotność nawet do 8 miesięcy. Również może zimować .grzybnia w obumarłych liściach i innych resztkach roślinnych pozostałych na powierzchni lub w wierzchnich warstwach gleby. Źródłem porażenia bywa także płytko przyorany obornik w przypadku spasania świeżych porażonych liści buraków. Zarodniki konidialne przenoszone są na liście najczęściej przez wiatr. Kiełkują w warunkach dużej wilgotności i w temperaturze 12-37°C.
Przy słabym porażeniu liści straty w plonie buraków są niewielkie, natomiast jeżeli występowanie choroby ma charakter epifitozy, to straty mogą być bardzo znaczne, a plon korzeni buraków cukrowych zmniejsza się o 15-45%. Ponadto porażone korzenie buraków cukrowych i pastewnych gorzej się przechowują.
Zwalczanie
Głębokie przyoranie resztek po zbiorze (grzybnia przyorana na głębokość 20 cm w bardzo krótkim czasie traci swą żywotność).
Liście buraków powinno się skarmiać w postaci kiszonek.
Niszczenie chwastów.
Plantacje buraków z siewu należy zakładać z dala od plantacji nasiennych.
Zaprawianie nasion przed siewem fungicydami
W momencie wystąpienia pierwszych plam plantacje należy opryskiwać fungicydami. Termin wykonania następnych oprysków zależy od przebiegu pogody. W warunkach utrzymującej się wysokiej temperatury i- dużej wilgotności powietrza drugie opryskiwanie powinno się wykonać po upływie ok. 14 dni, a w warunkach mniej sprzyjających rozwojowi choroby - nawet po_ 3 tygodniach od momentu pierwszego zabiegu. Często dwa zabiegi są wystarczające.Zalecane, są takie preparaty, jak:
Alternarioza pomidora (Alternaria porri) /Ell,/ Meerg. f. sp so1ani Ell. et Mart.
Sucha plamistość liści i bulw ziemniaka (Alternaria porri /Ell/. Neerg. f. sp. so1ani Ell. et Mart.
Choroba ta występuje w Polsce powszechnie na roślinach z rodziny psiankowatych, a zwłaszcza na pomidorach i ziemnia kach i często jest przyczyną znacznych strat w planach tych roślin.
Choroba pojawia się najpierw na liściach i rozwija się na nich przez cały okres wegetacji. Pierwsze objawy widoczne są na liściach zainfekowanych roślin zwykle po kwitnieniu, a w warunkach sprzyjających rozwojowi patogena - nawet wcześniej, Na liściach, najpierw dolnych, a później dalszych można zauważyć okrągłe, brązowe plamy o średnicy 0,5-1,0 cm, wyraźnie odcinające się od zdrowych tkanek liścia. Na powierzchni plam występują ułożone koncentrycznie pierścienie, co jest bardzo charakterystycznym objawem schorzenia, pozwalającym odróżnić je od zarazy ziemniaka.
Plamy pokrywa ciemnobrunatny aksamitny nalot: są to. trzonki konidialne i zarodniki konidialne, które mogą występować pojedyńczo lub zlewać się ze sobą. W przypadku silnego porażenia ulistnienie ulega zniszczeniu, co bardzo niekorzystnie odbija się na jakości i wysokości plonu. Porażeniu ulegają również owoce zarówno zielone, jak i dojrzałe. Tworzą się na nich stopniowo powiększające się brunatne lub czarne, zagłębione plamy, wyraźnie odgraniczone od zdrowej tkanki. Porażone tkanki stają się suche i skórzaste, a na ich powierzchni widoczny jest aksamitny, oliwkowo-czarny nalot.
Z liści ziemniaków zarodniki grzyba osypują się i trafiają na bulwy ziemniaczane bezpośrednio lub przez glebę, powodując ich suchą plamistość. Na powierzchni porażonych bulw pojawiają się wgłębione ciemne plamy, różnej wielkości i nieregularnych kształtów, wyraźnie różniące się od otaczających je zdrowych tkanek. Tkanki pod powierzchnią plam również wyraźnie odcinają się od tkanek zdrowych i tworzą zbitą, suchą, twardą i brązowo-czarną masę. Choroba osłabia zdolność kiełkowania sadzeniaków i zmniejsza przydatność bulw do przechowywania, gdyż plamy ułatwiają wnikanie do wnętrza bulwy innych czynników chorobotwórczych.
Patogenem wywołującym opisane zmiany chorobowe jest grzyb Alternaria porri f. sp. so1ani. Patogen na powierzchni plam tworzy ciemne, krótkie i poprzecznie podzielone trzonki konidialne, na których szczypie wykształcają się pojedynczo zarodniki konidialne w formie wydłużenie lub, owalnej -maczugi z wieloma (od 3 do 14) poprzecznymi i podłużnymi przegrodami. Wymiary zarodników są bardzo różne, mieszczą się w granicach 74-230 x 14 - 29µm. W okresie wegetacji grzyb rozprzestrzenia się za pomocą konidiów rozsiewanych przez wiatr. Zimuje w formie grzybni i zarodników w resztkach roślin, na powierzchni nasion pomidora oraz w zainfekowanych bulwach ziemniaków.
Choroba występuje najintensywniej w okresie suchych i gorących miesięcy letnich (optymalna temperatura dla kiełkowania zarodników waha się od 28 do 30°C).
Zwalczanie
Kilkuletnia przerwa w uprawie roślin żywicielskich nadanym polu.
Niszczenie resztek roślinnych po zakończeniu zbiorów.
Zwalczanie chemiczne przez stosowanie takich samych środków jak przy zwalczaniu zarazy ziemniaka. W uprawie pomidorów pierwsze opryskiwanie należy przeprowadzić w inspekcie, przed wysadzeniem rozsady na pola. Wczesne odmiany ziemniaków, które są podatniejsze na chorobę, powinno się zacząć opryskiwać już w połowie czerwca.
Antraknpza fasoli (Colletotrichum lindemuthianum /Sacc. et Magh/. Bri. et Cav.)
Choroba ta występuje we wszystkich krajach, w których uprawia się fasolę. W Polsce jest jedną z groźniejszych chorób tej rośliny, przy czym najsilniej poraża fasolę szparagową.
Pierwsze objawy antraknozy to. brunatnoczerwone, nieco wgłębione plamy na liścieniach. Na porażonej łodyżce siewek tworzą się nieregularne, wydłużone smugi nekrotyczne. Objawom tym towarzyszy gnicie korzeni powodujące zamieranie siewek. Na liściach porażone są głównie nerwy, które brązowieją, a przylegająca do nich tkanka żółknie i stopniowo usycha. Na strąkach tworzą się okrągławe (o średnicy do 1 cm) brunatne, często wgłębione, plamy, o koncentrycznie strefowanej powierzchni. W ich miejscu tkanka strąka przeważnie ulega zniszczeniu i wówczas na nasionach tworzą się brunatne plamy. Porażone nasiona odznaczają się mniejszą zdolnością kiełkowania.
Antraknozę fasoli powoduje grzyb Colletotrichum lindemuthianum. Patogen w obrębie plam wytwarza grzybnię, na której powstają acerwulusy, a z nich brunatne szczecinki i trzonki konidialne z konidiami. Zarodniki konidialne są bezbarwne, jednokomórkowe, cylindryczne, o wymiarach 10,5-23,0 x 3,5-6,5, µm. Konidia tworzące się na liściach wraz z kroplami deszczu lub rosy przedostają się do części podliścieniowej roślin i infekują ją. Z pierwotnych ognisk choroby konidia są przenoszone przez wiatr, deszcz lub owady na zdrowe rośliny. Grzyb zimuje głównie w nasionach oraz w resztkach roślinnych.
Rozwojowi choroby sprzyja duża wilgotność powietrza (deszcze, obfita rosa), zbyt gęsty siew i zachwaszczenie. Temperatura optymalna do kiełkowania zarodników wynosi 20 C.
Choroba atakuje rośliny we wszystkich fazach rozwoju, ale największe szkody wyrządza w okresie wschodów i w czasie zawiązywania strąków. Grzyb wytwarza liczne rasy fizjologiczne o dużej wirulencji. Dotychczas nie udało się wyhodować odmian fasoli całkowicie odpornych na antraknozę.
Zwalczanie
1. Wysiew nasion pochodzących ze zdrowych plantacji.
2. Zaprawianie nasion bezpośrednio przed siewem fungicydami:
Po wzejściu roślin należy opryskać plantację jednym z następujących preparatów: Miedzianem 50, Dithane M-45, Cynkotoxem lub Kaptanem zawiesinowym 50. Następne zabiegi powinno się wykonywać podczas zawiązywania strąków, co 7-10 dni w razie utrzymywania się w tym czasie deszczowej pogody.
3. Pod uprawę fasoli należy przeznaczyć stanowisko przewiewne i nie wolno siać tej rośliny zbyt gęsto.
Septorioza selera (Septoria apii graveo1entis) Dorogin, (Septoria apii) Chester
Jest to bardzo rozpowszechniona choroba selerów i kopru włoskiego. W Polsce powoduje corocznie znaczne straty. Zmiany chorobowe występują na blaszkach i ogonkach liściowych oraz na pędach nasiennych. Na porażonych organach pojawiają się liczne, małe, jasnobrunatne, nekrotyczne plamy, pokryte dużą ilością czarnych punkcików (piknidia grzyba). Plamy ta otoczone są chlorotyczną obwódką stopniowo przechodzącą w zdrową tkankę. Silnie opanowane liście, brunatnieją i zasychają, a nasienniki słabiej owocują.
Septoriozę powodują dwa. Grzyby: Septaria apii graveolentis i Septoria apii. Częściej spotykany jest pierwszy z wymienionych grzybów. Objawy chorobowe wywoływane przez oba gatunki grzybów są podobne, jednak w przypadku porażenia roślin przez S. apii plamy są większe, o brzegach ciemnobrunatnych, bez chlorotycznej obwódki. Grzyby te mają podobny rozwój. Zimują w formie piknidiów na resztkach liści i ogonków liściowych oraz na powierzchni rozłupek. Piknidia są kuliste, czarne, o średnicy od 70 .do 160µm. Zarodniki są wydłużone, nieco zgięte, tępo zakończone, wielokomórkowe. Ich wymiary mieszczą się w granicach 25-60 x l,5-3µm. Grzyby rozwijają się najlepiej przy dużej wilgotności. Zakażenie odbywa się w obecności kropli wody.
Zwalczanie
1. Niszczenie resztek roślin po zbiorze.
2. Odkażanie ziemi inspektowej i skrzyń.
3. Moczenie nasion w Sadoplonie 75 (0,25%) o temperaturze 300C przez 24 godziny lub zaprawianie nasion na sucho Zaprawą nasienną T zawiesinową lub Punabenem T w dawce 3 g/kg nasion.
4. Opryskiwanie plantacji Topsinem M, Dithane M-45 lub Cynkotoxem. Pierwsze dwa zabiegi wykonuje się w inspekcie, a następne od lipca co 7-10 dni.
Sucha zgnilizna kapustnych (Phoma lingam /Tode/ Desm.)
Choroba ta atakuje uprawne i dziko rosnące rośliny z rodziny krzyżowych, a więc kapustę, kalafior, jarmuż, kalarepę, brukiew, rzepę, rzodkiewkę, brokuł, rzepak i in. W Polsce sucha zgnilizna występuje sporadycznie, jednak, jak wynika z danych pochodzących z wielu państw europejskich, straty przez nią powodowane mogą być znaczne i spadek plonów może dochodzić nawet do kilkudziesięciu procent. Choroba notowana jest coraz częściej na uszlachetnionych odmianach rzepaku. Objawy chorobowe zależą od gatunku żywiciela, wieku rośliny, porażonych organów oraz od warunków rozwoju choroby. Na liścieniach, łodyżce i korzonku siewek widoczne są szarozielone plamy z ciemniejszą obwódką. Plamy te stopniowo powiększają się i obejmują znaczną część lub całą powierzchnię porażonych organów, Liścianie szarzeją i więdną, a podliścieniowa część łodyżki zasycha i przewęża się, wskutek czego siewki obumierają. Na obumierających roślinach występują liczne czarne punkty (piknidia). U roślin starszych pierwszym objawem porażenia jest więdnięcie, któremu towarzyszy sine zabarwienie liści. Niekiedy na liściach pojawiają się plamy, w obrębie, których tkanka brunatnieje i zamiera, a na powierzchni widoczne są piknidia w .formie czarnych punkcików. Plamy te otacza chlorotyczna lub brunatnoczerwona obwódka. Na szyjce korzeniowej i korzeniach tworzą się suche, wgłębione, brunatne plamy z czerwoną obwódką. Porażone korzenie stopniowo brunatnieją, zasychają i rozpadają się. Patogen poraża również szypułki kwiatowe i łuszczyny kapusty nasiennej, z których może przedostawać się do nasion.
Sprawcą choroby jest grzyb Phoma lingam, który na powierzchni porażonych tkanek wytwarza kuliste owocniki -piknidia. W okresie wegetacji rozprzestrzenia się za pomocą zaródników konidialnych tworzących się w piknidiach. Konidia roznoszone są przez wiatr, krople deszczu i rosy oraz przez różne owady. Zarodniki są jednokomórkowe, pałeczkowate lub szerokoeliptyczne, bezbarwne, o wymiarach 2,5-6,0 x l-2µm. Grzyb zimuje w formie grzybni, przede wszystkim na nasionach i resztkach porażonych roślin, na których wiosną tworzą się piknidia z zarodnikami konidialnymi.
Zwalczanie
1. Na polu, na którym wystąpiła choroba, nie należy w ciągu 4-5 lat uprawiać roślin żywicielskich.
2. Należy usuwać chore rośliny z plantacji i niszczyć resztki roślin po zakończeniu zbiorów.
3. Chemiczne lub termiczne odkażanie ziemi do produkcji rozsady.
4. Termiczne /naprawianie nasion roślin kapustnych w wodzie o temperaturze 500C przez 30 minut lub chemicznie Zaprawą nasieną T, Benlate lub Topsinem M,
5. Izolacja przestrzenna plantacji kapusty nasiennej od planacji kapusty konsumpcyjnej.
Askochytoza arochu (Ascochyta pisi Lib., A. pinodella Jones, A. pinodes Jones
Choroba notowana na wszystkich odmianach gcochu oraz peluszki. Je) występowanie ma charakter powszechny. Atakuje rośliny przez cały okres wegetacji, a jej nasilenie wzrasta zwłaszcza w latach o obfitych opadach deszczu.
Askochytoza pojawia się na plantacjach już w fazie siewek, u których objawy porażenia przypominają objawy zgorzeli siewek. Zainfekowane rośliny zamierają, a pozostałe przy życiu bardzo słabo się rozwijają. Na liściach, pędach i strąkach z nasionami widoczne są rudawobrąsowe plamy o średnicy 3-9 mm, otoczone ciemnobrunatną obwódką, przy czym plamy na pędach są bardzie] wydłużone, a na strąkach są bardziej wgłębione. Tkanka w obrębie plam pokryta jest czarnymi, drobnymi wzniesieniami, które mogą układać się koncentrycznie. Na nasionach plamy są rozmyte, o barwie jasnożółtej lub ciemniejszej.
Opisane objawy chorobowe powodują A. pisi, A. pinodella i A. pinodes. Tylko w przypadku A. pinodes zostało opisane stadium workowe - Mycosphaerella pinodes (Berk. et Blok) Stone, które w Polsce dotychczas nie zostało stwierdzone.
W Polsce najczęściej występuje Ascochyta pisi. Wszystkie trzy patogeny zimują w postaci grzybni na nasionach oraz w resztkach roślinnych. Na siewkach, które wyrosły z zainfekowanych, nasion, patogen tworzy piknidła z zarodnikami konidialnymi, zakażającymi sąsiednie rośliny, Piknidia są brunatnoczame, a zarodniki konidialne są bezbarwne, cylindryczne, lekko zgięte, o zaokrąglonych obu końcach, dwukomórkowe; u Ascychota pinodella również jednokomórkowe.
Zwalczanie
1. Zdrowy materiał siewny. Nasiona wysiewać możliwie najwcześniej i przestrzegać zalecanej normy wysiewu.
2. Zbiór i niszczenie resztek roślinnych pozostałych na polu po zbiorze.
3. Stosowanie co najmniej 3-letnlej przerwy w uprawie grochu i peluszki na .tym samym polu.
4. Zaprawianie nasion zaprawami tiuramowymi: Zaprawa Funaben T, Zaprawa nasienna T, Zaprawa nasienna. T zawiesinowa lub karbaminowymi, np. Dithane M-45.
5. W momencie wystąpienia pierwszych objawów na liściach należy opryskiwać plantację Cynkotoxem lub Dithane M-45 z dodatkiem zwilżacza. W razie potrzeby zabieg powtarza się co 10-14 dni.
7
Wyszukiwarka
Podobne podstrony:
Szkodniki warzyw (tabele), studia rolnictwo, semestr 6 ( w budowie)
Choroby roślin warzywnych (opis aktualny, studia rolnictwo, semestr 6 ( w budowie)
Zwalczanie chemiczne chorób roślin warzywnych, studia rolnictwo, semestr 6 ( w budowie)
Żywe organizmy przeznaczone do zwalczania szkodników warzyw uprawianych pod osłonami (3), studia rol
Podstawy produkcji roślinnej egzamin, studia rolnictwo, semestr 6 ( w budowie)
Żywe organizmy przeznaczone do zwalczania szkodników warzyw uprawianych pod osłonami (4), studia rol
Choroby zbóż, studia rolnictwo, semestr 6 ( w budowie)
Żywe organizmy przeznaczone do zwalczania szkodników warzyw uprawianych pod osłonami(1), studia roln
Żywe organizmy przeznaczone do zwalczania szkodników warzyw uprawianych pod osłonami (2), studia rol
Świniaki, studia rolnictwo, semestr 6 ( w budowie)
owies, studia rolnictwo, semestr 6 ( w budowie)
Kopia (3) Kolokwium z morfologii i wielożernych, studia rolnictwo, semestr 6 ( w budowie)
Kolokwium z morfologii i wielożernych, studia rolnictwo, semestr 6 ( w budowie)
sadownictwo, studia rolnictwo, semestr 6 ( w budowie)
Kolokwium z morf. i wieloż, studia rolnictwo, semestr 6 ( w budowie)
CHÓW ZWIERZĄT ĆW, studia rolnictwo, semestr 6 ( w budowie)
CHÓW ZWIERZĄT WYK (2), studia rolnictwo, semestr 6 ( w budowie)
SADOWNICTWO WYK, studia rolnictwo, semestr 6 ( w budowie)
więcej podobnych podstron