1. PODAJ REAKCJĘ POMIĘDZY FeSO4 I CH4. JAKIEGO PROCESU W ŚRODOWISKU DOTYCZY TA REAKCJA?
FeSO4 + CH4 = FeCO3 + H2S + H2O
Reakcja ta dotyczy powstawania siarkowodoru w warunkach beztlenowych. W reakcji tej jednocześnie siarczan(VI) żelaza(II), pod działaniem organicznych substancji redukujących, w warunkach beztlenowych, przechodzi w węglan żelaza(II).
2. PODAJ WZÓR I TREŚĆ PRAWA LAMBERTA-BEERA.
Prawo Lamberta-Berra opisuje absorpcję (pochłanianie) promieniowania elektromagnetycznego podczas przechodzenia przez materię. Mówi ono, że warstwy takiego samego roztworu, o jednakowej grubości, w identycznych warunkach, pochłaniają zawsze taką samą część padającego na nie promieniowania. Absorpcja światła zależy również od stężenia substancji absorbującej w roztworze (absorpcja jest proporcjonalna do stężenia substancji pochłaniającej).
It = I0 * 10-εcl
l - grubość warstwy roztworu,
c - stężenie substancji pochłaniającej,
I0 - natężenie promieniowania padającego,
ε - molowy współczynnik absorpcji, niezależny od stężenia, zależny od długości fali światła padającego, rodzaju substancji pochłaniającej światło i temperatury roztworu.
W równaniu tym natężenie światła przechodzącego uzależnione jest od grubości warstwy pochłaniającej, stężenia substancji pochłaniającej oraz od natężenia promieniowania padającego.
3. SCHARAKTERYZUJ KATIONITY I PRZEDSTAW RÓWNANIA OBRAZUJĄCE ICH „PRACĘ”.
Kationity to substancje pochodzenia naturalnego lub wytwarzane sztucznie, nierozpuszczalne w wodzie, zbudowane ze szkieletu, w który wbudowane są kwasowe grupy funkcyjne. Ich szkielety stanowią najczęściej polimery styrenu i diwinylobenzenu (DVB). Grupami funkcyjnymi są grupy kwasowe, tj. RjSO3H (mocne) i RjCOOH (słabe); mogą również występować w formie soli np. sodowej.
Grupy funkcyjne kationitów dysocjują w wodzie i zdolne są do wymiany swoich jonów na jony z otaczającego je roztworu w równoważnych ilościach; po aktywowaniu przyjmują one ładunek dodatni i w związku z tym są zdolne do pochłaniania kationów, np. wymieniacz-H + Me+ → wymieniacz-Me + H+.
Schemat pracy kationitu:
[Kt]H + Na+ = [Kt]Na + H+
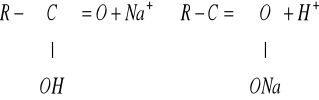
4. DOBIERZ WSPÓŁCZYNNIKI DO RÓWNANIA Al + HNO3 = Al(NO3)3 + NH3 + H2O. WSKAŻ UTLENIACZ I REDUKTOR ORAZ REAKCJE UTLENIANIA I REDUKCJI.
8Al + 27HNO3 = 8Al(NO3)3 + 3NH3 + 9H2O
Al0 - 3e → Al+3 /*8 (reakcja utleniania, Al - reduktor)
N+5 + 8e → N-3 /*3 (reakcja redukcji, N - utleniacz)
8Al0 - 24e → 8Al+3
3N+5 → 3N-3
5. OBLICZ pH 0,001 MOLOWEGO ROZTWORU HCl.
[H+] = 0,001 mol*dm-3 = 10-3 mol*dm-3
pH = -log[H+]
pH = -log10-3 = 3log10 = 3
Odp. pH 0,001 molowego roztworu HCl wynosi 3.
6. OMÓW ZASADĘ DZIAŁANIA TLENOMIERZA (PRZEDSTAW ODPOWIEDNIE RÓWNANIA REAKCJI).
Tlenomierze (sondy tlenowe) są to aparaty do oznaczania rozpuszczonego tlenu w wodzie lub ściekach. Pozwalają one na szybki pomiar zawartości rozpuszczonego tlenu w wodzie w zakresie 0-24 mg/dm3. Podstawą metody jest pomiar prądu dyfuzyjnego, płynącego w wyniku reakcji elektrodowej redukcji tlenu zawartego w wodzie.
Elektroda do pomiaru tlenu składa się z anody i katody, zanurzonych w elektrolicie i oddzielonych od badanej wody półprzepuszczalną (selektywną) membraną. Membrana jest nieprzepuszczalna dla zanieczyszczeń i domieszek zawartych w wodzie, a przepuszczalna dla cząsteczek tlenu.
Stosowane są 2 typy sond do pomiaru tlenu: ogniwo galwaniczne i elektroda redukująca.
* w ogniwie galwanicznym występuje zwykle srebrna katoda i ołowiana anoda. Zachodzą tu następujące reakcje:
- na katodzie: redukowany jest tlen, przechodzący przez membranę
O2 + 2H2O + 4e → 4OH-
- na anodzie: jony metalu przechodzą do roztworu
Pb + 4OH- → PbO22- + 2H2O + 2e
Wielkość natężenia prądu wytwarzanego przez to ogniwo jest wprost proporcjonalna do stężenia tlenu rozpuszczonego w wodzie.
* elektroda redukująca wymaga przyłożenia zewnętrznego napięcia prądu stałego w zakresie 0,6-1,1 V. Jako elektrody stosuje się zwykle platynę i srebro, złoto i srebro lub węgiel i srebro.
7. NAPISZ REAKCJĘ ROZPUSZCZANIA SIARCZKU OŁOWIU(II) Z CO2 I H2O.
PbS + 2CO2 + 2H2O → Pb2+ + 2HCO3- + H2S
8. WYZNACZ WARTOŚĆ STĘŻENIA AZOTU AMONOWEGO, JEŚLI WARTOŚCI EKSTYNKCJI ODCZYTANYCH ZE SPEKTROFOTOMETRU „SPEKOL” WYNOSZĄ ODPOWIEDNIO:
I seria pomiarowa: 0,255; 0,295; 0,262
II seria pomiarowa: 0,270; 0,278; 0,269
Należy przyjąć, że wyniki nie mogą różnić się między sobą o więcej niż 10%.
Zależność E = f(c) wynosi E = 0,75*c
10% z 0,255 = 0,0255
0,255 + 0,0255 = 0,2805 (odrzucamy wartości wyższe od 0,2805, czyli 0,295)
0,255 - 0,0255 = 0,2295 (odrzucamy wartości niższe od 0,2295)
cNH4NO3 = ?
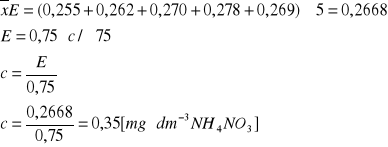
Odp. Stężenie azotu amonowego wyniosło 0,35 mg*dm-3
9. SCHARAKTERYZUJ ANIONITY I PRZEDSTAW RÓWNANIA CHEMICZNE OBRAZUJĄCE ICH „PRACĘ”.
Anionity to substancje pochodzenia naturalnego lub wytworzone sztucznie, nierozpuszczalne w wodzie, zbudowane ze szkieletu, w który wbudowane są zasadowe grupy funkcyjne. Ich szkielety stanowią najczęściej polimery styrenu i diwinylobenzenu (DVB).
Grupami funkcyjnymi są grupy aminowe, np. -NH2 (słabe), -NHR, -NR2 (średnie), bądź czwartorzędowe grupy amoniowe: -[NR3]+ (silne). Anionity mogą występować również w formie chlorków.
Grupy funkcyjne anionitów dysocjują w wodzie i są zdolne do wymiany swoich jonów na jony z otaczającego je roztworu w równoważnych ilościach; po aktywowaniu przyjmują one ładunek ujemny i w związku z tym są zdolne do pochłaniania anionów np. wymieniacz-OH + A- → wymieniacz-A + OH-
Schemat pracy anionitu:
R[An]OH + CO32- = [An]2CO3 + 2OH-
R-OH + NO2- → RNO2 + OH-
10. WYJAŚNIJ POJĘCIE ChZT.
ChZT - chemiczne zapotrzebowanie tlenu. Określa ilość tlenu potrzebną do oksydacji materii organicznej. Określa ilość tlenu równoważną ilości zużytego utleniacza. Określa zawartość w wodzie substancji organicznych utleniających się nadmanganianem potasy KMnO4 i wyrażona jest w mg O2/dm3 badanej wody. Umownie służy ono do określenia substancji organicznych zawartych w wodzie. Oznacza się je kilkoma metodami, m.in. metodą nadmanganianową.
W zależności od zastosowanego środka utleniającego rozróżnia się zapotrzebowanie tlenu nadmanganianowe (ChZT-Mn) i dwuchromianowe (ChZT-Cr).
11. NAPISZ REAKCJĘ HYDROLIZY NH4NO3. PODAJ ODCZYN ROZTWORU TEJ SOLI.
* cząsteczkowo:
NH4NO3 + H2O ↔ NH4OH + HNO3
* jonowo:
NH4+ + NO3- + H2O ↔ NH4OH + H+ + NO3-
* jonowo w sposób skrócony:
NH4+ + H2O ↔ NH4OH + H+
pH roztworu < 7 (odczyn kwaśny)
12. OMÓW BUDOWĘ ZWIĄZKÓW KOMPLEKSOWYCH NA PRZYKŁADZIE DOWOLNIE WYBRANEGO ZWIĄZKU.
Związki kompleksowe (kompleksy, związki koordynacyjne) to związki chemiczne, w których można wyróżnić jeden lub więcej atomów centralnych, otoczonych przez inne atomy lub ich grupy zwane ligandami; przynajmniej jedno wiązanie atomu centralnego z ligandem ma charakter wiązania koordynacyjnego.
K4[Fe(CN)6] - sześciocyjanożelazian(II) potasowy (zwyczajowo żelazocyjanek potasowy) - związek ten zbudowany jest z pierwiastka, stanowiącego centrum koordynacji - żelaza(II) - kompleksowego anionu [Fe(CN)6]- oraz kationu potasu.
- JON/ATOM CENTRALNY - atom lub jon przyłączający (koordynujący) cząsteczki,
- LIGANDY - grupy lub jony związane z jonem (atomem) centralnym,
- LICZBA KOORDYNACYJNA - sumaryczna liczba pełnych pojedynczych wiązań atomu centralnego z atomami ligandów.
13. NAPISZ 2 REAKCJE PRZEDSTAWIAJĄCE UTLENIANIE H2S.
H2S + ½O2 → H2S + S (w środowisku tlenowym)
H2S + 2O2 → H2SO4 (przy udziale bakterii siarkowych)
14. PRZEDSTAW SCHEMAT I OMÓW ZASADĘ DZIAŁANIA „SPEKOLA”.
* Budowa „Spekola”:
- miernik ze skalą liniową i logarytmiczną,
- pokrętło do regulacji położenia wskazówki miernika (położenie „0” i „100”),
- pokrętło do nastawiania długości fali,
- przełącznik przesłony fotoogniwa,
- źródło światła,
- soczewki,
- zwierciadło,
- przesłona,
- siatka dyfrakcyjna,
- szczelina wyjściowa z przesłoną,
- kuweta,
- fotoogniwo z szybką ochronną,
- wzmacniacz prądu z fotoogniwa.
* Zasada działania „Spekola”:
Źródłem światła jest żarówka wolframowa lub lampa rtęciowa. Żarówka umieszczona jest w specjalnej obudowie z tyłu przyrządu i jej położenie reguluje się za pomocą trzech pokręteł. W ten sposób włókno można ustawić dokładnie w ognisku układu optycznego.
Strumień światła, po przejściu przez układ soczewek, pada na siatkę dyfrakcyjną o zmiennym położeniu. Gałka regulacyjna umożliwia zmianę położenia siatki. W ten sposób na wyjściu z układu optycznego można otrzymywać w sposób ciągły wiązkę światła o szerokości 12 nm. Długość fali można regulować w zakresie 360-750 nm.
Światło, po rozszczepieniu na siatce dyfrakcyjnej, kierowane jest na szczelinę wyjściową przyrządu. Przed szczeliną umieszczona jest obudowa, w której znajdują się kuwety (o grubości 1,2,5 lub 10 mm) i fotoogniwo selenowe. Prąd powstający w fotoogniwie wzmacniany jest we wzmacniaczu tranzystorowym i powoduje wychylenie wskazówki miernika, który zaopatrzony jest w skalę liniową i logarytmiczną. Wskazówkę miernika można ustawić w położeniu „0” lub „100”.
„Spekol” przeznaczony jest w pierwszym rzędzie do pomiarów rutynowych (seryjnych).
15. OBLICZ ZAWARTOŚĆ NaOH W 1 dm3 ROZTWORU, JEŚLI NA MIARECZKOWANIE PRÓBKI ZAWIERAJĄCEJ NaOH O POJEMNOŚCI 10 cm3 ZUŻYTO ŚREDNIO 5,45 cm3 ROZTWORU HCl O STĘŻENIU 0,15 mol/dm3.
VHCl = 5,45 ml
CHCl = 0,15 mol*dm-3
VNaOH = 10 ml
CNaOH = ?
![]()
(w 10 ml)
NaOH + HCl → NaCl + H2O
1 mol NaOH przereagował z 1 molem HCl
M NaOH = 40 g
1 mol - 40 g NaOH
0,08 mol - x g NaOH
x = 40 * 0,08 = 3,2 g NaOH (w 1 dm3)
Odp. W 1 dm3 zawartość NaOH wyniosła 3,2 g.
16. WYJAŚNIJ POJĘCIE INDEKSU NADMANGANIANOWEGO.
Indeks nadmanganianowy (IMn) - stężenie masowe tlenu, równoważne ilości jonu nadmanganianowego zużywanego podczas reakcji próbki wody z tym utleniaczem, w określonych warunkach.
![]()
[mg O2/l]
V0 - objętość roztworu KMnO4 zużyta w ślepej próbie [ml],
V1 - objętość roztworu KMnO4 zużyta do miareczkowania badanej próbki [ml],
V2 - objętość roztworu KMnO4 zużyta do miareczkowania przy mianowaniu roztworu [ml],
f - współczynnik przeliczeniowy na tlen.
17. OMÓW NA PODSTAWIE BUFORU OCTANOWEGO KIERUNEK I WIELKOŚĆ ZMIAN pH PO DODANIU DO BUFORU:
a) ROZTWORU WODOROTLENKU,
b) ROZTWORU KWASU.
Bufor octanowy (CH3COOH + CH3COONa) zawiera 0,5 mola CH3COOH i 0,5 mola CH3COONa w 1 dm3.
Stała dysocjacji kwasu octowego KK = 1,700 * 10-5. Stężenie jonów wodorowych w roztworze jest równe KK octowego:
![]()
Wynika z tego, że pH = -log[H+] = -log1,700 * 10-5 = 4,76955.
a) 1 cm3 NaOH o stężeniu 1 mol/dm3:
Dodając 1 cm3 NaOH o stężeniu 1 mol/dm3 wprowadzamy 0,001 mola jonów wodorotlenowych, które reagują z kwasem według reakcji:
CH3COOH + OH- = CH3COO- + H2O
Spowoduje to nieznaczne zmniejszenie stężenia kwasu i nieznaczne zwiększenie stężenia soli. Stężenie jonów wodorowych w buforze osiągnie:
![]()
a pH = 4,77129. Dodanie zatem 1 cm3 NaOH o stężeniu 1 mol/dm3 spowoduje, iż pH mieszaniny buforowej zwiększy się o 0,00174 (≈ 0,002):
ΔpH = 4,77129 - 4,76955 = 0,00174 (≈ 0,002)
b) 1 cm3 HCl o stężeniu 1 mol/dm3:
Dodając do buforu 1 cm3 HCl o stężeniu 1 mol/dm3 wprowadzamy 0,001 mola jonów wodorowych, które zostają związane w bardzo słabo zdysocjowany kwas octowy:
CH3COO- + H+ = CH3COOH
Stężenie jonów wodorowych w buforze osiągnie wartość:
![]()
a pH = 4,76781. Z powyższego wynika, że po dodaniu 1 cm3 HCl o stężeniu 1 mol/dm3 pH mieszaniny buforowej zmniejszy się o 0,00174 (≈ 0,002):
ΔpH = 4,76955 - 4,76781 = 0,00174 (≈ 0,002)
18. PRZEDSTAW METODĘ WYKRYWANIA JONÓW CHLORKOWYCH W WODZIE. PODAJ ODPOWIEDNIE RÓWNANIA REAKCJI.
Przy pomocy wody destylowanej oraz NaCl sporządzamy roztwór standardowy o stężeniu 0,05 mol/dm3 NaCl i 3 pozostałe roztwory NaCl z roztworu standardowego o stężeniach: 0,01; 0,005 i 0,002 mol/dm3.
Do czterech probówek wlewamy po 1 cm3 każdego z roztworów NaCl, a do trzech następnych - po 1 cm3 badanych wód.
Do każdej probówki dodajemy kilka kropel AgNO3. Zachodzi reakcja:
Ag+ + Cl- = ↓AgCl
W probówce I (z roztworem standardowym - 0,05 M) powstaje obfity osad, w II (0,01 M) - mniej osadu, w III (0,005 M) nastąpi zmętnienie, a w IV (0,002 M) - brak osadu.
Porównujemy ilość osadu wtrąconego w probówkach V, VI i VII (z badanymi wodami) z przygotowanymi wzorcami i „określamy” stężenie jonów chlorkowych w badanych wodach.
19. NAPISZ REAKCJĘ PRZEDSTAWIAJĄCĄ KOROZJĘ ŻELAZA ZE WZGLĘDU NA OBECNOŚĆ H2S W ŚRODOWISKU WODNYM.
4Fe + SO42- + 2CO2 + 4H2O = FeS + 3Fe(OH)2 + 2HCO3-
lub
4Fe + CaSO4 + 4H2O + 2CO2 = FeS + 3Fe(OH)2 + Ca(HCO3)2
Siarkowodór powoduje rozwój bakterii siarkowych, które redukują siarczany i są przyczyną korozji żelaza.
20. WYJAŚNIJ RÓŻNICĘ MIĘDZY POJĘCIAMI EKSTYNKCJI I TRANSMITANCJI.
* EKSTYNKCJA (wartość absorpcji, gęstość optyczna) (A) - jest to osłabienie natężenia promieniowania w wyniku rozpraszania i pochłaniania w ośrodku, przez który przechodzi promieniowanie. Ekstynkcja jest miarą nieprzezroczystości ośrodka.
![]()
ε - molowy współczynnik absorpcji,
c - stężenie substancji pochłaniającej w badanym roztworze,
l - grubość warstwy roztworu,
T - transmitancja (przepuszczalność roztworu).
* TRANSMITANCJA (przepuszczalność roztworu) (T) - to wielkość określająca ilość promieniowania pochłoniętego (zaabsorbowanego) przez daną próbkę. Wyraża stosunek natężenia promieniowania przechodzącego do natężenia promieniowania padającego.
Termin ten określa również całkowite wzmocnienie układu ze sprzężeniem zwrotnym (elektronika i automatyka).
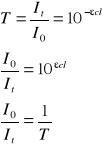
ε - molowy współczynnik absorpcji,
It - natężenie promieniowania transmitowanego przez próbkę, czyli wychodzącego z niej,
I0 - natężenie promieniowania padającego na próbkę.
21. OMÓW BUDOWĘ I PODZIAŁ JONITÓW.
* Podział jonitów:
a) ze względu na pochodzenie:
- organiczne,
- nieorganiczne.
- naturalne (np. zeolity, montmorylonity, glaukonity, celuloza, węgiel aktywowany),
- półsyntetyczne,
- syntetyczne (np. silkażele, żele krzemionkowo-aluminoksanowe).
b) ze względu na charakter grup funkcyjnych:
- kationity - grupy funkcyjne kwasowe (np. RjSO3H, RjCOOH),
- anionity - grupy funkcyjne zasadowe (np. -NH2, -NHR, -NR3, -[NR3]+),
- jonity amfoteryczne - posiadające zdolność pochłaniania zarówno anionów jak i kationów.
c) ze względu na aktywność grup funkcyjnych:
- mocne (np. RjSO3H),
- średnie (np. NHR, -NR2),
- słabe (np. -NH2).
* Budowa jonitów:
Jonity to substancje pochodzenia naturalnego lub wytwarzane sztucznie, nierozpuszczalne w wodzie, mające zdolność wymiany jonów z roztworu na jony związane z masą jonitu. Jonity to zwykle żele lub substancje porowate, które posiadają zdolność selektywnego uwalniania jednych jonów i pochłaniania innych. Ich makrocząsteczki mają postać przestrzennego szkieletu, w który wbudowane są grupy funkcyjne, dysocjujące w wodzie i zdolne do wymiany swoich jonów na jony z otaczającego je roztworu w równoważnych ilościach.
Aktualnie używa się jonitów syntetycznych. Ich szkielety stanowią najczęściej polimery styrenu i diwinylobenzenu (DVB) - czynnika sieciującego.
Jonity zbudowane są z wielkocząsteczkowej matrycy i grupy jonoczynnej (kationity - grupy kwasowe, anionity - grupy zasadowe). Mogą one występować również w formie soli, np. sodowej (kationity) lub chlorków (anionity).
* Zastosowanie jonitów:
Jonity wykorzystywane są w instalacjach do uzdatniania wody w celu zmiękczania i demineralizacji wody (czyli całkowitego usunięcia z niej rozpuszczonych soli mineralnych i gazów).
Jonity są szeroko stosowane w laboratoriach i w przemyśle do zmiękczania i demineralizacji wody dla energetyki, wydzielania i rozdzielania jonów cennych metali w metalurgii, wydzielania uranu i pochłaniania pierwiastków promieniotwórczych, katalizowania procesów chemicznych, odbarwiania i oczyszczania soków w cukrownictwie oraz przemyśle spożywczym, wydzielania antybiotyków i rozdzielania aminokwasów w przemyśle farmaceutycznym, stanowią podstawę jednej z chromatograficznych technik analitycznych (chromatografia jonowymienna).
22. OMÓW PODSTAWY TEORETYCZNE MANGANOMETRII.
Manganometria to jedna z redoksymetrycznych metod ilościowej analizy miareczkowej (metoda oksydymetryczna), obejmująca oznaczenia wykonywane za pomocą mianowanego roztworu manganianu(VII), najczęściej potasu (KMnO4), który jest jednym z najsilniejszych utleniaczy stosowanych w metodach oksydymetrycznych.
Płynem miareczkującym w manganometrii jest roztwór manganianu(VII) potasu KMnO4, który ma właściwości utleniające i dlatego substancjami oznaczanymi są reduktory.
Roztwory zawierające MnO4- mają barwę czerwonofioletową, a roztwory z jonami Mn2+ - lekko różową. Jeżeli do roztworu oznaczanego reduktora dodajemy roztwór zawierający jony MnO4- w środowisku kwaśnym, to dopóki obecny jest reduktor, następuje ich redukcja do Mn2+. Gdy cała ilość reduktora zostanie utleniona, wówczas roztwór zabarwia się na lekko różowy kolor. Dlatego w manganometrii wskaźnikiem jest płyn miareczkujący (KMnO4).
Utleniające działanie manganu(VII) potasu uzależnione jest od stężenia jonów wodorowych w roztworze.
W środowisku kwaśnym jony MnO4- redukują się do Mn2+:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
W roztworze lekko zasadowym lub obojętnym jony MnO4- redukują się do Mn4+:
MnO4- + 2H2O + 3e = MnO2 + 4OH-
W roztworze silnie zasadowym reakcja przebiega według równania:
MnO4- + e = MnO42-
Wszystkie oznaczenia metodą manganometryczną prowadzi się w środowisku kwaśnym.
Substancją podstawową, za pomocą której ustalamy stężenie roztworu KMnO4 jest kwas szczawiowy.
Można także stosować tlenek arsenu(III) As2O3, lecz ze względu na swoje trujące właściwości bywa on rzadko stosowany.
23. CO TO JEST STOPIEŃ DYSOCJACJI ELEKTROLITYCZNEJ? WYMIEŃ MOCNE ELEKTROLITY.
* Stopień dysocjacji elektrolitycznej to stosunek liczby cząsteczek zdysocjowanych na jony do ogólnej liczby cząsteczek wprowadzonych do roztworu. Wartość stopnia dysocjacji (α) wyraża się ułamkiem dziesiętnym lub w procentach:
![]()
lub ![]()
n1 - liczba cząsteczek zdysocjowanych na jony,
n0 - liczba cząsteczek wprowadzonych do roztworu.
Wielkość stopnia dysocjacji elektrolitycznej jest podstawą praktycznego podziału elektrolitów na elektrolity mocne i słabe.
* Do silnych elektrolitów zaliczamy:
- sole (z nielicznymi wyjątkami, np. SnCl4, HgCl2, Hg(CN)2): NaCl, K2SO4, (NH4)2CO3, FeCl3,
- mocne kwasy: HCl(aq), HBr(aq), H2SO4, HNO3, HClO4,
- mocne zasady: wodorotlenki litowców i berylowców (z wyjątkiem Be(OH)2 i Mg(OH)2), tj. KOH, NaOH.
24. OBLICZ WARTOŚĆ STĘŻENIA TLENU W WODZIE, JEŚLI POMIARU DOKONANO W TERENIE, W TEMPERATURZE 8oC I WYNOSI ONA 10,5 mg/dm3 (ROZPUSZCZALNOŚĆ: 12,5 mg/dm3), A PRZYRZĄD KALIBROWANO W LABORATORIUM W TEMPERATURZE 20oC (ROZPUSZCZALNOŚĆ: 7,8 mg/dm3).
wartość prawdziwa = wartość odczytaną w temperaturze, w której dokonano pomiaru * rozpuszczalność w temperaturze pomiaru (ρ(O)m)/rozpuszczalność w temperaturze kalibracji (ρ(O)c):
10,5 * (12,5/7,8) = 10,5 * 1,6 = 16,8 mg/dm3
Odp. Stężenie tlenu w wodzie wyniosło 16,8 mg/dm3.
25. NAPISZ REAKCJĘ POWSTAWANIA Fe(OH)3 Z FeSO4.
I. FeSO4 + H2O = 2Fe(OH)2 + H2SO4
II. 2Fe(OH)2 + ½O2 + H2O = 2Fe(OH)3
sumarycznie:
2FeSO4 + 2Ca(HCO3)2 + ½O2 + H2O = 2Fe(OH)3 + 2CaSO4 + 4CO2
26. OBLICZ, JAKĄ OBJĘTOŚĆ WODY DESTYLOWANEJ I 0,5 M ROZTWORU NaCl NALEŻY UŻYĆ, ABY OTRZYMAĆ 0,5 dm3 ROZTWORU 0,35 M.
V = 0,5 dm3 = 500 cm3
C1 - stężenie wody
C2 - stężenie NaCl
m1 - masa wody [dm3]
m2 - masa NaCl [dm3]
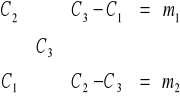

0,5/(0,35+0,15) = 0,5/0,5 = 1
m1 = 0,35 * 1 = 0,35 dm3 wody
m2 = 0,15 * 1 = 0,15 dm3 NaCl
Odp. Należy użyć 0,35 dm3 wody destylowanej (= 350 cm3) i 0,15 dm3 NaCl (= 150 cm3).
27. OMÓW PODSTAWY TEORETYCZNE ALKACYMETRII.
Alkacymetria jest to dział analizy miareczkowej, obejmujący alkalimetrię i acydymetrię, opierający się na reakcjach kwas-zasada.
W alkacymetrii reakcjami służącymi do oznaczenia stężenia badanej substancji są reakcje zobojętniania. Wskaźnikami stosowanymi w tej metodzie są roztwory związków organicznych, które zmieniają barwę w zależności od stężenia jonów wodorowych. Do najczęściej stosowanych wskaźników należą: metylooranż, fenoloftaleina, czerwień metylowa, lakmus i błękit bromotymolowy.
Zmiana barwy wskaźnika następuje przy różnych wartościach pH.
28. PRZEDSTAW KRZYWĄ MIARECZKOWANIA JONÓW Fe2+ ZA POMOCĄ JONÓW MnO42-.
29. OMÓW RODZAJE ELEKTROD STOSOWANYCH W PEHAMETRACH.
Pehametry (potencjometry) stosuje się do pomiaru pH (odczynu) wody i ścieków.
Rodzaje elektrod:
* elektroda kalomelowa - używana jako elektroda odniesienia; ma ona stały potencjał. Elektrodę stanowi drut platynowy, będący w kontakcie z rtęcią metaliczną pokrytą warstwą chlorku rtęci(I) Hg2Cl2 (kalomelu), zanurzoną w nasyconym roztworze chlorku potasu,
* elektroda szklana - używana jako elektroda pomiarowa (wskaźnikowa); w celu ustalenia pH badanego roztworu wykorzystuje się zależność jej potencjału od stężenia jonów wodorowych w roztworze, w jakim elektroda się znajduje. Można ją stosować do oznaczenia pH w szerokim zakresie, nie zanieczyszcza badanego roztworu, nie jest wrażliwa na obecność substancji utleniających i redukujących oraz zawiesin, jest ona czuła natomiast na jony wodorowe. Elektroda szklana daje pewne błędy w przypadku znacznych stężeń jonów sodu i potasu (przy pH>11) i w obecności dużej ilości fluorków w roztworach. Stosowane są wtedy elektrody szklane wykonane ze specjalnego szkła,
* elektroda antymonowa - stosuje się ją w specjalnych przypadkach, np. w niskiej temperaturze lub gdy elektroda szklana może być łatwo uszkodzona; jest ona łatwa do przygotowania, ma małą oporność, jest odporna na uszkodzenia, wykazuje jednak mniejszą dokładność i powtarzalność niż elektroda szklana. Elektrodę stanowi drut antymonowy w rurce szklanej, pokryty warstwą tlenku antymonu(III).
30. PRZEDSTAW METODĘ WYKRYWANIA JONÓW ŻELAZA(III) W WODZIE. PODAJ ODPOWIEDNIE RÓWNANIE REAKCJI.
Przy pomocy wody destylowanej oraz FeCl3 sporządzamy roztwór standardowy o stężeniu 0,05 mol/dm3 FeCl3 i 4 pozostałe roztwory FeCl3 z roztworu standardowego o stężeniach: 0,01; 0,005; 0,001 i 0,0002 mol/dm3.
Do pięciu probówek wlewamy po 1 cm3 każdego z roztworów FeCl3, a do trzech następnych - po 1 cm3 badanych wód.
Do każdej probówki dodajemy po jednej kropli roztworu tjocyjanianu amonu. Zachodzi reakcja:
[Fe(H2O)6]3+ + 6SCN- = [Fe(SCN)6]3- + 6H2O
W probówce I (0,05 M), II (0,01 M) i III (0,005 M) następuje zmiana barwy z żółtej na czerwoną. W probówce IV (0,001 M) pojawia się barwa różowa, a w probówce V (0,0002 M) - brak zabarwienia.
Porównujemy zabarwienia w probówkach VI, VII i VIII (z badanymi wodami) z przygotowanymi wzorcami i „określamy” stężenie jonów żelaza(III) w badanych wodach.
31. NAPISZ REAKCJĘ POWSTAWANIA Fe(OH)3 Z Fe(HCO3)2.
I. 2Fe(HCO3)2 = 2Fe(OH)2 + 4CO2
II. 2Fe(OH)2 + ½O2 + H2O = 2Fe(OH)3
sumarycznie:
2Fe(HCO3)2 + ½O2 + H2O = 2Fe(OH)3 + 4CO2
32. OMÓW PODSTAWY TEORETYCZNE ANALIZY KOLORYMETRYCZNEJ.
Kolorymetria to metoda analizy miareczkowej, której celem jest wyznaczenie stężenia danej substancji w roztworze na podstawie pomiaru natężenia barwy jej roztworu. Analizę kolorymetryczną wykonuje się metodą wizualną (porównanie barwy badanego roztworu z barwami roztworów wzorcowych) lub za pomocą kolorymetru. Jeśli oznaczany składnik nie ma własnego zabarwienia, to przeprowadza się go w związek silnie zabarwiający roztwór.
Analiza kolorymetryczna wykorzystuje zjawisko absorpcji (pochłaniania) światła przez roztwory do ilościowego oznaczania substancji barwnych lub barwiących się w wyniku reakcji oznaczanego składnika z odpowiednim odczynnikiem.
Jeżeli światło pochłaniane odpowiada długości fali 400-760 nm, to roztwór pochłaniający je jest barwny. Intensywność zabarwienia zależny od stężenia roztworu i jest wykorzystywane do oznaczania ilości substancji rozpuszczonej w badanym roztworze.
Podczas badania pochłaniania światła przez roztwór umieszcza się go w kuwecie (przezroczystym naczyńku o przekroju prostokątnym i równoległych do siebie ściankach). Na jedną ze ścianek kuwety pada światło o natężeniu I0, które zostaje częściowo odbite od powierzchni kuwety (Ir), częściowo zaabsorbowane ( przez substancję rozpuszczoną w roztworze znajdującym się w kuwecie (Ia), a pozostała jego część przechodzi przez kuwetę z roztworem (It):
I0 = Ir + Ia + It
33. WYJAŚNIJ POJĘCIE I METODĘ WYZNACZANIA POJEMNOŚCI WYMIENNEJ JONITU.
* POJEMNOŚĆ WYMIENNA JONITU (zdolność wymienna jonitu) - jest to liczba miligramorównoważników (mgR, val lub mval) jonów, które mogą być wymienione przez jednostkę masy (g) lub objętości jonitu (dm3) (liczba moli jonów, które może zaabsorbować w jednostce masy jonitu). Rozróżnia się całkowitą i roboczą zdolność wymienną jonitów.
Zdolność wymienna całkowita jest stała dla danego jonitu. Określa łączną liczbę miligramorównoważników przeciwjonów, które w najkorzystniejszych warunkach mogą być wymienione przez jednostkę masy lub objętości jonitu.
Zdolność wymienna robocza (użytkowa) ma znaczenie praktyczne, ponieważ stanowi tę część całkowitej zdolności wymiennej, która może być wykorzystana w czasie eksploatacji jonitów. Wyraża ona liczbę miligramorównoważników przeciwjonów, które są wymieniane przez jednostkową ilość jonitu, aż do chwili przebicia złoża jonowymiennego.
Wymianę jonową prowadzi się do momentu osiągnięcia roboczej zdolności wymiennej (momentu „przebicia złoża”), a następnie jonity poddaje się procesowi regeneracji (proces odwrotny, polegający na przemywaniu złoża kationitu roztworem HCl, a anionitu - roztworem NaOH).
* Wyznaczanie pojemności wymiennej jonitu:
Kolumnę wypełnia się moczonym uprzednio w wodzie destylowanej jonitem o określonej masie. Jonit na początku doświadczenia powinien być zregenerowany, tj. mieć formę wodorową (zdolną do wymiany jonów H+). W tym celu kolumnę po wypełnieniu przemywa się kilkakrotnie 1,7 molowym roztworem HCl. Nadmiar kwasu z jonitu usuwa się przemywając kolumnę wodą destylowaną, aż odczyn wycieku będzie obojętny.
Następnie przez kolumnę przepuszcza się 0,01 M roztwór NaOH i mierzy się objętość wycieku (należy utrzymać stałą szybkość przepływu, max. do 2 cm3 na minutę). Kolejne porcje wycieku o objętości 10 ml miareczkować 0,05 M roztworem HCl wobec fenoloftaleiny.
Pomiary prowadzi się do momentu, aż stężenie w wycieku będzie takie same, jak w roztworze wyjściowym.
Praca jonitu zachodzi według reakcji:
RH + Na+ = RNa + H+
Jony sodu zatrzymywane są na jonicie. W miarę doprowadzania roztworu NaOH na kolumnę z jonitem, czoło wymiany przesuwa się ku dołowi i w pewnym momencie w wycieku (eluacie) pojawiają się jony Na+ i OH-.
Na podstawie wyników miareczkowania oblicza się stężenie molowe NaOH w kolejnych frakcjach wycieku. Dla każdej frakcji należy również obliczyć stosunek c:c0 (c0 - stężenie początkowe roztworu NaOH, podawanym na kolumnę = 0,1 mol/dm3).
* PUNKT PRZEBICIA JONITU - jest to punkt, w którym podczas prowadzenia wymiany jonowej osiągamy założone stężenie wymienianego jonu w oczyszczonym roztworze, po którym złoże wyłącza się z pracy i poddaje regeneracji.
34. OBLICZ ZAWARTOŚĆ JONÓW Fe2+ W PRÓBCE O OBJĘTOŚCI 10 cm3, JEŚLI NA MIARECZKOWANIE JEJ ZUŻYTO 12,5 cm3 ROZTWORU KMnO4.
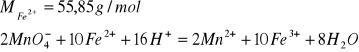
1000 cm3 2M KMnO4 → 10 * 55,85 g Fe2+
V cm3 ZM KMnO4 → x g Fe2+
![]()
V = 12,5 cm3 KMnO4
ZM KMnO4 = 0,0183 M
Vkolby = 100 cm3
Vpróbki = 10 cm3
![]()
Odp. Zawartość jonów Fe2+ w próbce wyniosła 0,6388 g.
35. CO TO JEST PRZEWODNOŚĆ WŁAŚCIWA? DO CZEGO MOŻNA WYKORZYSTAĆ JEJ POMIARY?
* PRZEWODNOŚĆ WŁAŚCIWA (konduktywność) (χ) - to miara podatności materiału na przepływ prądu elektrycznego. Jest to przewodność słupa cieczy o grubości 1 cm i przekroju 1 cm2. Jej jednostką jest S*cm-1. Przewodność właściwa świeżej wody destylowanej = 0,5-2,0 μS*cm-1 (w trakcie przechowywania wartość ta wzrasta do 2-4 μS*cm-1, wskutek pochłaniania CO2 i NH3 z powietrza), wód naturalnych = 50-1000 μS*cm-1, ścieków przemysłowych = do 10 000 μS*cm-1.
Przewodność elektryczna wzrasta wraz z temperaturą (≈ o 2% przy wzroście temperatury o 1oC).
Na podstawie wartości przewodności można wnioskować o zawartości jonów rozpuszczonych w wodzie (mg/dm3). Pomiary przewodności właściwej mogą posłużyć do sprawdzenia wyników analizy w zakresie jonowego składu wód:
χ = b * c
b - współczynnik przeliczeniowy,
c - stężenie jonów [mmol/dm3].
Przewodność właściwa roztworu równa jest sumie przewodności właściwych jonów obecnych w roztworze.
36. CZYM RÓŻNIĄ SIĘ POJĘCIA ROZPUSZCZALNOŚCI I ILOCZYNU ROZPUSZCZALNOŚCI?
* ROZPUSZCZALNOŚĆ - jest to stężenie roztworu nasyconego, często wyrażone jako maksymalna liczba gramów substancji, którą można rozpuścić w 100 g rozpuszczalnika w danych warunkach ciśnienia i temperatury.
* ILOCZYN ROZPUSZCZALNOŚCI - jest to iloczyn ze stężeń jonów w roztworze nasyconym związku chemicznego trudno rozpuszczalnego. Jest to stała równowagi procesu rozpuszczania; iloczyn podniesionych do odpowiednich potęg stężeń molowych jonów, które powstały w wyniku dysocjacji elektrolitycznej trudno rozpuszczalnego elektrolitu (soli, wodorotlenku) i które pozostają w równowadze z osadem tej substancji w danej temperaturze i ciśnieniu.
37. CO TO JEST KRZYWA ABSORPCJI?
* KRZYWA ABSORPCJI - jest to wykres zależności absorpcji od długości fali światła padającego. Przepuszczając przez roztwór barwny światło monochromatyczne, o różnej długości fali i mierząc odpowiednie wartości absorpcji, uzyskuje się tzw. krzywą absorpcji.
38. CO TO JEST ABSORPCJA I CZEMU SŁUŻĄ JEJ POMIARY?
* ABSORPCJA PROMIENIOWANIA (pochłanianie promieniowania) - ubytek energii promieniowania, m.in. światła, przechodzącego przez ośrodek materialny. Polega ona na przekazywaniu energii ośrodkowi przez wzbudzenie jego atomów, cząsteczek lub całej sieci krystalicznej. Absorpcja zależy od długości fali promieniowania i stanu skupienia ośrodka.
Widmo absorpcji promieniowania dostarcza m.in. informacji o poziomach energetycznych elektronów w atomach, cząsteczkach i ciałach stałych oraz o energiach drgań atomów w cząsteczkach i kryształach.
39. CO TO JEST ADSORPCJA, SORBENT, ADSORBAT I ADSORBENT?
* ADSORPCJA - jest to proces polegający na osadzaniu i gromadzeniu się na powierzchni ciała stałego lub cieczy drobin innych substancji (gazów, cieczy, ciał stałych). Adsorpcja wywołana jest przez siły działające na cząsteczki tych drobin ze strony podłoża (adsorbentu). Może mieć ona charakter odwracalny (adsorpcja fizyczna) lub nieodwracalny, gdy między substancją adsorbującą (adsorbatem), a podłożem (adsorbentem) tworzą się trwałe wiązania chemiczne (adsorpcja chemiczna, chemisorpcja).
Adsorpcja znajduje zastosowanie w oczyszczaniu lub rozdzielaniu mieszanin gazowych i ciekłych. Przykładem adsorpcji fizycznej jest oczyszczanie wody wodociągowej przepływającej przez węgiel aktywny z rozpuszczonych w niej zanieczyszczeń. Przykładem adsorpcji chemicznej jest oczyszczanie wody z rozpuszczonych w niej soli.
* ADSORBENT - ciało, na powierzchni którego zachodzi proces adsorpcji (czyli podłoże); jest nim np. węgiel aktywny.
* ADSORBAT - substancja ulegająca adsorpcji.
* SORBENT - ciało stałe, na którego powierzchni, lub w którego wnętrzu, na skutek oddziaływania odpowiednich sił, wzrasta stężenie substancji znajdującej się w fazie kontaktującej się z sorbentem; jest nim np. węgiel aktywowany z filtra przeciwpyłowego.
40. OMÓW METODĘ ANALIZY POLAROGRAFICZNEJ.
Metoda analizy polarograficznej polega na rejestrowaniu natężenia prądu przepływającego w czasie elektrolizy z zastosowaniem elektrod rtęciowych, w zależności od przyłożonego potencjału. Katodę stanowi kroplowa elektroda rtęciowa, a anodę - warstwa rtęci na dnie naczyńka elektrody kroplowej, na której zachodzi redukcja kationów.
Mierząc natężenie prądy płynącego przez roztwór przy wzrastających wartościach przyłożonego napięcia, otrzymuje się tzw. krzywą polarograficzną (polarogram). Na polarografie występują stopnie, czyli tzw. fale polarograficzne, charakterystyczne dla poszczególnych jonów wydzielających się na katodzie. Potencjał mierzony w połowie wysokości fali, tzw. potencjał półfali Π1/2, pozwala na jakościowe określenie jonu.
Wysokość powstającej fali, a więc natężenie graniczne prądu dyfuzyjnego, zależy od stężenia oznaczanego jonu i pozwala ilościowo określić jego zawartość.
Metoda polarograficzna pozwala na oznaczenie stężeń metali (np. Zn, Cu, Pb, Ni, Co, Ba, Al i in.), a także cząstek obojętnych, jak np. tlenu w wodzie oraz szeregu związków organicznych, które redukują się na elektrodzie rtęciowej (np. węglowodorów, alkoholi, witamin i in.). Polarografy służą również do amperometrycznego miareczkowania i oznaczania wolnego i związanego chloru w wodzie i ściekach.
41. OMÓW OZNACZANIE CHEMICZNEGO ZAPOTRZEBOWANIA TLENU (UTLENIALNOŚCI) METODĄ NADMANGANIANOWĄ (ChZT-Mn).
Utlenialność to właściwość wody, polegająca na redukowaniu nadmanganianu wskutek utleniania się obecnych w wodzie związków organicznych. Niektóre związki organiczne, jak sole żelaza(II), azotyny i inne, również ulegają utlenieniu w tych warunkach. Przez utlenialność w tej metodzie uważa się liczbę miligramów tlenu, zużytego przez badaną próbkę, ogrzewaną we wrzącej łaźni wodnej w ciągu 30 min. z roztworem KMnO4 w środowisku kwaśnym (wynik podaje się w mg O2/dm3).
Utlenialność wody jest wskaźnikiem orientacyjnym, dającym jedynie ogólną charakterystykę zanieczyszczenia próbki związkami organicznymi. Pełniejszą miarą ich ilości jest chemiczne zapotrzebowanie tlenu oznaczane metodą dwuchromianowi (ChZT-Cr).
Wody naturalne, niezanieczyszczone, mają utlenialność od ułamka do 2-3 mg O2/dm3. Utlenialność wody do picia nie powinna przekraczać 3 mg O2/dm3.
42. CO TO JEST REDOKSOMETRIA? OMÓW JEJ PODZIAŁ I PODSTAWY TEORETYCZNE.
* REDOKSOMETRIA - jest to dział analizy miareczkowej, wykorzystującej do oznaczeń reakcje utleniania i redukcji. Obejmuje 2 podstawowe działy:
a) oksydymetrię - dzieli się na kilka metod, w zależności od użytego titranta:
- manganometria (titrant: KMnO4),
- jodometria (I2, Na2S2O3),
- bromianometria (KBrO3),
- jodanometria (KIO3),
- chromianometria (K2Cr2O7),
- cerometria (Ce(SO4)2).
b) reduktometrię - obejmuje kilka działów:
- ferrometria (titrant: FeSO4),
- tytanometria (TiCl3),
- askorbinometria (kwas askorbinowy - witamina C).
Metody redoksymetryczne polegają na reakcjach utleniania i redukcji, które są procesami ściśle ze sobą sprzężonymi (reakcji utleniania zawsze towarzyszy reakcja redukcji i na odwrót).
Wielkością charakteryzującą daną reakcję utleniania i redukcji jest potencjał redoks. Jego wielkość zależy od:
- rodzaju substancji reagujących,
- stężenia czynnika redukującego i utleniającego,
- temperatury,
- stężenia jonów H+ (dla niektórych układów).
Potencjał redoks możemy zmierzyć względem normalnej elektrody wodorowej, której potencjał wynosi „0”. Wartość potencjału redoks dla poszczególnych układów utlenienia i redukcji można także wyliczyć ze wzoru Nerntsa:
![]()
(dla T = 298oK = 25oC)
E0 - potencjał normalny, charakterystyczny dla danego układu,
n - liczba elektronów biorących udział w reakcji,
cutl - stężenie formy utlenionej,
cred - stężenie formy zredukowanej.
Potencjał redoks określonego układu jest wyższy, im większy jest stosunek cutl do cred.
Reakcja utleniania i redukcji między różnymi układami jest możliwa tylko wtedy, gdy ich potencjały redoks są różne. Rolę utleniacza spełnia układ, którego potencjał redoks jest wyższy. Im większa różnica między ich potencjałami, tym większa szybkość reakcji.
Podczas miareczkowania w metodach redoksymetrycznych stężenie formy utlenionej do stężenia postaci zredukowanej ulega zmianie, a więc zmienia się również potencjał redoks. Zmiany potencjału redoks w czasie oznaczania możemy przedstawić graficznie w postaci tzw. krzywej miareczkowania redoks.
43. OPISZ CEL, METODY I PODZIAŁ ANALIZY ILOŚCIOWEJ.
Metody stosowane w analizie ilościowej:
a) klasyczne (chemiczne) - do ilościowego oznaczania wykorzystuje się tu reakcje chemiczne. Ze względu na technikę postępowania dzieli się je na:
* metody objętościowe (miareczkowe) - polegają na mierzeniu objętości roztworu substancji reagujących o dokładnie znanym i nieznanym stężeniu - znając objętości obu roztworów i stężenie jednego z nich, możemy wyliczyć stężenie drugiego roztworu. Ze względu na typ reakcji zachodzącej podczas oznaczania stężenia określanego składnika w roztworze metody objętościowe dzielimy na:
- alkacymetrię - wykorzystującą reakcje zobojętniania,
- redoksymetrię - opartą na reakcjach utleniania i redukcji,
- strąceniowe - tu podstawę oznaczeń stanowią reakcje polegające na tworzeniu trudnorozpuszczalnych soli,
- kompleksometrię - wykorzystującą reakcje powstawania związków kompleksowych.
* metody wagowe - polegają na określeniu masy oznaczanego składnika, uprzednio wydzielonego w postaci osadu, którego skład jakościowy i ilościowy jest znany.
b) instrumentalne - oparte na pomiarze wielkości fizycznych lub fizykochemicznych oznaczanego składnika za pomocą odpowiednich przyrządów. Do metod instrumentalnych należą m.in.:
- kolorymetria,
- fotometria,
- polarografia,
- chromatografia.
Przed każdym oznaczeniem ilościowym należy przygotować próbkę do analizy, tj.:
- odpowiednio pobrać próbę (przygotować odważkę analizowanej substancji),
- przeprowadzić badaną substancję do roztworu,
- usunąć składniki przeszkadzające,
- wytworzyć konieczne warunki do prawidłowego przebiegu reakcji, zachodzącej w czasie oznaczania.
44. OMÓW BŁĄD BEZWZGLĘDNY I WZGLĘDNY ANALIZY ILOŚCIOWEJ.
Błąd właściwego oznaczania (błąd metody analitycznej) mieści się w granicach 0,1-1%.
* BŁĄD BEZWZGLĘDNY (Bb) analizy to różnice między wartością uzyskaną w wyniku ilościowego oznaczania danego składnika, a jego rzeczywistą ilością:
Bb = X - Y
X - wartość uzyskana w wyniku analizy,
Y - wartość rzeczywista.
* BŁĄD WZGLĘDNY (Bw) - określa dokładność oznaczenia; wyraża on w procentach stosunek Bb do rzeczywistej wartości:
![]()
Bw nie powinien przekraczać 0,1%.
Wartość Y nie jest na ogół znana; zastępujemy ją średnią arytmetyczną z pewnej liczby oznaczeń.
Im mniejszy Bw, tym większa jest dokładność analizy.
45. OMÓW PODSTAWY TEORETYCZNE ANALIZY OBJĘTOŚCIOWEJ.
Roztworem miareczkującym jest roztwór związku chemicznego, którego stężenie znamy i używamy do oznaczenia ilości badanego składnika.
Płynem miareczkującym napełniamy biuretę. Dokładne stężenie płynu miareczkującego ustalamy za pomocą substancji podstawowej. Związki używane jako substancje podstawowe muszą być czyste chemicznie i nie powinny pochłaniać z powietrza CO2 i H2O.
Ściśle określone objętości roztworu substancji podstawowej (również oznaczanej) odmierzamy pipetą. Płyn z pipety powinien spływać swobodnie, ciągłym strumieniem. W każdej metodzie musi być roztwór odpowiedniej substancji, zwanej wskaźnikiem, którego polega na wskazaniu momentu, kiedy reakcja zachodząca podczas oznaczania przebiegła ilościowo do końca.
46. PRZEDSTAW KRZYWĄ MIARECZKOWANIA MOCNEGO KWASU 0,1M HCl MOCNĄ ZASADĄ 0,1M NaOH.
47. PRZEDSTAW KRZYWĄ MIARECZKOWANIA MOCNEJ ZASADY 0,1M NaOH ZA POMOCĄ MOCNEGO KWASU 0,1M HCl.
48. OMÓW PODSTAWY TEORETYCZNE ALKALIMETRII.
Alkalimetria należy do metod opartych na reakcjach zobojętniania. Płynem miareczkującym są tu kwasy (najczęściej 0,1 molowy roztwór HCl), natomiast substancjami oznaczanymi - zasady lub sole pochodne mocnej zasady i słabego kwasy. Jako substancja podstawowa stosowany jest węglan sodu. Wskaźnik dobieramy w zależności od tego, w jakim przedziale mieści się skok miareczkowania.
49. CO TO SĄ ELEKTROLITY I DYSOCJACJA ELEKTROLITYCZNA?
* ELEKTROLITY - są to związki chemiczne, przewodzące prąd elektryczny (kwasy, zasady, sole). Roztwory wodne elektrolitów mają większe ciśnienie osmotyczne, podwyższenie temperatury wrzenia i większe obniżenie temperatury krzepnięcia niż roztwory nieelektrolitów.
* TEORIA DYSOCJACJI ELEKTROLITYCZNEJ - mówi, że elektrolity w wodzie rozpadają się na jony. Jony są to grupy atomów lub atomy obdarzone ładunkiem elektrycznym (ładunek ujemny mają aniony, a dodatni - kationy). Teorię tę w latach 1885-1887 ogłosił Svante Arrhenius.
* DYSOCJACJA ELEKTROLITYCZNA - proces samorzutnego rozpadu elektrolitów (kwasów, zasad, soli) na jony. Proces ten zachodzi przy pewnym współudziale wody, ale dysocjacja może również zachodzić w innych rozpuszczalnikach o charakterze polarnym (np. ciekły amoniak).
50. WYMIEŃ MOCNE, ŚREDNIE I SŁABE ELEKTROLITY.
* mocne elektrolity:
- sole (z nielicznymi wyjątkami, np. SnCl4, HgCl2, Hg(CN)2): NaCl, K2SO4, (NH4)2CO3, FeCl3,
- mocne kwasy: HCl(aq), HBr(aq), H2SO4, HNO3, HClO4,
- mocne zasady: wodorotlenki litowców i berylowców (z wyjątkiem Be(OH)2 i Mg(OH)2), tj. KOH, NaOH.
* średnie elektrolity:
- H3PO4,
- Mg(OH)2.
* słabe elektrolity:
- kwasy organiczne: HCOOH, CH3COOH,
- kwasy nieorganiczne: H2CO3, H2SO3, HNO2, H3BO3, HCN, H2S(aq),
- zasada: NH4OH,
- NH3(aq).
51. JAK DYSOCJUJĄ ZWIĄZKI KOMPLEKSOWE?
Związki kompleksowe (zespolone) są to połączenia chemiczne, których budowa i właściwości wskazują, iż zarówno w stanie stałym, jak i w roztworach między ich częściami składowymi występuje wiązanie koordynacyjne, powstające za pośrednictwem pary elektronów, należącej do jednego z atomów wchodzących w skład kompleksu.
* Dysocjacja związków kompleksowych przebiega dwuetapowo:
I. K4[Fe(CN)6] ↔ 4K+ + [Fe(CN)6]4-
II. [Fe(CN)6]4- ↔ Fe2+ + 6CN-
52. CO TO EJST STAŁA DYSOCJACJI ELEKTROLITYCZNEJ?
* STAŁA DYSOCJACJI ELEKTROLITYCZNEJ (K) - jest to stała równowagi, która opisuje stan równowagi elektrolitycznej i jest równa stosunkowi iloczynu stężeń molowych form zdysocjowanych (jonów) do stężenia molowego formy niezdysocjowanej danego elektrolitu. Jeśli substancja ulega dysocjacji stopniowej, to dla każdego etapu procesu można podać K.
![]()
[A] - stężenie kationów,
[B] - stężenie anionów,
[AB] - stężenie związku, który uległ dysocjacji.
Stała dysocjacji jest stała dla danego związku w określonej temperaturze; nie zależy ona od stężenia, a od rodzaju elektrolitu i temperatury.
53. CO TO JEST STAŁA TRWAŁOŚCI I STAŁA NIETRWAŁOŚCI ZWIĄZKÓW KOMPLEKSOWYCH?
Związki kompleksowe dysocjują w dwóch etapach; posiadają 2 stałe dysocjacji (K):
I. K[Ag(CN)2] ↔ K+ + [Ag(CN)2]-
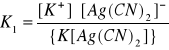
II. [Ag(CN)2]- ↔ Ag+ + 2CN-
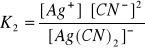
54. CO TO JEST ILOCZYN JONOWY WODY?
Woda jest słabym elektrolitem, jej dysocjacja przebiega w nieznacznym stopniu:
H2O ↔ H+ + OH-
Stała dysocjacji wody:
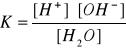
stąd:
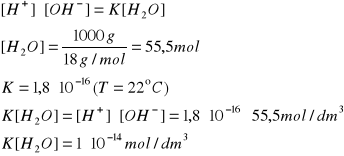
Iloczyn jonowy wody określa zależność między stężeniem [H+] i [OH-]; jest on stały w danej temperaturze.
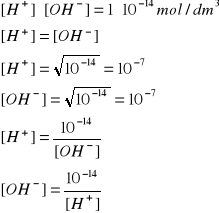
55. CO TO JEST WYKŁADNIK STĘŻENIA JONÓW WODOROWYCH H+?
Skala pH to ilościowa skala kwasowości i zasadowości roztworów wodnych związków chemicznych. Skala ta jest oparta na aktywności jonów hydroniowych [H3O+] w roztworach wodnych. Dokładnie jest to:
pH = -log10[H3O+]
czyli ujemny logarytm dziesiętny aktywności jonów hydroniowych wyrażonych w molach na decymetr sześcienny.
pH = -log[H+]
56. NA CZYM POLEGA HYDROLIZA?
Zjawisko hydrolizy odnosi się tylko do soli i polega na łączeniu się jonów soli z jonami wody. Efektem tego procesu jest powstanie kwasu i zasady, z których dana sól powstała, np.:
NH4Cl + HOH = NH4OH + HCl
Hydroliza jest reakcją odwrotną do zobojętniania:
NH4OH + HCl = NH4Cl + H2O
Hydroliza jest procesem odwracalnym. Sole powstałe z silnych kwasów i silnych zasad nie hydrolizują.
57. CO TO JEST STOPIEŃ HYDROLIZY?
* STOPIEŃ HYDROLIZY - stosunek liczby cząsteczek soli, które uległy hydrolizie do ogólnej liczby cząstek wprowadzonych do roztworu:
![]()
c1 - liczba cząsteczek soli, które uległy hydrolizie,
c2 - ogólna liczba cząstek soli wprowadzonych do roztworu.
Stopień hydrolizy zależy od stężenia roztworu, temperatury i rodzaju soli. Ze wzrostem rozcieńczenia oraz temperatury stopień hydrolizy rośnie.
58. JAK PRZEBIEGA HYDROLIZA SOLI POCHODNYCH MOCNYCH ZASAD I SŁABYCH KWASÓW?
* CH3COONa:
- cząsteczkowo:
CH3COONa + HOH ↔ NaOH + CH3COOH
- jonowo:
CH3COO- + Na+ + HOH ↔ CH3COOH + Na+ + OH-
- jonowo w sposób skrócony:
CH3COO- + HOH ↔ CH3COOH + OH-
odczyn roztworu jest zasadowy ze względu na obecność zdysocjowanych jonów OH-
* Na2CO3:
- cząsteczkowo:
I. Na2CO3 + H2O ↔ NaHCO3 + NaOH
II. NaHCO3 + H2O ↔ H2CO3 + NaOH
- jonowo:
I. 2Na+ + CO32- + H2O ↔ Na+ + HCO3- + Na+ + OH-
II. Na+ + HCO3- + H2O ↔ H2CO3 + Na+ + OH-
- jonowo w sposób skrócony:
I. CO32- + H2O ↔ HCO3- + OH-
II. HCO3- + H2O ↔ H2CO3 + OH-
- sumarycznie cząsteczkowo:
Na2CO3 + H2O ↔ H2CO3 + 2NaOH
- sumarycznie jonowo:
CO32- + 2H2O ↔ H2CO3 + OH-
* Ba(CN)2:
- cząsteczkowo:
I. Ba(CN)2 + H2O ↔ Ba(OH)CN + HCN
II. Ba(OH)CN + H2O ↔ Ba(OH)2 + HCN
- jonowo:
I. Ba2+ + 2CN- + H2O ↔ [Ba(OH)]+ + CN- + HCN
II. Ba2+ + OH- + CN- + H2O ↔ Ba2+ + 2OH- + HCN
- jonowo w sposób skrócony:
I. CN- + H2O ↔ OH- + HCN
II. OH- + CN- + H2O ↔ 2OH- + HCN
59. JAK PRZEBIEGA HYDROLIZA SOLI POCHODNYCH SŁABYCH ZASAD I MOCNYCH KWASÓW?
* NH4Cl:
- cząsteczkowo:
NH4Cl + H2O ↔ NH4OH + HCl
- jonowo:
NH4+ + Cl- + H2O ↔ NH4OH + H+ + Cl-
- jonowo w sposób skrócony:
NH4+ + H2O ↔ NH4OH + H+
odczyn roztworu jest kwaśny ze względu na obecność zdysocjowanych jonów H+
* MgCl2:
- cząsteczkowo:
I. MgCl2 + H2O ↔ Mg(OH)Cl + HCl
II. Mg(OH)Cl + H2O ↔ Mg(OH)2 + HCl
- jonowo:
I. Mg2+ + 2Cl- + H2O ↔ [Mg(OH)]+ + H+ + 2Cl-
II. Mg(OH)+ + Cl- + H2O ↔ Mg(OH)2 + H+ + Cl-
- jonowo w sposób skrócony:
I. Mg2+ + H2O ↔ [Mg(OH)]+ + H+
II. [Mg(OH)]+ + H2O ↔ Mg(OH)2 + H+
- sumarycznie cząsteczkowo:
MgCl2 + 2H2O ↔ Mg(OH)2 + 2HCl
- sumarycznie jonowo:
Mg2+ + 2H2O ↔ Mg(OH)2 + H+
* Fe2(SO4)3:
- cząsteczkowo:
I. Fe2(SO4)3 + 2H2O ↔ 2Fe(OH)SO4 + H2SO4
II. 2Fe(OH)SO4 + 2H2O ↔ [Fe(OH)2]2SO4 + H2SO4
- jonowo:
I. 2Fe3+ + 3SO42- + 2H2O ↔ 2[Fe(OH)]2+ + 2H+ + 2SO42-
II. 2[Fe3+(OH)]2+ + 2SO42- + 2H2O ↔ [Fe(OH)2]+ + 2H+ + 2SO42-
- jonowo w sposób skrócony:
I. Fe3+ + H2O ↔ [Fe(OH)]2+ + H+
II. Fe3+ + 2H2O ↔ Fe(OH)2+ + 2H+
- sumarycznie cząsteczkowo:
Fe2(SO4)3 + 4H2O ↔ [Fe(OH)2]2SO4 + H2SO4
- sumarycznie jonowo:
Fe3+ + 2H2O ↔ [Fe(OH)2]+ + 2H+
60. JAK PRZEBIEGA HYDROLIZA SOLI POCHODNYCH SŁABYCH ZASAD I SŁABYCH KWASÓW?
* CH3COONH4:
- cząsteczkowo:
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
- jonowo:
CH3COO- + NH4+ + H2O ↔ CH3COOH + NH4OH
odczyn roztworu jest praktycznie obojętny
* (NH4)2CO3:
- cząsteczkowo:
I. (NH4)2CO3 + H2O ↔ NH4HCO3 + NH4OH
II. NH4HCO3 + H2O ↔ H2CO3 + NH4OH
- jonowo:
I. 2NH4+ + CO32- + H2O ↔ NH4+ + HCO3- + NH4OH
II. NH4+ + HCO3- + H2O ↔ H2CO3 + NH4OH
- sumarycznie cząsteczkowo:
(NH4)2CO3 + 2H2O ↔ 2NH4OH + H2CO3
- sumarycznie jonowo:
2NH4+ + CO32- + 2H2O ↔ 2NH4OH + H2CO3
* Al(CH3COO)3:
- cząsteczkowo:
I. Al(CH3COO)3 + H2O ↔ [Al(OH)](CH3COO)2 + CH3COOH
II. [Al(OH)](CH3COO)2 + H2O ↔ [Al(OH)2](CH3COO) + CH3COOH
III. [Al(OH)2](CH3COO) + H2O ↔ Al(OH)3 + CH3COOH
- jonowo:
I. Al3+ + 3CH3COO- + H2O ↔ [Al(OH)]2+ + 2CH3COO- + CH3COOH
II. [Al(OH)]2+ + 2CH3COO- + H2O ↔ [Al(OH)2]+ + CH3COO- + CH3COOH
III. [Al(OH)2]+ + CH3COO- + H2O ↔ Al(OH)3 + CH3COOH
- jonowo w sposób skrócony:
I. Al3+ + CH3COO- + H2O ↔ [Al(OH)]2+ + CH3COOH
II. [Al(OH)]2+ + CH3COO- + H2O ↔ [Al(OH)2]+ + CH3COOH
III. [Al(OH)2]+ + CH3COO- + H2O ↔ Al(OH)3 + CH3COOH
- sumarycznie cząsteczkowo:
Al(CH3COO)3 + 3H2O ↔ Al(OH)3 + 3CH3COOH
- sumarycznie jonowo:
I. Al3+ + 3CH3COO- + 3H2O ↔ Al(OH)3 + 3CH3COOH
61. CO TO JEST MIESZANINA BUFOROWA I POJEMNOŚĆ BUFOROWA?
* BUFORY - roztwory, których wartość pH po dodaniu niewielkich ilości mocnych kwasów albo zasad, jak i po rozcieńczeniu wodą prawie się nie zmienia. Roztworami buforowymi są roztwory słabych kwasów oraz ich soli z mocną zasadą, albo słabych zasad i ich odpowiednich soli o zbliżonych stężeniach. Rolę mieszanin buforowych spełniają również roztwory wodorosoli np. NaHCO3, NaH2PO4 lub Na2HPO4.
Mieszaniny buforowe mają określoną pojemność. Miarą tej pojemności jest stosunek dodanej do roztworu ilości kwasu (zwykle HCl-u) lub zasady (zwykle NaOH), wyrażonej w molach jonów wodorowych lub wodorotlenowych na 1 dm3 do uzyskanej przez to zmiany pH. Jeśeli dodanie do 1 dm3 roztworu buforowego 1 mola jonów H+ lub OH- spowoduje zmianę jego pH o 1, to pojemność tego buforu wynosi 1.
Pojemność buforowa (jej wartość jest zależna od pH) określa więc wrażliwość określonej ilości roztworu na dodawanie mocnego kwasu lub zasady, np. zmiana pH o 0,01 w wyniku dodania 0,006 mola kwasu lub zasady oznacza β=0,6 mol.
* POJEMNOŚĆ BUFOROWA - liczba moli mocnego jednozasadowego kwasu lub mocnej jednowodorotlenkowej zasady, która dodana do 1 dm3 roztworu buforowego zmienia jego pH o jednostkę; wyraża się ją najczęściej liczbą ułamkową. Obniża się ona wraz z dodawaniem kwasu lub zasady, a staje się równa „0”, gdy cała zawarta w buforze sól zamienia się w słaby kwas lub też słaby kwas zostanie przeprowadzony w sól.
Rozcieńczenie również obniża pojemność buforową mieszaniny buforowej, ale nie wpływa na jej pH.
62. NA CZYM POLEGAJĄ REAKCJE UTLENIANIA I REDUKCJI?
Reakcje utleniania i redukcji charakteryzują się wymianą elektronów walencyjnych między atomami, które biorą udział w danym procesie, czego efektem jest zmiana wartościowości pierwiastków uczestniczących w reakcji.
Atom przyjmujący elektrony walencyjne zmniejsza swoją wartościowość dodatnią, redukuje się i jest utleniaczem. Atom oddający elektrony zwiększa swoją wartościowość dodatnią, utlenia się i jest reduktorem.
63. CO TO JEST KRZYWA MIARECZKOWANIA?
* KRZYWA MIARECZKOWANIA - jest to graficzny obraz zmian, które zachodzą w roztworze podczas procesu miareczkowania; stanowi ona wykres w prostokątnym układzie współrzędnych, na którym na osi odciętych (x) znajduje się objętość zużytego roztworu titranta, a na osi rzędnych (y) wartości liczbowe parametru związanego ze stężeniem oznaczanego składnika, np. potencjał redoks, przewodność elektryczna.
64. CZEGO DOTYCZY PRAWO ROZCIEŃCZEŃ OSTWALDA?
Prawo rozcieńczeń Ostwalda wyraża zależność między stałą dysocjacji, a całkowitym stężeniem molowym elektrolitu i jego stopniem dysocjacji. Jest ono słuszne dla elektrolitów słabych:
![]()
K - stała dysocjacji (stężeniowa),
c - całkowite stężenie elektrolitu,
α - stopień dysocjacji.
Gdy elektrolit jest bardzo słabo zdysocjowany, to wtedy α jest bardzo małe i można przyjąć, że 1-α ≈ 1. Prawo rozcieńczeń Ostwalda przyjmuje wówczas postać:
K = c * α2
Jeśli np. kwas ulega dysocjacji stopniowej, to prawo stosuje się dla każdego etapu oddzielnie.
65. WYJAŚNIJ POJĘCIE ELUCJA, ELUENT I ELUAT.
* ELUCJA - proces wymywania składnika lub składników mieszaniny rozdzielanej metodami chromatografii, spowodowany przepływem fazy ruchomej (niestacjonarnej) względem fazy nieruchomej (stacjonarnej). Metoda ta najczęściej jest wykorzystywana w chromatografii jonowymiennej.
* ELUAT - roztwór zawierający substancje wymyte, np. pobierany z generatora izotopów roztwór zawierający pożądany izotop pochodny.
* ELUENT - czynnik wymywający. W chromatografii jest to płyn (gaz lub ciecz), który pełni funkcję czynnika przenoszącego analizowaną mieszaninę przez złoże, na którym następuje jej rozdział na poszczególne związki.
Eluentami są zwykle związki chemiczne o niskiej masie cząsteczkowej, które nie reagują ze złożem i przechodzą przez to złoże przy jak najmniejszych oporach przepływu.
Przykłady eluentów: wodór, hel, aceton, acetonitryl, chlorek metylenu, chloroform, etanol, THF, toluen, woda.
66. WYJAŚNIJ POJĘCIE DYSOCJACJA, HYDROLIZA I ZOBOJĘTNIENIE:
* DYSOCJACJA - rozpad związku chemicznego lub jonu na związki prostsze (np. mniejsze cząsteczki, atomy lub jony), wywołany działaniem czynników fizycznych (temperatura, ciśnienie). Jest to proces odwracalny.
* HYDROLIZA - reakcja danej substancji z wodą, w wyniku której następuje rozkład tej substancji. Hydrolizie ulegają:
- sole mocnych kwasów i słabych zasad (odczyn roztworu jest kwaśny z powodu hydrolizy kationowej - wytwarzają się jony H+):
NH4NO3 + H2O = NH3 * H2O + HNO3
NH4+ + NO3- + H2O = NH3 * H2O + H+ + NO3-
NH4+ + H2O = NH3 * H2O + H+
- sole mocnych zasad i słabych kwasów (odczyn roztworu jest zasadowy z powodu hydrolizy anionowej - wytwarzają się jony OH-):
Na2CO3 + 2H2O = H2CO3 + 2NaOH
2Na+ + CO32- + 2H2O = H2CO3 + 2Na+ + 2OH-
CO32- + 2H2O = H2CO3 + 2OH-
- sole słabych kwasów i słabych zasad (odczyn roztworu jest praktycznie obojętny):
(NH4)2CO3 + 2H2O = 2NH3 * H2O + H2CO3
2NH4+ + CO32- + 2H2O = 2NH3 * H2O + H2CO3
- substancje organiczne, np., estry, białka, tłuszcze, cukry.
* REAKCJE ZOBOJĘTNIANIA - są to reakcje jonowe, polegające na łączeniu się jonów w obojętne cząsteczki, które pozostają w roztworze. Ogóle równanie zobojętniania:
H3O+ + A- + B+ + OH- = 2H2O + B+ + A-
67. CO TO SĄ LIGANDY I WIĄZANIE KOORDYNACYJNE?
* LIGANDY (addendy) - w związkach kompleksowych atomy, cząsteczki lub aniony, które są bezpośrednio przyłączone do atomu centralnego lub kationu centralnego, zwanego centrum koordynacji albo rdzeniem kompleksu.
Elementem łączącym addend z atomem lub kationem centralnym jest, należący do addendu, tzw. atom ligandowy (czasem grupa atomów), który zawiera wolną parę elektronową, wbudowującą się w wolne orbitale rdzenia, lub zapełnione orbitale π, zachowujące się w ten sam sposób. W bardzo rzadkich przypadkach połączenie może odbywać się poprzez wolny orbital nakładający się na zajęte orbitale atomu centralnego. Atomem ligandowym może być atom pierwiastka silnie elektroujemnego (np. tlenu, azotu) lub pierwiastka niezbyt elektroujemnego - na przykład atom (lub grupa atomów) węgla, przez który z definicji przyłączają się wszystkie ligandy metaloorganiczne. Grupami donorowymi mogą być cząsteczki elektrycznie obojętne (np. NH3, H2O, CO, niektóre związki organiczne) lub aniony (OH-, SO42-, F-, Cl-).
* WIĄZANIE KOORDYNACYJNE to rodzaj kowalencyjnego wiązania chemicznego. Istotą tego wiązania jest uwspólnienie pary elektronowej między dwoma atomami, przy czym oba te elektrony formalnie pochodzą od jednego atomu.
W wiązaniach koordynacyjnych wyróżnia się atom donora (dostarczyciela) i akceptora (przyjmującego) elektronów. W większości przypadków donorem elektronów jest atom bardziej elektrododatni, a akceptorem bardziej elektroujemny. Czasem jednak oba związane atomy są jednocześnie donorami i akceptorami. W takich przypadkach wiązanie ma podwójny charakter: donorowy i redonorowy (inaczej zwrotny).
68. CO TO JEST TWARDOŚĆ WODY I JAK SIĘ JĄ WYRAŻA?
* TWARDOŚĆ WODY - jest to cecha wody, będąca funkcją stężenia soli wapnia, magnezu i innych metali, które są zdolne do tworzenia soli na wyższym niż pierwszy stopniu utlenienia.
Twardość wody wyraża się w trzech różnych skalach:
- stopniach niemieckich (°n lub °d) - 1 °n = 10,00 mg CaO w 1 litrze wody oraz 1°n = 17,9 mg CaCO3 w 1 litrze wody
- stopniach francuskich (°f) - 1 °f = 10,00 mg CaCO3 w 1 litrze wody
- milivalach na litr - (mval/l) - 1 mval = 1 miligramorównoważnik (0,5 milimol) jonów Ca2+ oraz 1 mval/litr = 50 mg CaCO3/litr.
69. WYJAŚNIJ POJĘCIE KALIBRACJA. W JAKIM CELU SIĘ JĄ PRZEPROWADZA?
* WZORCOWANIE (inaczej kalibracja) - ogół czynności ustalających relację między wartościami wielkości mierzonej wskazanymi przez przyrząd pomiarowy a odpowiednimi wartościami wielkości fizycznych, realizowanymi przez wzorzec jednostki miary wraz z podaniem niepewności tego pomiaru. Polega to na określeniu różnicy pomiędzy wskazaniem przyrządu wzorcowego a wskazaniem przyrządu wzorcowanego z uwzględnieniem niepewności pomiaru dokonanego przy pomocy przyrządu wzorcowego.
Celem wzorcowania jest zwykle poświadczenie, że wzorcowany przyrząd spełnia określone wymagania metrologiczne, przy czym wynik wzorcowania poświadczany jest w świadectwie wzorcowania.
70. CO TO JEST ROZTWÓR WZORCOWY?
* ROZTWÓR WZORCOWY (mianowany) - jest to roztwór związku chemicznego o precyzyjnie zmierzonym stężeniu.
71. DO CZEGO SŁUŻY KONDUKTOMETR?
Konduktometr - jest to rodzaj przyrządu pomiarowego, który służy do pomiaru przewodności roztworów elektrolitów. Ten przyrząd jest stosowany do orientacyjnych pomiarów zanieczyszczenia, zasolenia wody oraz w miareczkowaniu konduktometrycznym.
72. CO TO JEST TITRANT?
* TITRANT - w miareczkowaniu jest to roztwór dodawany z biurety w postaci kropel do roztworu analizowanej substancji (analit). Titrant jest roztworem mianowanym związku chemicznego zdolnego do reakcji charakterystycznej analizowanego indywiduum chemicznego.
73. WYJAŚNIJ POJĘCIE SKOK MIARECZKOWANIA.
Skokiem miareczkowania nazywa się gwałtowną zmianę wartości pH w pobliżu punktu równoważności. Skok miareczkowania zależy od stężeń roztworu miareczkowanego i titranta. Im bardziej stężone są roztwory, tym większy jest skok miareczkowania.
74. CO TO JEST ŁAŹNIA WODNA?
* ŁAŹNIA WODNA - jest to rodzaj łaźni grzejnej; umożliwia ona ogrzewanie naczynia laboratoryjnego wodą podgrzaną w sposób kontrolowany do odpowiedniej temperatury lub wrzącą wodą pod normalnym ciśnieniem, a więc do stosunkowo niskiej temperatury ok. 100°C. Po dodaniu do ogrzewającej wody wybranej substancji rozpuszczającej się w wodzie istnieje możliwość zmiany temperatury wrzącego roztworu w ograniczonym zakresie poniżej lub powyżej temperatury wrzenia wody destylowanej. W przypadku kontrolowanego podgrzewania wody ogrzewającej jedynie do wybranej temperatury poniżej temperatury wrzenia, duża jej ilość w łaźni sprzyja zachowaniu stabilności temperatury.
75. OMÓW ZASADĘ DZIAŁANIA PEHAMETRU. NA CZYM POLEGA POMIAR pH?
Pehametr, woltomierz elektroniczny służący w codziennej praktyce laboratoryjnej, badaniach naukowych lub zastosowaniach polowych do wyznaczania pH roztworu (odczynu roztworu wodnego) na podstawie pomiaru siły elektromotorycznej ogniwa (SEM). Pehametr wyposażony jest najczęściej w elektrodę szklaną, lub kombinowaną.
Najczęściej do oznaczania pH stosuje się elektrodę kombinowaną, którą stanowi ogniwo zbudowane z elektrody pracującej, o zmiennym potencjale zależnym od stężenia jonów wodorowych (elektroda szklana) i elektrody porównawczej o stałym potencjale (elektroda chlorosrebrowa). Elektrody te są umieszczone w jednej wspólnej oprawce wyposażonej w przewód koncentryczny. Punkt zerowy tej elektrody leży w pobliżu pH 7. Elektrodę kombinowaną przechowuje się w naczyniu z nasyconym roztworem chlorku potasowego.
Elektrodę przed wykonaniem pomiaru należy przemyć wodą destylowaną. Głębokość zanurzenia elektrody podczas pomiaru nie może być większa niż 2/3 długości części szklanej.
Pomiar siły elektromotorycznej (E) między elektrodami pracującą i porównawczą, zanurzonymi w badanym roztworze przeprowadza się za pomocą specjalnych potencjometrów, które w przypadku skali wycechowanej w jednostkach pH nosi nazwę pehametrów.
76. WYMIEŃ TRUDNOROZPUSZCZALNE OSADY W WODZIE.
- siarczan(VI) baru (BaSO4),
- siarczek rtęci(II),
- fosforany metali,
- chlorki, bromki, jodki srebra, ołowiu (np. AgI2, AgCl2, AgBr2),
- węglan baru (BaCO3),
- węglan wapnia (CaCO3),
- chromian baru (BaCrO4),
- i inne.
77. PODAJ DOPUSZCZALNE WARTOŚCI pH DLA KLAS WÓD.
Zgodnie z rozporządzeniem Ministra Ochrony Środowiska, Zasobów Naturalnych i Leśnictwa z dnia 5 listopada 1991 r. w sprawie klasyfikacji wód dopuszczalne wartości pH w wodach powierzchniowych są następujące:
- klasa I ≤ 6,5 - 8,5
- klasa II ≤ 6,5 - 9,0
- klasa III ≤ 6,0 - 9,0
Dopuszczalne wartości pH w wodzie do picia dla Polski wynoszą od 6,5 do 8,5.
78. PODAJ PRZYCZYNY ODSTĘPSTW OD PRAWA LAMBERTA-BEERA.
Powodem odstępstw od prawa Beera mogą być:
a) przyczyny chemiczne (związane z próbką) - zależą one od charakteru środowiska:
- zmiana współczynnika absorpcji,
- zmiana stężenia,
- zmiana pH,
- reakcje tworzenia się kompleksów,
- dysocjacja,
- asocjacja,
- polimeryzacja,
- solwatacja,
- dimeryzacja,
- hydroliza itp.,
- odchylenia od prawa Lamberta-Beera mogą również wystąpić w wyniku oddziaływań typu van der Waalsa lub wiązań wodorowych.
b) przyczyny fizyczne (instrumentalne):
- brak ścisłej monochromatyzacji wiązki promieniowania
- jeżeli w przyrządzie zachodzi rozpraszanie promieniowania (wywiera ono tym większy wpływ, im większe są wartości mierzonych absorpcji),
- zbyt duża szerokość spektralna wiązki promieniowania przechodzącego przez próbkę,
- niedostateczna czułość różnych detektorów, a także niehomogeniczne (mętne) środowisko optyczne.
79. OD CZEGO ZALEŻY PRZEWODNICTWO ELEKTROLITÓW?
Przewodnictwo właściwe roztworów zależy od obecnych w nim jonów - ich stężenia i ruchliwości, a także rodzaju (wielkość, ładunek), oraz rodzaju rozpuszczalnika.
80. ZASADA DZIAŁANIA KONDUKTOMETRU.
* Metoda pomiaru przewodnictwa elektrycznego:
Przyjęta metoda pomiaru polega na sekwencyjnym przełączaniu czujników i sekwencyjnym zapisie wyników w jednym pliku. Sortowanie wyników odbywa się po zakończeniu zbierania za pomocą odpowiednio zaprogramowanego arkusza kalkulacyjnego programu Excel. Program umożliwia przeniesienie ich do kolumn grupujących wyniki z kolejnych punktów pomiarowych, a następnie podstawienie do wcześniej wprowadzonych równań. Warunkiem zastosowania tej metody zbierania wyników jest założenie, że szybkość zmian mierzonych wartości jest kilkakrotnie mniejsza od szybkości “obsługi” wszystkich punktów pomiarowych. Ta z kolei zależy od czasu ustalania się wyniku na wyświetlaczu przyrządu i reakcji komputera na komendę “ ENTER -zapis”. Ponieważ program obsługi dostarczony przez producenta konduktometru zapewnia gromadzenie wyników w pamięci zewnętrznej (na dysku), czas zapisu wynosi ok. 1-2 s, a czas ustalania się wyświetlacza ok. 5 s, to okres między przełączeniami kolejnych punktów nie powinien być mniejszy niż 10 - 15 s.
Program obsługi konduktometru może pracować w trybie automatycznym lub ręcznym. W pierwszym przypadku zapis następuje we wcześniej zadeklarowanych przez użytkownika odstępach czasu, w drugim - po naciśnięciu klawisza ENTER. Do współpracy z multiplikatorem wybrano tę drugą opcję. Naciśniecie klawisza można symulować zwarciem przekaźnika kontaktronowego umieszczonego wewnątrz obudowy klawiatury i podłączonego do wyprowadzeń klawisza ENTER.
* Działanie konduktometru:
Zegar generuje asymetryczny przebieg prostokątny, którego okres i współczynnik wypełnienia regulowane są stałymi czasowymi elementów C1, P2 i P1 + R1. Wartości elementów dobrano tak, aby t2 = 0,5 s, a t 1 = 3...180 s. Regulacji t2 dokonuje się potencjometrem nastawnym P2, a t1 potencjometrem P1. Dodatni impuls (rys. 4) generowany przez zegar steruje przekaźnikiem sygnału ENTER, co powoduje wpisanie do pamięci zewnętrznej komputera wartości z wyświetlacza konduktometru, a zanegowany pierwszą bramką układu opóźniającego powoduje ustawienie wyjścia układu w stan wysoki na czas określony stałą C3 - rezystancja sąsiedniej bramki (tu ok. 10 s). Zbocze opadające tego impulsu powoduje wpisanie pierwszego bitu do licznika 7493 ( przy założeniu, że licznik był wcześniej wyzerowany) i pojawienie się stanu niskiego na wyjściu "1" dekodera 7442. Inwerter połączony z tym wyjściem steruje tranzystorem T2, a ten łączy wejścia 2 A B z wyjściami A B. Potwierdzeniem tego jest świecenie diody LED.
Do wejścia konduktometru podłączony zostaje czujnik nr 2. Wynik na wyświetlaczu zmienia się i po kilkunastu sekundach następuje jego ustalenie. Taki stan trwa aż do następnego impulsu, z tym, że na ok. 10 s przed jego wystąpieniem pojawia się sygnał ENTER wpisujący kolejny wynik do pamięci, a następnie przełącza się kolejny punkt pomiarowy. W chwili pojawienia się stanu niskiego na wyjściu "4" dekodera (piąty impuls) następuje samoczynne zerowanie licznika przez bramkę 1/4 7400 i diodę D7 wysokim stanem wejść R0(1) i R0(2). Licznik ustawia niski stan na wyjściu "0" dekodera, załączone jest wejście 1AB. Cykl się powtarza.
Istnieje możliwość rozbudowy urządzenia przez dodanie jeszcze sześciu wejść. Bramkę zerującą należałoby wtedy połączyć z wyjściem 9 dekodera.
Układ należy wyzerować ręcznie przez podanie napięcia +5V przyciskiem Reset przed rozpoczęciem pomiarów.
Wyszukiwarka
Podobne podstrony:
chemia-kolo, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Magdy
chemia-koło, Studia, 1-stopień, inżynierka, Ochrona Środowiska
egz-koło, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ocena oddziaływania na środowisko
Gleba - koło, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Gleboznawstwo
Instrukcja1-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja3-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja5-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja4-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja2-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
prawo Lamberta–Beera, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja1-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Składowanie na wysypiskach, Studia, 1-stopień, inżynierka, Ochrona Środowiska
biochemia cz 1, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
Buforowość gleby, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ochrona i rekultywacja gleb
BIAŁKA DO 10, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
Proces inwestycyjny a decyzja środowiskowa, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ocena
Rola wody w życiu lasu, Studia, 1-stopień, inżynierka, Ochrona Środowiska
sciaga scieki, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Technologie stosowane w ochronie ś
więcej podobnych podstron