Wymiana jonowa, oznaczenie pojemności wymiennej jonitu
Cel:
Zapoznanie się z pełnym cyklem pracy wymieniacza jonowego i wykonanie pomiarów określających podstawowe parametry pracy kolumny i złoża
Wprowadzenie:
Uzdatnianie wody oznacza dostosowanie właściwości i składu wody do wymagań wynikających z jej przeznaczenia. Aby to osiągnąć, wodę należy poddać odpowiednim zabiegom takim jak: klarowanie, odbarwianie, odżelazianie, odmanganianie, dezodoryzacja, dezynfekcja, odgazowanie, zmiękczanie, odsalanie, demineralizacja, stabilizacja, dezaktywacja i fluorowanie. Wymienione zabiegi mogą być realizowane za pomocą różnych procesów. Nie stosuje się wszystkich jednocześnie, lecz dokonuje się odpowiedniego ich doboru. Podstawą doboru powinny byś fizyczne, chemiczne i biologiczne badania wody z ujęć oraz badania mające na celu ustalenie procesów niezbędnych do uzyskania wymaganego efektu uzdatniania wody. W instalacjach do uzdatniania wody stosuje się szereg połączonych procesów jednostkowych. Jedną z metod zmiękczania lub demineralizacji wody (całkowitego usunięcia rozpuszczonych soli mineralnych i gazów) jest metoda jonitowa.
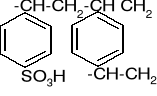
Jonity są to substancje pochodzenia naturalnego lub wytwarzane sztucznie, nierozpuszczalne w wodzie, mające zdolność wymiany jonów z roztworu na jony związane z masą jonitu. Ich makrocząsteczki mają postać przestrzennego szkieletu, w który wbudowane są grupy funkcyjne dysocjujące w wodzie i zdolne do wymiany swoich jonów na jony z otaczającego je roztworu w równoważnych ilościach. Jonity można podzielić na organiczne i nieorganiczne, naturalne, półsyntetyczne i syntetyczne. Aktualnie używa się wyłącznie jonitów syntetycznych. Ich szkielety stanowią najczęściej polimery styrenu i diwinylobenzenu (DVB). DVB to czynnik sieciujący.
Styren jonit z grupą sulfonową
Jonity zbudowane są z wielkocząsteczkowej matrycy i grup jonoczynnych.
Schematy jonitów: podłoże - grupy kwasowe (kationity),
- grupy zasadowe (anionity).
Wymiana jonowa to proces odwracalny w ilościach równoważnych.
W zależności od charakteru grup funkcyjnych jonity dzieli się na kationity i anionity. Istnieje również inny podział w zależności od aktywności grupy funkcyjnej na mocne i słabe.
Grupami funkcyjnymi w kationitach są grupy kwasowe takie jak:
RjSO3H (mocne) i RjCOOH (słabe). W anionitach grupami funkcyjnymi są grupy aminowe np. -NH2 (słabe), -NHR, -NR2 (średnie) bądź też czwartorzędowe grupy amoniowe -[NR3]+ (silne). Jonity mogą występować również w formie soli np. sodowej (kationity) lub chlorków (anionity). Ich praca będzie jednak prowadziła do zmiękczenia, a nie demineralizacji wody.
Schemat pracy jonitu
(kwas) [Kt]H + Na+ = [Kt]Na + H+
R-C=O + Na+ → R-C=O + H+
Ⴝ
OH ONa
(zasada) 2[An]OH + CO32- = [An]2CO3 + 2OH-
R-OH + NO2- → RNO2 + OH-
Zdolność wymienna jonitów
Jest to liczba milivali jonów, które mogą być wymienione przez jednostkę masy lub objętości jonitu. Rozróżnia się całkowitą zdolność wymienną i roboczą zdolność wymienną jonitów. Praktycznie wymianę jonową prowadzi się do momentu osiągnięcia roboczej zdolności wymiennej, a następnie jonity poddaje się regeneracji.
Demineralizacja jest to wymiana jonowa na jonitach pracujących w cyklu wodorowym. Jony Ca2+, Mg2+, Na+ i inne kationy wymieniane są na jony H+, a towarzyszące im aniony na jon OH-. Jonity, po wyczerpaniu swej zdolności jonowymiennej mogą być zregenerowane i ponownie użyte
Regeneracja
Jest to proces odwrotny, polegający na przemywaniu złoża kationitu roztworem HCl a anionitu roztworem NaOH. Stosuje się roztwory rozcieńczone 2...10%. Takie stężenia zapewniają największą szybkość regeneracji. Szybkość przepływu czynnika regenerującego powinna być wyższa na początku operacji, dla szybkiego wyparcia wody z przestrzeni między ziarnami jonitu. Następnie należy zmniejszyć szybkość z powodów ekonomicznych. O szybkości regeneracji stanowią procesy na granicy roztwór - ziarno jonitu. Dlatego jest ona zależna od stopnia rozdrobnienia jonitu. Jonit o ziarnach małej średnicy regeneruje się szybciej niż jonit o ziarnach dużej średnicy. Zalecane przez producentów czasy regeneracji zamykają się w przedziale 30...60 min. Dla typowych kolumn jonitowych prędkość przepływu roztworów przez złoże wynosi 2...70 m/h.
Pierwszą operacją, jaką należy wykonać jest regeneracja jonitów. Jonity pracują w cyklu wodorowo - wodorotlenowym. Do regeneracji kationitu używa się 5% roztworu HCl, a do anionitu 5% roztworu NaOH. Regeneracja polega na przetłaczaniu odpowiednich roztworów przez złoża jonitów znajdujących się w kolumnach. Po ustawieniu odpowiednich zaworów roztwory ze zbiorników tłoczy pompa. Eluat kontrolowany jest konduktometrem. Pojawienie się w eluacie mocnego elektrolitu jakim są roztwory regenerujące świadczy o zakończeniu procesu regeneracji. Następnie należy odmywać nadmiar roztworów regenerujących pozostających w złożu za pomocą podgrzanej wody destylowanej. Wodę do przemywania tłoczy się ze zbiornika tą samą pompą, co roztwory regenerujące. O zakończeniu odmywania świadczy obojętny odczyn eluatu i zanik przewodnictwa elektrycznego.
WYKONANIE DOŚWIADCZENIA
Odczynniki
mianowany roztwór HCl o stężeniu 0,05 mol/dm3
mianowany roztwór NaOH o stężeniu 0,1mol/dm3,
mianowany roztwór HCl o stężeniu 1,7 mol/dm3
etanolowy roztwór fenoloftaleiny
Przyrządy i szkło laboratoryjne
kolumna szklana
żywica kationitowa Amberlit IR-120
Sposób postępowania
Kolumnę wypełnić (moczonym uprzednio w wodzie destylowanej) jonitem o określonej masie. Jonit na początku doświadczenia powinien być zregenerowany to jest mieć formę wodorową, czyli zdolną do wymiany jonów H+. W tym celu kolumnę po wypełnieniu przemywa się kilkakrotnie 1,7 molowym roztworem HCl. Nadmiar kwasu z jonitu usuwa się przemywając kolumnę wodą destylowaną, aż odczyn wycieku będzie obojętny.
Następnie przez kolumnę przepuszcza się 0,01 molowy roztwór NaOH i mierzy się objętość wycieku. Należy utrzymywać stałą szybkość przepływu maksymalnie do 2 cm3 na minutę.
Kolejne porcje wycieku o objętości 10 ml miareczkować 0,05 molowym roztworem HCl wobec fenoloftaleiny. Pomiary prowadzić do momentu aż stężenie w wycieku będzie takie same jak w roztworze wyjściowym.
C/Co
1,0
0,5
Praca jonitu zachodzi według schematu
RH + Na+ = RNa + H+ 0
v1 v2 objętość wycieku
Jony sodu zatrzymywane są na jonicie. W miarę doprowadzania roztworu NaOH na kolumnę z jonitem, czoło wymiany przesuwa się ku dołowi i w pewnym momencie w wycieku (eluacie) pojawiają się jony Na+ i OH-.
Na podstawie wyników miareczkowania należy obliczyć stężenie molowe NaOH w kolejnych frakcjach wycieku. Stężenie początkowe roztworu NaOH - co = 0,1 mol ⋅dm-3. Dla każdej frakcji należy obliczyć stosunek c:co. Wyniki należy zestawić w tabelce a następnie przedstawić graficznie według podanego schematu.
Nr |
Objętość HCl z miareczkowania [ml] |
Wartość stężenia roztworu NaOH w wycieku (c) |
Stosunek c:co |
1 |
|
|
|
... |
|
|
|
n |
|
|
1 |
W punkcie v1 nastąpiło przebicie wypełnienia kolumny i w eluacie pojawiły się jony OH-. Znając objętość v1 można obliczyć pojemność przebicia. Pojemność całkowita jonitu jeat większa i określa się ją na podstawie punktu, którego współrzędne wynoszą 0,5 i v2 (jeżeli krzywa jest symetryczna).
Pojemność przebicia można wyrazić iloczynem(v1⋅ co)
v1 - objętość wycieku wyrażona w litrach
co - stężenie molowe NaOH w roztworze podawanym na kolumnę.
Jest to pojemność przebicia odniesiona do masy jonitu zawartej w badanej kolumnie. Pojemność całkowitą można wyrazić iloczynem(v2⋅ co) i oznacza całkowitą zdolność wymienną jonitu zawartego w kolumnie z doświadczenia.
Podstawą do uzyskania zaliczenia ćwiczenia jest prawidłowe wypełnienie tabelki i wykonanie obliczeń i wykresu, obliczenie obu pojemności jonitu w odniesieniu do jednego kilograma.
HCl
NaOH
Wyszukiwarka
Podobne podstrony:
Instrukcja1-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja3-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja4-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja2-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Instrukcja1-2008, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Hydrochemia - kolo 2, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
prawo Lamberta–Beera, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Hydrochemia
Składowanie na wysypiskach, Studia, 1-stopień, inżynierka, Ochrona Środowiska
biochemia cz 1, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
Buforowość gleby, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ochrona i rekultywacja gleb
BIAŁKA DO 10, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
Proces inwestycyjny a decyzja środowiskowa, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ocena
Rola wody w życiu lasu, Studia, 1-stopień, inżynierka, Ochrona Środowiska
sciaga scieki, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Technologie stosowane w ochronie ś
Ścieki ściąga(egzamin), Studia, 1-stopień, inżynierka, Ochrona Środowiska, Technologie stosowane w o
Fizyka - ściąga 2, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Fizyka
zmiany klimatu Cwicz do dania, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Zagrożenia cywiliz
Podstawy Ekologii, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ekologia
więcej podobnych podstron