Agnieszka Magiera i Ewelina Zielińska
Sprawozdanie z ćwiczenia 8.
Wstęp teoretyczny:
Opracowanie wyników pomiarowych
Obliczyć ilość ładunku, który przepłynął przez roztwór podczas elektrolizy badanego roztworu kwasu siarkowego (VI) korzystając z zależności:
gdzie : m2= masa katody po elektrolizie (26,797g);
m1= masa katody przed elektrolizą (26,773g);
F= stała Faradaya (96500C).
Po podstawieniu do powyższej zależności wartości liczbowych ilość ładunku , która przepłynęła przez roztwór wynosi: Q=72,899 C
Na podstawie wyników miareczkowania roztworu przed i po elektrolizie obliczmy zmianę ilości gramojonów czyli zmianę ilości moli odpowiednio dla H+ , Cl- w użytej w doświadczeniu objętości roztworu.
Roztwór miareczkujący NaOH : C= 0,1M
Objętość roztworu miareczkującego przed elektrolizą V1=0,01904 dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni anodowej V2a=0,01913dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni katodowej V2k= 0,01856 dm3
Roztwór miareczkowany HCl : V=0,020 dm3
Roztwór miareczkujący NaOH : C= 0,1M
Objętość roztworu miareczkującego przed elektrolizą V1=0,07616 dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni anodowej V2a=0,07652dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni katodowej V2k= 0,07424 dm3
Roztwór miareczkowany HCl : V=0,080 dm3
Obliczanie ilości moli przed elektrolizą :
Równanie reakcji : NaOH + HCl → NaCl +H2O
Wzór na stężenie molowe : ![]()
Ilość moli NaOH
= 0,007616 mol
Zgodnie z powyższym równaniem reakcji NaOH i HCl reagują ze sobą w proporcjach 1:1 czyli :
1 mol NaOH = 1 mol HCl
0,007616 mola = x moli, czyli :
x = 0,007616
Stężenie molowe HCl obliczamy ze wzoru
Ck = 0,0952 M
Równia reakcji dysocjacji HCl :
HCl → H+ + Cl - gdzie ![]()
![]()
założenie : [H+ ] = [Cl - ]
czyli :
po przekształceniu : ![]()
stężenie moli H+ i Cl -wynosi = 975,7M
ilość moli poszczególnych jonów obliczmy ze wzoru : ![]()
![]()
Obliczanie ilości moli po elektrolizie na anodzie :
Równanie reakcji : NaOH + HCl → NaCl +H2O
Wzór na stężenie molowe : ![]()
Ilość moli NaOH
= 0,007652
Zgodnie z powyższym równaniem reakcji NaOH i HCl reagują ze sobą w proporcjach 1:1 czyli :
1 mole = 1 mol
0,007652mola = x moli, czyli :
x= 0,007652
Stężenie molowe HCl obliczamy ze wzoru
Ck = = 0,09565 M
Równia reakcji dysocjacji HCl :
HCl H+ + Cl - Ka1= 107
założenie : [H+ ] = [Cl - ]
czyli :
po przekształceniu :
stężenie moli H+ wynosi = 978 M
ilość moli poszczególnych jonów obliczmy ze wzoru : ![]()
![]()
78,24 = [Cl - ]
Obliczanie ilości moli po elektrolizie na katodzie :
Równanie reakcji : NaOH + HCl → NaCl +H2O
Wzór na stężenie molowe : ![]()
Ilość moli NaOH
= 0,07424 mol
Zgodnie z powyższym równaniem reakcji NaOH i HCl reagują ze sobą w proporcjach 1:1 czyli :
1 mole = 1 mol
0,07424 mola = x moli, czyli :
x= 0,07424
Stężenie molowe HCl obliczamy ze wzoru
Ck = 0,928
Równia reakcji dysocjacji HCl :
HCl → H+ + Cl - Ka1= 107
założenie : [H+ ] = [Cl - ]
czyli :
po przekształceniu : 3046,31M = [Cl - ]
stężenie moli H+ wynosi =3046,31M
ilość moli poszczególnych jonów obliczmy ze wzoru :
po przekształceniu
243,7 mol = [Cl - ]
Zmiana ilości moli jonów w roztworze
Mole |
|
Wartość początkowa [mol] |
78,056 |
Wartość na anodzie [mol] |
78,24 |
Wartość na katodzie [mol] |
243,7 |
Różnica wartości początkowej (anoda) |
-0,184 |
Różnica wartości początkowej (katoda) |
-165,644 |
Na podstawie wzorów wynikających z rozważania zmian zachodzących w przestrzeniach przyelektrodowych wyznaczymy liczby przenoszenia jonów.
Równania reakcji procesów zachodzących na elektrodach :
K(-): 2H++ 2e- → H2
A(+): 2Cl- -2e- → Cl2
zmiany ilości moli w przestrzeniach ma wzór :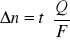
po przekształceniu powyższego wzoru wyznaczamy liczby przenoszenia jonów :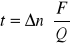
wyliczamy dla przestrzeni anodowej :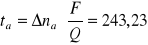
wyliczamy dla przestrzeni katodowej : ![]()
Porównać uzyskane wyniki z literaturowymi i obliczyć błąd pomiaru kulometrycznego.
Współczynnik aktywności przenoszenia jonów HCl z danych tablicowych wynosi … dla roztworu 0.1 molalnego, wartości wyliczone w doświadczeniu są dla roztworu 0,0952 molalnego i wynoszą dla przestrzeni anodowej ![]()
a dla przestrzeni katodowej ![]()
.
Obliczamy błąd kulometryczny
Z pierwsze prawa Faradaya możemy wyliczyć masę substancji wydzielonej na elektrodzie
gdzie:
- masa substancji wydzielona na elektrodzie;
I - natężenie prądu (50 mA);
t- czas trwania elektrolizy ( 40 min = 2400 s)
- równoważnik elektrochemiczny, który ma wzór
gdzie : A- masa atomowa substancji wydzielonej na elektrodzie(dla Cu = 64 g/mol)
Po podstawieniu wartości do równania na masę substancji wydzielonej na elektrodzie,
=0,0398g
W doświadczeniu masa wydzielona na elektrodzie wynosiła
= 0,024g.
Błąd pomiaru wynosi
= 60,3%
Wnioski
Prędkości jonów są małe. Wynika to z dużej lepkości ośrodka, w którym poruszają się jony, a przy tym ruchy temperaturowe cząsteczek rozpuszczalnika też wpływają hamująco na ukierunkowany ruch jonów. Płaszcz solwatacyjny zwiększa wymiary jonów, utrudniając poruszanie się ich. Występuje jeszcze jeden czynnik utrudniający ruch jonów - ich nierównomierne rozmieszczenie w roztworze. Niejednakowe prędkości poruszających się w polu elektrycznym jonów pochodzących z jednego elektrolitu powodują makroskopowe zmiany stężeń w poszczególnych częściach roztworu.
Ruchliwości kationu wodorowego i anionu chlorkowego różnią się bardzo znacznie, pozostając w stosunku ok. 5:1. Mechanizm przepływu prądu przez poszczególne części układu jest różny. Od zasilającego układ źródła prąd płynie przez przewodniki I klasy, druty łącznikowe i metaliczne elektrody, wykonane na przykład w rozważanym przypadku z platyny. Nośnikami są tu elektrony. Granicę faz przekraczają tylko jony chlorkowe przechodzące na anodzie w atomy chloru. Odczepione od nich elektrony odpływają przez przewodniki I klasy. Przez wspomnianą granicę faz elektron jest przenoszony tylko przez jeden rodzaj jonów. Natomiast w roztworze elektrolitu między elektrodami nośnikami elektronu są obydwa rodzaje jonów, w których każdy porusza się w kierunku innej elektrody. Na granicy faz katoda-roztwór nośnikami naboju są tylko jony wodorowe. Pobierają one elektrony z metalu katody, przemieniając się w atomy wodoru. Wskutek przepływu 1 F naboju przez elektrolizer ilość chlorowodoru zmaleje w przestrzeni anodowej o 5/6 mola, a w przestrzeni katodowej o 1/6 mola; zmiany nastąpią w stosunku równym stosunkowi ruchliwości kationu i anionu. Suma liczb przenoszenia wszystkich jonów roztworu jest równa jedności.
Liczby przenoszenia jak widać na przykładzie tego doświadczenia, można łatwo wyznaczać doświadczalnie, oznaczając zmiany stężeń roztworu w przestrzeniach anodowej i katodowej (co daje stosunek ruchliwości jonów równy stosunkowi liczb przenoszenia, gdy roztwór zawiera jeden elektrolit symetryczny; drugim niezbędnym równaniem do znalezienia dwóch niewiadomych jest suma liczb przenoszenia równa jedności). Ruchliwości jonów w danym rozpuszczalniku zależą od stężenia roztworu i od jego temperatury. Od tych samych parametrów w mniejszym stopniu zależą liczby przenoszenia. Dla elektrolitu symetrycznego ze wzrostem temperatury liczby przenoszenia dążą do wartości 0,5. Natężenie prądu nie ma wpływu na wartość liczb przenoszenia, które natomiast zależą od rodzaju rozpuszczalnika. Liczby przenoszenia zwane liczbami Hittorfa, wyznaczone w opisany wyżej sposób pomiarami zmiany stężenia elektrolitu nie są dokładne. W obliczeniach wykonywanych do ich wyznaczenia nie uwzględniamy solwatacji jonów, która powoduje, że przenoszone są jony rozpuszczalnika równocześnie wędrówki jonów w polu elektrycznym.
5
Wyszukiwarka
Podobne podstrony:
nasze przenoszenie jonów dobrze, fizyczna, chemia fizyczna, Fizyczna, laborki
Ćwiczenie 2 - liczby przenoszenia i ruchliwosc jonow, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Liczby przenoszenia, Chemia Fizyczna, chemia fizyczna- laborki rozne, Liczby przenoszenia
Nasze H2O2, Chemia Fizyczna, chemia fizyczna- laborki rozne, lab10
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Dane, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
teoria 1, fizyczna, chemia fizyczna, Fizyczna, laborki
więcej podobnych podstron