Agnieszka Magiera i Ewelina Zielińska
Sprawozdanie z ćwiczenia 8.
Wstęp teoretyczny:
Opracowanie wyników pomiarowych
Obliczyć ilość ładunku, który przepłynął przez roztwór podczas elektrolizy badanego roztworu kwasu siarkowego (VI) korzystając z zależności:
gdzie : m2= masa katody po elektrolizie (26,797g);
m1= masa katody przed elektrolizą (26,773g);
F= stała Faradaya (96500C).
Po podstawieniu do powyższej zależności wartości liczbowych ilość ładunku , która przepłynęła przez roztwór wynosi: Q=72,899 C
Na podstawie wyników miareczkowania roztworu przed i po elektrolizie obliczmy zmianę ilości gramojonów czyli zmianę ilości moli odpowiednio dla H+ , Cl- w użytej w doświadczeniu objętości roztworu.
Roztwór miareczkujący NaOH : C= 0,1M
Objętość roztworu miareczkującego przed elektrolizą V1=0,01904 dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni anodowej V2a=0,01913dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni katodowej V2k= 0,01856 dm3
Roztwór miareczkowany HCl : V=0,020 dm3
Roztwór miareczkujący NaOH : C= 0,1M
Objętość roztworu miareczkującego przed elektrolizą V1=0,07616 dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni anodowej V2a=0,07652dm3
Objętość roztworu miareczkującego po elektrolizie z przestrzeni katodowej V2k= 0,07424 dm3
Roztwór miareczkowany HCl : V=0,080 dm3
Obliczanie ilości moli przed elektrolizą :
Równanie reakcji : NaOH + HCl → NaCl +H2O
Wzór na stężenie molowe : ![]()
Ilość moli NaOH
= 0,007616 mol
Zgodnie z powyższym równaniem reakcji NaOH i HCl reagują ze sobą w proporcjach 1:1 czyli :
1 mol NaOH = 1 mol HCl
0,007616 mola = x moli, czyli :
x = 0,007616
Stężenie molowe HCl obliczamy ze wzoru
Ck = 0,0952 M
Równia reakcji dysocjacji HCl :
HCl → H+ + Cl - gdzie ![]()
![]()
założenie : [H+ ] = [Cl - ]
czyli :
po przekształceniu : ![]()
0. 3085
Stężenie moli H+ i Cl -wynosi = 975,7M
ilość moli poszczególnych jonów obliczmy ze wzoru : ![]()
![]()
0,0235
Obliczanie ilości moli po elektrolizie na anodzie :
Równanie reakcji : NaOH + HCl → NaCl +H2O
Wzór na stężenie molowe : ![]()
Ilość moli NaOH
= 0,007652
Zgodnie z powyższym równaniem reakcji NaOH i HCl reagują ze sobą w proporcjach 1:1 czyli :
1 mole = 1 mol
0,007652mola = x moli, czyli :
x= 0,007652
Stężenie molowe HCl obliczamy ze wzoru
Ck = = 0,09565 M
Równia reakcji dysocjacji HCl :
HCl H+ + Cl - Ka1= 107
założenie : [H+ ] = [Cl - ] czyli :
po przekształceniu : 0,0392
stężenie moli H+ wynosi = ![]()
M
ilość moli poszczególnych jonów obliczmy ze wzoru : ![]()
![]()
78,24 = [Cl - ] 0,00299
Obliczanie ilości moli po elektrolizie na katodzie :
Równanie reakcji : NaOH + HCl → NaCl +H2O
Wzór na stężenie molowe : ![]()
Ilość moli NaOH
= 0,07424 mol
Zgodnie z powyższym równaniem reakcji NaOH i HCl reagują ze sobą w proporcjach 1:1 czyli :
1 mole = 1 mol
0,07424 mola = x moli, czyli :
x= 0,07424
Stężenie molowe HCl obliczamy ze wzoru
Ck = 0,928
Równia reakcji dysocjacji HCl :
HCl → H+ + Cl - Ka1= 107
założenie : [H+ ] = [Cl - ]
czyli :
po przekształceniu : 3046,31M = [Cl - ] 0,9633
Stężenie moli H+ wynosi =3046,31M
ilość moli poszczególnych jonów obliczmy ze wzoru :
po przekształceniu
243,7 mol = [Cl - ] 0,0715
Zmiana ilości moli jonów w roztworze
Mole |
|
Wartość początkowa [mol] |
78,056 0,0235 |
Wartość na anodzie [mol] |
78,24 0,00299 |
Wartość na katodzie [mol] |
243,7 0,9633 |
Różnica wartości początkowej (anoda) |
-0,184 0,02051 |
Różnica wartości początkowej (katoda) |
-165,644 -0,9398 |
Na podstawie wzorów wynikających z rozważania zmian zachodzących w przestrzeniach przyelektrodowych wyznaczymy liczby przenoszenia jonów.
Równania reakcji procesów zachodzących na elektrodach :
K(-): 2H++ 2e- → H2
A(+): 2Cl- -2e- → Cl2
zmiany ilości moli w przestrzeniach ma wzór :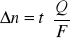
po przekształceniu powyższego wzoru wyznaczamy liczby przenoszenia jonów :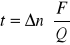
wyliczamy dla przestrzeni anodowej :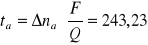
27
wyliczamy dla przestrzeni katodowej : ![]()
Porównać uzyskane wyniki z literaturowymi i obliczyć błąd pomiaru kulometrycznego.
Współczynnik aktywności przenoszenia jonów HCl z danych tablicowych wynosi 0,5 dla roztworu 0.1 molalnego, wartości wyliczone w doświadczeniu są dla roztworu 0,0952 molalnego i wynoszą dla przestrzeni anodowej ![]()
a dla przestrzeni katodowej ![]()
.
Obliczamy błąd kulometryczny
Z pierwsze prawa Faradaya możemy wyliczyć masę substancji wydzielonej na elektrodzie
gdzie:
- masa substancji wydzielona na elektrodzie;
I - natężenie prądu (50 mA);
t- czas trwania elektrolizy ( 40 min = 2400 s)
- równoważnik elektrochemiczny, który ma wzór
gdzie : A- masa atomowa substancji wydzielonej na elektrodzie(dla Cu = 64 g/mol)
Po podstawieniu wartości do równania na masę substancji wydzielonej na elektrodzie,
=0,0398g
W doświadczeniu masa wydzielona na elektrodzie wynosiła
= 0,024g.
Błąd pomiaru wynosi 60,3%
Wnioski
Błędy, które wychodzą z naszych obliczeń, są bardzo duże, co zostało spowodowane problemami z biuretą. Podczas wykonywania trzech pierwszych miareczkowań, biureta nie była szczelna i przekroczyłyśmy punkt równoważnikowy. Poza tym, w momencie miareczkowania płynu przykatodowego, fenoloftaleina zabarwiła nam się na kolor żółto-brązowy, mętny, co prowadzący wyjaśnił jako konsekwencje obecności smarów i klejów w roztworze. To również było następstwem posiadania zepsutej biurety. W następnych pomiarach pani laborantka przyniosła nam drugą biuretę, która sprawowała się już znakomicie, jednakże nie mogłyśmy powtórzyć wcześniejszych pomiarów - musiałybyśmy przeprowadzić całe ćwiczenie od początku, a to było niemożliwe z powodów czasowych i prowadzący zatwierdził otrzymane przez nas dane z uwzględnieniem błędnych pierwszych pomiarów. Trzeba o tym pamiętać w momencie sprawdzania otrzymanych przez nas danych. Błąd, który otrzymujemy, jest spowodowany problemami technicznymi, nie wynikającymi z naszej winy, a nie merytorycznymi pomyłkami. Dalsze wnioski starałyśmy się oprzeć na naszych teoretycznych rozważaniach i przewidywanych przez nas wynikach pomiarowych.
Prędkości jonów są małe. Wynika to z dużej lepkości ośrodka, w którym poruszają się jony, a przy tym ruchy temperaturowe cząsteczek rozpuszczalnika też wpływają hamująco na ukierunkowany ruch jonów. Płaszcz solwatacyjny zwiększa wymiary jonów, utrudniając poruszanie się ich. Występuje jeszcze jeden czynnik utrudniający ruch jonów - ich nierównomierne rozmieszczenie w roztworze. Niejednakowe prędkości poruszających się w polu elektrycznym jonów pochodzących z jednego elektrolitu powodują makroskopowe zmiany stężeń w poszczególnych częściach roztworu.
Ruchliwości kationu wodorowego i anionu chlorkowego różnią się bardzo znacznie, pozostając w stosunku ok. 5:1. Mechanizm przepływu prądu przez poszczególne części układu jest różny.
Liczby przenoszenia jak widać na przykładzie tego doświadczenia, można łatwo wyznaczać doświadczalnie, oznaczając zmiany stężeń roztworu w przestrzeniach anodowej i katodowej. Ruchliwości jonów w danym rozpuszczalniku zależą od stężenia roztworu i od jego temperatury. Od tych samych parametrów w mniejszym stopniu zależą liczby przenoszenia. Dla elektrolitu symetrycznego ze wzrostem temperatury liczby przenoszenia dążą do wartości 0,5. Natężenie prądu nie ma wpływu na wartość liczb przenoszenia, które natomiast zależą od rodzaju rozpuszczalnika. Liczby przenoszenia zwane liczbami Hittorfa, wyznaczone w opisany wyżej sposób pomiarami zmiany stężenia elektrolitu nie są dokładne. W obliczeniach wykonywanych do ich wyznaczenia nie uwzględniamy solwatacji jonów, która powoduje, że przenoszone są jony rozpuszczalnika równocześnie wędrówki jonów w polu elektrycznym. Liczba Hittorfa nie jest charakterystyczna dla jonu, ponieważ zależy od przewodnictwa równoważnikowego także innych jonów wchodzących w skład elektrolitu oraz od stężenia - maleje ze wzrostem stężenia. Dla jonów H3O+ i OH- liczba Hittorfa wynosi ok. 0,8; dla innych jonów ok. 0,5; dla cząstek obojętnych jest równa zeru.
Jak widać na podstawie wyżej wypisanych przez wniosków, obecność różnych klejów i smarów w roztworze miała dość znaczny wpływ na wyznaczaną przez nas ruchliwość jonów, a ich obecność nie była naszą winą.
5
Wyszukiwarka
Podobne podstrony:
nasze przenoszenie jonów, fizyczna, chemia fizyczna, Fizyczna, laborki
Ćwiczenie 2 - liczby przenoszenia i ruchliwosc jonow, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Liczby przenoszenia, Chemia Fizyczna, chemia fizyczna- laborki rozne, Liczby przenoszenia
Nasze H2O2, Chemia Fizyczna, chemia fizyczna- laborki rozne, lab10
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Dane, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
teoria 1, fizyczna, chemia fizyczna, Fizyczna, laborki
więcej podobnych podstron