ALKACYMETRIA
Teoria Bronsteda kwasów i zasad.
Większość cząsteczek ulega reakcji protolizy czyli reakcji z cząsteczką wody. Reakcji protolizy nie ulegają:
kationy I grupy układu okresowego i początku II grupy - Mg, Ca, Be
aniony, które są resztami kwasowymi silnych kwasów
Teoria Bronsteda stwierdza, że kwasami są wszystkie substancje zdolne oddać proton, a zasadami - substancje zdolne przyjąć proton.
HA → H+ + A-
KWAS 1 ZASADA 1
B + H+ → BH+
ZASADA 2 KWAS 2
HA + BH ⇔ BH + A
KW. 1 ZAS. 2 KW. 2 ZAS.1
Kwasami wg Bronsteda są:
kwasy cząsteczkowe
kationy, np. H3O+ , NH4+
wszystkie uwodnione jony metali - kwasy słabe
niektóre aniony, np. HS-
Zasadami wg Bronsteda są:
zasady cząsteczkowe
aniony - reszty kwasowe słabych kwasów
Istnieją również związki, które w zależności od środowiska mogą być albo kwasem albo zasadą. Są to amfotery.
Czym wg teorii protonowej są: HCO3- , Ni(H2O)n2+ , SO32-
HCO3- jest amfolitem
Ni(H2O)n2+ jest kwasem
SO32- jest zasadą
Który z kwasów jest najmocniejszy: HclO4 , HCl , HNO3 .
Miarą mocy kwasów jest stała dysocjacji kwasów. Powyższe kwasy mają w wodzie taką samą moc gdyż ich stopień dysocjacji wynosi 1 (100%). Jest to tzw. efekt wyrównujący wody.
W innym rozpuszczalniku niż woda mają różną moc.
Podaj: wartość iloczynu jonowego wody; pH 0,1M roztworu kwasu octowego (pKa= 4,75)
2H2O ⇔ H3O+ + OH-
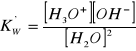
Wartość [H2O] jest stała i wynosi 55,5
K'w [H2O] = Kw = [H3O+][ OH-]
Kw = 10-14
[H3O+][ OH-] = 10-14
0,1M CH3COOH pKa= 4,75
H+ = c . α α<1
![]()
![]()
![]()
= 2,9
Podaj skład i wyjaśnij zasadę działania roztworu buforowego.
Bufory są to roztwory zawierające słaby kwas i sprzężoną z nim zasadę lub słabą zasadę i sprzężony z nią kwas. Roztwory te pod wpływem dodawania małej ilości kwasu lub zasady nieznacznie zmieniają swoje pH, gdyż zależy ono od stosunku ich stężeń.
CH3COOH + H2O → CH3COO- + H3O+
SŁABY KWAS SPRZĘŻONA
Z NIM ZASADA
![]()
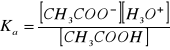
![]()
Ka - stała dysocjacji kwasu octowego
![]()
![]()
Mamy mieszaninę CH3COOH, CH3COO- , Na+
Jeżeli wprowadzimy zasadę - OH- przereaguje z CH3COOH - powstanie obojętna woda i jony CH3COO- nie wpływające na pH.
Jeżeli wprowadzimy kwas - H3O+ przereaguje z CH3COO- i powstanie słabo dysocjujący kwas CH3COOH nie zmieniający pH.
REDOKSYMETRIA
Na czym polega reakcja utleniania i redukcji. Reakcje połówkowe i końcowe.
Reakcja utleniania polega oddawaniu elektronów. Można ją zapisać ogólnie:
red1 ⇔ utl1 + ne
Reakcja redukcji polega na pobraniu elektronów:
utl2 + ne ⇔ red2
utl1 + n1e → red1 |n2
red2 → utl2 + n2e |n1
n2utl1 + n1red2 = n2red1 + n1utl2 |
W jaki sposób wyznaczamy potencjał normalny układu redoks. Jak zbudowana jest elektroda wodorowa. Od czego zależy jej potencjał.
Potencjał układu redoks ustala się tylko w odniesieniu do pewnego potencjału, przyjętego za zerowy. Za taki zerowy potencjał przyjęto potencjał normalnej elektrody wodorowej. Elektroda wodorowa jest to blaszka platynowa pokryta czernią platynową, zanurzona w roztworze jonów wodorowych o aktywności 1 i obmywana wodorem pod ciśnieniem 1 atm.
W układzie tym ustala się równowaga:
H2 ⇔ 2H+ + 2e
Potencjał układu wynosi, zgodnie ze wzorem Nernsta:
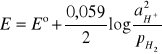
W warunkach normalnych ![]()
= 1 oraz ![]()
= 1, potencjał elektrody będzie zatem równy potencjałowi normalnemu, który właśnie przyjęto za równy zeru:
E = E° = 0
Wzór ten pozwala ustalić zależność między potencjałem elektrody wodorowej a aktywnością jonów wodorowych w roztworze. W przypadku roztworów rozcieńczonych, kiedy ![]()
= [H+], jest to zależność między potencjałem elektrody wodorowej a stężeniem jonów wodorowych, czyli pH roztworu.
Przyjmując, że ciśnienie wodoru jest równe 1 atm wzór przekształca się do postaci:
![]()
Pamiętając, że pH = -log[H+], można napisać:
E = 0,059 pH |
Zmiana pH o 1 powoduje zmianę potencjału o 59 mV.
Reakcja połówkowa dla jonu dwuchromianowego i środowiska kwaśnego. Równanie Nernsta. Obliczyć gramorównoważnik redoks K2Cr2O7.
Cr2O72- + 14H+ + 6e ⇔ 2Cr3+ + 7 H2O
![]()
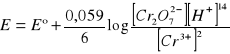
gramorównoważnik K2Cr2O7 = ![]()
= ![]()
= 49
Dokończyć reakcje jeżeli zachodzą:
Fe + HCl Cu + HNO3 Cu + HCl Cu2+ + Fe
Fe2+/ Fe3+ = -0,44V
NO3-/ NO = +0,96V
Fe + 2HCl → Fe2+ + H2 + 2Cl-
Fe0 → Fe+2 + 2e |1
2H+ + 2e → H2 |1
3Cu + 8HNO3 →3Cu(NO3)2 + 2NO↑ + 4H2O
Cu0 → Cu2+ + 2e |3
N+5 + 3e → N+2 |2
Cu + HCl → nie zachodzi
Cu2+ + Fe → Cu + Fe+2
Cu2+ + 2e → Cu0 |1
Fe → Fe+2 + 2e |1
Czy pH roztworu, wytrącanie osadu lub kompleksowanie mają wpływ na potencjał układu redoks. Jeżeli tak to podać przykład.
pH ma wpływ na potencjał układu redoks, w przypadku gdy w reakcji biorą udział jony H+ lub OH-.
Przykładowo dla reakcji:
MnO4- + 5e + 8H+ → Mn2+ + 4H2O
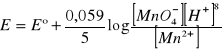
![]()
W połowie miareczkowania, gdy [MnO4-] = [Mn2+]
E° = 1,52
pH = 0
E = 1,52 + 0 - 0 = 1,52
pH = 3
E = 1,52 + 0 - 0,094 . 3 = 1,24
pH = 6
E = 0,95
Obniżenie kwasowości powoduje zmniejszenie potencjału, zwiększenie - potencjał układu rośnie.
Kompleksowanie również ma wpływ na potencjał redoks.
Fe3+ + e → Fe2+
![]()
Fe3+ + [L] → [FeL]3+
[FeL]3+ → [L] + Fe3+ stała nietrwałości 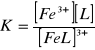
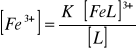
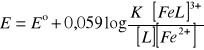
Kompleksowanie powoduje obniżenie potencjału redoks.
Przykładem wpływu reakcji wytrącania osadów na potencjał układu redoks może być jodometryczne oznaczenie Cu2+. Normalny potencjał układu Cu2+/Cu+ wynosi 0,17V, natomiast potencjał normalny układu I2/2I- wynosi 0,53V. Należałoby więc przewidywać, że jony Cu+ powinny być utleniane przez jod do Cu2+. W rzeczywistości zachodzi reakcja w odwrotnym kierunku
2 Cu2+ + 4I- → 2CuI + I2
Wytłumaczenie tego przebiegu reakcji jest następujące: potencjał redoks układu Cu2+/ Cu+ wynosi
![]()
Wskutek wytrącania trudno rozpuszczalnego osadu CuI, w roztworze pozostaje bardzo małe stężenie jonów Cu+. Iloczyn rozpuszczalności IRCuI = 10-12, a więc stężenie jonów Cu+ w roztworze 0,1 mol/l KI wyniesie
![]()
Wobec tak małego stężenia formy zredukowanej, potencjał układu ulegnie znacznemu zwiększeniu, osiągając dla roztworu soli miedzi o stężeniu 0,1 mol/l, wartość
![]()
Dzięki tak dużemu wzrostowi potencjału (z 0,17V do 0,76V) jony Cu2+utleniają jony I- i reakcja przebiega w kierunku tworzenia CuI i I2, którego miareczkowe oznaczenie stanowi podstawę oznaczania Cu2+ w roztworze.
Jak podczas miareczkowania zmienia się potencjał. Wzór na EPR.
red1 ⇔ utl1 + ne E1
utl2 + ne ⇔ red2 E2
Początkowo potencjał redoks jest równy 0, ponieważ występuje tylko red1. Potencjał zależy od stosunku stężeń utl1 i red1 . Utl2 i red2 nie wpływają na potencjał.
Potencjał układu rośnie, gdyż w trakcie miareczkowania wzrasta stężenie utl1 i wyraża się wzorem
![]()
W punkcie równoważności następuje zrównanie potencjałów obu układów
![]()
Równanie ogólne wyrażające potencjał w PR miareczkowania ma postać
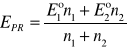
Po przekroczeniu PR potencjał roztworu zależy wyłącznie od stosunku stężeń utl2 i red2 i wyraża się wzorem
![]()
Reakcja z ćwiczenia
2MnO4- + 5H2O2 + 6H+ → 2Mn2+ + 5O2↑ + 8H2O
Mn+7 + 5e → Mn+2 |2
2O- → O2 + 2e |5
KOMPLEKSOMETRIA
Oblicz: Próbkę zawierającą jony Ca2+ i Mg2+ o masie 0,5000 grama rozpuszczono i rozcieńczono w kolbce miarowej do 100,0 ml. Następnie z tego roztworu pobrano dwie porcje po 20,0 ml każda. Jedną z nich miareczkowano wobec czerni eriochromowej T przy pH = 10 zużywając 35,5 ml 0,0104 molowego roztworu EDTA. Drugą miareczkowano wobec mureksydu w silnie zasadowym środowisku zużywając 30,2 ml tego samego roztworu EDTA. Oblicz % zawartość jonów wapnia i magnezu w badanej próbce. /Mg - 24,3; Ca - 40/
mCa = V2 . cEDTA . 0,04008 . 5
mMg = (V1 - V2) . cEDTA . 0,02432 . 5
V1 = 35,5 ml
V2 = 30,2 ml
CEDTA = 0,0104 M
mCa = 0,0629 g
mMg = 0,0067 g
0,5 g → 100% 0,5 g → 100%
0,0629 g → x 0,0067 g → x
x = 12,58% Ca x = 1,34% Mg
Wiązanie koordynacyjne.
Wiązanie koordynacyjne (semipolarne) polega na tym, że wspólna para elektronowa pochodzi tylko od jednego atomu (donora), zaś drugi atom (akceptor) uzupełnia powłokę walencyjną elektronami donora. Jest to wiązanie charakterystyczne dla związków kompleksowych, występujące między ligandem a atomem centralnym.
Co to jest i od czego zależy liczba koordynacyjna?
Liczba koordynacyjna jest to liczba wiązań koordynacyjnych utworzonych przez atom centralny, czyli liczba ligandów, które są zgrupowane w kompleksie prostym, dookoła atomu centralnego. Najczęściej liczby koordynacji wynoszą 4 i 6. Liczba koordynacji wiąże się z przestrzenną strukturą kompleksów.
O liczbie koordynacyjnej metalu decydują trzy czynniki: budowa elektronowa, symetria przestrzenna i upakowanie.
Podział związków kompleksowych ze względu na rodzaj ligandu - podaj przykłady.
Ze względu na rodzaj ligandu kompleksy dzieli się na proste i chelatowe.
Kompleksy proste powstają w wyniku reakcji jonu centralnego z ligandami jednofunkcyjnymi, np.:
[H3N → Ag ← NH3]
Kompleksy chelatowe powstają w wyniku reakcji jonu centralnego z ligandami wielofunkcyjnymi z utworzeniem pierścienia, np.:
H2C _ CH2 2+
H2N NH2
Cu
H2N NH2
H2C _ CH2
Wyprowadź i wyjaśnij co to jest warunkowa stała trwałości.
Ogólną stałą trwałości wyraża wzór:
![]()
Z wzoru tego wynika, że stosunek stężenia jonu kompleksowego do stężenia atomu centralnego jest funkcją stężenia ligandu:
![]()
Obliczenie stałej trwałości kompleksu powstającego w roztworze wymaga znajomości stężeń jonów metalu i ligandu nie związanych w kompleks. Jon metalu może wchodzić w skład innych kompleksów, wolny ligand może kompleksować jony innych metali. Obliczenie w takich warunkach stężeń rzeczywiście nie związanych, wolnych jonów metalu i ligandu jest praktycznie niemożliwe. W takich przypadkach można posłużyć się warunkowymi stałymi trwałości.
Dla reakcji:
Me + L ↔ MeL
warunkową stałą trwałości wyraża wzór:
![]()
w którym [Me'] oznacza stężenie jonu metalu obecnego w roztworze we wszystkich postaciach z wyjątkiem kompleksu MeL, [L'] zaś wyraża odpowiednie stężenie ligandu we wszystkich postaciach z wyjątkiem kompleksu MeL.
W celu zobrazowania wpływu ubocznych jonów obecnych w roztworze Schwarzenbach wprowadził pojęcie współczynników reakcji ubocznych α zdefiniowanych wzorami:
![]()
gdzie αMe(A) oznacza współczynnik reakcji ubocznych metalu Me z ligandem konkurującym A, [A] - stężenie ligandu konkurującego, a k'MeA to kolejne stałe trwałościkompleksów jonu Me z ligandem A, oraz:
![]()
gdzie [B] oznacza stężenie konkurującego jonu metalu, a k'BL to kolejne stałe trwałości kompleksów jonu B z ligandem L.
Z powyższych wzorów można obliczyć, że:
[Me'] = αMe[Me] [L'] = αL[L]
Podstawiając te wartości do wzoru na warunkową stałą trwałości otrzymuje się:
![]()
Wzór ten wiąże stałą trwałości βMeL z odpowiednią warunkową stałą trwałości β'MeL, przy czym współczynniki αMe i αL określają uboczne wpływy innych jonów metali lub innych ligandów.
Napisz wzór strukturalny EDTA i zaznacz atomy ligandowe.
HOOCH2C H H CH2COOH
| |
N ― C ― C ― N
| |
HOOCH2C H H CH2COOH
Zasada działania i podział wskaźników w kompleksometrii /przykłady/.
Wskaźniki stosowane w kompleksometrii można podzielić na wskaźniki redoks i tzw. metalowskaźniki .
Do wskaźników redoks należy przede wszystkim błękit wariaminowy. Oznaczenie kompleksometryczne wobec wskaźników redoks polega na zmianie potencjału układu na skutek związania kationu w trwały kompleks. Postać utleniona błękitu wariaminowego ma barwę niebieską. Na skutek gwałtownego zmniejszenia potencjału redoks następuje odbarwienie roztworu.
Metalowskaźniki można podzielić na trzy grupy.
Grupa I są to związki praktycznie bezbarwne, np. kwas salicylowy. Związki te reagując z kationami tworzą barwne kompleksy.
Grupa II są to związki, które reagując z kationem powodują zmętnienie, np. H2C2O4 dla Ca2+, lub tworzą zabarwione, nierozpuszczalne lub koloidalne laki (np. galocyjanina dla Ga).
Grupa III, tzw. wskaźniki metalochromowe są to barwniki organiczne zdolne do tworzenia kompleksów z metalami, przy czym reakcji towarzyszy zmiana zabarwienia. Zmiany zabarwienia wskaźników tej grupy są ostrzejsze i wyraźniejsze niż wskaźników należących do grup poprzednich. Przykładem wskaźnika jest czerń eriochromowa T mająca dwa przejścia barwne odpowiadające dwustopniowej dysocjacji protonów z grup hydroksylowych:
pH=6,3 pH=11,5
H2F- → HF2- → F3-
różowy niebieski pomarańczowy
ARGENTOMETRIA 1
Podaj dokładną definicję iloczynu rozpuszczalności i zapisz jego postać stężeniową i termodynamiczną.
Iloczynem rozpuszczalności trudno rozpuszczalnej substancji AB nazywamy iloczyn stężeń jonów tej substancji w roztworze pozostających w równowadze z osadem.
W przypadku reakcji ogólnej typu:
mAn+ + nBm- ⇔ AmBn↓
iloczyn rozpuszczalności trudno rozpuszczalnego związku AmBn wyrazi się wzorem:
IR = [An+]m [Bm-]n
lub w postaci termodynamicznej:
IR = [An+]m [Bm-]n fA+ . fB-
gdzie współczynniki f odpowiadają współczynnikom aktywności.
Oblicz rozpuszczalność (mol/l) osadu siarczanu baru / IR = 1. 10-10/ :
a) w wodzie b) w 0,01 molowym r - rze Na2SO4 c) w 0,1 molowym r - rze NaCl
i wyjaśnij dlaczego jest ona inna w każdym z podanych wyżej roztworów.
IR = [Ba 2+] [SO42-] ![]()
= 1 . 10-10
[Ba 2+] = [SO42-] = 10-5
w wodzie
![]()
![]()
![]()
Rozpuszczalność siarczanu baru w wodzie wynosi 10-5 mol/l.
w 0,01 molowym r - rze Na2SO4
[Ba 2+] [SO42-] = 10-10
[SO42-] = 10-2
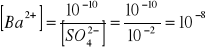
mol/l
Rozpuszczalność siarczanu baru w 0,01 molowym r - rze Na2SO4 jest dużo mniejsza niż w wodzie . Jest to spowodowane efektem wspólnego jonu, który powoduje zmniejszenie rozpuszczalności osadu na skutek obecności jonu wspólnego z osadem w roztworze.
w 0,1 molowym r - rze NaCl
![]()
(składniki wynikające z obecności Ba 2+ i SO42- pominięto jako niewspółmiernie mniejsze)
![]()
![]()
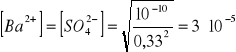
Rozpuszczalność siarczanu baru w 0,1 molowym r - rze NaCl wzrosła 3-krotnie w stosunku do rozpuszczalności w wodzie. Spowodowane jest to efektem solnym polegającym na zwiększeniu rozpuszczalności substancji o budowie jonowej pod wpływem elektrolitów.
Co decyduje o kolejności wytrącania jonów w postaci trudno rozpuszczalnego osadu soli srebrowej w przypadku mieszaniny zawierającej jony: a) Cl- , Br- , I- b) CrO42- , Cl-
odpowiedź uzasadnij. / IRbromku = 5 . 10-13, IRchlorku = 1,5 . 10-10, IRchromianu = 1,3 . 10-12,
IRjodku = 8 . 10-17/
a)
x x x
AgCl → Ag+ + Cl-
IR = 1,5 . 10-10
[Ag+] [Cl-] = 1,5 . 10-10
x . x = 1,5 . 10-10
x = ![]()
[Ag+] = 1,22 . 10-5
Osad AgCl zacznie się wytrącać wtedy, gdy w roztworze będzie stężenie jonów [Ag+] = 1,22 .10-5
x x x
AgBr → Ag+ + Br-
IR = 5 . 10-13
[Ag+] [Br-] = 1,5 . 10-10
x . x = 5 . 10-13
x = ![]()
[Ag+] = 7,07 . 10-6
Osad AgCl zacznie się wytrącać wtedy, gdy w roztworze będzie stężenie jonów [Ag+] = 7,07 . 10-6
x x x
AgI → Ag+ + I-
IR = 8 . 10-17
[Ag+] [I-] = 1,5 . 10-10
x . x = 8 . 10-17
x = ![]()
[Ag+] = 8,94 . 10-8
Osad AgCl zacznie się wytrącać wtedy, gdy w roztworze będzie stężenie jonów [Ag+] = 8,94 . 10-8
Jako pierwszy strąca się osad jodku następnie bromku a na końcu chlorku srebra.
b)
x x x
AgCl → Ag+ + Cl-
IR = 1,5 . 10-10
[Ag+] [Cl-] = 1,5 . 10-10
x . x = 1,5 . 10-10
x = ![]()
[Ag+] = 1,22 . 10-5
Osad AgCl zacznie się wytrącać wtedy, gdy w roztworze będzie stężenie jonów [Ag+] = 1,22 .10-5
Ag2CrO4 → 2Ag+ + CrO42-
IR = 1,3 . 10-12
[Ag+] [CrO4-] = 1,3 . 10-12
x . x = 1,3 . 10-12
x = ![]()
[Ag+] = 1,14 . 10-6
Osad AgCl zacznie się wytrącać wtedy, gdy w roztworze będzie stężenie jonów [Ag+] = 1,14 . 10-6
Jako pierwszy wytrąci się osad chromianu a następnie chlorku srebra.
O kolejności wytrącania jonów decyduje stężenie jonów srebra przy którym zacznie się wytrącać osad danej soli. Samo porównanie iloczynów rozpuszczalności może prowadzić do błędnych wniosków.
Na czym polega metoda Mohra oznaczania chlorków / napisz odpowiednie reakcje i wyjaśnij dlaczego odczyn roztworu powinien być obojętny.
Metoda Mohra polega na bezpośrednim miareczkowaniu obojętnego roztworu zawierającego chlorki mianowanym roztworem AgNO3 w obecności jonów chromianowych. Dodawany azotan srebra strąca trudno rozpuszczalny osad chlorku srebra:
Ag+ + Cl- → AgCl↓
W końcu miareczkowania, gdy stężenie jonów Ag+ w roztworze stanie się odpowiednio duże, zaczyna strącać się brunatnoczerwony osad chromianu srebrowego i pojawia się brunatne zabarwienie:
2Ag+ + CrO42- → Ag2CrO4↓
które wskazuje na koniec miareczkowania.
Sposobem Mohra można miareczkować roztwory chlorków o pH 6,5 - 10,5. Chromian srebrowy, jako sól słabego kwasu, rozpuszcza się w roztworze kwaśnym. W środowisku alkalicznym (pH > 10,5) chromian srebra przechodzi w trudniej rozpuszczalny tlenek Ag2O.
Jaki odczyn i dlaczego powinien mieć roztwór podczas oznaczania chlorków metodą Volharda?
Podczas oznaczania chlorków metodą Volharda roztwór powinien mieć odczyn kwaśny ponieważ wskaźnikiem są jony żelaza Fe3+, które istnieją tylko w roztworach o pH < 3.
Ile miligramów NaCl znajduje się w 100 ml analizowanego roztworu, jeżeli po dodaniu do 25 ml tego roztworu 40 ml 0,1005 molowego roztworu AgNO3 na odmiareczkowanie nadmiaru jonów srebrowych zużyto 5 ml 0,1105 molowego roztworu NH4SCN / napisz odpowiednie reakcje/? Na - 23; Cl - 35,5
Ag+ + Cl- → AgCl↓
Ag+ + SCN- → AgSCN↓
m = (V . M - V1 . M1) . 35,5 . 4
V = 40 ml
M = 0,1005
V1 = 5 ml
M1 = 0.1105
m = (40 . 0,1005 - 5 . 0,1105) . 35,5 . 4 = 492,4 mg
ARGENTOMETRIA 2
Kiedy rozpoczyna się wytrącanie osadu soli trudnorozpuszczalnej?
Strącanie osadu soli trudnorozpuszczalnej zaczyna się po przekroczeniu w roztworze takich stężeń jonów, których iloczyn ma wartość iloczynu rozpuszczalności tej soli.
Porównaj rozpuszczalność chlorku srebra (IR = 1 . 10-10) w wodzie z jego rozpuszczalnością w 0,01 M roztworze NaCl.
IR = [Ag+] [Cl-] ![]()
= 1 . 10-10
[Ag+] = [Cl-] = 10-5
w wodzie
![]()
![]()
![]()
Rozpuszczalność chlorku srebra w wodzie wynosi 10-5 mol/l.
w 0,01 molowym r - rze NaCl
[Ag+] [Cl-] = 10-10
[Cl-] = 10-2
![]()
mol/l
Rozpuszczalność chlorku srebra w 0,01 molowym r - rze NaCl wynosi 10-8 mol/l.
Rozpuszczalność chlorku srebra w 0,01 molowym r - rze NaCl jest dużo mniejsza niż w wodzie . Jest to spowodowane efektem wspólnego jonu, który powoduje zmniejszenie rozpuszczalności osadu na skutek obecności jonu wspólnego z osadem w roztworze.
Wymień rodzaje osadów analitycznych (przykłady).
drobnokrystaliczne, np. BaSO4
krystaliczne
grubokrystaliczne, np. MgNH4PO4
Osady
serowate, np. AgCl
koloidowe
galaretowate, np. Fe(OH)3
hydrofilowe hydrofobowe
SiO2 . nH2O As2S3
Jakie osady poddaje się procesowi starzenia i na czym on polega?
Starzeniem osadu nazywa się zmianę właściwości osadu pozostającego w roztworze macierzystym w miarę upływu czasu. Zmiana ta może następować na skutek np. wzrostu kryształu, rekrystalizacji, zmniejszenia powierzchni rozdziału faz, straty wody lub współstrąconych jonów. Starzenie osadu polega na pozostawieniu osadu na dłuższy czas w kontakcie z roztworem macierzystym. Jedną z form starzenia jest dla osadów krystalicznych dojrzewanie, polegające na tworzeniu się większych kryształów z mniejszych, które charakteryzują się większą rozpuszczalnością niż duże.
Jak dzielimy osady koloidalne ze względu na powinowactwo do rozpuszczalnika.
Pod względem powinowactwa do rozpuszczalników osady koloidowe dzieli się na liofilowe (koloidy odwracalne, przyłączające cząsteczki rozpuszczalnika) i liofobowe (koloidy nieodwracalne, nie wykazujące powinowactwa do rozpuszczalnika).
W związku z powyższym koloid liofilowy definiuje się jako koloid, którego cząstki fazy rozproszonej są solwatowane przez fazę rozpraszającą, np. zol żelatyny w wodzie, lub kauczuku w benzenie.
Koloid liofobowy jest to koloid, którego cząstki fazy rozproszonej nie są solwatowane przez fazę rozpraszającą, np. zole metali szlachetnych w wodzie.
W przypadku, gdy rozpuszczalnikiem jest woda, rozróżnia się koloidy hydrofilowe i hydrofobowe.
Na czym polega peptyzacja i jak jej zapobiegamy?
Peptyzacja jest to przeprowadzenie żelu, czyli świeżo strąconego osadu koloidowego, w zol pod wpływem przemywania czystym rozpuszczalnikiem. Peptyzacja polega na usunięciu z osadu zaadsorbowanych jonów koagulujących - cząstki koloidalne odzyskują swój pierwotny ładunek i ponownie zaczynają się odpychać. Peptyzację obserwuje się np. podczas przemywania czystą wodą świeżo wytrąconych siarczków metali ciężkich.
Ciecz zawierająca speptyzowany siarczek spływa z sączka do naczynia, w którym znajduje się przesącz po oddzieleniu osadu, zawierający nadmiar wytrącającego elektrolitu. W rezultacie zachodzi ponowna koagulacja i wytrącenie osadu, które w analizie nazywa się przechodzeniem osadu przez sączek.
Zapobiega się peptyzacji przez przemywanie osadów koloidowych roztworami elektrolitów.
Oznaczanie żelaza w postaci Fe2O3.: - sposób i warunki oznaczenia
-reakcje zachodzące podczas strącania i prażenia osadu
Metoda polega na straceniu żelaza (III) z kwaśnego roztworu amoniakiem w postaci trudno rozpuszczalnego wodorotlenku żelazowego Fe(OH)3 ( a właściwie uwodnionego tlenku Fe2O3. nH2O) i wyprażeniu osadu do Fe2O3. Amoniak nie strąca jonów żelaza ilościowo, toteż w przypadku ich obecności należy je najpierw utlenić do Fe(III) za pomocą nadtlenku wodoru, wody bromowej lub kwasu azotowego. Wodorotlenek żelazowy jest koloidem o charakterze liofilowym. Aby uniknąć utworzenia się zolu, strąca się żelazo na gorąco z roztworu zawierającego sole amonowe. Zastosowanie do przemywania roztworu soli amonowej zamiast wody zapobiega ewentualnej peptyzacji osadu.
Fe3+ + 3NH3 + H2O → Fe(OH)3 + 3NH4+
Tlenek żelazowy należy prażyć (najlepiej w tyglu porcelanowym lub kwarcowym) w temperaturze wyższej niż 900°C, gdyż dopiero w tej temperaturze staje się on całkowicie niehigroskopijny. W temperaturze wyższej niż 1200°C Fe2O3 przechodzi częściowo w Fe3O4. Sączek z osadem należy spalać powoli, starając się o dobry dostęp powietrza, aby węgiel z sączka nie zredukował brunatnego tlenku Fe2O3 do czarnego Fe3O4
2Fe(OH)3 → Fe2O3 + 3H2O
SPRZĘŻONA PARA
KWAS - ZASADA
Wyszukiwarka
Podobne podstrony:
CHEMIA ANALITYCZNA Pytania na Egzamin, Chemia analityczna, Od Krzemi, Nowy folder
Analka - egzamin zestawy, Chemia analityczna, Egzamin
chemia opracowanie od wszystkich, Mechatronika, Chemia
Zadanie 4 CHEMIA ANALITYCZNA
Chemia analityczna kolos
CHEMIA ANALITYCZNA 2 TEST poprawione przez G M
analiza wody sprawozdanie chemia analityczna analiza wody teoria
chemia analityczna wyklad 11 i 12
kationy IIIgr(1), Farmacja, Farmacja, - Chemia Analityczna
Notatki chemia analityczna
chemia analityczna wyklad 02
Chemia analityczna skrypt
Program, Ochrona Środowiska, Chemia analityczne środowiska
Zasady nazewnictwa wybranych klas zwi-zk-w organicznych, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA
semestr 1, Studia, Ogólne, Fiyzka, od romka, studia materiały, chemia
Fizjologia zwierząt wszystkie opracowania, chemia organiczna, biologia ewolucyjna-wykłady, genetyka,
więcej podobnych podstron