Sposoby wyrażania zawartości substancji rozpuszczonej w roztworze - stężenia
Najczęściej stosowane stężenia:
- ułamek masowy (wagowy), (stężenie procentowe),
- ułamek objętościowy (% objętościowy),
w odniesieniu do roztworów cieczy w cieczach oraz mieszanin gazowych,
- ułamek molowy,
w obliczeniach fizykochemicznych,
- stężenie masowe,
w analizie chemicznej ilościowej,
- stężenie molowe (molowość, molarność),
w analizie chemicznej ilościowej,
- stężenie molalne (molalność),
w obliczeniach fizykochemicznych,
- stężenie normalne,
w niektórych starych normach, obecnie nie zalecane.
Ułamek masowy (wagowy), stężenie procentowe
Ułamek masowy określa stosunek masy składnika roztworu do masy roztworu:
![]()
gdzie: Ws - ułamek masowy (wagowy) składnika
ms - masa składnika [jednostki masy, np.: g, kg]
mr - masa roztworu [jednostki masy, np.: g, kg]
Ułamek masowy - wielkość niemianowana
często:
stężenie procentowe:
![]()
gdzie: ![]()
- stężenie procentowe składnika (stężenie procentowe roztworu)
ms - masa składnika
mr - masa roztworu
lub:
![]()
gdzie: mR - masa rozpuszczalnika
zatem:
Stężenie procentowe (masowe) podaje liczbę gramów substancji rozpuszczonej zawartą w 100 g roztworu.
Suma ułamków masowych wszystkich składników roztworu = 1.
Przykład 1. W 200 g roztworu zawarte jest 25 g wodorotlenku sodu. Obliczyć stężenie procentowe tego roztworu.
dane:
mr = 200 g
ms = 25 g
![]()
= ![]()
= 12,5 % mas.
Przykład 2. W 250 cm3 roztworu kwasu azotowego(V) o gęstości 1,08 g/cm3 zawarte jest 37,8 g czystego kwasu. Obliczyć stężenie procentowe tego roztworu.
dane:
Vr = 250 cm3
dr = 1,08 g/cm3
ms = 37,8 g
ponieważ gęstość dowolnej substancji: d = ![]()
to: mr = dr Vr
czyli:
![]()
![]()
14,0 % mas.
Przykład 3. Do 100,0 g wody wprowadzono 25,0 g CaCl26 H2O. Obliczyć stężenie procentowe powstałego roztworu.
MCa = 40,08 u; MCl = 35,45 u; MH = 1,008 u; MO = 15,999 u;
dane:
![]()
25,0 g
![]()
(100,0 + 25,0) g = 125,0 g
![]()
(40,08 + 235,45 + 121,008 + 615,999)g = 219,07 g
w tym:
![]()
(40,08 + 235,45)g = 110,98 g
zatem, jeżeli:
w 219,07 g CaCl26 H2O jest 110,98 g CaCl2
to: w 25,0 g CaCl26 H2O jest ![]()
stąd:
![]()
= 12,665 g
czyli:
ms = 12,665 g
![]()
mas.
Przykład 4. Obliczyć masę HCl zawartą w 1,00 dm3 30,0 % roztworu tego kwasu. Gęstość roztworu d = 1,15 g/cm3.
dane:
![]()
mas.
Vr = 1,0 dm3 = 1000,0 cm3
dr = 1,15 g/cm3
![]()
skąd:
![]()
= ![]()
![]()
= 345,0 g
Ułamek objętościowy
Ułamek objętościowy określa stosunek objętości danego składnika roztworu do całkowitej objętości roztworu:
![]()
gdzie: Os - ułamek objętościowy
Vs - objętość składnika [jednostki objętości, np.: cm3, dm3, m3]
Vr - objętość roztworu [jednostki objętości, np.: cm3, dm3, m3]
Ułamek objętościowy - wielkość niemianowana
także:
stężenie w procentach objętościowych:
![]()
lub:
![]()
gdzie: VR - objętość rozpuszczalnika
Procent objętościowy podaje liczbę cm3 substancji rozpuszczonej zawartą w 100 cm3 roztworu.
Suma ułamków objętościowych wszystkich składników roztworu = 1.
Przykład 5. Zmieszano 50 cm3 heksanu i 150 cm3 benzenu. Obliczyć procent objętościowy obu składników roztworu.
dane:
Vh = 50 cm3
Vb = 150 cm3
Vr = Vh + Vb = 200 cm3
![]()
= ![]()
= 25 % obj.
![]()
= ![]()
= 75 % obj.
Przykład 6. Obliczyć stężenie procentowe (procent masowy) roztworu metanolu, w którym procent objętościowy metanolu wynosi 48,2. Gęstość tego roztworu dr = 0,936 g/cm3. Gęstość bezwodnego metanolu dm = 0,796 g/cm3.
dane:
![]()
= 48,2 % obj.
dr = 0,936 g/cm3
dm = 0,796 g/cm3
![]()
założenie: 100 cm3 roztworu
tzn.: Vm = 48,2 cm3
![]()
= ![]()
= 38,37 g
![]()
= ![]()
= 93,6 g
![]()
= 40,99 % mas.
Ułamek molowy
Ułamek molowy określa stosunek liczby moli danego składnika roztworu do sumy liczby moli wszystkich składników roztworu:
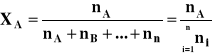
gdzie: XA - ułamek molowy składnika A
nA - liczba moli składnika A
![]()
- suma liczby moli wszystkich składników roztworu
Ułamek molowy - wielkość niemianowana
Suma ułamków molowych wszystkich składników roztworu = 1.
Przykład 7. W 210 g roztworu wodnego zawarte jest 48 g metanolu [CH3OH] i 72 g acetonu [(CH3)2CO]. Podać skład tego roztworu w ułamkach molowych jego składników.
MC = 12,01 u; MH = 1,008 u; MO = 15,999 u;
dane:
mm = 48 g
ma = 72 g
mw = 210 g - 48 g - 72 g = 90 g
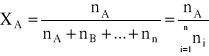
liczba moli metanolu: ![]()
= 1,498 mola
liczba moli acetonu: ![]()
= 1,240 mola
liczba moli wody: ![]()
= 4,996 mola
suma liczby moli składników roztworu: n = 7,734 mola
ułamek molowy metanolu: ![]()
= ![]()
= 0,1937
ułamek molowy acetonu: ![]()
= ![]()
= 0,1603
ułamek molowy wody: ![]()
= ![]()
= 0,6460
Przykład 8. Obliczyć ułamek molowy wodorotlenku sodu w 20,0 % wodnym roztworze tego wodorotlenku.
MNa = 22,99 u; MH = 1,008 u; MO = 15,999 u;
dane:
![]()
mas.
to znaczy:
w 100,0 g roztworu zawarte jest:
mNaOH = 20,0 g
![]()
= 80,0 g
zatem:
![]()
= 0,5000 mola
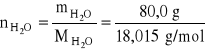
= 4,4407 mola
![]()
= 4,9407 mola
![]()
= 0,1012
Stężenie masowe
Podaje stosunek masy składnika roztworu do objętości roztworu:
![]()
gdzie: ![]()
- stężenie masowe
ms - masa składnika [jednostki masy, np.: g, kg]
Vr - objętość roztworu [jednostki objętości, np.: cm3, dm3, m3]
przyjęta jednostka - g/dm3
czyli:
Stężenie masowe podaje masę (liczbę gramów) substancji rozpuszczonej zawartą w 1 dm3 roztworu.
stosowane także: - [mg/dm3], mg = 10-3 g
- [g/dm3], g = 10-6 g
Przykład 9. W 150 g roztworu o gęstości 1,11 g/cm3 znajduje się 30 g H3PO4. Obliczyć stężenie masowe tego roztworu.
dane:
mr = 150 g
dr = 1,11 g/cm3
ms = 30 g
![]()
ponieważ:
![]()
to: ![]()
= ![]()
= 0,222 g/cm3 = 222 g/dm3
lub, przyjmując dr = 1110 g/dm3:
![]()
= ![]()
= 222 g/dm3
Przykład 10. 10,0 cm3 roztworu H2SO4 o stężeniu 10 % (masowych), mającego gęstość ![]()
= 1,07 g/cm3 rozcieńczono wodą do objętości 100 cm3. Obliczyć stężenie masowe otrzymanego roztworu.
dane:
![]()
![]()
![]()
![]()
masa substancji zawarta w roztworze:
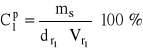
![]()
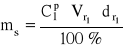
= ![]()
= 1,07 g
stąd:
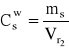
= ![]()
= 0,0107 g/cm3 = 10,7 g/dm3
Stężenie molowe
Określa zawartość liczby moli składnika roztworu w objętości roztworu:
![]()
= ![]()
gdzie: ![]()
- stężenie molowe (molowość, molarność)
ns - liczba moli składnika
Vr - objętość roztworu [dm3]
ms - masa składnika [g]
Ms - masa molowa składnika [g/mol]
przyjęta jednostka - mol/dm3
czyli:
Stężenie molowe podaje liczbę moli substancji zawartą w 1 dm3 roztworu.
stosowane także: - [mmol/dm3], mmol = 10-3 mola
- [mol/dm3], mol = 10-6 mola
Przykład 11. 50,0 g CaCl26 H2O rozpuszczono w wodzie i całość rozcieńczono do objętości 250 cm3. Obliczyć stężenie molowe powstałego roztworu.
MCa - 40,078 u; MCl = 35,45 u;
dane:
![]()
= 50,0 g
Vr = 250 cm3 = 0,25 dm3
![]()
= 219,068 g/mol; ![]()
= 110,978 g/mol
219,068 g CaCl2·6 H2O - 110,978 g CaCl2
50 g CaCl2·6 H2O - x g CaCl2
x = 25,330 g CaCl2
![]()
![]()
![]()
= 0,913 mol/dm3
Przykład 12. 20 cm3 2 molowego roztworu NaOH rozcieńczono do objętości 250 cm3. Obliczyć stężenie molowe powstałego roztworu.
dane:
![]()
= 20 cm3
![]()
= 2 mol/dm3
![]()
= 250 cm3
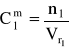
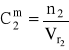
liczba moli NaOH w roztworze (1) i w roztworze (2) jest taka sama:
n1 = n2
zatem:
![]()
skąd:
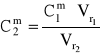
= ![]()
= 0,16 mol/dm3
Stężenie molalne
Określa liczbę moli składnika roztworu przypadającą na jednostkę masy rozpuszczalnika:
![]()
= ![]()
gdzie: ![]()
- stężenie molalne (molalność)
ns - liczba moli składnika
mR - masa rozpuszczalnika [kg]
przyjęta jednostka - mol/kg
czyli:
Stężenie molalne podaje liczbę moli substancji rozpuszczonej przypadającą na 1 kg rozpuszczalnika.
Przykład 13. W 85 g wody rozpuszczono 15,0 g Na2SO4. Obliczyć stężenie molalne powstałego roztworu.
MNa = 22,99 u; MS = 32,066 u;
dane:
mR = 85 g = 0,085 kg
ms = 15,0 g
Ms = 142,042 g/mol
![]()
![]()
= ![]()
= 1,242 mol/kg
Przykład 14. Obliczyć stężenie molalne 12,0 % roztworu HNO3.
MN = 14,01 u;
dane:
![]()
= 12,0 % mas.
![]()
= 63,015 g/mol
to znaczy: w 100 g roztworu zawarte jest:
ms = 12,0 g
mR = 88 g = 0,088 kg
![]()
![]()
= ![]()
= 2,164 mol/kg
Przykład 15. 40,0 % wodny roztwór H3PO4 ma gęstość d = 1,25 g/cm3. Obliczyć:
a) stężenie molowe tego roztworu,
b) stężenie masowe tego roztworu,
c) stężenie molalne tego roztworu,
d) ułamki molowe składników tego roztworu.
MP = 30,974 u;
dane:
![]()
= 40 % mas.
dr = 1,25 g/cm3
![]()
= 97,994 g/mol
ad a)
jeżeli dr = 1,25 g/cm3 to 1 dm3 tego roztworu waży 1250 g
zatem z zależności:
![]()
masa H3PO4 zawarta w 1 dm3 roztworu:
![]()
= ![]()
= 500 g
stąd liczba moli zawarta w 1 dm3 roztworu = stężenie molowe:
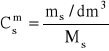
= ![]()
= 5,102 mol/dm3
ad b)
![]()
ad c)
w 100 g roztworu 40 % zawarte jest:
ms = 40,0 g i mR = 60,0 g = 0,060 kg
![]()
![]()
= ![]()
= 6,803 mol/kg
ad d)
w 100 g roztworu 40 % zawarte jest:
![]()
= 40,0 g i ![]()
= 60,0 g
czyli:
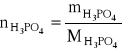
= ![]()
= 0,4082 mola
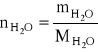
= ![]()
= 3,3306 mola
![]()
= 3,7388 mola
![]()
= ![]()
= 0,1092
Przykład 16. Stężony, 38,32 %, roztwór kwasu solnego ma gęstość dr = 1,19 g/cm3. Obliczyć objętość tego roztworu, którą należy użyć, aby sporządzić 2 dm3 roztworu 0,5 molowego.
MCl = 35,45 u;
dane:
![]()
= 38,32 % mas.
![]()
= 1,19 g/cm3
MHCl = 36,458 g/mol
![]()
= 0,5 mol/dm3
![]()
= 2 dm3
ponieważ:
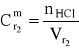
to: w 2,0 dm3 roztworu 0,5 molowego zawarte jest:
nHCl = ![]()
= 0,5 mol/dm3 2 dm3 = 1 mol
czyli: mHCl = 36,458 g
zatem, z definicji stężenia procentowego:
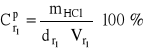
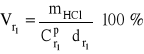
= ![]()
= 79,95 cm3
Zadania
1. Obliczyć stężenia procentowe roztworów powstałych przez rozpuszczenie w 150 g wody 2,8 g:
a) bezwodnego siarczanu(VI) sodu
b) dziesięciowodnego siarczanu(VI) sodu,
2. 90,0 g związku rozpuszczono w 180 g wody. Obliczyć stężenie procentowe powstałego roztworu.
3. W 300 g roztworu zawarte jest 30 g soli. Obliczyć stężenie procentowe tego roztworu.
4. Obliczyć masę chlorku potasu jaką należy rozpuścić w 100 g wody, aby otrzymać roztwór o stężeniu 5 % mas.
5. Obliczyć masy azotanu(V) sodu i wody konieczne do otrzymania 1,6 kg roztworu o stężeniu 10 % mas.
6. Obliczyć masę siarczanu(IV) sodu niezbędną do sporządzenia 5 dm3 roztworu o stężeniu 8 % mas. Gęstość takiego roztworu wynosi 1,075 g/cm3.
7. Obliczyć masę chlorowodoru zawartą w 250 cm3 roztworu o stężeniu 10 % mas. Gęstość takiego roztworu wynosi 1,05 g/cm3.
8. Ile gramów roztworu, o stężeniu 3 % mas. można otrzymać z 10 g siedmiowodnego siarczanu(VI) magnezu ?
9. Ile moli pięciowodnego siarczanu(VI) manganu należy dodać do 100 moli wody, aby otrzymać roztwór o stężeniu 20 % mas. ?
10. Do 300 g roztworu wodorotlenku potasu o stężeniu 15 % mas. dodano 100 g wody. Obliczyć stężenie procentowe powstałego roztworu.
11. Obliczyć masę wody jaką należy dodać do 20 cm3 roztworu kwasu siarkowego(VI) o stężeniu 20 % mas. (gęstość = 1,14 g/cm3), aby otrzymać roztwór o stężeniu 5 % mas. ?
12. Ile gramów chlorku sodu należy dodać do 150 g roztworu o stężeniu 8 % mas., aby otrzymać roztwór o stężeniu 18 % mas. ?
13. Do 950 g wody dodano 50 cm3 roztworu kwasu siarkowego(VI) o stężeniu 48 % mas. i gęstości 1,38 g/cm3. Obliczyć stężenie procentowe powstałego roztworu.
14. W 1 dm3 roztworu bromianu(V) potasu zawarte jest 85,12 g soli. Gęstość tego roztworu wynosi 1,064 g/cm3. Obliczyć stężenie procentowe tego roztworu.
15. W 500 cm3 acetonu o gęstości 0,79 g/cm3 rozpuszczono 25 g bromu. Obliczyć stężenie procentowe powstałego roztworu.
16. Obliczyć objętość metanolu (gęstość = 0,7915 g/cm3) potrzebną do sporządzenia 400 g roztworu wodnego o stężeniu 20 % mas.
17. Do 120 g roztworu chloranu(VII) sodu o stężeniu 5 % mas. dodano 20 g bezwodnej soli i 30 g wody. Obliczyć stężenie procentowe powstałego roztworu.
18. W 1 dm3 wody (d = 1 g/cm3) rozpuszcza się 677 dm3 amoniaku (zmierzonego w warunkach normalnych). Obliczyć stężenie procentowe powstającego roztworu.
19. Do 50 g roztworu siarczanu(VI) żelaza(II) o stężeniu 12 % mas. dodano 5 g siedmiowodnej soli. Obliczyć stężenie procentowe siarczanu(VI) żelaza(II) w powstałym roztworze.
20. Obliczyć masę chromianu(VI) sodu zawartą w 100 cm3 roztworu tej soli o stężeniu 16 % mas. Gęstość tego roztworu = 1,15 g/cm3.
21. Obliczyć masę stałego wodorotlenku potasu, jaką należy dodać do 200 g roztworu tego wodorotlenku o stężeniu 10 % mas., aby otrzymać roztwór o stężeniu 12 % mas.
22. Zmieszano 120 g roztworu o stężeniu 20 % mas. i 80 g roztworu o stężeniu 40 % mas., po czym całość rozcieńczono wodą do 250 g. Obliczyć stężenie procentowe powstałego roztworu.
23. W jakiej objętości roztworu kwasu azotowego(V) o stężeniu 5 % mas. i gęstości 1,02 g/cm3 zawarte jest 2,0 g kwasu ?
24. Do 200 cm3 roztworu chlorku potasu o stężeniu 18 % mas. i gęstości 1,2 g/cm3 dodano 50 g wody. Obliczyć stężenie procentowe powstałego roztworu.
25. Do 200 cm3 roztworu kwasu solnego o stężeniu 12 % mas. i gęstości 1,08 g/cm3 dodano 100 g wody. Obliczyć stężenie procentowe powstałego roztworu.
26. Obliczyć % objętościowy acetonu w roztworze o stężeniu 20 % mas. i gęstości 0,969 g/cm3. Gęstość bezwodnego acetonu = 0,786 g/cm3.
27. Zmieszano 30 cm3 gliceryny i 60 cm3 etanolu. Obliczyć % objętościowy gliceryny w powstałym roztworze.
28. Obliczyć masę bezwodnego glikolu etylenowego jaką należy użyć do przygotowania 0,5 dm3 roztworu o stężeniu 25 % objętościowych. Gęstość bezwodnego glikolu etylenowego wynosi 1,056 g/cm3.
29. Zmieszano 20 g benzenu (d = 0,879 g/cm3) i 30 g czterochlorku węgla (d = 1,594 g/cm3). Obliczyć % objętościowy benzenu w powstałym roztworze.
30. Obliczyć procent objętościowy gliceryny w roztworze o stężeniu 20 % mas. i gęstości 1,047 g/cm3. Gęstość bezwodnej gliceryny wynosi 1,261 g/cm3.
31. Obliczyć ułamek molowy wodorotlenku potasu w wodnym roztworze o stężeniu 25 % mas.
32. Do 50 cm3 eteru etylowego [(C2H5)2O, d = 0,7135 g/cm3] wprowadzono 1,27 g jodu. Obliczyć skład powstałego roztworu w ułamkach molowych.
33. W 1 dm3 wodnego roztworu zawarte jest 0,2 mola kwasu siarkowego(VI). Gęstość tego roztworu wynosi 1,010 g/cm3. Obliczyć ułamek molowy kwasu siarkowego(VI) w tym roztworze.
34. W wodnym roztworze kwasu octowego [CH3COOH] ułamek molowy kwasu wynosi 0,05. Obliczyć stężenie procentowe tego roztworu.
35. W mieszaninie acetonu [(CH3)2CO] i benzenu [C6H6] ułamek molowy benzenu wynosi 0,15. Obliczyć masę acetonu zawartą w 100 g tego roztworu.
36. Obliczyć ułamki molowe składników w wodnym roztworze chloranu(V) magnezu o stężeniu 12 % mas.
37. 50 g chlorku żelaza(III) rozpuszczono w 100 cm3 wody o gęstości 1 g/cm3. Obliczyć ułamek molowy chlorku żelaza(III) w powstałym roztworze.
38. Do 200 g wodnego roztworu chloranu(V) baru o stężeniu 15 % mas. dodano 20,0 g stałego chloranu(V) baru. Obliczyć ułamki molowe składników otrzymanego roztworu.
39. W 150 cm3 roztworu zawarte jest 0,2 mola kwasu mrówkowego [HCOOH]. Obliczyć stężenie masowe tego roztworu.
40. 4,0 g wodorotlenku sodu wprowadzono do naczynia miarowego i dodano wodę do objętości 250 cm3. Obliczyć stężenie masowe powstałego roztworu.
41. 10 cm3 roztworu azotanu(V) sodu o stężeniu 16 % mas. i gęstości 1,112 g/cm3 rozcieńczono wodą do objętości 250 cm3. Obliczyć stężenie masowe powstałego roztworu.
42. Obliczyć ile moli chloranu(VII) sodu zawarte jest w 250 cm3 roztworu o stężeniu 0,2 g/dm3.
43. Do 30 cm3 roztworu chlorku żelaza(III) o stężeniu 10 % mas. i gęstości 1,085 g/cm3 dodano 10 g bezwodnej soli, a następnie całość rozcieńczono wodą do objętości 250 cm3. Obliczyć stężenie masowe powstałego roztworu.
44. W 2 dm3 roztworu zawarte jest 163,63 g chlorku amonu. Obliczyć stężenie molowe tego roztworu.
45. W 250 cm3 roztworu zawarte jest 1,46 g chlorku sodu. Ile moli chlorku sodu zawarte jest w 1 dm3 tego roztworu ?
46. Do kolby miarowej wprowadzono 249,5 g pięciowodnego siarczanu(VI) miedzi(II) i dopełniono wodą do objętości 500 cm3. Obliczyć stężenie molowe powstałego roztworu.
47. 20 cm3 roztworu wodorotlenku potasu o stężeniu 25 % mas. i gęstości 1,24 g/cm3 rozcieńczono wodą do objętości 100 cm3. Obliczyć stężenie molowe utworzonego roztworu.
48. Do naczynia miarowego wprowadzono 25 cm3 roztworu bromku amonu o stężeniu 20 % mas. i gęstości 1,122 g/cm3 oraz 20 g stałego bromku amonu, a następnie całość rozcieńczono wodą do objętości 500 cm3. Obliczyć stężenie molowe powstałego roztworu.
49. Do 400 cm3 roztworu wodorowęglanu amonu o stężeniu 0,2 mol/dm3 dodano 10,0 g stałego wodorowęglanu amonu, po czym całość rozcieńczono wodą do objętości 500 cm3. Obliczyć stężenie molowe powstałego roztworu.
50. 125 g roztworu wodorotlenku sodu o stężeniu 16 % mas. rozcieńczono wodą do objętości 2,0 dm3. Obliczyć stężenie molowe powstałego roztworu.
51. Zmieszano 200 cm3 0,2 molowego roztworu kwasu siarkowego(VI) i 250 cm3 0,5 molowego roztworu tego kwasu, po czym całość rozcieńczono wodą do objętości 500 cm3. Obliczyć stężenie molowe otrzymanego roztworu.
52. Obliczyć objętość roztworu wodorosiarczku potasu o stężeniu 20 % mas. i gęstości 1,15 g/cm3 jaką należy odmierzyć celem przygotowania 2 dm3 roztworu 1 molowego.
53. 12,5 g roztworu zawierającego 16 % mas. bromianu(V) sodu rozcieńczono wodą do objętości 500 cm3. Obliczyć stężenie molowe otrzymanego roztworu.
54. 50 g chlorku wapnia rozpuszczono w 100 g wody. Otrzymany roztwór ma gęstość 1,2 g/cm3. Obliczyć stężenie molowe tego roztworu.
55. Jaką objętość 0,5 molowego roztworu wodorotlenku potasu należy odmierzyć, aby po odpowiednim rozcieńczeniu wodą, otrzymać 400 cm3 roztworu 0,15 molowego ?
56. 13,63 g chlorku cynku rozpuszczono w 500 g wody. Obliczyć stężenie molalne powstałego roztworu.
57. Obliczyć masę siarczanu(VI) manganu(II) zawartą w 300 g roztworu 2,5 molalnego.
58. W 300 cm3 roztworu o gęstości 1,026 g/cm3 zawarte jest 61,566 g kwasu octowego [CH3COOH]. Obliczyć stężenie molalne tego roztworu.
59. Obliczyć masę glikolu etylenowego [C2H4(OH)2] potrzebną do sporządzenia 2 kg 2 molalnego roztworu wodnego.
60. Obliczyć objętość roztworu kwasu ortofosforowego(V) o stężeniu 60 % mas. i gęstości 1,432 g/cm3 konieczną do przygotowania 2,5 kg roztworu 2 molalnego.
61. Do 210 cm3 roztworu węglanu potasu o stężeniu 25 % mas. i gęstości 1,19 g/cm3 dodano 150 g roztworu tej soli o stężeniu 10 % mas. Obliczyć stężenie molalne otrzymanego roztworu.
62. Obliczyć stężenie molalne wodnego roztworu chloranu(VII) cynku o stężeniu 22 % mas.
63. Do 100 cm3 roztworu chlorku kobaltu(II) o stężeniu 50 % mas. i gęstości 1,31 g/cm3 dodano 100 g wody. Obliczyć stężenie molalne utworzonego roztworu.
64. Do 210 cm3 roztworu chlorku strontu o stężeniu 25 % mas. i gęstości 1,26 g/cm3 dodano 200 cm3 roztworu tej soli o stężeniu 12 % mas. i gęstości 1,113 g/cm3. Obliczyć stężenie molalne otrzymanego roztworu.
65. 0,8 molowy wodny roztwór węglanu sodu ma gęstość 1,08 g/cm3. Obliczyć ułamki molowe składników tego roztworu.
66. Obliczyć ułamek molowy i ułamek masowy wodorotlenku sodu w wodnym roztworze o stężeniu 1,5 mol/dm3. Gęstość roztworu jest równa 1,06 g/cm3.
67. Wodny roztwór jodku potasu o stężeniu 40 % mas. ma gęstość 1,396 g/cm3. Obliczyć ułamek molowy jodku potasu w tym roztworze oraz stężenie masowe, molowe i molalne tego roztworu.
68. 1,65 molowy wodny roztwór chromianu(VI) sodu ma gęstość 1,216 g/cm3. Obliczyć ułamek molowy soli w tym roztworze oraz stężenie masowe, procentowe i molalne tego roztworu.
69. W roztworze wodnym o gęstości 1,303 g/cm3 ułamek molowy węglanu sodu wynosi 0,062. Obliczyć stężenie procentowe, molalne, molowe i masowe tego roztworu.
70. 1,47 molalny roztwór azotanu(V) srebra ma gęstość 1,194 g/cm3. Obliczyć ułamek molowy azotanu(V) srebra w tym roztworze oraz stężenie procentowe, molowe i masowe tego roztworu.
71. Roztwór kwasu chlorowego(VII) o stężeniu 225,6 g/dm3 ma gęstość równą 1,128 g/cm3. Obliczyć stężenie molowe, procentowe i molalne tego roztworu oraz ułamek molowy kwasu chlorowego w tym roztworze.
72. W warunkach normalnych w 1 dm3 wody rozpuszcza się 1120 dm3 amoniaku, dając roztwór o gęstości 0,884 g/cm3. Obliczyć stężenie procentowe, molowe i molalne otrzymanego roztworu.
73. Zmieszano 30 cm3 0,1 molowego roztworu KOH i 20 cm3 0,24 molowego roztworu NaOH. Otrzymany roztwór rozcieńczono do objętości 200 cm3. Obliczyć stężenie molowe otrzymanego roztworu względem KOH, NaOH i jonów wodorotlenowych.
74. Na zobojętnienie 135 g roztworu wodorotlenku wapnia potrzeba 60 cm3 0,5 molowego roztworu kwasu siarkowego(VI). Obliczyć stężenie procentowe wodorotlenku wapnia w analizowanym roztworze.
75. Obliczyć objętość chlorowodoru, zmierzoną w warunkach normalnych, jaką należy rozpuścić w 150 g wody, aby otrzymać roztwór kwasu solnego o stężeniu 5 % mas.
76. Obliczyć objętość 10 % roztworu kwasu siarkowego(VI) (dr = 1,07 g/cm3) konieczną do rozpuszczenia 5,5 g stopu cynku z magnezem. Ułamek molowy magnezu w analizowanym stopie wynosi 0,45.
77. Obliczyć objętość 18,3 % roztworu wodorotlenku sodu (dr = 1,17 g/cm3) konieczną do całkowitego wytrącenia jonów Fe3+ z 300 cm3 0,5 molowego roztworu FeCl3.
78. Chlorowodór otrzymany w wyniku działania kwasem siarkowym(VI) na 11,7 g chlorku sodu (wydajność reakcji = 75 %) pochłonięto w 300 g wody. Obliczyć stężenie procentowe otrzymanego roztworu kwasu solnego.
79. Przez 100 cm3 0,1 molowego roztworu chlorku żelaza(III) przepuszczano siarkowodór, otrzymany z rozkładu siarczku żelaza(II) roztworem kwasu solnego (wydajność rozkładu = 80 %). Obliczyć masę siarczku żelaza(II), jaką należy poddać rozkładowi, aby z roztworu chlorku żelaza(III) całkowicie wytrącić jony żelaza(III) w postaci siarczku żelaza(III). Wydajność procesu wytrącania osadu siarczku ż4elaza(III) = 90 %.
80. Amoniak wydzielony z 200 cm3 20 % roztworu wodorowęglanu amonu (dr = 1,083 g/cm3) wprowadzono do 100 cm3 6,0 molowego roztworu kwasu solnego, po czym całość rozcieńczono do objętości 200 cm3. Obliczyć stężenie molowe utworzonego roztworu chlorku amonu.
81. Chlorowodór, na skalę laboratoryjną otrzymuje się działając stężonym roztworem kwasu siarkowego(VI) na chlorek sodu. Obliczyć minimalną masę chlorku sodu, którą należałoby użyć, aby wydzielonym chlorowodorem (wydajność reakcji = 80 %) wytrącić chlorek srebra ze 100 cm3 0,01 molowego roztworu azotanu(V) srebra.
82. Obliczyć objętość 0,4 molowego roztworu wodorotlenku sodu konieczną do zobojętnienia kwasu siarkowego(VI) zawartego w 10 cm3 roztworu o stężeniu 5,0 % mas. (dr = 1,0317 g/cm3).
83. Obliczyć objętość 10 % roztworu chlorku sodu (dr = 1,074 g/cm3) konieczną do całkowitego wytrącenia chlorku srebra ze 100 cm3 0,05 molowego roztworu azotanu(V) srebra.
84. Obliczyć objętość roztworu H2SO4 o stężeniu 49 % mas. i gęstości 1,40 g/cm3 potrzebną do roztworzenia 5,0 g stopu zawierającego 75 % mas. czystego cynku.
85. Obliczyć objętość 2 molowego roztworu kwasu solnego konieczną do roztworzenia 10,0 g wapna palonego, zawierającego 90 % mas. tlenku wapnia i 10 % mas. węglanu wapnia.
86. Kwas ortooksoborowy otrzymuje się działając na dziesięciowodny tetraboran disodu (boraks) roztworem kwasu siarkowego(VI). Obliczyć objętość roztworu kwasu siarkowego(VI) o stężeniu 90 % mas. i gęstości 1,83 g/cm3 jaką należy użyć, aby otrzymać kwas ortooksoborowy z 191 g boraksu. Obliczyć masę otrzymanego kwasu ortooksoborowego.
87. Na 5,0 g próbkę, zawierającej jako główny składnik chlorek magnezu, działano stężonym roztworem kwasu siarkowego(VI), a wydzielony chlorowodór rozpuszczano w wodzie. Otrzymano 100 cm3 roztworu kwasu solnego. Na wytrącenie chlorku srebra z 20 cm3 otrzymanego roztworu kwasu solnego zużyto 12,25 cm3 0,3 molowego roztworu azotanu(V) srebra. Obliczyć procentową zawartość chlorku magnezu w analizowanej próbce.
88. Do 30 cm3 0,5 molowego roztworu siarczanu(VI) miedzi(II) wprowadzono 25 cm3 roztworu wodorotlenku sodu o stężeniu 6,0 % mas. (dr = 1,041 g/cm3). Wytrącony osad wodorotlenku miedzi(II) wyprażono do otrzymania tlenku miedzi(II). Obliczyć masę otrzymanego tlenku miedzi(II).
89. Zmieszano 30 g roztworu NaCl o stężeniu 20 % mas. i 20 g roztworu HCl o stężeniu 25 % mas. Obliczyć ułamki molowe jonów w powstałym roztworze.
90. Próbkę metalicznego cynku o masie 6,6 g wprowadzono do 100 cm3 roztworu kwasu siarkowego o stężeniu 25 % mas. (dr = 1,18 g/cm3). Po zakończeniu reakcji roztwór rozcieńczono do objętości 500 cm3. Obliczyć:
a) stężenie molowe kwasu siarkowego(VI) w powstałym roztworze,
b) stężenie molowe utworzonego siarczanu(VI) cynku w powstałym roztworze.
91. Do 300 cm3 0,8 molowego roztworu kwasu siarkowego(VI) dodano 50 cm3 roztworu wodorotlenku sodu o stężeniu 20 % mas. i gęstości 1,22 g/cm3. Obliczyć objętość roztworu NaOH o stężeniu 20 % mas. i gęstości 1,22 g/cm3, jaką należy dodać, aby odczyn otrzymanego roztworu był obojętny.
92. Działając wodnym roztworem kwasu solnego na 25,0 g siarczku żelaza(II) otrzymano siarkowodór (wydajność reakcji - 80 %), który następnie przepuszczano przez 50 cm3 0,5 molowego roztworu arsenianu(III) sodu (zakwaszonego kwasem solnym). Czy wydzielony siarkowodór wystarczy do całkowitego wytrącenia siarczku arsenu(III) ? Obliczyć masę wydzielonego siarczku arsenu(III), jeżeli wydajność procesu wytrącania osadu wynosi 95 %.
93. Do roztworu zawierającego 3,5 g chlorku chromu(III) dodano nadtlenek wodoru w obecności wodorotlenku sodu. Po zakończeniu reakcji całość rozcieńczono do objętości 250 cm3. Obliczyć stężenie molowe chromianu(VI) sodu w otrzymanym roztworze.
94. W wyniku redukcji dichromianu(VI) potasu chlorowodorem otrzymuje się chlorek chromu(III), gazowy chlor, chlorek potasu i wodę. Obliczyć objętość chlorowodoru (zmierzoną w warunkach normalnych), której należy użyć w celu zredukowania dichromianu(VI) potasu zawartego w 100 cm3 0,05 molowego roztworu tej soli.
Odpowiedzi
1. a) 1,83 % mas. b) 0,82 % mas.
2. 33,33 % mas.
3. 10 % mas.
4. 5,26 g
5. msoli = 160 g mwody = 1440 g
6. 430 g
7. 26,25 g
8. 162,80 g
9. 1,87 mola
10. 11,25 % mas.
11. 68,40 g
12. 18,29 g
13. 3,25 % mas.
14. 8 % mas.
15. 5,95 % mas.
16. 101,07 cm3
17. 15,29 % mas.
18. 33,98 %
19. 15,88 % mas.
20. 18,4 g
21. 4,54 g
22. 22,40 % mas.
23. 39,22 cm3
24. 14,90 % mas.
25. 8,20 % mas.
26. 24,66 % obj.
27. 33,33 % obj.
28. 132 g
29. 54,73 % obj.
30. 16,60 % obj.
31. 0,0967
32. Xetanolu = 0,9897, Xjodu = 0,0103
33. 0,0036
34. 14,92 % mas.
35. 80,82 g
36. Xsoli = 0,0127, Xwody = 0,9873
37. 0,0526
38. Xsoli = 0,0171, Xwody = 0,9829
39. 61,36 g/dm3
40. 16,00 g/dm3
41. 7,12 g/dm3
42. 4,1·10-4 mola
43. 13,02 g/dm3
44. 1,53 mol/dm3
45. 0,1 mola
46. 2 mol/dm3
47. 1,10 mol/dm3
48. 0,52 mol/dm3
49. 0,41 mol/dm3
50. 0,25 mol/dm3
51. 0,33 mol/dm3
52. 627,60 cm3
53. 2,65·10-2 mol/dm3
54. 5,41 mol/dm3
55. 120 cm3
56. 0,2 mol/kg H2O
57. 82,21 g
58. 4,16 mol/kg H2O
59. 220,85 g
60. 476,82 cm3
61. 1,74 mol/kg H2O
62. 1,07 mol/kg H2O
63. 3,05 mol/kg H2O
64. 1,48 mol/kg H2O
65. Xsoli = 0,0143, Xwody = 0,9857
66. uł. mas. =0,0566; Xsoli = 0,0263
67. XKI = 0,0675, Cmasowe = 558,4 g/dm3, Cmolowe = 3,36 mol/dm3, Cmolalne = 4,02 mol/kg H2O
68. Xsoli = 0,0304, Cmasowe = 267,3 g/dm3; C% = 21,98 % mas.; Cmolalne = 1,74 mol/kg H2O
69. C% = 28,00 % mas., Cmolalne = 3,67 mol/kg H2O, Cmolowe = 3,44 mol/dm3, Cmasowe = 364,83 g/dm3
70. Xsoli = 0,0258, C% = 19,99 % mas., Cmolowe = 1,40 mol/dm3, Cmasowe = 238,58 g/dm3
71. Cmolowe = 2,25 mol/dm3, C% = 20,00 % mas., Cmolalne = 2,49 mol/kg H2O, Xkwasu = 0,0429
72. C% = 45,98 %, Cmolowe = 23,86 mol/dm3; Cmolalne = 49,98 mol/kg H2O
73. CKOH = 0,015 mol/dm3, CNaOH = 0,024 mol/dm3, ![]()
= 0,039 mol/dm3
74. 1,65 % mas.
75. 4,85 dm3
76. 107,48 cm3
77. 84,06 cm3
78. 1,79 % mas.
79. 1,83 g
80. 2,74 mol/dm3
81. 0,073 g
82. 26,30 cm3
83. 2,72 cm3
84. 8,20 cm3
85. 170,48 cm3
86. Vkwasu siarkowego(VI) = 29,82 cm3; mkwasu ortoksobowego 123,88 g
87. 17,50 %
88. 1,19 g
89. ![]()
, ![]()
, ![]()
90. ![]()
= 0,4 mol/dm3, ![]()
= 0,2 mol/dm3
91. 28,68 cm3
92. wystarczy, 2,92 g
93. 8,84·10-2 mol/dm3
94. 1,57 dm3
11
Wyszukiwarka
Podobne podstrony:
Roztwory buforowe, Inżynieria chemiczna i procesowa
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
zadanie1 3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, tran
pytania operacje, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 4
Stechiometria, Inżynieria chemiczna i procesowa
D III rokBiopreparatywykłady 1-3fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i pro
Staliwa węglowe i konstrukcyjne stopowe, Inżynieria chemiczna i procesowa, Materiało- i maszynoznaws
Przykładowa analiza AWZ, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, bez
mikro3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikrobio
biotechnologia2, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III semestr 6
allbiochemia, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I semestr 2, bio
mikrokapsułkowanie aromatów, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I
egz mikro, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikro
Tabelka do zadania, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr
2012 - Pytania do kol wyk, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 2, d
Strona 1 cw2 tytulowa, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, dynam
zagadnienia fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III seme
więcej podobnych podstron