Egzamin 2005-02-03
Struktura elektronowa atomów (6 pkt)
Struktura elektronowa ![]()
przedstawia się następująco ...................................................................................................................................... .
Na podstawie zapisu struktury elektronowej można stwierdzić, iż atom żelaza posiada............. elektronów walencyjnych, z których.........znajdują się na orbitalu........... i pozostałe.......... na orbitalch .......... . Żelazo leży w grupie ......... , okresie .........., w bloku ........ układu okresowego pierwiastków.
Orbitale molekularne (3 pkt)
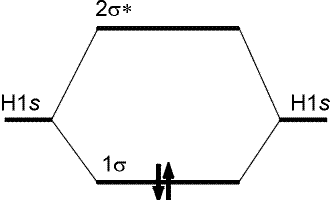
Na rysunku przedstawiono diagram poziomów energetycznych orbitali molekularnych w cząsteczce H2. Gdy dwa orbitale 1s nakładają się dodatnio powstaje wiązanie. Taką kombinację można traktować jako samodzielny orbital molekularny, będący orbitalem ................................... . Orbital molekularny podobnie jak orbital atomowy podlega zakazowi Pauliego; oznacza to, że może on być zajęty maksymalnie przez ....... elektrony, które muszą różnić się ................................ .
Reakcje dysocjacji (6 pkt)
Dysocjacja kwasu fosforowego (V) H3PO4 w roztworze wodnym zachodzi w trzech następujących etapach
1......................................................................................................................................
2......................................................................................................................................
3......................................................................................................................................
Na przykładzie pierwszej reakcji zgodnie z teorią Brönsteda-Lowry'ego można stwierdzić, iż.....................................jest kwasem, ponieważ .................................... proton, czyli jest ................................... .
Hydroliza (6 pkt)
W wyniku reakcji hydrolizy CH3COONa ....................................................................... (napisz reakcję) w roztworze stężenie jonów ..................... jest większe niż stężenie jonów ....................... . Odczyn roztworu po hydrolizie octanu sodu będzie...................
Procesy redoks (6 pkt)
Uzgodnij współczynniki stechiometryczne równania. Napisz równania połówkowe.
MnO4 - + Fe2+ + H3O+ ↔ Mn2+ + Fe3+ + H2O
Procesowi utleniania towarzyszy ................... elektronów przez reagent ulegający utlenieniu nazywany ........................... , którym w przypadku powyższej reakcji jest................................ . Natomiast w reakcji redukcji elektrony są ................... przez reagent ulegający redukcji nazywany .........................., którym w przypadku powyższej reakcji jest.................................. .
Węglowodory aromatyczne (4 pkt)
Cząsteczka benzenu składa się z sześciu atomów węgla tworzących pierścień i sześciu atomów wodoru. Każdy atom węgla jest związany z trzema innymi atomami poprzez wiązanie powstałe przez nakładanie się orbitali o hybrydyzacji..................... leżące............................................................... . Cząsteczka benzenu jest płaska i symetryczna. Kąty między wiązaniami wynoszą....................... stopni. Każdy atom węgla jest związany z trzema innymi atomami; do tego celu wykorzystuje on orbitale o hybrydyzacji................, leżące w tej samej płaszczyźnie. Oprócz trzech orbitali zhybrydyzowanych ................ każdy z atomów węgla dysponuje jeszcze orbitalem ............. . Składa się on z dwóch równych pętli - jednej leżącej powyżej, a drugiej poniżej płaszczyzny pierścienia. Orbital ......... jednego atomu węgla może się nakładać z orbitalem sąsiedniego atomu, w wyniku czego dochodzi do sparowania elektronów i utworzenia dodatkowego wiązania........... .Orbital ....... każdego atomu węgla nakłada się w równym stopniu z orbitalami ....... obu sąsiadujących z nim atomów ................... . W rezultacie powstają dwie ciągle chmury elektronowe o kształcie pierścienia kołowego, jedna leżąca powyżej, a druga poniżej płaszczyzny wyznaczonej przez atomy pierścienia.
Wyszukiwarka
Podobne podstrony:
egzamin test v3, Inżynieria Środowiska PW semestr I, chemia, sesja
16. egzamin test 1rok, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin test v2, Inżynieria Środowiska PW semestr I, chemia, sesja
13. egzamin 17 09 04, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin 2004sciaga, Inżynieria Środowiska PW semestr I, chemia, sesja
3. egzamin 22 01 2007, Inżynieria Środowiska PW semestr I, chemia, sesja
2. egzamin 9 2 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
Chemia egzamin 2004(2005-06), Inżynieria Środowiska PW semestr I, chemia, sesja
1. egzamin 2 2 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
SESJA ZIMOWA 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
zestawy 28 pyt Ai B mini, Inżynieria Środowiska PW semestr I, chemia, sesja
testy 1rok egz2, Inżynieria Środowiska PW semestr I, chemia, sesja
11. testy 1rok v4, Inżynieria Środowiska PW semestr I, chemia, sesja
wszystkie pytania - ciąg - sciąga - długopisy, Inżynieria Środowiska PW semestr I, chemia, sesja
sciaga chemia, Inżynieria Środowiska PW semestr I, chemia, sesja
więcej podobnych podstron