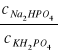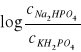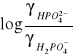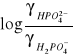Zakład Chemii Fizycznej
Laboratorium Studenckie
SPRAWOZDANIE Z ĆWICZENIA 25
POMIAR pH W ZASTOSOWANIU DO WYZNACZANIA STAŁEJ RÓWNOWAGI REAKCJI DYSOCJACJI
ZAGADNIENIA TEORETYCZNE
Roztwory buforowe
Roztwory buforowe są mieszaninami wodnych roztworów:
Słabego kwasu i jego soli z mocną zasadą
Słabej zasady i jej soli z mocnym kwasem
Dwu soli pochodzących od kwasów o kilku stopniach dysocjacji, których stałe dysocjacji różnią się znacznie między sobą
Składów specjalnych
Roztwory buforowe odznaczają się zdolnością zachowania w dużym stopniu stałości wykładnika jonów wodorowych. Praktycznie pH roztworów buforowych nie ulega zmianom w wyniku dodania lub odparowania pewnej ilości rozpuszczalnika lub też dodania do roztworu niezbyt dużych ilości kwasu lub zasad. Z tego też powodu roztwory buforowe służą często jako wzorce wartości pH.
Niezmienność pH roztworów buforowych obserwuje się tyko w pewnych granicach, po przekroczeniu których pH buforu gwałtownie się zmienia i roztwór traci swoje buforujące własności. Dla ilościowego określenia zmiany pH pod wpływem danej ilości mocnego kwasu lub zasady do ściśle określonej objętości roztworu buforowego wprowadzono termin pojemności buforowej. Jej miarą jest stosunek dodanej ilości kwasu lub zasady *b (gramorównoważnik/ dm3 roztworu) do osiągniętej przez to zmiany pH
![]()
Pojemność buforowa wzrasta ze stężeniem roztworu i maleje wraz z jego rozcieńczeniem. Na tej podstawie można stwierdzić, że chociaż rozcieńczenie roztworu nie wpływa bezpośrednio na zmianę jego odczynu to jednak mimo wszystko jest niekorzystne ze względu na zmniejszenie pojemności buforowej roztworu.
Potencjometria
Potencjometria opiera się na pomiarze siły elektromotorycznej (SEM) ogniwa zbudowanego z dwóch elektrod zanurzonych w badanym roztworze. Ogniwo galwaniczne jest urządzeniem, w którym samorzutny przebieg reakcji chemicznych wytwarza prąd elektryczny. Ogniwo składa się z dwóch elektrod, czyli przewodników metalicznych będących w kontakcie z elektrolitem. Układ tworzony przez elektrodę i roztwór, w którym jest ona zanurzona nazywamy półogniwem. Elektrolit w obu półogniwach może być jednakowy lub różny. W drugim przypadku roztwory obu półogniw stykają się albo bezpośrednio, tworząc cienką granicę faz, albo za pośrednictwem ośrodka przewodzącego, zwanego kluczem elektrolitycznym. Elektrody dobrane są w ten sposób, że potencjał jednej z nich zależy od aktywności określonego jonu w badanej próbce (elektroda wskaźnikowa), natomiast potencjał drugiej jest stały w warunkach pomiaru (elektroda porównawcza).
SEM jest różnicą potencjałów tych elektrod, mierzoną w warunkach bezprądowych. Wartość SEM ogniwa pomiarowego zależy więc od wartości obu elektrod, a te z kolei są uzależnione od charakteru procesów elektrodowych.
Dla pojedynczej elektrody nie potrafimy ani zmierzyć, ani obliczyć absolutnej wartości potencjału. Może on być określony liczbowo jedynie w odniesieniu do potencjału innej elektrody w wyniku pomiaru siły elektromotorycznej ogniwa utworzonego z ich udziałem. Za wzorcowy, równy zeru, przyjęto umownie potencjał standardowej elektrody wodorowej (SEW) i względem niej wyznacza się potencjały innych elektrod.
Potencjał elektrody, równanie Nernsta
Przykład: najprostsza elektroda wykonana z metalu i zanurzona w roztworze soli tego metalu. Ustala się równowaga między fazą stałą (elektroda) i fazą ciekłą (roztwór badany):
M0 * Mn+ + ne-
Efektem tej równowagi jest potencjał powstający na granicy faz. Zależność potencjału elektrody od aktywności jonu metalu w roztworze, liczby elektronów biorących udział w tej reakcji i od temperatury opisuje równanie Nernsta:
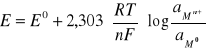
gdzie:
- E - potencjał elektrody
E0 - potencjał standardowy elektrody - wartość stała; charakterystyczna dla danej elektrody, odpowiadająca
potencjałowi elektrody w roztworze o aktywności jonów Mn+ równej jedności;
n - liczba elektronów biorących udział w reakcji elektrodowej
R - stała gazowa
T - temperatura w skali bezwzględnej
F - liczba Faradaya
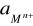
- aktywność jonów Mn+ w roztworze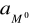
- aktywność metalu
Zgodnie z przyjętą zasadą, że metal w postaci pierwiastkowej ma aktywność równą 1, ![]()
=1, oraz
![]()
= ![]()
(zgodnie z definicją aktywności), wzór przyjmuje postać;
![]()
gdzie:
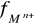
- współczynnik aktywności jonów Mn+ , zależny od siły jonowej roztworu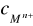
- stężenie molowe jonów Mn+ w roztworze badanym
W roztworach rozcieńczonych i w roztworach o stałej sile jonowej równanie Nernsta opisuje zależność potencjału elektrody bezpośrednio od stężenia jonu badanego, gdyż w pierwszym przypadku ![]()
=1, a w drugim ![]()
=const.
elektrody
Istotną rolę w pomiarach potencjometrycznych odgrywają elektrody, gdyż decydują one o możliwościach analitycznych metody. Scharakteryzować je można stosując różne kryteria podziału, np.: budowę i mechanizm działania lub funkcję jaką pełnią w układzie pomiarowym.
podział elektrod ze względu na budowę i zasadę działania
Zgodnie z tym kryterium, elektrody można podzielić w następujący sposób:
elektrody pierwszego rodzaju - zbudowane z metalu będącego w równowadze z roztworem, zawierającym jony tego samego metalu. Potencjał takiej elektrody zależy od aktywności (stężenia) jonów metalu w roztworze. Reakcję elektrodową można przedstawić następująco:
M0 * Mn+ + ne-
Przykład: elektroda srebrowa (Ag0 * Ag+ + e-)
elektrody drugiego rodzaju - zbudowane są z metalu pokrytego warstwą jego trudno rozpuszczalnej soli. Potencjał takiej elektrody zależy od stężenia w roztworze anionu tej soli. Równanie reakcji elektrodowej ma postać:
M0+A- * MA + e-
Przykład: elektroda chlorosrebrowa (Ag0 + Cl- * AgCl + e-)
elektrody trzeciego rodzaju - zbudowane są z metalu (M10) pokrytego cienką warstewką trudno rozpuszczalnej soli tego metalu (M1A) zawierającą jeszcze drugi kation, który ze wspólnym anionem tworzy sól łatwiej rozpuszczalną (M2A). Potencjał takiego półogniwa zależy od stężenia w roztworze drugiego kationu, zgodnie z równowagą opisaną równaniem:
M10 + M2A * M1A + M2n+ + ne-
Przykład: elektroda odwracalna względem jonów wapnia (Pb0 + Ca2C2O4 * PbC2O4 + Ca2+ + 2e-)
elektrody utleniająco- redukujące (redoks) - elektrodę stanowi obojętny chemicznie metal (Pt,Au), spełniający funkcję przewodnika elektronów, zanurzony w roztworze zawierającym substancję w postaci utlenionej i zredukowanej (jony tego samego pierwiastka różniące się stopniem utlenienia). Potencjał takiej elektrody zależy od stosunku stężeń obu postaci. Elektrody redoks są najczęściej stosowane jako elektrody wskaźnikowe w miareczkowaniach redoksymetrycznych.
elektrody jonoselektywne - elektrody te reagują selektywnie na określony jon w obecności innych i z tego względu nazywane są elektrodami jonoselektywnymi. Często stosuje się też termin elektrody membranowe, gdyż istotnym elementem ich budowy jest zawsze membrana (stała lub ciekła), zawierająca substancję elektroaktywną. Elektrody te są elektrochemicznymi półogniwami, w których na granicy faz membrana/roztwór powstaje różnica potencjałów zależna od aktywności określonego jonu, który występuje w fazie roztworu i w fazie membrany, mogąc przechodzić łatwo z jednej fazy do drugiej.
W przeciwieństwie do elektrod pierwszego, drugiego i trzeciego rodzaju, w procesach elektrodowych nie biorą udziału elektrony, a za powstawanie potencjału jest odpowiedzialna równowaga reakcji wymiany jonowej między roztworem a membraną, wyrażona równaniem:
I r * I m
gdzie:
Ir - jon I w roztworze
Im - jon I w fazie membrany
Podział elektrod ze względu na rolę odgrywaną w układzie pomiarowym
elektrody wskaźnikowe - potencjał elektrod jest zależny od stężenia jonu (względem którego elektroda jest odwracalna) w badanym roztworze
elektrody porównawcze - potencjał ich powinien być stały , niezależny od składu roztworu badanego
Elektrody wskaźnikowe decydują o możliwościach analitycznych potencjometrii, gdyż dany jon (substancję) można oznaczać potencjometrycznie tylko wówczas, gdy istnieje czuła na ten jon (lub czuła na jon wchodzący w reakcję analityczną z danym jonem) elektroda wskaźnikowa. Potencjometrycznie można oznaczać stężenia jonów wodorowych (pH) oraz wielu innych jonów (kationów i anionów).Przykładowe elektrody wskaźnikowe to elektroda srebrowa, elektroda platynowa, elektroda szklana, elektroda antymonowa, oraz elektrody jonoselektywne inne niż szklana.
Drugim elementem ogniwa pomiarowego (obok elektrody wskaźnikowej) jest elektroda porównawcza. Znajomość właściwości tej elektrody jest bardzo ważna, gdyż niewłaściwy dobór i przygotowanie elektrody porównawczej może być źródłem największych błędów przy pomiarach SEM. Elektrody porównawcze, zwane też elektrodami odniesienia, muszą charakteryzować się stałym, powtarzalnym potencjałem, praktycznie niezależnym od składu badanego roztworu. Spośród wielu możliwych układów odniesienia jedynie standardowa elektroda wodorowa, elektroda chlorosrebrowa i kalomelowa znalazły praktyczne zastosowanie.
potencjometryczne techniki analityczne
Podstawą potencjometrycznych metod analitycznych jest równanie Nernsta opisujące liniową zależność potencjału elektrody wskaźnikowej od logarytmu aktywności jonu, względem którego elektroda jest odwracalna. Do celów analitycznych wykorzystuje się na ogół empiryczną postać równania Nernsta;
![]()
gdzie:
E - potencjał elektrody
E0 - potencjał standardowy elektrody
ai - aktywność jonu I w roztworze badanym
S - nachylenie krzywej kalibracji
Nachylanie krzywej kalibracji S określa zmianę potencjału elektrody przy zmianie stężenia jonów o rząd i wyraża się wzorem:
![]()
Potencjometryczne oznaczanie zawartości określonego składnika roztworu może być przeprowadzane następującymi metodami:
metodą potencjometryczną bezpośrednią - polega ona na wyznaczaniu stężenia oznaczanego składnika na podstawie zmierzonej wartości SEM. Wymienić tu należy przede wszystkim pomiary pH roztworów, a także oznaczanie stężeń różnych jonów za pomocą elektrod jonoselektywnych jako elektrod wskaźnikowych
metodą miareczkowania potencjometrycznego - polega ona na rejestrowaniu zmian potencjału elektrody wskaźnikowej spowodowanych dodawaniem (titrant) lub usuwaniem (roztwór badany) określonych jonów w trakcie miareczkowania.
podstawy potencjometrycznych pomiarów pH
Metoda jest oparta na pomiarach SEM ogniwa złożonego z elektrody wskaźnikowej o potencjale zależnym od aktywności jonów wodorowych (wodorowa, szklana, chinhydronowa) i elektrody odniesienia o stałym znanym i odtwarzalnym potencjale (najczęściej kalomelowa). SEM utworzonego ogniwa równa jest różnicy potencjałów obu elektrod.
![]()
![]()
gdzie:
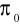
- normalny potencjał danej elektrody odniesiony do wartości potencjału normalnej elektrody wodorowejz - liczba elektronów biorących udział w reakcji elektronowej
R - stała gazowa
F - stała Faradaya
T - temperatura bezwzględna
Podstawiając ![]()
i przekształceniu powyższego równania względem pH, otrzymujemy związek między wartością pH badanego roztworu i wartością SEM ogniwa zbudowanego z tego roztworu i zanurzonych w nim dwóch elektrod: wskaźnikowej i odniesienia.
![]()
CEL ĆWICZENIA
Celem ćwiczenia jest wyznaczenie stałej równowagi reakcji dysocjacji II stopnia kwasu fosforowego:
![]()
![]()
w oparciu o oznaczenia pH roztworów buforowych o znanym stosunku stężeń roztworów dwu soli kwasu fosforowego: 1/15 M roztworu Na2HPO4 i 1/15 M roztworu KH2PO4.
Stała równowagi tej reakcji wynosi:
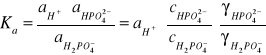
gdzie: Ka - jest termodynamiczną stałą dysocjacji kwasu ortofosforowego drugiego stopnia
![]()
- stężeniem molowym jonu HPO![]()
![]()
- stężeniem molowym jonu H2PO![]()
W roztworze buforowym złożonym z Na2HPO4 i KH2PO4 można przyjąć, że:
![]()
=![]()
![]()
=![]()
stąd też:
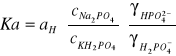
Po zlogarytmowaniu otrzymujemy
![]()
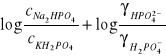
Podstawiając ![]()
i odpowiednio przekształcając otrzymuje się ostatecznie:
![]()
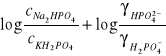
Pomiary pH wykonuje się dla różnych stosunków (![]()
/![]()
). Wyznaczona doświadczalnie wartość pH dla
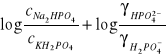
=0
daje szukaną wartość stałej Ka.
POMIAR pH ROZTWORÓW
Oznaczenia pH roztworów można wykonać metodą potencjometryczną. Metoda ta jest oparta na pomiarach siły elektromotorycznej ogniwa, w którego skład wchodzi elektroda wskaźnikowa o potencjale zależnym od aktywności jonów wodorowych w roztworze i elektroda odniesienia - o stałym, znanym i odtwarzalnym potencjale. Elektrodami wskaźnikowymi mogą być na przykład elektroda wodorowa, szklana i inne. Jako elektrodę porównawczą stosuje się najczęściej elektrodę kalomelową. Siła elektromotoryczna E utworzonego w ten sposób ogniwa równa jest różnicy potencjałów elektrody odniesienia ![]()
odnies. i elektrody wskaźnikowej ![]()
wskaź.
E=![]()
odnies - ![]()
wskaź
Oznaczanie doświadczalne pH roztworów w niniejszym ćwiczeniu polega na pomiarze siły elektromotorycznej ogniwa, którym jest elektroda kombinowana. Elektroda kombinowana jest jednoprętowym ogniwem pomiarowym składającym się ze szklanej elektrody wskaźnikowej i chlorosrebrowej elektrody odniesienia umieszczonej w jednej wspólnej obudowie. W praktyce wyznaczanie pH roztworu badanego wymaga uprzedniego wycechowania układu za pomocą wzorcowych roztworów o znanych pH.
WYPOSAŻENIE ĆWICZENIA:
Aparatura i urządzenia:
PH-metr typ N517
Elektroda kombinowana
9 kolbek
Zlewka
3 pipety
Bibuła
Odczynniki:
1/15 M roztwór Na2HPO4
1/15 M roztwór KH2PO4
Roztwory buforowe
Woda redestylowana
PRZEBIEG POMIARÓW:
1.Sprawdzenie pH-metru.
Przełącznik rodzaju pracy powinien być ustawiony na pH. Po włączeniu aparatu do sieci i włączeniu przełącznika „~”, powinny pojawić się wskaźniki cyfrowe na polu odczytowym.
2.Cechowanie pH-metru N517
Do cechowania aparatu stosuje się dwa wzorcowe roztwory buforowe o różnym pH, takie aby spodziewane wartości pH badanych próbek mieściły się w zakresie pH tych buforów. Pehametr powinien wskazywać pH tego roztworu z dokładnością nie mniejszą niż 0,05 jednostki.
3.Pomiar pH roztworów
Sporządzić w kolbkach 9 roztworów mieszaniny Na2HPO4 i roztworu KH2PO4. Następnie pierwszy z nich umieścić w zlewce, zanurzyć elektrodę i odczytać wartość pH. Wykonać te same pomiary dla pozostałych roztworów.
OTRZYMANE WYNIKI:
Tabela 1. Wyniki pomiarów
Skład roztworu [cm3] |
pH |
|
|
|
|
Na2HPO4 |
KH2PO4 |
|
|
|
|
3
|
27 |
5,92 |
1,2023E-06 |
0,1111 |
-0,9542 |
6
|
24 |
6,277 |
5,2845E-07 |
0,2500 |
-0,6021 |
9
|
21 |
6,54 |
2,8840E-07 |
0,4286 |
-0,3680 |
12
|
18 |
6,74 |
1,8197E-07 |
0,6667 |
-0,1761 |
15
|
15 |
6,91 |
1,2303E-07 |
1,0000 |
0,0000 |
18
|
12 |
7,13 |
7,4131E-08 |
1,5000 |
0,1761 |
21
|
9 |
7,34 |
4,5709E-08 |
2,3333 |
0,3680 |
24
|
6 |
7,6 |
2,5119E-08 |
4,0000 |
0,6021 |
27
|
3 |
8 |
1,0000E-08 |
9,0000 |
0,9542 |
Tabela 2. Wyniki obliczeń.
Lp. |
pH |
|
|
|
|
I |
|
|
|
X |
1 |
5,92 |
0,0134 |
0,0603 |
0,0603 |
0,0067 |
0,0804 |
0,3550 |
0,7719 |
-0,3373 |
-1,2916 |
2 |
6,277 |
0,0268 |
0,0536 |
0,0536 |
0,0134 |
0,0938 |
0,3331 |
0,7597 |
-0,3580 |
-0,9601 |
3 |
6,54 |
0,0402 |
0,0469 |
0,0469 |
0,0201 |
0,1072 |
0,3146 |
0,7489 |
-0,3766 |
-0,7446 |
4 |
6,74 |
0,0536 |
0,0402 |
0,0402 |
0,0268 |
0,1206 |
0,2987 |
0,7393 |
-0,3936 |
-0,5697 |
5 |
6,91 |
0,067 |
0,0335 |
0,0335 |
0,0335 |
0,134 |
0,2847 |
0,7305 |
-0,4092 |
-0,4092 |
6 |
7,13 |
0,0804 |
0,0268 |
0,0268 |
0,0402 |
0,1474 |
0,2724 |
0,7224 |
-0,4236 |
-0,2475 |
7 |
7,34 |
0,0938 |
0,0201 |
0,0201 |
0,0469 |
0,1608 |
0,26137 |
0,7150 |
-0,4371 |
-0,0691 |
8 |
7,6 |
0,1072 |
0,0134 |
0,0134 |
0,0536 |
0,1742 |
0,2516 |
0,7081 |
-0,4497 |
0,1524 |
9 |
8 |
0,1206 |
0,0067 |
0,0067 |
0,0603 |
0,1876 |
0,2425 |
0,7017 |
-0,4615 |
0,4927 |
OBLICZENIA:
Na2HPO4 a=3
KH2PO4 b=27
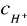
- stężenie jonów wodorowych obliczamy na podst. znanej wartości pH z zależności:
pH = - log[ H+ ]
pH=5,92 ⇒ - log [H+] = 5,92 ⇒ log [H+] =-5,92 ⇒
⇒ [H+] = 10-5,92 = 10-5 ⋅10-0,92 = 1,202 ⋅10-6
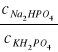
- stosunek stężeń obu roztworów = stosunkowi ich objętości:
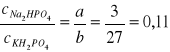
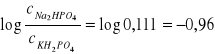
Stężenia poszczególnych jonów :
![]()
![]()
![]()
![]()
J - siła jonowa roztworu :
![]()
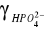
- współczynnik aktywności dla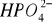
z równania Debey'a i Hückela :
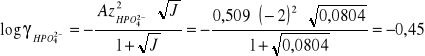
z = -2 - ładunek jonu;
J - siła jonowa roztworu;
A - stała zależna od stałej dielektrycznej rozpuszczalnika i temperatury (dla wody w
temp.=250C: A=0,509 [(dm3)1/2 mol-1/2] ).
![]()
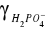
-współczynnik aktywności dla jonu H2PO4-, dla z i = -1
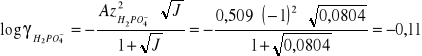
![]()
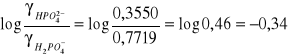
X obliczono wg poniższego wzoru:
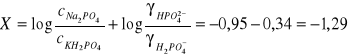
Na podstawie wartości X oraz pH sporządzono wykres pH = f(X)
WYKRES
Na podstawie obliczonych wartości X oraz pH sporządzono wykres pH = f(X) . Z wykresu odczytano wartość pH dla X=0 , która wyniosła ( 7.08 ) .
pH= pKa ⇒ pKa = 7.08
pKa = - log Ka
-log pKa = - 7.08 ⇒ Ka = 10 -7.08 = 10 -7 * 10 -0.08 = 8.31*10 -8
7
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
więcej podobnych podstron