W1 Kontrolowane systemy uwalniania leków- możliwość stałego dozowania leku od kilku dni do kilku lat.
CDDS- controlled drug delivery systems (systemy dostarczający lek w sposób kontrolowany)
DCRS- drug controlled release systems ( systemy uwalniające lek w sposób kontrolowany)
OROS- wykorzystanie zjawiska osmozy do uzyskania stałego kontrolowanego do 24h uwalniania leku, można stosować zarówno dla leków hydrofilowych jak i hydrofobowych. Możliwość administracji stałych, dużych dawek leku
ALZA`s L- OROS- technologia pozwala administrować lek, który w normalnych warunkach występuje w postaci ciekłej.
-Zwiększa możliwość stosowania leków o niskiej rozpuszczalności.
-Zwiększa biodostępność stosowanych leków
-Dla wielu leków zero rzędowa kinetyka profilu uwalniania leku nie jest korzystna dlatego technologia ta pozwala na dopasowanie uwalniania do wymogów terapeutycznych
SYSTEMY TRANSDERMALNE ELEKTRONICZNE
-Większa gama stosowanych leków
-Zwiększenie szybkości administracji leku przez skórę poprzez zastosowanie niskonapięciowych prądów
Macroflux- transdermalna technologia
Transdermalna technologia wprowadziła cienkie tytanowe osłony z precyzyjnymi mikronakłuwaczami, które przechodzą przez martwą tkankę skóry i powodują powstanie wygodnej drogi do administracji leku, nawet makrocząsteczek. Umozliwai opcję opłaszczenia na sucho leku na powierzchni mikronakłuwaczy i wprowadzenie leku do organizmu poprzez skórę w postaci bolusa lub użycie rezerwuaru z lekiem
TECHNOLOGIA STEALTH składa się z lipidowych nanocząstek, które są otoczone polietylenoglikolidem (PGE). To opłaszczenie pomaga ominąć lub opuścić potencjalną odpowiedz układu immunologicznego i umożliwia precyzyjne dozowanie leków do miejsc zmienionych chorobowo w organizmie.
DOXIL jest pierwszym produktem handlowym, który wykorzystuje technologię STEALTH i zawiera lek przeciwnowotworowy. Stosowany w nowotworach jajnika i z AIDS związanymi mięsakami Kaposi'ego.
Metoda Tissue Targeting - lek dążący do celu i zwiększający swe stęż. wokół zmienionej chorobowo tkanki.
Redukcja toksyczności: STEALTH technologia może przyspieszać biodystrybuję wielu środków terapeutycznych przez kierowanie ich tylko do organów chorych z ominięciem zdrowych przez co zmniejszają się ich toksyczne efekty uboczne.
Polepszają rozpuszczalność leków: duzo nierozpuszczalnych lub słabo rozpuszczalnych leków można wprowadzić do liposomów STEALTH zwiększając ich profil rozpuszczalności.
Wewnątrzkomórkowa administracja leku: STEALTH liposomy mogą przenosić ligandy, które mogą łączyć się z receptorami w komórkach zmienionych chorobowo, a związanie z ligandem promuje efektywność wniknięcia leku do komórki i zwiększa jego skuteczność.
DUROS implant jest technologią zaprojektowaną do długoterminowego dozowania leków zarówno o małych masach c. jak również peptydów, protein i makrocząstek. Wykorzystując zjawisko osmozy, , technologia składa się z miniaturowego, tytanowego cylindra i pozwala na ciągłe, stałe dozowanie leku aż do jednego roku.
VIADUR - (leuprolide acetale implant) - pierwszy handlowy produkt wykorzystujący technologie DUROS stosowany w leczeniu paliatywnych w zaawansowanym stadium raka prostaty.
MIKROSFERY, NANOSFERY, MIKROKAPSUŁKI
ALZAMER - jest zaprojektowanym narzędziem z rezerwuarem leku do dozowania biofarmaceutyków i leków w czasie 2 dni do 2 miesięcy. Podczas kiedy tradycyjne rezerwuary z lekiem to mikrosfery. Technologia ALZAMER oferuje możliwość dozowanie bezwodnych roztworów polimerowych dla stabilizacji makrocząsteczki (w roztworze organicznym polimer nie ulega hydrolitycznej degradacji i może zapewnić odpowiedni profil uwalniania leku).
ALZAMER technologia pozwala ominąć częsty początkowy `burst efekt', zwiększa stabilność leku
ALZAMER technologia nie formuje porowatej matrycy przy iniekcji do tkanki umożliwiając ekonomiczne dozowanie i długą administrację leku. Jest to możliwe przez kontrolę morfologii wewnątrz urządzenia i stałych wskaźników rozpuszczalności leku.
Implantacja resorbowanych lub matryc zawierających lek (cytostatyk) bezpośrednio do daje tkanki.
W2 CHRONOTERAPIA
-samoregulujące systemy uwalniania leków (np. glukoza-insulina)
-cykliczne zmiany stężenia poziomu hormonu i metabolitów - dobowe
-melatonina - miesięczne: estradiol, progesteron
Systemy uwalniania leków powinny umożliwiać dozowanie leków bez zmiany ich bioaktywności - również dużych cząsteczek: peptydów i protein.
DRUG-TARGETING - systemy uwalniania leku dążącego do celu, dozowanie leku wybiórczo do specyficznych komórek i organów - spadek toksyczności leku poprzez obniżenie ekspozycji zdrowych komórek lub organów na dozowany lek.
W systemach drug-targeting konieczna jest wyraźna molekularna różnica pomiędzy komórkami zdrowymi a chorymi.
Wodorozpuszczalne systemy polimerowe zawierające przeciwciała przeciw komórkom chorym, np. specyficzne przeciwciała przeciw komórkom nowotworowym jajnika CA-125 (cancer-antigen).
Hydrożele są podstawowymi materiałami w kontrolowanych systemach uwalniania leków.
Definicja: Hydrożel jest to materiał, który wprowadzony do wody, posiada własność jej szybkiego wchłonięcia i zatrzymaniu w swej strukturze, materiał nie ulega rozpuszczaniu w wodzie tworząc trójwymiarową sieć.
-Hydrożele zwykle są wykonywane z hydrofilowych cząsteczek polimeru, połączonych poprzecznie wiązaniami chemicznymi lub innymi siłami kohezji takimi jak oddziaływania jonowe.
-Hydrożel ulegający po pewnym czasie rozpuszczeniu w wodzie przechodzi w formę hydrozolu, (np. w formę koloidalnej dyspersji w wodzie).
-Wysuszony hydrożel nazywamy kserożelem lub tzw. „suchy żel” (proszek do wody= hydrożel).
Zalety hydrożeli:
A. Maja zmienne właściwości fizyczne, objętość, przewodnictwo itd.
W zależności od środowiska, w którym się znajdują: pH, temperatura, pole elektryczne, siły mechaniczne, rodzaj rozpuszczalnika, wpływ dodatku i stężenia soli, światło; maja zastosowanie w biomedycynie, farmacji, rolnictwie.
B.Hydrożele są biomateriałami i są wysoce biokompatybilne, gdyż:
mają powierzchnie nie wywierające nacisków lub napięć na otaczające tkanki, przez co zminimalizowane są możliwości adsorpcji protein i adhezji komórek na powierzchni. Zminimalizowane infekcje, stany zapalne.
C.Z powodu dużej ilości wody powierzchnia hydrożelu nazywana jest tzw. Superhydrofilową powierzchnią dyfuzyjną o wysokiej biokompatybilności.
D.Hydrozele symulują niektóre hydrodynamiczne właściwości naturalnych biologicznych żeli, komórek, tkanek, - adsorpcja protein i adhezja komórek jest hamowana przez dużą ruchliwość łańcuchów na powierzchni żelu.
Wady:
Słabe właściwości mechaniczne. Ale można je poprawić przez :
*** Możliwość pominięcia poprzez tzw. Grafting - modyfikacja powierzchni lub przyczepienie innego materiału do powierzchni hydrożelu, aby nadać mu odpowiednie właściwości mechaniczne z zachowaniem biokompatybilności :
*adsorpcja fizyczna,
*sprzężenie zszywające (na zasadzie oddziaływań elektrostatycznych, sprzężenie łańcuchów),
*polimeryzacja.
HYDROŻELE BIODEGRADOWALNE
Biodegradowalne systemy polimerowe są szczególnie użyteczne w uwalnianiu leków - nośnik leku powodujący jego stopniowe uwalnianie a sam ulega degradacji i wchłonięciu w organizm.
Pozwalają przenosić duże cząsteczki leku- protein, peptydów, które nie podlegają prawom dyfuzyjnego kontrolowanego uwalniania z niedegradowalnych polimerowych matryc.
BIODEGRADOWALNE POLIMEROWE SYSTEMY UWALNIANIA LEKÓW:
Gdy szybkość uwalniania leku jest kontrolowana przez dyfuzję leku, to biodegradacja polimerowej matrycy nie ma większego znaczenia w profilu uwalniania leku.
Degradacja materiału polimerowego często wpływa na szybkość uwalniania leku i jest wykorzystywana do sterowania uwalnianiem.
BIODEGRADACJA def. - to konwersja materiału w mniej złożone produkty pośrednie, bądź produkt końcowy w wyniku prostej hydrolizy lub działania produkowanych biologicznie związków np. enzymów.
Materiał polimerowy może ulec fragmentacji w wyniku rozpadu wiązań międzycząsteczkowych (zachowana budowa łańcuchowa) lub wewnątrzcząsteczkowych (rozrywanie wiązań w łańcuchu głównym lub bocznym).Powstałe fragmenty mogą być usuwane z miejsca działania, lecz nie koniecznie z organizmu.
BIORESORPCJA - Proces degradacji materiału powodujący spadek jego ciężaru cząsteczkowego do postaci związku niskocząsteczkowego, który może zostać wyeliminowany z organizmu w wyniku naturalnych przemian biochemicznych.
BIOABSORPCJA - Usuwanie materiału polimerowego z organizmu z miejsca działania
(z degradacją lub bez) poprzez jego dyspersję i specjalny mechanizm transportu gdyż w większości przypadków zdyspergowana cząsteczka polimeru jest zbyt duża do usunięcia w wyniku procesu dyfuzji.
BIOEROZJA - Konwersja nierozpuszczalnych w wodzie polimerów w polimery wodorozpuszczalne lub wodorozpuszczalne produkty degradacji.
Erozja przebiegająca tylko na powierzchni materiału to erozja powierzchniowa (lub heterogeniczna).
Erozja wewnątrz materiału to erozja w masie (homogeniczna).
BIODETERIORACJA - termin używany do opisu wszelkich, niepożądanych zmian we właściwościach materiału: mechanicznych, fizycznych, chemicznych prowadzących do destrukcji materiału.
MECHANIZMY BIODEGRADACJI:
Solubilizacja
Formowanie ładunku poprzedzające rozpuszczenie.
Hydrolityczna degradacja
Enzymatycznie katalizowana degradacja
SOLUBILIZACJA
-Większość naturalnych polimerów i dużo syntetycznych jest rozpuszczalna w wodzie
-Syntetyczne polielektrolity: poli kwas akrylowy, karboksymetyloceluloza (CMC), rozpuszczają się w wodzie w wyniku oddziaływania obdarzonej ładunkiem grupy funkcyjnej, np. COO- z cząsteczką wody.
-Polarne polimery takie jak: polialkohol winylowy, PEO, poliwinylopyrolidon (PVP), dekstran, łatwo rozpuszczają się w wodzie w wyniku powstawania wiązań wodorowych z cząsteczką wody.
-Hydrofilowe polimery w postaci stałej pochłaniają cząsteczkę wody, tworząc w ten sposób hydrożel. Cząsteczki wody dyfundują wolno przez luźną sieć utworzoną z łańcuchów polimeru. Dodanie wody powoduje rozluźnienie oddziaływań między cząsteczkowych pomiędzy łańcuchami polimeru, i pojedyncze łańcuchy rozpuszczają się tworząc roztwór o wysokiej lepkości.
Szybkość rozpuszczania wodorozpuszczalnych polimerów zależy od ciężaru cząsteczkowego oraz stereoregularności łańcucha polimerowego.
-Powstanie żelu zależy od stężenia polimeru w roztworze wodnym. Stężenie polimeru, przy którym powstaje żel zależy od rodzaju polimeru.
Przemiana żel w zol jest przy stałym stężeniu polimeru, zależy od pH i temperatury roztworu (proces odwracalny).
Formowanie ładunku poprzedzającego rozpuszczanie - JONIZACJA lub PROTONOWANIE.(wzory)
Rozpuszczalność polikwasów silnie zależy od pH.
-pH niskie - nierozpuszczalne, ze wzrostem pH następuje deprotonacja grupy karboksylowej, wzrost stężenia grup jonowych, wzrost hydrofilności, absorpcja wody, pęcznienie rozpuszczanie.
-Polizasady odwrotne pH, niska rozpuszczalność
-Polikwasy materiały powlekające leki nierozpuszczalne w żołądku tylko w jelitach.
pH czułe dojelitowe polimerowe materiały powlekające:
(wszystko dotyczy tabletek dojelitowych)
Szelak
CAP - octano- ftalan celulozy
Cas - octano-suksynian celulozy
Kopolimer kwasu metakrylowego z metakrylanem metylu.
Poli-octano ftalan winylu
Ftalany hydroksy- propylom etylocelulozy
FORMOWANIE ŁADUNKU POPRZEDZAJĄCE ROZPUSZCZANIE :
Hydroliza poprzedzająca jonizację
Nierozpuszczalne w wodzie polimery zawierające boczne grupy bezwodnikowe lub estrowe mogą być rozpuszczalne po ich hydrolizie do form zjonizowanych kwasów w łańcuchu polimerów.
HYDROLITYCZNA BIODEGRADACJA
Hydrolityczna degradacja łańcucha głównego syntetycznego polimeru prowadzi stopniowo do niskocząsteczkowych oligomerów a następnie do substancji małocząsteczkowych mogących ulegać wchłonięciu w organizmie.
Biopolimery takie jak: proteiny, policukry zawsze ulegają hydrolitycznej degradacji. (one też ulegają degradacji enzymatycznej)
Podstawowe polimery ulegające biodegradacji :Polipeptydy, Poli (kwas mlekowy), Polikwas glikolowy, Poli e-kaprolakton, poli (B-hydroksy walerian)
także poliestry : Poli-beta-hydroksywalerian, polidioksanon (poliwęglan), polietylen tere ftalowy, polikwasy maleinowy,polikwasy szczawiowy, Poli -o-estry - polibezwodniki, policyjanoakrylany, polifosfoestry, polifosfazeny.
Przedstawione polimery są w większości rozpuszczalne w wodzie i nie mogą tworzyć hydrożeli nawet w obecności nadmiaru wody.
Jednakże można je używać w formie hydrożelu po odpowiednim spreparowaniu.
Kopolimeryzacja z polimerem tworzącym hydrożel
Otrzymywanie blend polimerowych z polimerem tworzącym hydrożel.
Tworzenie IPN -wewnątrz sieci polimerowych z wodororozpuszczalnymi polimerami.:
- Wpływ morfologii (budowy nadcząsteczkowej) na degradację krystaliczne domeny degradują wolniej niż amorficzne.
I etap: nieenzymatyczna hydroliza wiązań :
* dyfuzja dużych cząstek enzymu jest niemożliwa do masy polimerowej
* degradacja powierzchniowapoliortoestry i polibezwodniki ta właściwość jest idealna do tworzenia tzw. systemów w uwalnianiu leków zerowego rzędu degradacja czuła na pH pozwala dowolnie sterować szybkością uwaniania leków:
Poliestry - degradują poprzez prostą hydrolizę
Polikwas glikolowy pierwszy syntetyczny polimer, bioabsorbowalne nici chirurgiczne
PHB resorbowany w organizmie degraduje do CO2 i H2O, użyteczny do produkcji nici chirurgicznych i implantowanych systemów uwalniania leków.
PHB i PHV są syntetyzowane przez hodowlę bakterii - odżywka wzbogacona w węglowodory z niedoborem azotu.
Kopolimery PHB i PHV wzrost udziału PHV redukuje temp.topnienia kopolimeru.
Policyjanoakrylany hydroliza wiązań C-C- produkty degradacji -formaldehyd i cyjanooctan mogą być wysoce toksyczne.
Polifosfazeny hydrolityczna stabilność jest regulowana przez zmianę bocznych podstawników.
Polifosfoestry O-P-O-C w łańcuchu głównym.
Poliestrouretany wzrost udziału estru zwiększa możliwość degradacji hydrolitycznej.
Polieterouretanydużo wolniej hydrolizują niż poliestrouretany.
DEGRADACJA HYDROLITYCZNA KATALIZOWANA ENZYMAMI
enzymy degradują głównie rolę w degradacji syntetycznych poliaminokwasów:
Poli L-lizyna, poli L-arginina, poli L- kwas asparaginowy, poli L-kwas glutaminowy.polietylen, polipropylen, PMMA, PS uważa się za nie ulegające degradacji.(za stabilne)Jednakże po ich implantacji w organizmie obserwuje się pewien stopień ich degradacji w wyniku działania enzymów. (esterazy)
Hydroliza elastomerów wykorzystywanych z poliestrów np. poli ε-kaprolaktonu i poli δ-walerolaktonu przebiega szybciej in vivo niż in vitro, co świadczy o przebiegającym procesie degradacji enzymatycznej w organizmie obok degradacji hydrolitycznej.
Możliwość penetracji enzymu w syntetyczny materiał polimerowy determinuje rozmiar degradacji katalizowanej enzymem oraz jej rodzaj.
Rodzaje degradacji enzymatycznej:
Degradacja powierzchniowa
Degradacja wewnątrz masy polimerowej.
!!!Stopień penetracji enzymu wewnątrz polimeru zależy od:
-Wymiaru enzymu
-Fizycznych właściwości polimeru morfologii (obszary amorficzne i krystaliczne).
Ten sam polimer może ulegać degradacji powierzchniowej lub w masie w zależności od rodzaju enzymu np. BIOMER.
Im większa elastyczność, miękkość materiału polimerowego i nieuporządkowanie łańcuchów (amorficzność), tym łatwiejsza penetracja enzymu wewnątrz masy polimerowej; degradacja wolniejsza w obszarach krystalicznych w porównaniu z amorficznymi.
Wodororozpuszczalne syntetyczne polimery również ulegają enzymatycznej degradacji. Np. PEG, polipropylowane glikole, polialkohol winylowy. Degradacja enzymatyczna wywołana przez enzymy bakteryjne powoduje otwarcie wiązań C-C.
W3
Forma leku o przedłużonym działaniu czy systemy terapeutyczne - są lepsze w leczeniu nowotworów?
-System terapeutyczny - postać leku uwalniająca substancję leczniczą z określoną szybkością i przez określony czas (kilka godzin, miesięcy)
W tym okresie ma zapewniać stałe stężenie substancji leczniczej. Szybkość uwalniania nie jest zależna od ilości leku pozostającego w systemie.
-W większości leków o przedłużonym działaniu szybkość uwalniania substancji maleje wraz ze zmniejszającą się ilością substancji w danej postaci.
-Lek o przedłużonym działaniu może działać równie długo jak system terapeutyczny, lecz nie zawsze zapewnia stałe stężenie substancji leczniczej we krwi.
-System terapeutyczny nie jest charakteryzowany dawką lecz ilością substancji uwolnionej do organizmu w jednostce czasu i okresem w którym stała szybkość uwalniania jest utrzymana.
Matryca polimerowa a nanosfera w leczeniu nowotworów
-Budowa matrycy (1) i nanosfery (2) a profil uwalniania
Mechanizm uwalniania leków z matryc polimerowych
-Lek będzie się uwalniał dwuetapowo
-W wyniku dyfuzji z powierzchni matrycy polimerowej (ang. turret effect?????)
-W wyniku degradacji z masy matrycy polimerowej
Mechanizmy uwalniania leków z matryc polimerowych.
Degradacja zależy od rodzaju polimeru. Może zachodzić na powierzchni lub w masie polimeru
Metody otrzymywania matryc polimerowych
Procedura przygotowania matryc o różnych kształtach
Mamy rozpuszczalnik z polimerem i lekiem. Teraz możemy go zamrozić, ew. wysuszyć i nadać kształt pod wpływem ogrzewania i kompresji ( czyli nie jest płaski, ale ma jakiś kształt)
Możemy również wylać roztwór na płaskie podłoże i odparować rozpuszczalnik ( otrzymujemy płaską warstwę polimeru).
Metoda otrzymania matryc polimerowych a kontrolowane uwalnianie leku z powierzchni:
a) metoda otrzymania matrycy trójwarstwowej
Mamy SMD czyli pojedynczą matrycę zawierającą lek. Nad nią, jak i pod nią umieszczamy FD czyli matryce z lekiem. W wyniku kompresji w odpowiedniej temperaturze, przy odpowiednim F i tau, otrzymujemy TLDR- trójwarstwowy krążek z umieszczonym centralnie zbiornikiem leku
Mikrofilmy polimerowe do kontrolowanego uwalniania paklitakselu
Zalety stosowania mikrofilmów:
Matryce z polimerów biodegradowalnych- kolagen
Lepsza farmakokinetyka
Zdolność do lokalnego i ciągłego uwalniania
Elastyczność matryc- odpowiednie dla powierzchni tkanek
Wyniki badań:
Matryca zastosowana lokalnie po usunięciu guza
Stałe uwalnianie przez 45 dni
Cytotoksyczność w warunkach In vitro
Ochrona przed wznową guza ( małe zwierzęta)
Mikrofilmy polimerowe do kontrolowanego uwalniania paklitakselu
Zalety stosowania mikrofilmów:
Matryce z polimerów biodegradowalnych - kolagen
Lepsza farmakokinetyka
Zdolność do lokalnego i ciągłego uwalniania
Elastyczność matryc: odpowiednie dla powierzchni tkanek
Wyniki badań:
Matryca zastosowana lokalnie po usunięciu guza
Stałe uwalnianie przez 45 dni
Cytotoksyczność w warunkach In vitro
Ochrona przed wznową guza (małe zwierzęta)
Inne leki stosowane w systemie matrycowym do leczenia nowotworów
System matrycowy In situ z dox
Matryce do uwalniania hydroksykamptotecyny
Struktury i skróty hydrofobowych analogów polimeru
Karmustyna
Jako nośnik stosowany polifeprosan 20 (kopolimer bis-(p-karboksyfenoksy)propanu i kwasu sebacynowego 20/80
Wymiary implantu: d=1,45 cm Ø=1mm
Zawartość karmustyny: 7,7mg
Ilość polimeru: 192,3mg
Gliadel—komercyjnie dostepna matryca do uwalniania karmustyny
-Badania kliniczne wykazały, ze płatki Gliadel są dobrze tolerowane i efektywne
-Płatki umieszcza się (w ilości do 8) w tkance mózgowej po chirurgicznym usunięciu guza
-Według badań klinicznych u 15.8% stosujących Gliadel i 11,7% pacjentów otrzymujących placebo zauważono nieprawidłowości dotyczące gojenia ran.
-Natomiast z przeprowadzonych badań na 240 chorych wynika, że stosowanie płatków z karmustyną powoduje przedłużenie czasu przeżycia z 11,6 do 13,8 miesięcy
Inne leki stosowane w systemie matrycowym do leczenia nowotworów:
-doksorubicyna- dox.
-jako nośnik kopolimer bis-(p-karboksyfenoksy)propanu i kwasu sebacynowego 10/90
-Wymiary implantu d=3 mm, średnica =1mm , ciężar 10 mg
Badania kliniczne
-in vitro:
badano kinetykę uwalniania w zależności od zawartości doksorubicyny w polimerze 1- 10%
-in vivo:
po podaniu domózgowym mediana przeżycia wynosiła:
dla polimeru 21 dni
dla 3% dox. w polimerze 34 dni
dla 5% dox. w polimerze 45 dni
W jakich typach nowotworów są stosowane mikrofilmy?
Typ nowotworu |
Ilość przypadków |
Ilość zmarłych |
Stopień przeżycia |
Płuc |
215 020 |
161 840 |
16 % |
Mięsakorak |
10 390 |
3 680 |
30-90 % |
Piersi |
184 450 |
40 930 |
89 % |
Czerniak |
62 480 |
8 420 |
92 % |
Jelita |
148 810 |
49 960 |
65 % |
Komercjalizacja mikrofilmów
Krok 1 — zebranie środków na badania (grant)
współpraca naukowców
dostęp do zwierząt, na których przeprowadzi się implantacje
Krok 2 — po opracowaniu technologii uzyskanie licencji
zyski pozwolą przeprowadzić badania kliniczne implantów wprowadzonych do nowotworów
Krok3 — Faza badań klinicznych (I)
Krok 4 — Faza badań klinicznych (II, III)
potrzeba sponsoringu w celu promocji implantu a następnie komercyjnego dostępu
Metoda otrzymania nanosfer
- do reaktora wprowadzamy monomer, lek, wodę i surfaktant, następnie poddajemy procesowi sonikacji, w wyniku czego otrzymujemy nanosfery
Nanocząstki polimerowe
- nanocząstki do uwalniania czynnika proangiogennego
- jako nośnik zastosowano kopolimer glikolidu z D,L-laktydem oraz poloxamer (Pluronic F68 jako stabilizator suspensji)
- czynnikiem proangiogennym może być VEGF-ENZ7 (jedna z trzech form genu VEGF-E wirusa Orf-wirusa ospy owczej)
* profil uwalniania poliaminokwasu z PLGA/poloxamer nanocząstek w PBS
- zastosowanie mikrocząstek powoduje uwolnienie 80% po 12 dniach
- zastosowanie nanosfer - 20% po 12 dniach
Nanocząstki polimerowe
- nanocząstki z tamoksifenem
- jako nośnik polimerowy zastosowano kopolimer glikolidu z D,L-laktydem 50/50
- zwiększenie ilości polimeru w stosunku do ilości leku wpływa na zwiększenie stopnia enkapsulacji leku
- zwiększenie ilości polimeru w stosunku do ilości leku wpływa na zwiększenie ilości uwolnionego leku
- najlepszy F2 10:1 (stosunek polimer:lek) - uwalnia się 40% leku i profil jest stabilny po 8h
Nanocząstki polimerowe
- nanocząstki do uwalniania 5-fluorouracylu
- jako nośnik zastosowano lipidy (SLNs-solid lipid nanoparticles)
- spadek uwalniania w przypadku kompleksu Fr-SLNs mógł być spowodowany przez podwójną warstwę dyfuzyjną
- użycie kompleksu Fr-SLNs skutkowało zwiększeniem cytotoksyczności
Nanocząstki polimerowe
- nanocząstki z doxorubicyną aplikowane w formie aerozolu
- jako nośnik doxorubicyny zastosowano dekstran i cyjanoakrylan n-butylu
- przez zastosowanie nanocząstek uzyskano znacznie większą cytotoksyczność, w porównianiu do nanocząstek bez leku i samej doksorubicyny
Nanocząstki polimerowe
∙ Magnetyczne nanocząstki- SPION ( rys.)
Nanocząsteczki magnetyczne
∙ nośnik polimerowy jest biodegradowalny
∙ zaleta: zmiany pH wpływają na zwiększenie rozmiaru nanocząstek i uwalnianie leku
∙ lokalna i stały uwalnianie substancji leczniczej ( niestety nie potrafię się odczytac)
∙ znacząca redukcja w zawartości leku
Inne możliwości:
∙ wykonane na zamówienia nanonośniki mogą zrewolucjonizować uwalnianie in vivo albo in vitro (nie wiem) leków
∙ wysoka dostępność
Zagrożenia:
∙ wczesna faza rozwoju podstawowe badania
- toksyczność
∙ brak produktu komercyjnego dostępnego na rynku
Nanocząstki- ciąg dalszy badań
ustalenie skali eksperymentu
ustalenie działania nanocząstek na komórki
ścieżka endocytarna, czas połowicznego rozpadu
ustalenie mechanizmu działania
uniknięcie pęknięcia błony endosomu, pęknięcie blony endosomu
pH wrażliwe uwalnianie leku z nanocząstek in vivo albo in vitro ( nie wiem)
dalsze ustalenia dotyczące działania celowanego
ustalenie biodystrybucji i potwierdzenie toksyczności
badania są przeprowadzane na „dużych” zwierzętach (naczelne)
rozpoczęcie komercjalizacji
Zgoda Fundacji ds. Administracji leków (Foundation of drug administration) FDA
Procedura dotyczy analizy produktu, która umożliwi komercyjne zastosowanie
Zbadanie leku i nośnika
Zbadanie technologii
- FDA wymaga określenia technologii połączenia leku z polimerem
- Nanocząsteczki jak na razie nie posiadają zgody, gdyż nie jest wiadomy mechanizm
OCP
Ocena efektywności zastosowanego leku na poprawę przeżywalności
- wymagane badania dużej ilości próbek - badania muszą być powtarzalne ($60-80M)
- wymagane badania implantacji do guza w celu potwierdzenia śmiertelności komórek
nowotworowych
Pytanie zasadnicze: czy wymagane oznaczenia produktu dotyczą zmniejszenia
ryzyka wystąpienia wznowy czy będą wystarczające dla FDA lub poprawią
wymaganą przeżywalność.
Zgoda FDA na zastosowanie innowacyjnego leku
Badania przedkliniczne:
Ocena toksyczności leku i efektu farmakologicznego potwierdzona przez badania in vitro i in vivo na zwierzętach
Badania na zwierzętach muszą zostać potwierdzone na co najmniej 2 gatunkach
Posiadanie IND obliguje do badań klinicznych na ludziach:
I faza badań:
Określenie ścieżki metabolicznej i efektu farmakologicznego u ludzi, skutki uboczne związane ze zwiększeniem dawki i potwierdzenie efektywności
Badania są prowadzone na zdrowych wolontariuszach
W przypadku raka badania prowadzi się na pacjentach chrujących na nowotwór, zazwyczaj pacjentach ze wznową
Generalnie badania obejmuja 20-80 zagadnień
II faza badań:
Otrzymanie wstępnych danych dotyczących efektywności dla poszczególnych objawów
Generalnie badania obejmują kilkaset zagadnień
III faza badań:
Otrzymanie dodatkowych informacji odnośnie efektywności i bezpieczeństwa wymagane do określenia całkowitej proporcji zalet/zagrożeń stosowania
Generalnie obejmuje od kilkuset do kilku tysięcy pacjentów, u których zastosowano lek
Nowe zastosowanie leku (NDA)
Recenzja:
FDA recenzuje wyniki badań klinicznych dla zgłoszonego produktu, proponuje etykietę, zdolność produkcyjną i miejsce bada ń klinicznych w porównaniu do innych produktów
W4
BIODEGRADOWALNE MATERIAŁY DO UWALNIANIA LEKÓW
1. Materiały polimerowe do uwalniania leków z degradowalnym łańcuchem głównym
1.1. Hydrożele zsieciowane (+ były wzory narysowane)
1.1.1. Hydrożele z naturalnych polimerów np. poliproteiny, policukry - degradacja enzymatyczna i hydrolityczna
Sieciowanie policukrów - policukry z grupą COOH poddajemy reakcji z estrem metylowym cysteiny i sieciujemy oksydacyjnie (tworzy się wiązanie S-S)
1.1.2. Hydrożele z syntetycznych poli-α-aminokwasów możemy sterowa odległością między łańcuchami (+były wzory)
1.1.3. IPN - wewnątrz penetrujące sieci hydrożelowe - materiał zawierajacy dwa polimery, każdy w formie zsieciowanej
Semi IPN - tylko jeden polimer zsieciowany
IPN hydrożele mogą być hybrydą własności wchodzących w skłąd polimerów np.:
pH czuły hydrożel + termoczuły hydrożel + IPN termo i pH czuły
mechaniczne własności hydrożelu mogą być wzmocnione przez użycie drugiego hydrofobowego polimeru
jeden lub oba polimery mogą być biodegradowalne
IPN - mogą być pomiędzy naturalnymi i syntetycznymi sieciami:
1) kopolimeryzacja akryloamidu z N, N' - metylenobisakrylamidu w roztworze żelatyny
2) żelatyna sieciuje z aldehydem glutarowym
3) semi IPN-HEMA o obecności 2% roztworu kolagenu
4)polimeryzacja hydroksyetylometanu (HEMA) w obecności 2% roztworu kolagenu
5) proteiny, policukry sieciowane w obecności wodororozpuszczalnych, syntetycznych polimerów
1.1.4. Poliestrowe hydrożele (+były wzory do pkt a lub b)
a)można je uzyskać biorąc prepolimer zawierający nienasycone wiązanie i sieciując akryloamidem lub winylopirolidonem
b)do poprawy hydrolizy alifatycznych poliestrów przy pH 7,4 i temp. 37oC w strukturę łańcucha głównego często dodaje się dikwasy np. kwas ketoglutarowy, kwas ketomalonowy, kwas diglikolowy
c)szybkość degrdacji takiego polimerowego żelu jest kontrolowana przez gęstość sieciowania i rodzaj dikwasu karboksylowego
-(O - CH2 - CHR - COO - CH2 -CH - COO - CH2 - CHR - CO)n -
COOH
d)biodegradowalne hydrożele z prepolimerów poliestrowych z bocznymi wiązaniami nienasyconymi - sieciowanie radiacyjne - zmiana erozji poprzez sterowanie strukturą (ilość wiązań podwójnych)
1.1.5. Polikaprolaktonowe IPN
Otrzymywanie:
PCl -IPN 1 Otrzymywanie:
1)polikaprolakton wprowadza się w hydrożel PHEMA (polihydroksyetylometakrylan).
2)Polikaprolakton poddajemy biodegradacji. Tworzą się puste miejsca w których możliwy jest wzrost komórek i podawanie czynników wzrostu i leków - inżynieria tkankowa
PCl -IPN 2:
1)polikaprolakton rozpuszczamy w monomerze HEMA
2)polimeryzujemy HEMA,
3)niezamknięty polikaprolakton wymywamy przez ekstrakcję
4)poddajemy modyfikacji - końcowe grupy OH reagują z bezwodnikiem np. itakonowym aby wprowadzić podwójne wiązanie.
5)polikaprolakton z grupami itakonowymi w żelu PHEMA poddajemy sieciowaniu. Tworzy się IPN
1.2. Hydrożele nizsieciowane
1.2.1. Fizyczne żele protein i policukrów
niektóre polimery tworzą 3D sieci bez chemicznych poprzecznych połączeń -
ŻELE FIZYCZNE - mechaniczne własności słabe, można je modyfikować poprzez chemiczne usieciowanie.
1.2.2. Hydrożele z kopolimerów blokowych (+wzory)
biodegradowalne rozpuszczalne w wodzie polimery kopolimeryzujemy z hydrofilowymi polimerami - otrzymujemy kopolimer mogący absorbować określoną ilość wody nie rozpuszczając się w niej
PEO (polietylenoglikol) + PLA (polikwas mlekowy) - możliwość chłonąca wody zależy od udziału PEO w łańcuchu
Gwiaździste polimery 3 i 4 ramienne PEO-PLA
s-PEO-PLA (super mikrokapsuła) - hydrofilowy blok PEO w rdzeniu kapsuły, zewnętrzna powierzchnia hydrofobowa łańcuchowa PLA
Iniekcyjne systemy dozowania leków o przedłużonym działaniu
wodny roztwór B-A-B triblokowego kopolimeru posiada właściwości zmiany zol-żel w sposób odwracalny w zależności od temperatury tworzy hydrożele bez niebezpiecznych toksycznych rozpuszczalników organicznych lub przebiegu reakcji chemicznej
do wodnego roztworu można wprowadzić lek rozpuszczalny w wodzie w niskiej temperaturze (poniżej temperatury żelowania) czyli w formie zolu, struktura triblokowego kopolimeru jest tak dobrana (długość bloków)aby temperatura żelowania wynosiła mniej niż 370 C
Roztwór żelu z lekiem wstrzyknięty w organizm powoduje jego żelowanie i utworzenie matrycy polimerowej zawierającej lek. Z matrycy polimerowej lek jest wolno uwalniany w wyniku dyfuzji oraz postępującej wolno degradacji hydrolitycznej łańcuchów polimerowych.
Inne hydrożele z kopolimerów blokowych
Estrouretany - polimeryzacja D, L - laktydu lub kopolimeryzacja D, L - laktydu z kaprolaktonem w obecności PEG jako inicjatora. Nastepnie reakcja z diizocjanianami do poliuretanowych biodegradowalnych hydrożeli
PEO-PET (hydrożele pH- czułe!!!) - polikondensacja dietylenoglikolowego tetraftalanu z PEG. Wzrost udziału PEO powoduje zwiększenie szybkości degradacji - szybkość hydrolizy wzrasta gwałtownie przy wzroście pH
1.2.3. Hydrożele kopoliaminokwasów
kopolimery hydrofobowych i hydrofilowych aminokwasów
hydrofilowy: L-kwas glutaminowy
hydrofobowy: L-leucyna lub estry hydrofilowych aminokwasów - glutaminian metylu
1.2.4. Kompleksy polielektrolitów:
jonowe oddziaływania pomiędzy dwoma przeciwnie naładowanymi polielektrolitami prowadzą do utworzenia polisoli lub polielektrolitowych kompleksów o właściwościach całkowicie różnych niż składowe komponenty.
Przykład komponentu polielektrolitowego [ żelatyna (proteina o ładunku dodatnim) + guma arabska (policukier z resztkami kw.D-glukuronowego)]
1.2.5. Blendy polimerowe
mieszanie dwóch różnego typu polimerów - otrzymywanie blendy polimerowej
Polimer A biodegradowalny + polimer B biodegradowalny
Polimer A biodegradowalny + polimer B niebiodegradowalny
Polimer A hydrofilowy + polimer B hydrofobowy
Polimer A hydrofilowy + polimer B hydrofilowy
Polimer A i B hydrofilowe, A - biodegradowalny
Przykład
PVA (polialkohol winylowy) + PLAGA (kopolimer laktydu z glikolidem) - ze wzrostem PVA wzrasta zawartość wody w blendzie
wprowadzenie leków do blendy z polialkoholem winylowym - możłiwość dyfuzji leków z blendy jest proporcjonalna do ilości PVA
2. Materiały polimerowe do uwalniania leków z degradowalnym czynnikiem sieciującym
hydrożele polimerowe otrzymane poprzez sieciowanie wodorozcieńczalnych polimerów biodegradowalnym czynnikiem sieciującym
łańcuch główny nie degraduje, w efekcie degradacji czynnika sieciującego powoduje powstanie rozpuszczalnych łańcuchów nośnika polimerowego i wymywanie pojedynczych łańcuchów
uwalnianie leku odbywa się nie z sieci polimerowej lecz w wyniku rozpuszczania hydrożelu i zależy od rozpuszczalności leku
leki dobrze rozpuszczalne w wodzie uwalniają się szybko dlatego ten typ systemu uwalniania leków jest stosowany dla leków o niskiej rozpuszczalności w wodzie lub leków o wysokich ciężarach cząsteczkowych (tj. peptydowe i proteinowe leki.)
2.1. Hydrożele sieciowane małymi cząsteczkami
2.1.1. Hydrożele sieciowane N, N' - metylenobisakryloamidem (BIS)
2.1.2. Hydrożele sieciowane azoreagentami
aromatyczne wiązania azowe -N=N- są otwierane przez azoreduktazę bakterii występującą w okrężnicy
hydrożelowe systemy zsieciowane tymi wiązaniami degradują w okrężnicy i uwalniają lek
np. insulina umieszczona w hydrożelu z sieciującymi wiązaniami azowymi jest chroniona przed destrukcją w żołądku przez co umożliwione jest jej dozowanie doustne
2.1.3. Hydrożele sieciowane sacharozą
dochodzi do utworzenia wiązania estrowego i wytworzenia sieci - łańcuchy główne są połączone sacharozą
2.2. Hydrożele sieciowane oligopeptydami
Degradacja enzymatyczna oligopeptydowego łącznika
Kopolimer N-(2-hydroksypropylo)-metakryloamidu (HPMA) i N-difenyloglicyloalaninowego estru p-nitro-fenylowego zsieciowanego bis,N-difenyloheksametylenodiaminą
Otrzymany zsieciowany hydrozel, następuje degradacja enzymatyczna zsieciowanego hydrożelu - chymotrypsyną
struktura oligopeptydowego łącznika wpływa na czas degradacji. Sterowanie czasem degradacji pozwala na sterowanie stężeniem i czasem uwalnianego leku
Łącznik dipeptydowy - nie degraduje zbyt duży enzym.
-im dłuższy oligopeptyd tym większe oczka sieci w polimerze i większe cząstki można do tej matrycy wprowadzić
-łączniki oligopeptydowe np. Gly-Phe, Gly-Gly, Ala-Val i inne
-degradacja następuje w różnym stopniu - mały oligonukleotyd powoduje, że “oczka sieci” są zbyt ciasne aby mogła tam dostać się chymotrypsyna - wtedy degradacja postępuje wolno
-rodzaj aminokwasu ma znaczenie - różna budowa ich cząsteczek warunkuje podatność na działanie enzymów
-im większy polipeptyd tym większa degradacja
2.3. Hydrożele sieciowane makrocząsteczkami
naturalnymi - policukry, proteiny
syntetycznymi - PLA, PLAGA (biodegradowalne, liniowe polimery)
2.3.1. Sieciowanie łańcuchów polimeru cząsteczkami insuliny
takie sieci degradują szybciej niż zsieciowane oligopeptydy bo cząsteczki insuliny są większe niż oligopeptydy!!!
2.3.2. Polimeryzacja winylowych monomerów w obecności makrocząsteczek z grupami funkcyjnymi
2.3.2.1. Hydrożele sieciowane albuminą
2.3.2.2. Hydrożele sieciowane policukrami
hydrożele poliakrylamidowe otrzymujemy przez sieciowanie allilokarboksymetylocelulozą, allilodekstranem
allilowe etery polisacharydów (AEP) można efektywnie kopolimeryzować z winylowymi monomerami do uzyskania zsieciowanej polimerowej matrycy do uwalniania leków
Zalety sieciowania makrocząsteczkami w porównaniu z małocząsteczkowymi substancjami sieciującymi :
1)sferyczna zawada formowania kompleksu enzym-substart jest zminimalizowana (wymiary makrocząsteczki czynnika sieciującego są dużo większe niż wymiary enzymatyczne)
2) Makrocząsteczki (albumina) mogą w wyniku działania enzymów (pepsyna, trypsyna) w doustnych systemach administracji leków użycie enzymatycznie degradowalnych hydrożeli jest możliwe dzięki enzymom ustrojowymzapewnia to całkowitą degradację.
3)kinetyka i wydajność degradacji może być sterowana przez modyfikację struktury makrocząsteczki
4)zmodyfikowane makrocząsteczki mogą być łatwo odizolowane od małych niskocząsteczkowych substancji modyfikujących.
Hydrożele z degradowalnymi łańcuchami (grupami) bocznymi
wysokocząsteczkowe leki (proteiny) można łatwo uwięzić w hydrożelowej matrycy, lecz niskocząsteczkowe leki szybko się uwalniają na drodze prostej dyfuzji
dlatego takie leki musimy przyłączyć do łańcucha polimerowego wiązaniem labilnym (łatwo biodegradowalnym)
molekuła może być uwolniona w wyniku degradacji hydrolitycznej wiązania lub w wyniku działania enzymu
jeśli molekuła ma ulegać degradacji enzymatycznej to musi być związana z makrocząsteczką wiązaniem ulegającym rozerwaniu na drodze enzymatycznej.
W5
SYSTEMY KONTROL.UWALNIANIA LEKÓW
Polimerowe hydrożele czułe na bodźce
Bodźce : pH, temperatura, pole elektryczne, pole magnetyczne, siła jonowa, rozpuszczalnik, światło.
Odpowiedź :
- zmiana wymiarów
- zmiana właściwości powierzchni
- zmiana rozpuszczalności
- zmiana molekularnego uporządkowania
- przemiana zol-żel
Termoczułe polimery
Temperatura żelowania w zależności od steżenia poloxameru
Stężenie poloxameru (%w/w) |
Temp. Żelowania (0C) |
10% |
- |
15% |
32,5 |
20% |
25,5 |
25% |
17,0 |
Farm. zastosowanie termoczułych polimerów
Termoczułe polimery:
- inżynieria tkankowa
- Systemy kontrolowanego uwalniania dążąc do celu
- Systemy kontrolowanego uwalniania z pamięcią kształtu
- Iniekcyjne systemy kontrolowanego uwalniania
- Samoregulujące systemy kontrolowanego uwalniania
- Terapia genowa
- Bioresorpcja ??
Inne czułe na bodźce polimery :
- pH - czułe polimery : polikwasy, polizasady
- polimery stymulowane polem elektrycznym : żele poliakrylamidowe
- polimery stymulowane światłem : bis-(4-di-mtyloamino)-fenylometyloleukocjanidy
- Systemy stymulowane biologicznie : np. stymulacja glukozą, przeciwciałami, enzymami.
Całkowicie bioresorbowalne CDDS z pamięcią kształtu :
Pamięć kształtu - jest to zdolność do powrotu z kształtu przejściowego tzw. zamrożonego do pierwotnego kształtu. Kształt przejściowy uzyskuje się w wyniku mechanicznej deformacji, a bodźcem stymulującym przejście do kształtu pierwotnego jest najczęściej temperatura,
Zastosowanie w medycynie (Tg w zakresie 36-40)
- bioresorbowalne implanty z pamięcią kształtu zawierają leki immunosupresyjne: samozaciskowe klamry, szpilki chirurgiczne, samorozprężające stenty
- bioresorbowalne pompy z pamięcią kształtu
Co rozumiemy przez kontrol. uwalnianie leku ?
- Kontrola szybkości uwalniania leku, czyli sterowanie stężeniem dozowanego leku w złożonym przedziale czasowym
- kontrola miejsca uwalniania i miejsca aktywności leku.
Czynniki brane pod uwagę przy projektowaniu systemów kontrolowanego uwalniania leków :
- Droga administracji leku
- Zamierzony czas działania leku (uwalniania)
- Biokompatybilnośc
- Mechanizm uwalniania leku
- Rodzaj nośnika leku w systemie dozowania
- zdolnośc do „ dążenia do celu”
- właściwości fizykochemiczne leku
Zalety systemów kontrolowanego uwalniania :
- możliwość utrzymywania poziomu stężenia leku w osoczu krwi w zakresie wymaganym terapeutycznie
- możliwość eliminacji lub redukcji niepożądanych efektów ubocznych, które wywołują tradycyjne metody administracji leków z krótkim In vivo czasem półtrwania umożliwiają przedłużone działanie terapeutyczne
- Stałe dozowanie małych ilości leków jest mniej uciążliwe i mniej bolesne niż wielokrotne podanie dużych dawek
- zwiększenie komfortu w przyjmowaniu leków przez pacjenta
- zmniejszenia marnotrawstwa cennych substancji leczniczych
Rodzaje systemów kontrolowanego uwalniania leków:
1. Lokalne systemy uwalniania leków- wprowadzane bezpośrednio do tkanki zmienionej chorobowo
2. Systemy dążące do celu
3.Stałe(stabilne, nieprzerwane) systemy kontrolowanego uwalniania (profil uwalniania zerowego rzędu)
4. Modulowanie uwalnianie leków
5. Sterowane systemy kontrolowanego uwalniania
a) modulowane możliwość ciągłego monitorowania stężenia leku
b)zatrzymywane posiadający zawór umożliwiający zatrzymanie dozowania
6. Implantacyjne systemy kontrolowanego dozowania:
a) stałe dozowanie profile uwalniania zerowego rzędu
b) manipulowalne dozowanie pulsacyjne dozowanie proces niezerowego rzędu
Rodzaje systemów kontrolowanego uwalniania leków
1. Dozowanie leku kontrolowane dyfuzyjnie
monolityczne systemy
systemy kontrolowane membraną
systemy oparte o ciśnienie osmotyczne
systemy kontrolowane pęcznieniem
2. Systemy dozowania leku kontrolowane chemicznie
erozja matrycy zawierającej lek
systemy kontrolowane erozyjno-dyfuzyjne
lek połączony kowalencyjnie z polimerem (koniugaty lek-polimer)
desorpcja zaadsorbowanego leku
3. Elektroniczne, zewnętrzne systemy dozowania leków
RODZAJE SYSTEMÓW KONTROLOWANEGO UWALNIANIA LEKÓW
I. Dozowanie leku kontrolowane dyfuzyjnie
A). Monolityczne systemy
lek jest uwalniany w wyniku procesu dyfuzji z matrycy polimeru
szybkość uwalniania zależy od stężenia początkowego leku (prawo Ficka)
dyfuzja leku poprzez matrycę limituje szybkość uwalniania!!!
Przypadek 1 : gdy stężenie leku jest poniżej stężenia granicznego rozpuszczania w matrycy C<Cs
Jak możemy kontrolowac uwalnianie? uwalnianie leku możemy kontrolować poprzez wybór matrycy:
* gładka matryca (D - kinetyczny współczynnik dyfuzji) (D ~ 10-10 - 10-12 cm2/s )
*gąbczasta matryca (D ~ 10-6 - 10-7 cm2/s )
Przypadek 2 : gdy stężenie leku jest powyżej granicznego stężenia rozpuszczania w matrycy C>Cs :
- obliczanie uwalniania leku
- oparte na równaniach dyfuzji Ficka :
- zmiana stężenia leku w czasie
- Co chcemy obliczyc? : szybkośc uwalniania leku dM/dt ; ilośc uwolnionego leku po czasie t Mt
-oprócz wolnych cząsteczek leku, tworzą się skupiska (aglomeraty), dyfuzja komplikuje się, ważne staje się napięcie powierzchniowe
-rozpuszczalność leku w polimerowej matrycy limituje szybkość uwalniania leku
B). Systemy kontrolowane membraną
membrany półprzepuszczalne
uwalnianie leku kontrolowane półprzepuszczalną membraną
dyfuzja przez membranę limituje szybkość uwalniania
zaleta: stałe uwalnianie leku z układu - podlega I prawu Ficka
nieporowate półprzepuszczalne membrany
dyfuzja leku zachodzi przez spęczniałą polimerową matrycę
uwalnianie leku jest stałe aż do wyczerpania leku
porowate półprzepuszczalne membrany
wielkość i zróżnicowanie porów ma znaczenie dla uwalniania leków ponieważ przez nie zachodzi dyfuzja
wymaga zamiany współczynnika dyfuzji D na Deff
kinetyka uwalniania leku zerowego rzędu
szybkość uwalniania leku jest kontrolowana przez wybór roztworu do pompy osmotycznej (np. NaCl)
PEG-interleukina
PEG-hemoglobina
PEG- α - interferony
PEG-asparaginaza (chemioterapeutyk)
Mierzące i uwalniające systemy sprzężone
Molekularne systemy do uwalniania insuliny w odpowiedzi na stężenie glukozy
Chemiczne zawory zsyntezowane przez immobilizację oksydazy glukozowej na zsieciowanej membranie polikwasu akrylowego.
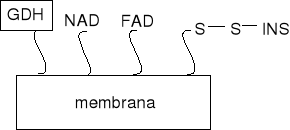
Membranowe urządzenia wykonane przez immobilizację insuliny poprzez łączniki disiarczkowe z kombinacją oksydazy glukozowej i reakcji elektronowych (utl/red).
Enzymatyczne urządzenia wykonane przez sprzężenie oksydazy glukozowej i insuliny łącznikami disiarczkowymi.
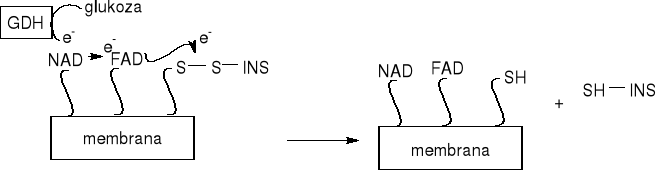
GDH- dehydrogenaza glukozowa-blisko powierzchni ma aktywne miejsce transmisji wygenerowanego elektronu do kofaktorów enzymatycznych NAD i FAD
Układ złożony jest z insuliny immobilizowanej na nierozpuszczalnej membranie polimerowej poprzez wiązania disiarczkowe i z GDH. Gdy cząsteczka glukozy pojawia się w roztworze, GDH utlenia ją i generuje elektrony. Te z kolei redukują wiązania disiarczkowe i uwalniają cząsteczki insuliny z membrany
typ A membrany: kofaktory enzymatyczne FAD i NAD są immobilizowane na membranie, ale GDH nie
typ B: membrany FAD, NAD i GDH są immobilizowane, co zapewnia czulsze uwalnianie insuliny przy małych stężeniach glukozy
Wpływ stężenia wolnego antygenu na współczynnik pęcznienia hydrożelu
Rozpoznawanie antygenu przez antygen-przeciwciało semi IPN hydrożel
Odwracalne zmiany pęcznienia
Antygenowo czułe przenikanie (modelowy lek proteinowy - hemoglobina przenika poprzez membranę hydrożelową)
rezerwuar leku
okienko do uwalniania leku
czujnik
`centrum pomiarowe'
baterie
w leczeniu nowotworów
Decapeptyl- jeden z pierwszych produktów kontrolowanego uwalniania wytworzony z 50:50 glikolidu/laktydy. W europie wprowadzony w'86. dostarcza 3,75 mg tryporeliny przez okres 1 m-ca. Podawany i.m jako mikrokapsułki. Zast.-rak prostaty, endometrioza
Supron Depot- do iniekcji w postaci mikrosfer wykonanych z kopolimeru 70:30 D,L-laktyd/glikolid zawiera leuprolelinę uwalnianą przez m-c
Teistar Depot- do iniekcji i.m w postaci mikrogranulek z PLAGA zawierających tryporelinę , uwalniana w ciągu 1 m-ca, zast-rak prostaty
Prostap 3- mikrosfery PLAGA dostarczające leuprorelinę w ciągu 3 m-cy
Eligard- matryca polimerowa In situ wyk. z PLAGA 75/25, dawka leuproreliny 7,5;22,5;30mg uwal. w ciągu 91 dni
Zoladex- biodegradowalny implant 1mm średnicy i 1cm dł. Zawiera gosereline -analog natural.hormonu wyzwalającego gonadotropine w kopolimerze 50/50 D,L-laktyd/glikolid. Podawany s.c w ścianę brzucha raz na 28 dni w leczeniu nowotw.gr.krok., endometriozie
w transporcie leków hormonalnych
Capronar - implant do podawania hormonów sterydowych (4 cm długości, składający się z epsilon-kaprolaktonu - uwalniający lewonorgestrel w stałej dawce 33 µm na dobę przez 1 rok
Nutropin Depot - przeznaczony do iniekcji, wykonany z PLGA, zawiera ludzki hormon wzrostu
Ascentra - mikrosfery otrzymywane z kopolimeru PLGA z PEG zawierające somatotropinę (hGH) uwalnianą w ciągu 2 tygodni
Somatuline - mikrosfery z PLGA dostarczające lanreotyd (syntetyczny analog somatostatyny) przez okres 1 miesiąca
Sandostatin LAR - mikrosfery z PLGA dostarczające octreotyd (syntetyczny analog somatostatyny) przez okres 1 miesiąca
Parlodel Lar - długoterminowe uwalnianie bromokryptyny - mikrosfery PLGA - wskazania: gruczolaki przysadki mózgowej produkujące prolaktynę (prolaktynoma), wybrane przypadki akromegalii, zaburzenia cyklu miesiączkowego, bezpłodność kobiet, hiperprolaktynemia
użycie cząsteczek, które mają hydrofilowe głowy i hydrofobowego ogona, aby uformować powłokę (amfifilowe, liposomy)
elektrostatyczne interakcje aby uwięzić cząsteczki leku- polielektrolity
lek- pimecrolimus, nośnik- bioresorbowalny
stent- bioresorbowalny magnezowy
trwałe niedeformujące się rezerwuary z lekiem
całkowicie bioresorbowalna platforma stentowa
programowalne, kontrolowane uwalnianie leku
całkowicie bioresorbowalny polimer z minimalną powierzchnią kontaktu tkanka/polimer
pojedyncze lub wielolekowe uwalnianie z niezależną kinetyką uwalniania.
- dyfuzja leku przez pory membrany
Deff = (Dpor*ε)/ζ
ε - porowatość membrany (0< ε<1)
ζ - określa kształt porów (nieregularność ζ ≥ 1)
C). Systemy oparte o ciśnienie osmotyczne (pompy osmotyczne)
-ciśnienie osmotyczne jest wzmacniane poprzez migrację wody przez półprzepuszczalną membranę do pompy osmotycznej i wzmacnia uwalnianie leku przez szczelinę np. implanty DURS 4mm*45mm
-szybkość uwalniania jest proporcjonalna do objętości rezerwuaru z lekiem
dMt/dt = (dV/dt)*C = AKΔπc/δ
Czynniki sterujące :
- ciśnienie osmotyczne
- gęstość i grubość półprzepuszczalnej membrany
- powierzchnia tłoka
- objętośc rezerwuaru z lekiem
II. Systemy dozowania leków kontrolowane chemicznie
II. 1 monolityczne erodujące systemy
lek wprowadzany jest do polimerowej matrycy bioerodującej lub ulegającej rozpuszczeniu
a). Systemy ulegające powierzchniowej erozji
-lek ulega uwolnieniu powoli, woda wnika do coraz głębszych warstw w matrycy
-przykład: DEOS, kinetyka O rzedu
-dla innych kształtów geometrycznych Ae jest funkcją czasu dM1/ dt = keAe (t)
b). Systemy ulegające erozji w masie
-jednolita hydroliza polimerowej matrycy
-szybkość uwalniania leku zależy od szybkości hydrolizy matrycy oraz szybkości dyfuzji leku
-dyfuzja leku limitowana
Przykład - degradacja kopolimerów laktydu z glikolidem
Występuje tu wiązanie estrowe - dlatego degradacja nie przebiega idealnie, powstają grupy COO-, które zakwaszają środowisko, następuje przez to przyspieszenie degradacji w masie, degradacja powierzchniowa jest wolniejsza niż degradacja w masie.
c). Systemy uwalniania pulsacyjne
-używa się erodujących cząstek o różnych szybkościach degradacji
- Przykłady systemów uwalniania pulsacyjnych np. „one shot” szczepionka tężec - błonica- żółtaczka typu B - gronkowiec enterotoksyczny typu B.
-jak możemy uzyskać różną szybkość degradacji systemów CDDS:
-profil degradacji dla pojedynczej eradującej cząstki :
Jak możemy uzyskac różne szybkości degradacji systemów CDDS ?
-przez zmianę struktury łańcuchów w tym samym kopolimerze
-przez różny rozkład komonomerów w łańcuchu np. Kopolimer PLGA
-przez zmianę geometrii tego samego materiału polimerowego
-PLGA - matryca, mikrosfera, średnica mikrosfery, grubośc matrycy mikrosfery.
d). Systemy regulowane
-samoregulujące systemy uwalniania leku (metabolitu, hormonu - insulina-glukoza) in vivo
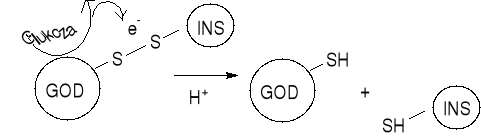
-przykładem jest sterowanie uwalniania insuliny poprzez oksydazę glukozową (GOD)
Glukoza + O2 + H2O GOD
Kwas glukonowy + H2O2
Powstający kwas glukonowy (COOH) zakwasza środowisko i wzmaga kwaśną hydrolizę matrycy, w której umieszcony jest enzym, powodując większe uwalnianie insuliny lub rozpuszczanie matrycy, w której jest enzym.
II.2 Koniugaty polimer-lek
Koniugat - lek jest związany wiązaniem kowalencyjnym lub jonowym z polimerem, wiązanie in vivo łatwo ulega zerwaniu i uwalnia lek nie zmieniając jego cząstki
Cele syntezy koniugatów polimer-lek
-zwiększenie odporności na proteolizę ( w przypadku leków proteinowych)
-redukcja immunogeniczności - redukcja indukcji odpowiedzi immunologicznej wywołanej wprowadzeniem obcej proteiny do organizmu, czyli powstanie przeciwciał przeciw wprowadzonej proteinie.
-przedłużenie żywotności wprowadzonego do organizmu leku, czasu jego cyrkulacji w organizmie
-polepszenie rozpuszczalności w roztworach wodnych leków hydrofobowych
-zmniejszenie toksyczności leku
Koniugaty stosowane klinicznie:
Leki stosowane w chemioterapii przyłączone do bocznego łańcucha polimeru poprzez łatwo hydrolizujące wiązanie, umożliwiające stopniowe uwalnianie leku
a). Dendrymeryczne koniugaty leków
-dendrymery - to sekwencyjnie syntetyzowane hiperozgałęzione makrocząsteczki
-istnieją dwie strategie kontrolowanego uwalniania leków z koniugatów dendrymerycznych:
-jeśli na końcach dendrymerów są grupy funkcyjne, to można do nich dołączyć lek (lek na końcu grup funkcyjnych)
-zdarza się że lek wypełni przestrzeń wewnątrz dendrymeru, a nie zostanie przyłączony na końcach (lek w rdzeniu) - uwalnianie kaskadowe z systemów dendrytycznych.
III. Elektroniczne systemy dozowania leków.
W6
METODY DOZOWANIA LEKÓW
1. Metoda transdermalna
lek dozowany wnika przez skórę do układu krwionośnego
systemy tradycyjne: maści, kremy, zawiesiny leków
systemy nowoczesne: plastry z lekiem
zalety systemów transdermalnych: efektywne, systematyczne dozowanie leku, wygodne w stosowaniu
a) systemy transdermalne oparte na membranie o laminarnej powierzchni
-powierzchniowa warstwa z PE, PP, PET
-zbiornik leku: olej mineralny, poliizobutylen
-polimerowa matryca: PP, PVC, PAN, polisilikon
-warstwa adhezyjna
-warstwa ochronna
b) monolityczne systemy transdermalne
lek jest w postaci kryształków, powoli rozpuszcza się w rezerwuarze polimerwoym
rozpuszczalność leku w polimerowej matrycy kontroluje szybkość uwalnainia leku
Niedogodności systemów transdermalnych
-epiderma hydrofilowa
-główne drogi wnikania leku przez pory, mała powierzchnia porów dlatego słabe wnikanie
- przepuszczalność leków przez skórę (martwy naskórek stratum corneum stanowi hydrofobową barier 10-15 um
-leki przyczepiające się do skóry - desoprpcja jest wtedy etapem limitującym szybkość dozowania leku
-reakcje alert na materiał systemu - warstwę adhezyjną
-zablokowanie niektórych procesów skóry
Metody polepszenia przenikania leku przez skórę
-oddziaływanie osłonowe tradycyjne
-kremy woda/olej + lipidy (amfifile)
-JONOFOREZA - terapia jonami, metoda polegająca na wprowadzaniu jonów (cząstek obdarzonych ładunkiem elektrycznym) do organizmu przez skórę lub śluzówkę przy pomocy odpowiedniego urządzenia wytwarzającego niewielkiego pola elektryczne.
-nakłuwanie mikroigłami, aby pokonać martwą warstwę hydrofobową naskórka
-stosowanie ultradźwięków
Macloflux - transdermal technology.
Transdermalna technologia wprowadziła cienkie tytanowe osłony z precyzyjnymi mikronakłuwaczami, które przechodzą przez martwą warstwę skóry i powodują powstanie wygodnej drogi do administracji leku nawet makrocząsteczek. Umożliwia opcję opłaszczenia na sucho leku na powierzchni mikronakłuwaczy i wprowadzenie leku do organizmu poprzez skórę w postaci bolusa lub użycie rezerwuaru z lekiem.
Zalety systemów transdermalnych
-redukcja efektu I przejścia - skokowy wzrost stężenia leku
-w miarę stabilne dozowanie leków
-nieinwazyjność
-małe efekty uboczne płynące z postaci leku
-w każdej chwili można zaprzestać stosowanie
Współczynnik przepuszczalności - podstawowy czynnik w uwalnianiu leków
Transport = przepływ
P*A*(Cd-Cr) [mg/cm2/s]
Współczynnik przepuszczalności
P = D*K/h (cm/sec)
A - powierzchnia plastra
D - dyfuzyjność leku w membranie/skórze
K - współczynnik podziału (plaster/skóra)
Cd - stężenie donorowe (plaster)
Cr - stężenie receptorowe (skóra)
h - grubość membrany (skóry)
donor =plaster
receptor = skóra
Wymagania dla leku w TDD
-dawka dzienna mniej niż 20mg/dobę
-T0,5 mniej niż 10h
-Ciężar cząsteczkowy mniejszy niż 500Da
-Niska temperatura topnienia mniej niż 200oC
-Zdolność przenikania przez skórę
-Rozpuszczalność w lipidach (współczynnik podziału Log P 1-4)
-Profil toksykologiczny (nie może powodować stanów zapalnych i uszkodzeń skóry)
Rodzaje TDD
Membranowy (rezerwuar z lekiem)
matrycowy: wielo lub jednopłaszczowe (lek w warstwie adhezyjnej)
Porównanie obu systemów
MATRYCOWY |
MEMBRANOWY |
Uproszczona konstrukcja plastra |
Skomplikowana konstrukcja plastra |
Skomplikowany model uwalniania |
Uproszczony model uwalnainia |
Uwalnianie kontrolowane przez skórę |
Uwalnianie kontrolowane przez membranę |
Cienka konstrukcja |
Wielowarstwowa konstrukcja |
Możliwość dozowania niskich dawek, lecz nie większych |
Możliwość dozowania większych dawek |
Rozwój TDD
-stosowanie materiałów redukujących negatywne reakcje skóry na zastosowane materiały konstrukcyjne plastra
-stosowanie materiałów zwiększających adhezyjność lecz bez odczynów zapalnych, umożliwiających oddychanie skóry w miejscu plastra
-dozowanie leków o dużych masach cząsteczkowych
-projektowanie plastrów o różnych profilach uwalniania leków
2. Koloidalne systemy administracji leku
sferyczne cząstki polimerów lub lipidów z dyspergowanymi, zaadsorbowanymi, kowalencyjnie połączonymi lub zakapsułkowanymi substancjami terapeutycznymi
przykłady: nanosfery, mikrosfery, mikrokapsułki, liposomy, nanokapsułki
Drogi dozowania
A. doustna - uwalniany lek jest adsorbowany w jelitach
zalety: - akceptowana przez pacjentów metoda konwencjonalna dozowania leku
wady - krótki czas działania leku
- możliwość interakcji z pokarmem - zmiana skuteczności
B.wstrzyknięcie podskórne - fagocytoza dla cząstek mniejszych niż 10 um, a większe niż 30 um zbierają się w miejscu wstrzyknięcia
zalety - wprowadzany lek z pominięciem układu pokarmowego
wady - słaba migracja leku do miejsca działania
- możliwość powstania stanu zapalnego w miejscu wstrzyknięcia
C.podanie dożylne - regularna cyrkulacja dla cząstek mniejszych niż 4um, oddziaływanie z RES
zalety -- wprowadzany lek z pominięciem układu pokarmowego
wady - krótki czas cyrkulacji
- fagocytoza w wątrobie, płucach
Rodzaje:
nanosfery 10nm-1um
mikrosfery 1-10um - lek jest zdyspergowany w matrycy lub opłaszczony na niej
Metody otrzymywania mikrosfer/nanosfer
1. Polimeryzacja emulsyjna z dyspergowanym lekiem
środowisko reakcji wodne lub organiczne zależne od rodzaju polimeru i leku
przykłady:poliakryloamid/przeciwciała szczepionek; biodegradowalny polialkilocyjanoakrylan/doksorubicyna; PMMA/przeciwciała szczepionek
2. Emulsyfikacja polimeru i leku
-gotowy polimer hydrofobowy rozpuszcza się w lotnym rozpuszczalniku (chloroform, chlorek metylenu, octan etylu)
-organiczny roztwór mieszamy z roztworem wodnym, do uzyskanej emulsji dodajemy środek powierzchniowo czynny i stabilizator emulsji (PAV) - dla wytworzenia emulsji
-lek wprowadzamy do fazy organicznej (jeśli jest lipofilny) lub do fazy wodnej (jeśli jest hydrofilowy)
-nanocząstki otrzymujemy poprzez odparowanie rozpuszczalnika organicznego lub drogą precypitacji poprzez rozciennczanie z wodą.
-suszenie, sterylizacja, przechowywanie
stosowane polimery:PLA; PLAGA; PHB; PCL; Poliortoestry (czułe na kwasowość układu)
Czynniki wpływające na szybkość uwalniania leków / szybkość degradacji mikro/nanosfer:
-ciężar cząsteczkowy polimeru
-krystaliczność/amorficzność materiału polimerowego
-średnica cząstek
-możliwość wchłaniania wody (pęcznienie, rozpuszczanie)
-temperatura zeszklenia polimeru Tg
-wpływ pH środowiska na degradację polimeru
Metody otrzymywania nanokapsułek/mikrokapsułek
1. Polikondensacja na granicy faz prowadząca do poliamidów
-dichlorek kwasowy + lek w fazie olejowej (organicznej)
-diamina w fazie wodnej
-utworzenie emulsji
-monomer migruje do granicy faz olej/woda i polimeryzuje na drodze kondensacji zamykając lek
-trichlorki kwasowe i triaminy dodaje się aby uzyskać układ zsieciowany
NH2-R -NH2 + R`(COCl2) (COCl2) -R`-CONH -R- NH2 + HCl
2. Koacerwacja na granicy faz
-polimer A przeznaczony do enkapsulacji rozpuszczamy w fazie organicznej
-cząstki leku dodajemy do fazy organicznej (gdy lek jest nierozpuszczalny w fazie organicznej - powstaje suspensja leku)
-do suspensji dodajemy polimer B (lub inny nierozpuszczalnik) nierozpuszczalny w fazie z pierwszym, co powoduje separacje faz
-polimer A ulega wytrąceniu na powierzchni cząsteczek leku formując kapsułkę
3. Koacerwacja złożona
-przygotowanie dwóch roztworów polielektrolitów o przeciwnych ładunkach A i B
-dodanie do jednego z nich leku, - powstaje dyspersja leku w roztworze polielektrolitowym A
-zmieszanie roztworów A i B - zachodzi kompleksowanie i wytrącanie cząsteczek polielektrolitów na cząsteczkach leku np. żelatyna + guma arabska
4. Wielopłaszczyznowe (wielowarstwowe) polielektrolity
-przygotowanie roztworów polielektrolitów A i B o przeciwnych ładunkach
-kompleksujemy na przemian polielektrolity:
A + B = AB
AB + A = ABA
ABA + B = ABAB
- na końcu dodajemy polielektrolitu z lekiem
- tworzy się wielopłaszczyznowa (multipłaszczyznowa) polielektrolitowa warstwa zawierająca cząsteczki leku
LIPOSOMY (polimerosomy, amfifilne)
-lek zamkniety w sferycznej podójnej warstweilipidowej
-metoda otrzymywania: utworzenie emulsji o/w; w warstwie wodnej - lek, w warstwie organicznej - lotny rozpuszczalnik
-odparowanie organicznego rozpuszczalnika - cząsteczki lipidów ustawiają się wokół wodnych mikrokropel tworząc pecherzyki
SONIFIKACJA - konwersja do uporządkowanych lamelarnych struktur
NANOFILTRACJA - w celu uzyskania kontrolowanej dystrybucji wymiaru otrzymywanych liposomów
Metody otrzymywania polimerosomów:
A.Metoda otrzymywania z cienkiej warstwy - otrzymuje się mltimelarne pęcherzyki
B.Odparowanie pęcherzyków metodą odwróconej fazy. Metoda otrzymywania dużych unilamelarnych, oligomelarnych, multimelarnych pęcherzyków.
C.Mrożenie i topnienie multimelarnych pęcherzyków. Metoda otrzymywania multimelarnych polimerosomów - odparowanie w ciekłym azocie i topnienie w wodzie lub rozpuszczalniku hydrofobowym (40C). Na końcu otrzymane polimerosomy przechowuje się w temperaturze pokojowej do stabilizacji dwuwarstwy.
D.Dehydratacja, rehydratacja pęcherzyków. Multilamelarne polimerosomy otrzymane w metodzie 1,2, lub 3 poddaje się liofilizacji. Otrzymany liofilzoway produkt zostaje rozproszony w warstwie wodnej (hydrofobowej) i tworzą się oligolamelarne lub multilamelarne polimerosomy.
E.Pęcherzyki otrzymywane metodą wytłaczania. Pęcherzyki o podobnych wymiarach (niska dystrybucja wymiaru) otrzymywane w wyniku wytłaczania multilamelarnych polimerosomow poprzez membranę poliwęglanową o roznych wymiarach porów (50-400m). Najczęściej 10 cykli wystarcza do otrzymania homogenicznej formulacji o takim samym wymiarze pęcherzyków.
F.Metoda napełniania przy pomocy pH gradientu. Ta metoda używana jest do napełniania pęcherzyków polimerosomów lekami posiadającymi możliwosc jonizacji. Oparta jesto tworzenie się pH gradientu pomiędzy wewen. Warstwą wodną lizosomalną fazą a zewn. Środowiskiem hydrofobowym.
Zalety:
a). niska toksyczność
b). wysoka wydajność transfekcji
c). mogą przenikać przez błony komórkowe
Wady:
a)Krótki czas cyrkulacji w wyniku fagocytozy (nie zdobędą celu):
Metody wydłużenia czasu cyrkulacji : zmniejszenie wymiarów, zwiększenie sztywności…….
b)Niestabilność liposomów (niska stabilność mechaniczna, łatwa hydroliza)
- fosfolipidy łatwo hydrolizują
- otwarcie wiązań estrowych
- wymywanie leku
c)Niedogodność procesu formowania liposomów - wpływ rozpuszczalnika, temperatury, sił mechanicznych.
d)Po wprowadzeniu do organizmu In vivi zmienne pH powoduje zmiany w strukturze podwójnej warstwy lipidowej.
Nowe zastosowania
A.Zastosowanie systemów uwalniania leków oparte o technologię cząsteczek nanomagnetycznych (Licencja Nanoset, LLC)
B.Obecnie są stosowane jako obrazowanie MR, jako czynniki kontrastowe
Zasada działania
A.Przyłączenie leku do nanomagnetyczngo materiału, który reaguje na zewn.przyłożone pole elektryczne.
B.Właściwości materiału muszą spełniać odpowiednie warunki jako systemy uwalniania leków:
-Kierunkowy transport do określonych specyficznych miejsc w organizmie.
-Możliwa weryfikacja ich położenia przy pomocy MRI
-Aktywacja transportu w limitowanym obszarze na zjadanie.
POWIERZCHNIOWA ELUCJA STEROWANA
TNT (Tergeted Nano Therapeutics) system atakuje raka 3 stopniowo :
1. Pacjent otrzymuje prostą infuzję zawierająca tryliony biocząstek, magnetycznych nanosfer powiązanych z p/c przeciw nowotworom
2. Bioczastki poprzez układ krwionośny migrują w okolice nowotworu i akumulują się w wyniku oddziaływania Ag-p/c.
3. Włączone jest odpowiednie pole magnetyczne w obszarze nowotworu i następuje koncentracja magnetycznych cząstek. Pole magnetyczne powoduje wzrost temperatury bioczastek, zabicie kom. rakowych w ciągu kilku minut.
Guided Drug Delivery - kierowane uwalnianie leków:
1. Nowotwór lity.
2. Użycie magnetycznego pola do koncentracji cząstek
3. Modulacja pola aby uwolnić lek z czastek.
W7
Samosterujące systemy uwalniania leków:
- kombinacja biosensorów i systemów kontrolowanego uwalniania leków
- zrewolucjonizowanie administracji leków poprzez umożliwienie terapii zindywidualizowanej
- ciągły pomiar parametrów stężenia i korekta do optymalnej wartości
- natychmiastowa odpowiedź i dozowanie przy użyciu odpowiedniego systemu pomiarowego i dozującego
- daje pacjentom komfort i brak konieczności ciągłych pomiarów parametrów stężeń leków
Idealne samoregulujące uwalnianie leków:
* wady obecnie dostępnych systemów
- nie są automatyczne, użytkownik musi decydować o dawce
- rezultat obliczonej dawki nie jest zawsze prawidłowy
- sensory i kontrolowane systemy uwalniania leków nie są ze sobą powiązane
* systemy idealne
- bardzo czuły, szybki pomiar obecności lub stężenia substancji, hormonu, leku którego stężeniem musimy sterować
- natychmiastowa odpowiedź układu
- detekcja i uwalnianie in vivo
- mały, biokompatybilny, dokładny i łatwy w produkcji
Pompy insulinowe:
- rezerwuar insuliny (podobny do zbiornika strzykawki)
- mała bateria jako zasilanie pompy
- czip komputerowy jako system kontrolny
- zestaw infuzyjny - cienka plastikowa rurka do dozowania insuliny do ciała
- terapia pompowa: stała bazowa szybkość dozowania i bolus insulinowy
- kombinacja z sensorami glukozowymi
Biosensory (np. Glucowatch):
- Biographer: nie inwazyjny, wygląda jak zegarek, mierzy poziom glukozy
- nieinwazyjny automatyczny pomiar co 10 min aż do 13 h- tradycyjny pomiar glukozy w większych odstępach czasu może nie odzwierciedlać rzeczywistego poziomu glikemii w ciągu dnia
- pomiary przechowywane są w pamięci
Zasada pracy Glucowatch
-na zasadzie odwrotnej jonoforezy
-nisko prądowe impulsy elektryczne wyciągają glukozę poprzez skórę
- glukoza jest gromadzona w 2 żelowych dyskach kolektorowych w AutoSensorze.
- elektrody w AutoSensorze mierzą glukozę.
Szlak enzymatyczny Glucowatch
-oksydaza glukozowa katalizuje utlenianie glukozy w hydrożelu
- nadtlenek wodoru reaguje na platynowej elektrodzie dostarczając elektrony
- wielkość prądu jest proporcjonalna do poziomu glukozy
Samoregulujące systemy uwalniania leków:
I. Glukozo czułe insulinowe molekularne systemy uwalniania
II. Smart polimery
III. Closed loop systems- systemy zamkniętej pętli
I. Glukozo czułe insulinowe molekularne systemy uwalniania:
1. Chemiczne zawory
Na porowatej membranie poliwęglanowej sieciowano polikwas akrylowy. Przy wysokim pH łańcuchy polimeru ekspandują zamykając pory, przy niskim pH łańcuchy kurczą się otwierając pory.
Chemiczne zawory stwierdzono wzrost szybkości dozowanej insuliny ze wzrostem stężenia glukozy
Wady w układach zaworowych:
-Zbyt mała czułość systemu(zbyt wolna odpowiedź układu na zmianę stężenia glukozy)
-Zbyt wolna dyfuzja insuliny poprzez pory membrany
-Wolne uwalnianie insuliny mimo braku glukozy
2. Systemy membranowe
- wykorzystują kofaktory enzymatyczne:
oksydoreduktazy katalizują przeniesienie równoważników redukcyjnych między dwoma układami redoks. Termin równoważnika redukcyjnego określa kombinację protonów i elektronów, które pojawiają się w procesach redoks
Procesy oksydoredukcyjne w komórkach zachodzą we wszystkich przedziałach subkomórkowych (cytozolu, wewnętrznej błonie mitochondriów, w błonie tylakoidów, błonach siateczki środplazmatycznej, błonie jądrowej, a także w przestrzeni międzykomórkowej). Procesy te są katalizowane przez enzymy współdziałające z rozpuszczalnymi (koenzymy) lub związanymi z białkiem enzymatycznym (grupy prostetyczne) kofaktorami. Najważniejszymi kofaktorami oksydoreduktaz są NAD+-nukleotyd nikotynamidoaadeninowy, NADP+, FMN, FAD, ubichinon ( koenzym Q) plastochinon, plastocyjanina, lipoamid, hem.
Systemy membranowe- wykorzystanie reakcji redox
A)
B)
3. Systemy enzymatyczne
Insulina jest połączona z enzymem GOD-oksydaza glukozowa
Schemat syntezy hybrydowych systemów enzymatycznych
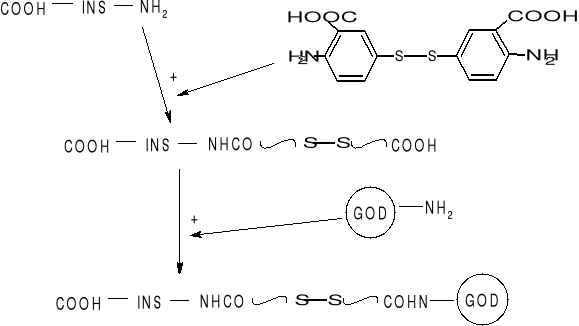
Hybrydowe systemy enzymatyczne:
- Insulina natychmiast się uwalnia z w/w systemu po dodaniu wodnego roztworu glukozy
- Uwalnianie insuliny może być sterowane konstrukcją hybrydy insulina/GOD
II. Smart polimery- Semi-interpenetrating networks- semi IPN
Oddziaływanie antygen-przeciwciało smart polimerów- wolne antygeny obecne w surowicy reagują z przeciwciałami, polimer pęcznieje, lek może się uwolnić
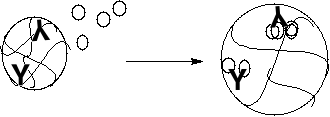
Badano:
Oddziaływanie antygen-przeciwciało smart polimerów
III. Samoregulujące czułe systemy terapeutyczne
Schemat samoregulujących czułych systemów terapeutycznych:
Dostępne biodegradowalne systemy uwalniania leków oparte o bioresorbowalne poliestry alifatyczne.
Atrigel in situ implant system:
- termoczuły roztwór polimeru degradowalnego zawierający lek
- po wstrzyknięciu żeluje powoli uwalniając substancję leczniczą
- polimery to głownie polilaktyd i poliglikolid
- rozpuszczalniki: N-metylo-2-pyrolidone i polietylenoglikol
Badania kliniczne nowych polimerowych systemów kontrolowanego uwalniania leków opartych na bioresorbowalnych poliestrach:
Leki antynowotworowe
1. mikrosfery wykonane z PLGA zawierające leuprolidynę lub goserelinę stosowane w raku prostaty
2. implantowane systemy otrzymywane z PLA zawierające chlorek nimustyny stosowane w leczeniu glejaka
3. formuły otrzymane z PLGA zawierające nafarelinę przeznaczone do podania domięśniowego raz na miesiąc lub na dwa miesiące
4. podawane bezpośrednio do guza implantowane matryce z PLA zawierające 5-FU, który uwalnia się po okresie 1 miesiąca
5. mikrosfery z cis platyną wykonane z PLA
6. matryce z PLA-PCL doxorybicyny z mikrosfer PLA
Leczenie jaskry
1. mikrosfery z PLA oraz PLGA w celu przedłużenia działania 5-FU i mitomycyny C
Transport antybiotyków
1. Administracja miejscowa w okolice rany zainfekowanej Streptococcus pyrogenes i Staphylococcus ureus mikrosfer wykonanych z 68/32 poli(D,L-laktydu-ko-glikolidy) zawierających ampicylinę, czas terapii 7 dni
2. Matryce wykonane z PLA zawierające ampicylinę stosowane w zapaleniu ucha
Metody fizyczne wprowadzania leku do polimerowych systemów kontrolowanego uwalniania:
- metoda Wurster'a
- koacerwacja
- spray dryling (lub precypitacja)
- coextrusion (extrusion - wyrzut)
- self-assembly metoda - samorganizowane, samomontowane
Wurter prosessing:
- Wurster proces polega na pokryciu polimerem cząsteczek leku z utworzeniem rdzenia zawierającego farmaceutyk.
- Polimerowa powłoka jest nakładana poprzez rozpylanie (sprying) podczas gdy rdzeń zawierający lek (w postaci stałej lub ciekłej) jest rozpylony i recylkuluje w strumieniu gazu.
Co - extrusion processing:
- Otrzymuje się koncentryczne cylindry pokryte polimerem i zawierające w rdzeniu lek w wyniku działania strumienia gazu obojętnego lub powietrza, wibracji elektrostatycznych lub mechanicznych.
Self-assembling delivery system:
- polimery z lekami jako samoformujące się systemy kontrolowanego uwalniania
- samoformowanie odbywa się na dwóch drogach:
Bioresorbowalne systemy kontrolowanego uwlaniania leków w stomatologii.
Bioabsorbowalne:
- eliminują potrzebę kolejnej operacji
- zachowują strukturalną integralność przez co najmniej 6 miesięcy
- całkowita bioresorpcja w czasie 9-12 miesięcy
Atrisorb- D FreeFlow GTR Barier:
- zawiera antybiotyk - doksycycklinę 4%
- zapewnia kontrolowane uwalnianie doksycykliny przez 7 dni
- zapobiega kolonizacji bakterii na nośniku
Stenty:
- stenty metaliczne powlekane bioresorbowalnym polimerem zawierającym leki immunosupresyjne: paklitaxel, tacrolimus, sirolimus
- obecnie dwa rodzaje stentów uwalniających leki- drug eluting stents DES:
* Cordings-CYPER TM sirolimus eluting stent
* Boston Scientific TAXUS TM paklitaxel eluting stent
- systemy są zaaprobowane przez FDA do sprzedaży w USA
- przyszłość- to bioresorbowalne metaliczne stenty
* Biotronik/Conor Dreams- Pimecrolimus eluting stent system:
- Projektowanie nowej klasy DES:
Najniższy punkt przy którym następuje proces żelowania
J = - D dC
dx
Szybkość uwalniania
Ilość uwolnionego leku
Wyszukiwarka
Podobne podstrony:
Polimery wykład 6 - ściąga, V ROK, Polimery, ściągi na egzam, egzamin od G Barańskiej ściągi
Polimery wykład 7 - ściąga, V ROK, Polimery, ściągi na egzam, egzamin od G Barańskiej ściągi
ściąga od Izy2011, ściągi na egzam
Polimery wykład 2 - ściąga, V ROK, Polimery, ściągi na egzam, egzamin od G Barańskiej ściągi
Polimery wykład 3 - ściąga, V ROK, Polimery, ściągi na egzam, egzamin od G Barańskiej ściągi
Polimery wykład 6 - ściąga, V ROK, Polimery, ściągi na egzam, egzamin od G Barańskiej ściągi
Testy na sem, ściągi na egzam
logika sciaga gotowa, 006 ściągi na Informatykę studia
Habuda ściąga, st. Administracja ściągi testy materiały egzam
Ściągi Na rodego - Diagnostyka VII, obd2 sciaga, Co to jest OBDII/EOBD
sciaga goracego, ściągi na gorącegomadzia, Zasoby wodne
Ściągi mikro, Ściąga wykład 8, Współczesne poglądy na cele
sciaga matka - na egzam z rzymu new
Ściąga do Wieprza na egzam, bhp i ergonomia, aerologia
Pytania na egzam-sciaga, informatyka, Mikrokontrolery
andragogika -ściąga na egzam., (1), Studia Pedagogika
Ściągaweczka 4, Ściągi na mature z j.polskiego
więcej podobnych podstron