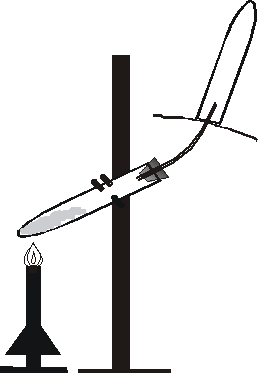
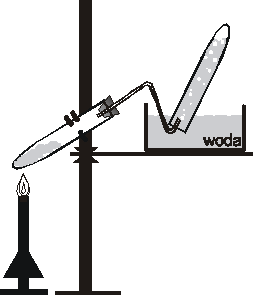
Ćwiczenie 11
stĘŻenie jonÓw wodorowych i wskaŹniki pH
Cel ćwiczenia. Opanowanie kolorymetrycznej metody wyznaczania stężenia jonów wodorowych przy użyciu wskaźników alkacymetrycznych. Obliczanie stężenia H+ i OH− oraz pH.
Zakres materiału. Iloczyn jonowy wody. Pojęcie pH. Wskaźniki pH. Definicje kwasów i zasad. Hydroliza soli.
Literatura. M. J. Sienko, R. A. Plane, "Chemia. Podstawy i zastosowania", WNT Warszawa 1999; Rozdz. 9.1.; 9.8, 15.3., L. Jones, P. Atkins, „Chemia ogólna”, PWN, Warszawa 2004, Rozdz.15, 16.1-16.3, str. 693-745.
Barwy wskaźników w roztworach o różnych wartościach pH
Używając świeżej, podwójnie destylowanej wody, przygotować 50 cm3 roztworu wzorcowego o pH = 2 przez dziesięciokrotne rozcieńczenie 0,1 M wzorcowego roztworu HCl o pH = 1. Z kolei, rozcieńczając dziesięciokrotnie roztwór o pH = 2, otrzymać roztwór o pH = 3. Analogicznie przyrządzić roztwór o pH = 12 przez rozcieńczenie 0,1 M roztworu NaOH.
Roztwory sporządzić używając czystej i przemytej odpowiednim roztworem pipety oraz czystej i przepłukanej podwójnie destylowaną wodą kolby miarowej. W przypadku roztworów o pH od 4 do 11 należy stosować gotowe roztwory wzorcowe (roztwory buforowe).
W statywie umieścić 13 suchych i czystych probówek. Do każdej z nich wprowadzić ok. 5 cm3 odpowiedniego roztworu wzorcowego (o pH od 1 do 13) i dodać po kilka kropel jednego z poniższych wskaźników:
*fiolet metylowy *lakmus
*oranż metylowy *fenoloftaleina
*czerwień metylowa *tymoloftaleina
lub zieleń bromokrezolowa *żółcień alizarynowa
*błękit bromotymolowy *karmin indygo
Zanotować barwy każdego ze wskaźników w poszczególnych roztworach, określić zakres pH, w jakim następuje zmiana barwy.
Oznaczanie stężenia jonów wodorowych w roztworach
2.1. Pobrać od prowadzącego ćwiczenia roztwór do analizy. Oznaczyć pH roztworu przez porównanie zabarwienia wskaźników w tym roztworze z przygotowaną w poprzednim ćwiczeniu skalą. W tym celu pobrać porcję badanego roztworu do suchej i czystej probówki i dodać kilka kropli wskaźnika. Określić odczyn roztworu (kwaśny czy zasadowy). Kolejne próby wykonać z nowymi porcjami badanego roztworu dobierając wskaźniki, których zmiana barwy zachodzi w zakresie pH wyznaczonym w pierwszej próbie. Sprawdzić u prowadzącego poprawność oznaczonej wartości pH.
Przedstawić schemat oznaczenia pH w analizowanym roztworze: wymienić użyte wskaźniki, podać barwę roztworu po dodaniu wskaźnika oraz wniosek wynikający z każdej próby.
2.2. W probówkach sporządzić roztwory podanych soli; NH4Cl, Na2CO3, Na2SO3, NaHSO3, NaHCO3, CH3COONa, AlCl3, CH3COONH4, rozpuszczając szpachelkę soli w wodzie podwójnie destylowanej. Oznaczyć pH roztworów przy pomocy wskaźnika uniwersalnego. Skalę pH dla wskaźnika uniwersalnego sporządzić jak w doświadczeniu 1.
Napisać jonowe równania reakcji, którym uległy sole, dając w wyniku obserwowany odczyn roztworu.
Równowagi w roztworach słabych elektrolitów. Przesunięcie równowagi (efekt wspólnego jonu)
Do probówki wprowadzić ok. 3 cm3 1 M roztworu kwasu octowego, dodać kilka kropli oranżu metylowego. Oznaczyć pH roztworu. Dodać 3 cm3 1 M roztworu octanu sodu i ponownie oznaczyć pH roztworu.
Do 3 cm3 0,1 M roztworu amoniaku dodać dwie krople tymoloftaleiny, a następnie 3 cm3 0,1 M roztworu chlorku amonu. Określić zmianę pH roztworu.
Napisać odpowiednie równania dysocjacji i wyrażenia na stałą równowagi. Zinterpretować zmianę pH jako efekt wspólnego jonu. Obliczyć zmianę stopnia dysocjacji kwasu octowego po dodaniu octanu sodu i amoniaku po dodaniu chlorku amonu.
Uwaga! Po zakończeniu ćwiczeń umyć probówki (jeżeli to konieczne - użyć do mycia acetonu), przepłukać wodą destylowaną i wstawić do suszarki.
Ćwiczenie 12
Stała równowagi. Miareczkowanie pehametryczne. Roztwory buforowe
Cel ćwiczenia. Wyznaczenie krzywej miareczkowania alkacymetrycznego dla słabych elektrolitów. Metody wyznaczania stałych kwasowych. Tworzenie się i stałość pH mieszanin buforowych.
Zakres materiału. Roztwory buforowe. Zmiany pH w procesach zobojętniania. Podstawy analizy miareczkowej.
Literatura: L. Jones, P. Atkins, „Chemia ogólna”, PWN, Warszawa 2004, Rozdz. 16.4 -16.10, str. 745 - 767.
M. J. Sienko, R. A. Plane, „Chemia. Podstawy i własności”, WNT Warszawa 1980; rozdz. 12.4.; 12.5.
Metoda miareczkowania pehametrycznego (potencjometryczna) polega na dodawaniu roztworu zasady lub kwasu o znanym stężeniu (titranta) do roztworu badanego kwasu lub zasady (badanego elektrolitu) i mierzeniu wartości pH po każdej dodanej porcji titranta. Na podstawie zbioru danych z tak przeprowadzonego miareczkowania wykreśla się krzywą miareczkowania, tj. zależność wartości pH od ilości dodanego titranta. Tak zwany punkt równoważnikowy (PR) odpowiada etapowi, w którym zmieszano stechiometryczne ilości kwasu i zasady. W pobliżu tego punktu (PR) krzywa pH = f(Vtitranta) wykazuje charakterystyczny skok, tj. znaczną zmianę wartości pH spowodowaną niewielką zmianą objętości dodanego titranta. Przyjmuje się, że punkt równoważnikowy (PR) znajduje się w połowie skoku krzywej miareczkowania. Znając objętość zużytego titranta (wynikającą z położenia PR na krzywej miareczkowania) oraz jego stężenie można łatwo obliczyć liczbę moli miareczkowanego elektrolitu obecną w badanym roztworze. Znając z kolei wyjściową objętość (V0) badanego roztworu elektrolitu, można wyznaczyć jego stężenie co.
Krzywa miareczkowania może służyć również do wyznaczenia wartości stałej dysocjacji kwasu lub zasady, a ściślej mówiąc, stałej równowagi reakcji przeniesienia protonu z cząsteczki kwasu na cząsteczkę wody (Ka) lub z cząsteczki wody na cząsteczkę zasady (Kb). Rozważmy to dla przypadku stałej dysocjacji słabego kwasu HA, dla którego równowaga przeniesienia protonu ma postać:
HA + H2O
H3O+ + A- (1)
Stała równowagi Ka dla tej reakcji:
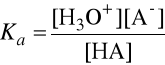
zawiera równowagowe stężenia jonów i cząsteczek biorących udział w tej równowadze.
.
Przykładowa krzywa miareczkowania słabego kwasu mocną zasadą
Po przekształceniu:
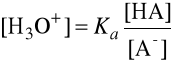
Ponieważ pH = -log [H3O+], możemy powyższe wyrażenie doprowadzić do postaci:
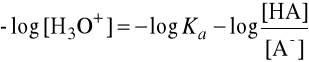
lub: 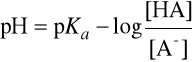
gdzie pKa = -log Ka.
Jeśli stężenia równowagowe kwasu HA i sprzężonej z nim zasady A- są równe, czyli [HA] = [A-], to pH = pKa, gdyż stosunek tych stężeń [HA]/[A-] = 1, i stąd log ([HA]/[A-])= 0.
W trakcie miareczkowania kwasu mocną zasadą dokonujemy zmiany stosunku stężeń równowagowych kwasu HA i sprzężonej z nim zasady A- przez przesuwanie położenia równowagi (1) w prawo w wyniku wiązania jonów H3O+ w reakcji zobojętnienia:
H3O+ + OH- _→ 2H2O (2).
Wartości stężeń równowagowych form HA i A- w miareczkowanym roztworze zrównają się, jeśli dodamy zasadę w ilości stanowiącej dokładnie połowę liczby moli miareczkowanego kwasu, co odpowiada tzw. Punktowi połowicznego zmiareczkowania (PP) roztworu. Punkt ten odpowiada objętości titranta równej dokładnie połowie objętości zużytej w punkcie równoważnikowym (PR). Wartość pH w punkcie połowicznego zmiareczkowania (PP) jest równa wartości pKa badanego kwasu.
W przypadku miareczkowania słąbej zasady mocnym kwasem analogiczne rozważania prowadzą do wniosku, że wartość pH w PP jest równa pKa dla kwasu sprzężonego z tą zasadą. Wartość pKb obliczamy, odejmując pH w PP od 14.
Wyznaczanie krzywej miareczkowania - oznaczanie stężenia kwasu lub zasady i stałej dysocjacji
Do zlewki o pojemności 150 cm3 pobrać, z biurety wskazanej przez prowadzącego, dokładnie 25 cm3 wyjściowego roztworu badanego elektrolitu. Dodać tyle wody destylowanej, aby sumaryczna objętość roztworu wyniosła ok. 75 cm3. Wodę dodajemy celu zwiększenia objętości mierzonego roztworu i uzyskania odpowiedniego zanurzenia elektrody. Czy po rozcieńczeniu wodą zmieniła się liczba moli badanego elektrolitu?
Zlewkę umieścić na stoliku mieszadła magnetycznego podłączonego do sieci przez autotransformator.
Na dnie zlewki umieścić serce mieszadła i, regulując napięcie na autotransformatorze, dobrać taką szybkość obrotów, aby mieszadło wirowało w płaszczyźnie dna zlewki, bez podskakiwania.
Ostrożnie zanurzyć koniec elektrody kombinowanej*, podłączonej do pehametru, w roztworze badanego elektrolitu. Elektroda powinna być umieszczona w ten sposób, aby dolny koniec jej osłony dzieliła od dna naczynia odległość ok. 1 cm, a od poziomu roztworu - 4 cm. Zestaw umieścić pod wylotem biurety przepłukanej uprzednio i napełnionej roztworem titranta (kwasu lub zasady o znanym stężeniu). Upewnić się, że część biurety poniżej kurka wypełniona jest roztworem.
Zmierzyć pH roztworu badanego elektrolitu w punkcie początkowym.
Włączyć mieszanie i dodawać porcje po 0,5 cm3 z biurety notując objętość dodanego roztworu titranta oraz wartość pH roztworu w zlewce po dodaniu każdej porcji. Miareczkowanie prowadzić do momentu, gdy zmiany pH powodowane dodawaniem kolejnych porcji roztworu z biurety będą już nieznaczne.
Na papierze milimetrowym wykreślić zależność pH od objętości dodanej zasady lub kwasu (krzywą miareczkowania).
Wyznaczyć punkt równoważnikowy (PR) i punkt połowicznego zmiareczkowania (PP).
Na podstawie wartości objętości roztworu titranta w PR (VPR) oraz objętości wyjściowego roztworu badanego kwasu lub zasady (Vo) obliczyć wyjściowe stężenie roztworu badanego elektrolitu co. Z krzywej miareczkowania odczytać wartość pH w PP, czyli wartość pKa badanego kwasu lub kwasu sprzężonego z badaną zasadą.
* Elektroda kombinowana - ogniwo złożone z elektrody szklanej i elektrody porównawczej (o stałym potencjale: kalomelowej lub chlorosrebrowej). SEM tego ogniwa zależy od pH roztworu, w którym zanurzona jest elektroda.
2. Wyznaczanie wartości stałej dysocjacji kwasowej metodą połowicznego zmiareczkowania.
Do zlewki o pojemności 250 cm3 nalać ok. 20 cm3 elektrolitu (tego samego, co w ćw. 1) i dodać cylindrem miarowym 100 cm3 wody. Uzyskany roztwór podzielić na dwie równe objętości za pomocą cylindra miarowego.
Do jednej objętości elektrolitu, umieszczonej w kolbce stożkowej, dodać 2-3 krople fenoloftaleiny, a następnie dodawać z biurety 0,1 M roztwór odpowiedniego titranta, aż do uzyskania trwałego zabarwienia wskaźnika lub do zaniku zabarwienia. Do tak przygotowanego roztworu dodać drugą objętość roztworu badanego elektrolitu.
Po zmieszaniu obu objętości uzyskuje się roztwór połowicznie zmiareczkowany (do elektrolitu została dodana tylko połowa stechiometrycznej ilości odpowiedniego titranta).
Wykonać pomiar pH dla końcowego roztworu. Zmierzona wartość pH jest równa pKa badanego kwasu lub kwasu sprzężonego z badaną zasadą.
Uwaga: Roztwór zachować do dalszych doświadczeń.
3. Potencjometryczne badanie stałości pH roztworu buforowego
Roztwór, uzyskany w doświadczeniu 2 w wyniku zmieszania zobojętnionej i niezobojętnionej porcji elektrolitu, jest mieszaniną równej liczby moli słabego kwasu i zasady sprzężonej z tym kwasem i może być używany jako roztwór buforowy.
Przygotować dwie porcje po ok. 30 cm3 roztworu z doświadczenia 2. Do jednej z nich dodać 5 kropel 0,1 M roztworu HCl, a do drugiej 5 kropel 0,1 M roztworu NaOH i wykonać pomiar pH obu roztworów pH-metrem.
Dla 30 cm3 wody destylowanej zmierzyć wartość pH, a następnie dodać 5 kropel 0,1 M roztworu HCl i oznaczyć ponownie pH. Podobny eksperyment wykonać dla innej porcji wody destylowanej dodając do niej 5 kropel 0,1 M. roztworu NaOH.
W innej zlewce przygotować roztwór składający się z 10 cm3 roztworu z doświadczenia 2 i 20 cm3 wody destylowanej Oznaczyć wartość pH uzyskanego roztworu.
Napisać jonowe równania reakcji zachodzących podczas dodawania do roztworu buforowego: a) roztworu HCl, b) roztworu NaOH.
Ćwiczenie 14
reakcje utleniania i redukcji
Cel ćwiczenia. Umiejętność dobierania współczynników w reakcjach utleniania i redukcji (redoks), pisanie reakcji połówkowych, układanie równań reakcji redoks.
Zakres materiału. Równania reakcji redoks.
Literatura. A. Śliwa, „Obliczenia chemiczne”, rozdz. 12.5
L. Jones, P. Atkins, „Chemia ogólna”, PWN, Warszawa 2004, Rozdz. 18.1, 18,2 str. 833 - 839.
M. M. Sienko, R. Plane „Chemia. Podstawy i zastosowania” W.N.T. W-wa 1992, 1999, Rozdz. 2.9, 9.5, 11.13.
Wykonanie ćwiczenia. Zestaw poniższych ćwiczeń każdy student wykonuje indywidualnie. Należy stosować minimalne ilości odczynników. Stosowanie pipet (z wyjątkiem reakcji kameleonowej) jest zabronione. Roztwory należy nalewać prosto z butelki, traktując podane w instrukcji ilości jako zalecane proporcje objętościowe. Obserwować przebieg reakcji (zmiany barw roztworów, wydzielanie się gazów, wytrącanie lub rozpuszczanie osadów). Po przeprowadzeniu każdej reakcji zapisać obserwacje, zidentyfikować produkty reakcji. Ćwiczenia należy wykonywać pod wyciągiem, próbówki po ich wykonaniu (zwłaszcza w ćwiczeniach 2-4) opróżnić i umyć przynajmniej wstępnie również pod wyciągami.
1. Wpływ odczynu środowiska na reakcje manganianu(VII) potasu.
Do trzech probówek wprowadzić po 5 kropli 0,02 M roztworu manganianu(VII) potasu KmnO4 (zwanego tradycyjnie nadmanganianem potasu).
Ponadto
- do probówki nr 1 dodać 5 kropli 12 M kwasu siarkowego,
- do probówki nr 2 dodać 5 kropli wody,
- do probówki nr 3 dodać 5 kropli 12 M roztworu NaOH.
Do wszystkich probówek wprowadzać kroplami 0,02 M roztwór wodorosiarczanu(IV) sodu NaHSO3 (nazwa tradycyjna: wodorosiarczyn sodu), aż do zmiany zabarwienia roztworów. - 5 -
Produkty redukcji KMnO4 zidentyfikować na podstawie zabarwienia otrzymanego roztworu, wiedząc, że barwa związków manganu zależy od jego stopnia utlenienia oraz od stężenia:
MnO4− − fioletowy do różowego
MnO42− − zielony
MnO2 − brunatny osad (w przypadku małej ilości widoczne jest żółto-
brązowe zabarwienie roztworu)
Mn2+ − bezbarwny lub bladoróżowy.
Określić, jakiej przemianie chemicznej ulega NaHSO3 w każdej reakcji, pamiętając, że w roztworze silnie zasadowym nie istnieją wodoroaniony.
Uwaga: Roztwór w probówce nr 3 zachować celem wykonania ćwiczenia nr 7.
2. Utleniające i redukujące własności pierwiastka w zależności od jego stopnia utlenienia (na przykładzie związków azotu)
Uwaga! W dośw. 2.2 i 2.3 mogą się wydzielać tlenki azotu, które są produktem ubocznie przebiegającej w środowisku kwaśnym reakcji między azotanem(III) potasu i kwasem siarkowym. Ze względu na trujące właściwości tlenków azotu, po zakończeniu ćwiczenia probówki myjemy pod wyciągiem!
2.1. Do probówki wprowadzić dwie krople roztworu KmnO4 i 10 kropel 25% roztworu amoniaku. Mieszaninę lekko ogrzać płomieniem palnika. Jednym z produktów reakcji jest wolny azot.
Produkt redukcji nadmanganianu zidentyfikować na podstawie zabarwienia roztworu.
2.2. Do probówki wprowadzić 4 krople roztworu 0,02 M KmnO4, dodać dwie krople 1 M kwasu siarkowego i pięć kropel roztworu KNO2.
Produkt redukcji nadmanganianu zidentyfikować na podstawie zabarwienia roztworu.
2.3. Do probówki wprowadzić po 3 krople roztworu KI i 1 M kwasu siarkowego, dodać 3 krople roztworu azotanu (III) potasu. (tradycyjnie: azotyn potasu).
Jednym z produktów reakcji jest azot, drugi produkt zidentyfikować na podstawie zabarwienia.
Jakie własności - utleniające czy redukujące - wykazuje azotan(III) potasu w reakcjach 2.1, 2.2 i 2.3?
2.4. Do dwóch probówek wprowadzić niewielką ilość miedzi (w postaci małego kawałka blaszki lub dwóch wiórków).
Do jednej probówki dodać 4 krople stężonego kwasu azotowego(V), do drugiej 4 krople 2 M roztworu tego samego kwasu, otrzymanego przez zmieszanie równych objętości 4 M HNO3 i wody.
Jaki gaz wydziela się w pierwszej, a jaki w drugiej probówce?
Wyciągnąć ogólny wniosek dotyczący właściwości redoks związków azotu w zależności od stopnia utlenienia, na jakim azot w tych związkach występuje.
3. Utleniająco-redukujące własności wody utlenionej
3.1. Do probówki wprowadzić 5 kropli roztworu soli ołowiu(II), dodać 5 kropli wody siarkowodorowej. Wytrąca się czarny osad PbS.
Do osadu PbS dodać 5 kropli 3% H2O2. Co dzieje się z osadem?
W celu identyfikacji produktu tej reakcji, w innej probówce przeprowadzić reakcję pomocniczą między azotanem(V) ołowiu(II) i siarczanem(VI) sodu następująco: do probówki wprowadzić 5 kropli soli ołowiu(II) a następnie wkraplać roztwór siarczanu(VI) sodu aż do wytrącenia osadu.
Zaproponuj produkty reakcji między PbS i H2O2. Jakie właściwości (utleniające czy redukujące) wykazuje woda utleniona w tej reakcji?
3.2. Do probówki wprowadzić po 5 kropli 3% H2O2 i 1 M HNO3, dodać kilka kryształków PbO2. Zwrócić uwagę na wydzielanie się tlenu.
Po zakończeniu reakcji w roztworze wykryć jony Pb2+ dodając jedną kroplę roztworu KI (wytrąca się charakterystyczny, żółty osad PbI2).
Jakie właściwości (utleniające czy redukujące) wykazuje woda utleniona w tej reakcji? Podać ogólny wniosek dotyczący utleniająco − redukujących własności nadtlenku wodoru. Napisać reakcje połówkowe utleniania i redukcji H2O2.
4. Proces dysproproporcjonawania siarczanu(IV) sodu
Dwie probówki wypełnić (na wysokość 0,5-1 cm) krystalicznym siarczanem(IV) sodu (tradycyjnie: siarczyn sodowy).
a) Probówkę nr 1 umocować w statywie i ogrzewać intensywnie do czerwonego żaru płomieniem palnika około 10 minut, pozostawić do ostygnięcia. Probówkę nr 2 pozostawić jako porównawczą.
b) Do obu probówek dodać około 1 cm3 wody destylowanej i mieszając bagietką doprowadzić do rozpuszczenia soli, a następnie wprowadzić kroplami roztwór chlorku miedzi(II), aż do wytrącenia osadu.
Porównać barwy osadów uzyskanych w obu probówkach. Jaki produkt reakcji dysproporcjonowania siarczanu(IV) sodu zidentyfikowano dzięki wytrąceniu czarnego osadu siarczku miedzi(II)?Jak można by zidentyfikować drugi produkt?
Reakcje utleniania i redukcji w grupie fluorowców
a) Do trzech probówek wprowadzić po około 1 cm3:
wody chlorowej (roztworu Cl2 w wodzie), wody bromowej (roztworu Br2 w wodzie) i wodnego roztworu jodu.
Do każdej probówki dodać około 1 cm3 chloroformu. Probówki wstrząsnąć.
Zapisać w tabeli barwy roztworów chloru, bromu i jodu w roztworze wodnym i w rozpuszczalniku organicznym. Charakterystyczne zabarwienie warstwy organicznej posłuży do identyfikacji produktów reakcji.
|
Barwa fluorowca |
|
Barwa warstwy organicznej |
Produkt reakcji |
|
|
w roztworze wodnym |
w warstwie organicznej |
|
|
|
1. Cl2 |
|
|
1. KBr + Cl2 |
|
|
2. Br2 |
|
|
2. KI + Cl2 |
|
|
3. I2 |
|
|
3. KBr + I2 |
|
|
|
|
|
4. KI + Br2 |
|
|
b) W czterech oddzielnych probówkach przeprowadzić następujące reakcje używając po około 1 ml roztworów substratów:
w prob. 1 między KBr w r-rze wodnym a chlorem w wodzie chlorowej
w prob. 2 między KI w r-rze wodnym a chlorem w wodzie chlorowej
w prob. 3 między KBr w r-rze wodnym a roztworem wodnym jodu
w prob. 4 między KI w r-rze wodnym a bromem w wodzie bromowej.
Do wszystkich probówek dodać po około 2 ml chloroformu, wstrząsnąć.
Zapisać obserwacje w tabeli i na podstawie zabarwienia warstwy organicznej ustalić produkty reakcji bądź stwierdzić, że reakcja nie zachodzi.
Ułożyć fluorowce w szeregu zmniejszających się własności utleniających. Wyjaśnić tę kolejność.
6. Substancje organiczne w roli reduktorów
Chromiany(VI) pod wpływem jonów H+ zmieniają swa żółtą barwę na pomarańczową, przechodząc w dichromiany(VI), które pod wpływem jonów OH− przechodzą z powrotem w chromiany.
2 CrO42− + 2 H+ ![]()
Cr2O72− + H2O
Cr2O72− + 2 OH− ![]()
2 CrO42− + H2O
a) Do probówki z roztworem dichromianu(VI) potasu (5-10 kropli) dodawać kroplami 12 M roztwór NaOH. Obserwować zmianę barwy roztworu.
b) Do probówki z roztworem chromianu(VI) potasu (5-10 kropli) dodawać kroplami 12 M roztwór H2SO4. Obserwować zmianę barwy roztworu
c) Do probówki z roztworem dichromianu potasu(VI) (5-10 kropli) wprowadzić 2-4 krople stężonego kwasu siarkowego i 4-5 kropli alkoholu etylowego C2H5OH. Zwrócić uwagę na zmianę zabarwienia roztworu i wystąpienie specyficznego „owocowego” zapachu. W równaniu reakcji uwzględnić powstawanie jonów Cr3+ oraz kwasu octowego.
Źródłem zapachu jest octan etylu CH3COOC2H5, który powstaje w następczej reakcji kwasu octowego CH3COOH z nadmiarem alkoholu etylowego, katalizowanej kwasem siarkowym.
7. Reakcja kameleonowa
Manganiany(VI) ulegają rozkładowi w wyniku reakcji dysproporcjonowania, która przebiega według schematu:
3 MnO42−+ 2 H2O ![]()
2 MnO4−+ MnO2 + 4 OH− (1)
Przedstawić, w jaki sposób uzyskano zbilansowanie równania (1). Ocenić, jak przesunie się równowaga powyższej reakcji po dodaniu kwasu, a jak pod wpływem dodanej zasady, stosując tzw. regułę przekory.
Sprawdzić wysunięte wnioski następująco:
a) usunąć z roztworu pozostałego w probówce nr 3 (dośw. 1) nadmiar jonów SO32- dodając do niego kroplami rozcieńczony roztwór KMnO4 dotąd, dopóki pogłębiać się będzie zielona barwa (ostatecznie roztwór może przyjąć niebieskawo-zielone zabarwienie).
b) do tak przygotowanego roztworu wprowadzić ostrożnie kilka kropli 12 M roztworu kwasu siarkowego, aż do uzyskania wyraźnie kwaśnego odczynu. Roztwór zabarwia się na różowo i wytrąca się brunatny osad.
Uwaga: zobojętnianiu mocnej, stężonej zasady mocnym, stężonym kwasem towarzyszy wydzielanie się dużych ilości ciepła, które może doprowadzić do wrzenia cieczy - należy zachować dużą ostrożność przy dodawaniu kwasu, a także zasady w punkcie c)!
Napisać równanie reakcji dysproporcjonowania manganianu(VI) w środowisku kwaśnym.
c) następnie do roztworu wprowadzać kroplami 12 M r-r NaOH, aż do uzyskania odczynu zasadowego i charakterystycznej zmiany barwy roztworu.
Wyjaśnić zmianę zabarwienia roztworu posługując się równaniem reakcji (1).
Uwaga! Reakcję kameleonową można zaobserwować tylko w przypadku, gdy w roztworze nie ma nadmiaru jonów SO32-.
Ćwiczenie 15
badanie wŁasnoŚci pierwiastkÓw Xv grupy
ukŁadu okresowego
Cel ćwiczenia. Eksperymentalne wykazanie charakteru zmian elektroujemności pierwiastków w grupie na podstawie zmian ich fizykochemicznych własności. Nabycie umiejętności przeprowadzania reakcji chemicznych, obserwacji przebiegu reakcji i ich zapisywania w postaci równań.
Zakres materiału. Charakterystyka azotowców. Budowa układu okresowego. Zmiana elektroujemności pierwiastków, w okresach i grupach. Skale elektroujemności. Wartościowość, stopień utlenienia. Zmiany własności fizykochemicznych pierwiastków w zależności od ich położenia w grupach i okresach zgodnie z rozbudową powłok elektronowych atomów.
Literatura. Dowolny podręcznik chemii nieorganicznej.
Uwaga! Ćwiczenia oznaczone # należy wykonywać pod wyciągiem!
1. Otrzymywanie amoniaku i badanie jego własności(#)
1.1. W tygielku wymieszać starannie bagietką siarczan(VI) amonu i wodorotlenek wapnia. Małą ilość mieszaniny przenieść do probówki. Probówkę zatkać korkiem z rurką odprowadzającą, umocować w statywie i ogrzać lekko palnikiem. Do wylotu rurki zbliżyć
a) zwilżony wodą uniwersalny papierek wskaźnikowy,
b) bagietkę zwilżoną stężonym roztworem HCl.
1.2. Probówkę napełnić amoniakiem zgodnie z metodą A pokazaną na rysunku. Na rurkę odprowadzającą nałożyć krążek bibuły mający utrudnić mieszanie się zbieranego gazu z powietrzem. Napełnioną gazem probówkę zdjąć ostrożnie z rurki, zatkać palcem i zanurzyć w naczyniu z wodą, przy czym probówkę otworzyć dopiero w momencie, gdy jej koniec znajdzie się pod wodą.
Jaka jest rozpuszczalność amoniaku w wodzie? Czy można amoniak zbierać metodą B?
|
|
metoda A |
metoda B |
2. Otrzymywanie tlenku azotu(II) i tlenku azotu(IV) [dwutlenku azotu] (#)
Do probówki wrzucić kilka kawałeczków miedzianej blaszki i zalać je 4 M HNO3. Probówkę zamknąć korkiem z rurką odprowadzającą, umocować w statywie i bardzo lekko ogrzać. Wydzielający się gaz zbierać w probówce metodą B do jej 3/4 objętości. Zatkać probówkę palcem i po wyjęciu z wody odwrócić do dołu dnem (w probówce powinna zostać woda). Obserwować brunatnienie gazu po otwarciu probówki. Zatkać probówkę i wytrząsać, aż do zaabsorbowania brunatnego gazu przez wodę. Ponownie obserwować brunatnienie gazu po otwarciu probówki i jego rozpuszczanie podczas wytrząsania. Zbadać odczyn powstałego roztworu za pomocą papierka uniwersalnego. Wyjaśnić obserwowane zjawiska.
3. Otrzymywanie kwasu azotowego(III) [kwasu azotawego] oraz tlenku azotu(III) − bezwodnika tego kwasu
Do kilku kropli nasyconego roztworu azotanu(III) potasu [azotynu potasowego] dodać jedną kroplę 1 M H2SO4. Roztwór przybiera błękitne zabarwienie od powstającego tlenku azotu(III) (bezwodnika N2O3).
Uwaga: zaobserwowaniu reakcji sprzyja uprzednie ochłodzenie roztworu azotynu w mieszaninie oziębiającej (do ok. 100 g pokruszonego lodu wsypać 2 łyżki soli kuchennej).
Dlaczego nad roztworem powstaje brunatny gaz?
4. Dimeryzacja tlenku azotu(IV) [ditlenku azotu] (pokaz)
Szklany pojemnik zawierający gazowy tlenek azotu(IV) zanurzyć w mieszaninie oziębiającej.
Wyjaśnić zaobserwowane zmiany zachodzące w miarę obniżania temperatury, wiedząc, że w procesie tym biorą udział dwie cząsteczki NO2. Napisać wyrażenie na stałą dimeryzacji. Jak wartość stałej zmienia się z wraz z temperaturą?
5. Alotropowe odmiany fosforu (pokaz)
Do probówki wsypać szczyptę fosforu czerwonego, wylot probówki zatkać watą. Probówkę umocować w statywie w pozycji poziomej i ogrzewać intensywnie część probówki, w której znajduje się fosfor.
Obserwować następujące zmiany:
a) pojawienie się świecącej aureoli
b) zmniejszanie się ilości fosforu czerwonego i jednoczesne osadzanie się na zimnych ściankach probówki fosforu białego i tlenku fosforu(V) [pięciotlenku fosforu P2O5].
Przerwać ogrzewanie, odetkać probówkę i włożyć do niej szklaną bagietkę. Następnie szybkim ruchem wyciągnąć bagietkę z probówki pocierając przy okazji te miejsca na ściankach probówki, na których pojawił się nalot białego fosforu.
Co dzieje się z fosforem białym po wyjęciu bagietki? Która odmiana fosforu jest bardziej reaktywna?
Otrzymywanie kwasu fosforowego(V)
[kwasu ortofosforowego](#)
Do parowniczki wprowadzić szczyptę czerwonego fosforu i dodać kilka kropel stężonego kwasu azotowego(V). Parowniczkę umieścić na siatce ceramicznej i lekko ogrzać do zapoczątkowania reakcji wydzielania się tlenku azotu(IV). Obserwować przebieg reakcji.
Zidentyfikować jon PO43-, wykorzystując niżej podaną reakcję charakterystyczną z molibdenianem(VI) amonu, w następujący sposób: do kilku kropli nasyconego roztworu molibdenianu(VI) amonu, ogrzanego do temperatury 50°C i zakwaszonego wcześniej kilkoma kroplami stęż. roztworu HNO3 dodać kroplę otrzymanego w doświadczeniu roztworu.
H3PO4 + 12(NH4)2MoO4 + 21HNO3 → (NH4)3H4P(Mo2O7)6 + 21NH4NO3 + 10H2O |
7. Hydroliza ortofosforanów(V) sodu
Do czterech probówek wprowadzić po kilka kropli obojętnego roztworu lakmusu. Pierwszą zostawić jako probówkę porównawczą, do drugiej dodać 3 - 4 kryształki ortofosforanu(V) sodu, do trzeciej tyle samo dwuwodoroortofosforanu(V) sodu, do czwartej wodoroortofosforanu(V) sodu. Zwrócić uwagę na zmianę zabarwienia lakmusu w roztworach.
Podać cząsteczkowe i jonowe równania reakcji, którym uległy powyższe sol,e dając w wyniku obserwowany odczyn roztworu. Napisać wyrażenia na stałe równowagi tych reakcji. Obliczyć wartości stałych.
8. Otrzymywanie arsanu [arsenowodoru] (pokaz)
Do stożkowej probówki wlać ok. 2 cm3 4 M roztworu HCl oraz kilka kropel arsenianu(III) sodu. Probówkę umocować pionowo w statywie, a następnie wrzucić do niej kilka granulek metalicznego cynku. Zatkać korkiem z rurką zgiętą pod kątem prostym. Probówkę można ostrożnie podgrzać w celu zainicjowania i przyśpieszenia reakcji. Po upływie 1 minuty rozpocząć ogrzewanie rurki płomieniem palnika mniej więcej w połowie jej długości (odcinek poziomy). Obserwować powstanie lustra arsenowego (rozkład powstającego arsanu [arsenowodoru]).
Po ostudzeniu probówki rurkę odprowadzającą zanurzyć w stężonym roztworze kwasu azotowego(V).
9. Redukujące własności związków arsenu(III)
Do kilku kropel wody nasyconej jodem dodać kilka kropel arsenianu(III) sodowego. Obserwować zmianę barwy. W zapisie równania reakcji uwzględnić powstawanie kwasu arsenowego(V) [kwasu ortoarsenowego].
10. Otrzymywanie wodorotlenku antymonu(III) Sb(OH)3
Do dwóch probówek wprowadzić kilka kropli roztworu chlorku antymonu(III) [chlorku antymonawego], a następnie dodać taką samą objętość 2 M roztworu NaOH. Obserwować strącanie się osadu. Osad przenieść do dwu probówek, a następnie dodawać, silnie mieszając, aż do zniknięcia osadu;
a) 2 M roztwór HCl do pierwszej probówki.
b) 2 M roztwór NaOH do drugiej probówki
Określ chemiczny charakter wodorotlenku antymonu(III) [wodorotlenku antymonawego].
11. Otrzymywanie wodorotlenku bizmutu(III) [wodorotlenku bizmutawego] Bi(OH)3
Wytrącić osad Bi(OH)3 dodając 2M NaOH do kilku kropel roztworu soli bizmutu(III). Zbadać rozpuszczalność otrzymanego osadu w 2 M roztworze HNO3 i 2 M roztworze NaOH.
12. Utleniające własności bizmutanów(V)
Do kilku kropel 0,001M roztworu MnSO4 dodać nadmiar 4 M roztworu HNO3 i kilka kryształków sproszkowanego bizmutanu(V) sodu NaBiO3. Obserwować zmianę barwy, jeśli nie będzie widoczna, mieszaninę ostrożnie podgrzać. Porównać ją z barwą jonów MnO4−.
W równaniu reakcji uwzględnij powstawanie azotanu(V) bizmutu(III) [azotanu bizmutawego].
Ćwiczenie 16
zmiana wŁasnoŚci fizykochemicznych pierwiastkÓw w grupie na przykŁadzie wĘglowcÓW
Cel ćwiczenia. Eksperymentalne wykazanie zmian elektroujemności w grupie głównej układu okresowego na podstawie zmian własności fizykochemicznych pierwiastków na przykładzie węglowców. Nabycie umiejętności przeprowadzania reakcji chemicznych, obserwacji przebiegu reakcji i ich zapisywania w postaci równań.
Zakres materiału. Charakterystyka węglowców. Zmiany własności pierwiastków w rodzinach zgodnie z rozbudową powłok elektronowych atomów.
Literatura. Dowolny podręcznik chemii nieorganicznej.
Wykonanie ćwiczenia. Zestaw poniższych doświadczeń każdy student wykonuje samodzielnie. Doświadczenia z solami cyny i ołowiu wykonywać pamiętając o ich silnym działaniu toksycznym i tym samym o konieczności mycia rąk po wykonaniu ćwiczenia oraz nierozlewaniu roztworów tych soli po stołach laboratoryjnych, zlewach itp.
Doświadczenia ze stężonymi kwasami i zasadami należy wykonywać pod wyciągiem i w okularach ochronnych.
Wylot ogrzewanej probówki z kwasem lub zasadą kierować ku wnętrzu wyciągu, aby, przy nieostrożnym ogrzewaniu i doprowadzeniu do przegrzania cieczy (co często powoduje wyrzucenie cieczy z probówki), nie dopuścić do zalania twarzy i oczu. Z tego powodu należy zachować ostrożność przy badaniu gazów będących produktami reakcji.
Uwaga: ćwiczenia oznaczone symbolem (#) należy wykonywać wyłącznie pod bezpośrednią opieką prowadzącego ćwiczenia.
1. Otrzymywanie metanu (pokaz)
Do suchego porcelanowego moździerza wsypać równe ilości stałego NaOH i uprzednio starannie wysuszonego octanu sodowego, przy czym suszenie octanu przeprowadzamy ogrzewając go intensywnie na palniku w porcelanowej parowniczce nie dopuszczając do jego zwęglenia objawiającego się brązowieniem lub czernieniem stopionej masy. Mieszaninę dokładnie rozetrzeć i napełnić nią probówkę do 1/3-1/2 jej objętości. Zatkać probówkę korkiem z rurką odprowadzającą i umocować w statywie w położeniu poziomym, możliwie równomiernie rozkładając mieszaninę w probówce. Probówkę ogrzewać ostrożnie płomieniem palnika. Gdy powietrze zostanie całkowicie usunięte z probówki, wówczas zapalić wydzielający się gaz u wylotu rurki odprowadzającej.
Zachować ostrożność! Mieszanina metanu z powietrzem jest wybuchowa!
2. Otrzymywanie wolnego krzemu i silanów (#)
Na szkiełko zegarkowe nasypać dwie mikroszpachelki ditlenku krzemu (wyprażonego żelu krzemionkowego lub piasku kwarcowego) i cztery mikroszpachelki sproszkowanego magnezu, starannie zmieszać bagietką i przenieść mieszaninę do probówki. Probówkę umocować w statywie i ogrzewać delikatnie początkowo całą probówkę, a następnie tylko tę jej część, w której znajduje się mieszanina. Ogrzewanie prowadzić do zapoczątkowania reakcji, w wyniku której mieszanina w probówce rozżarza się, świecąc ciemnoczerwonym żarem.
Po ostudzeniu stłuc probówkę i wyjąć spieczoną czarną masę, składającą się z krzemu, tlenku magnezu i krzemku dimagnezu (krzemku magnezowego). Następnie do tygielka lub parowniczki zawierającej kilka kropli 4 M roztworu HCl wrzucić kilka kawałeczków otrzymanej masy. Zwrócić uwagę na samorzutne zapalanie się wydzielanych w wyniku reakcji gazowych silanów i barwę pozostałego w tyglu wolnego krzemu w postaci proszkowej.
Podać równania zachodzących reakcji
a) otrzymywania krzemu w wyniku redukcji ditlenku krzemu magnezem
b) tworzenia się krzemku magnezu
c) krzemku magnezu z HCl (tworzenie silanu SiH4)
d) działania kwasu solnego na tlenek magnezu
e) spalania silanu.
Który z wodorków, CH4 czy SiH4, jest trwalszy?
3. Działanie kwasów na cynę metaliczną (#)
Cyna w rozcieńczonych kwasach rozpuszcza się wolno. Dlatego w doświadczeniu lepiej jest użyć kwasów stężonych.
Do trzech probówek wrzucić po małym kawałeczku cyny metalicznej. Do probówek dodać po 1 cm3 stęż. roztworów kwasów: HCl, H2SO4 i HNO3. Obserwować przebieg reakcji najpierw na zimno, jeżeli nie widać zmian, ostrożnie podgrzać probówkę płomieniem palnika. Zidentyfikować wydzielające się gazy. Po zakończeniu reakcji nadmiar kwasu zlać do zlewu pod wyciągiem, uważając by kawałki nieprzereagowanej cyny pozostały w probówce. Następnie probówkę z metalem przepłukać wodą, metal osuszyć bibułą i włożyć do pojemnika z cyną.
Napisać równania reakcji metalicznej cyny z: a) HCl; b) H2SO4; c) HNO3, biorąc pod uwagę, że pod wpływem HCl powstaje chlorkowy kompleks Sn(II) o l. k. 4, w stęż. H2SO4 powstają zwiazki Sn(IV), a pod wpływem kwasu HNO3 nierozpuszczalny kwas metacynowy (H2SnO3).
4. Działanie kwasów na ołów metaliczny
Do trzech probówek wrzucić niewielkie kawałki metalicznego ołowiu uprzednio oczyszczonego przez przepłukanie 1 M roztworem kwasu azotowego i trzykrotnie dużą ilością wody destylowanej. Następnie dodać kolejno po 1 cm3 4 M roztworu HCl, H2SO4 i HNO3. Probówki podgrzać małym płomieniem palnika. Po ostudzeniu roztworów wprowadzić do każdej probówki po 2-3 krople roztworu jodku potasowego.
W której probówce wydzielił się osad? Napisz równania reakcji metalicznego ołowiu z: a) HCl; b) H2SO4; c) HNO3. Określ rozpuszczalność ołowiu w badanych kwasach. Porównaj reakcje krzemu, cyny i ołowiu z użytymi w doświadczeniach kwasami.
5. Hydroliza krzemianu sodu
Do trzech probówek wprowadzić po kilka kropli roztworu krzemianu sodu.
Do pierwszej probówki dodaj kroplę roztworu fenoloftaleiny. Jaką barwę przyjął ten wskaźnik pH?
Do drugiej probówki dodaj kilka kropli 0,5 M roztworu HCl. Zwróć uwagę na tworzenie się trudnorozpuszczalnego osadu kwasu krzemowego.
Do trzeciej probówki dodaj równa objętość 1 M roztworu chlorku amonu.
Zapisz krótko obserwacje towarzyszące powyższym eksperymentom. Wyjaśnij je jonowymi równaniami odpowiednich reakcji.
6. Wpływ węglanów na hydrolizę soli niektórych metali
Do probówki nr 1 wprowadź kilka kropli chlorku żelaza(III) FeCl3, do probówki nr 2 wprowadź kilka kropli chlorku chromu(III) CrCl3. Następnie do obu probówek dodaj po kilka kropli roztworu węglanu sodu.
Zanotuj obserwowane zjawiska.
Jaki gaz się wydziela? Jaka substancja się wytrąca w każdej z probówek?
Podaj jonowe równania reakcji protolizy (hydrolizy) chlorku żelaza(III) i chlorku chromu(III) w obecności węglanu sodu. Dlaczego w obu przypadkach hydroliza przebiega do końca?
7. Otrzymywanie wodorotlenku cyny(II) [wodorotlenku
cynawego] i cyny(IV) [wodorotlenku cynowego]. Badanie ich
własności.
7.1. Do dwóch probówek wprowadzić po 2-3 krople roztworu chlorku cyny(II) i po 4-5 kropli (do wystąpienia białego osadu) 2 M roztworu NaOH. Do otrzymanego w ten sposób wodorotlenku cyny(II) dodać: do pierwszej probówki 2-4 krople 2 M roztworu HCl, do drugiej 2-4 krople 2 M roztworu NaOH.
Jak zachowują się osady w probówkach?
Napisać równania przeprowadzonych reakcji, wiedząc, że w reakcji z zasadą powstają cyniany(II), a z kwasem związki Sn(II). Jakie własności posiada wodorotlenek cyny(II)?
7.2. Ćwiczenie wykonać identycznie jak ćwiczenie 7.1., używając w tym wypadku świeżo przygotowanego chlorku cyny(IV) (rozpuścić kilka kryształków stałego SnCl4 w wodzie destylowanej).
Napisać równania reakcji wodorotlenku cyny(IV) z kwasem i zasadą, wiedząc, że tworzą się odpowiednio: chlorkowy kompleks cyny(IV) (l.k. = 6) i cynian(IV) sodu o wzorze Na2[Sn(OH)6].
8. Redukujące właściwości dwuwartościowej cyny
Do stożkowej probówki wprowadzić kilka kropli chlorku cyny(II), po czym dodawać kroplami 12 M roztwór wodorotlenku sodu, aż do rozpuszczenia się strącającego się osadu wodorotlenku cyny(II). Do roztworu utworzonego cynianu(II) sodu dodać 1- 4 krople roztworu soli bizmutu(III).
Obserwować wytrącanie się czarnego osadu metalicznego bizmutu o dużej dyspersji.
Jaki związek cyny powstaje wyniku tej reakcji? Napisać zbilansowane równanie zachodzącej reakcji.
9. Otrzymywanie wodorotlenku ołowiu(II) [wodorotlenku ołowiawego] i badanie jego własności
Do dwóch probówek wprowadzić 2-4 krople roztworu soli ołowiu(II) i do każdej probówki dodać po kilka kropli 2 M roztworu NaOH. Obserwować barwę wydzielającego się osadu. Następnie do jednej probówki dodać 2 M roztworu HNO3, do drugiej 2 M roztworu NaOH aż do rozpuszczenia się osadów.
Napisać równania reakcji:
a) powstawania wodorotlenku ołowiu(II)
b) dysocjacji wodorotlenku ołowiu(II)
c) wodorotlenku ołowiu(II) z HNO3 i NaOH.
W postaci jakich jonów może występować ołów w roztworze o wartości pH większej i mniejszej od 7?
Dlaczego w celu rozpuszczenia wodorotlenku ołowiu(II) nie należy stosować roztworu HCl (na zimno) i H2SO4 (zarówno na zimno jak i gorąco)?
Jakimi innym kwasami można zastąpić kwas azotowy (wymień co najmniej 3)?
Ćwiczenie 18
iloczyn rozpuszczalnoŚci
Zakres materiału. Równowagi w roztworach trudno rozpuszczalnych elektrolitów, definicje: IR, rozpuszczalność, roztwór nasycony, zależność między IR a rozpuszczalnością, warunki rozpuszczania i wytrącania osadów.
Literatura. L. Jones, P. Atkins, „Chemia ogólna”, PWN, Warszawa 2004, Rozdz. 16.11 - 16.17, str. 767 - 790.
A.Śliwa, "Obliczenia chemiczne", PWN Warszawa 1982, rozdz. 11.8;
M. J. Sienko, R. A. Plane, "Chemia. Podstawy i własności", WNT 1999; Rozdz. 15.7; 15.8
Wykonanie ćwiczenia. Zestaw poniższych doświadczeń każdy student wykonuje samodzielnie z wyjątkiem dośw. 1.2 i 2, które należy wykonać w zespołach. W zeszycie laboratoryjnym powinny zostać podane substraty użyte do przeprowadzenia każdej reakcji, obserwacje dotyczące jej przebiegu i wyciągnięte wnioski, w tym również uzgodnione produkty. W sprawozdaniu wszystkie reakcje wytrącania i rozpuszczania osadów należy zapisać w ostatecznej wersji jonowo. Uwaga! Doświadczenia 1.1 i 4.4 należy w całości (łącznie z myciem probówek) wykonać pod wyciągiem!
1. Warunki strącania osadów.
1.1 Eksperyment prowadzimy pod wyciągiem! Do dwóch probówek wprowadzić po 2-3 krople roztworu siarczanu żelaza(II). Do probówki nr 1 dodać 2-3 krople roztworu wody siarkowodorowej, do probówki nr 2 dodać 2-3 krople roztworu siarczku amonu. Do trzeciej probówki wprowadzić 2-3 krople roztworu siarczanu miedzi, a następnie kilka kropli wody siarkowodorowej. W których probówkach powstał osad?
Podać jonowe równanie reakcji. W oparciu o pojęcie iloczynu rozpuszczalności wyjaśnić powstawanie osadu w probówce nr 2 i 3 i brak osadu w probówce nr 1. W którym roztworze, siarkowodoru czy siarczku amonu, jest większe stężenie jonów siarczkowych? Porównaj wartości iloczynów rozpuszczalności FeS i CuS. Który osad jest trudniej rozpuszczalny?
1.2. Z kolby ssawkowej i wkraplacza zmontować aparaturę do otrzymywania CO2 z węglanu wapnia i kwasu solnego.
Otrzymywany CO2 przepuścić przez roztwory: Ba(OH)2, Ca(OH)2, KOH i NaOH. W których probówkach wydziela się osad? Zbadać również, czy powstają osady przy przepuszczaniu CO2 przez roztwory BaCl2 i CaCl2.
Pobierz niewielkie ilości zawiesiny strąconego w ten sposób osadu węglanu wapnia do probówki. Przez tę zawiesinę ponownie przepuszczaj strumień CO2. Obserwować rozpuszczanie się osadu.
Probówkę z otrzymanym tak roztworem wodorowęglanu wapnia ogrzej delikatnie w płomieniu palnika. Zaobserwuj pojawienie się osadu węglanu wapnia.
Zbadać wytrącanie osadów z roztworów wodorotlenków Ba(OH)2, Ca(OH)2, oraz z roztworów CaCl2 i BaCl2 pod wpływem węglanu sodu.
Wyniki doświadczeń zamieścić w tabelce. Napisać jonowe równania przeprowadzonych reakcji. Wyjaśnić różnicę w powstawaniu osadów pod wpływem dwutlenku węgla i węglanu sodu. Określić rozpuszczalność węglanów i wodorowęglanów badanych metali.
|
CO2 |
Na2CO3 |
Ca(OH)2 |
|
|
Ba(OH)2 |
|
|
NaOH |
|
|
KOH |
|
|
CaCl2 |
|
|
BaCl2 |
|
|
2. Strącanie frakcjonowane
Przygotować kilka (co najmniej 6) czystych probówek. W dwóch pierwszych przeprowadzić reakcje charakterystyczne, w pozostałych − strącanie frakcjonowane.
Do probówki nr 1 wprowadzić 4 krople 0,5 M roztworu chlorku sodu, do probówki nr 2 − 4 krople 0,5 M roztworu jodku potasu. Do każdej z nich dodać po 8 kropli 0,1 M roztworu azotanu srebra. Zanotować barwy wytrąconych osadów.
Do probówki nr 3 wprowadzić po 4 krople roztworu jodku potasu i chlorku sodu oraz 2 krople kwasu azotowego. Strącić osad dodając 8 kropli roztworu azotanu srebra. Osad odwirować. Ciecz znad osadu przenieść przy pomocy pipetki do czystej probówki (nr 4). Probówkę nr 3 z odwirowanym osadem zachować. Do probówki nr 4 z odpipetowanym roztworem dodać 8 kropli roztworu azotanu srebra. Wytrącony osad odwirować, ciecz znad osadu przenieść do czystej probówki nr 5. Probówkę z osadem zachować, itd.
Powtarzać wytrącanie osadu, odwirowywanie i odpipetowywanie aż do otrzymania białego osadu. Porównać barwę osadów w kolejności ich otrzymywania.
Które jony wytrącają się w reakcji z jonami srebra najpierw: chlorkowe czy jodkowe? Wyjaśnić kolejność wytrącania się z roztworu osadów AgCl i AgI uwzględniając wartości ich IR.
3. Wpływ wartości IR osadu na efektywność usunięcia jonu z roztworu
3.1. Do probówki nr 1 wprowadzić 4 krople roztworu chlorku wapniowego i 6 kropli roztworu siarczanu sodowego. Roztwór pozostawić do całkowitego wytrącenia osadu siarczanu wapnia, osad odwirować. Ciecz znad osadu przenieść do dwóch probówek. (nr 2 i nr 3).
Do probówki nr 2 dodać 2 krople roztworu siarczanu sodowego, aby upewnić się, czy nastąpiło całkowite wytrącenie siarczanu wapnia. Do probówki nr 3 dodać 3 krople roztworu szczawianu amonu.
Wyjaśnić strącanie się osadu po dodaniu jonów szczawianowych w roztworze, z którego usunięto już jony wapnia w postaci siarczanu wapnia.
3.2. Do probówki nr 1 wprowadzić 4 krople siarczanu sodu i 6 kropli chlorku wapniowego. Roztwór pozostawić do całkowitego wytrącenia osadu siarczanu wapnia. Ciecz znad osadu przenieść do dwóch probówek. (nr 2 i nr 3).
Do probówki nr 2 dodać 2 krople roztworu chlorku wapnia i sprawdzić, czy nastąpiło całkowite wytrącenie siarczanu wapnia. Do probówki nr 3 dodać 2 krople roztworu chlorku baru.
Wyjaśnić strącanie się osadu po dodaniu jonów baru w roztworze, z którego usunięto już jony siarczanowe w postaci siarczanu wapnia.
3.3. Do probówki nr 1 wprowadzić 4 krople roztworu azotanu ołowiu(II) i 6 kropli roztworu chlorku sodu. Osad odwirować. Ciecz znad osadu przenieść do dwóch probówek (nr 2 i nr 3).
Do probówki nr 2 dodać 3 krople chlorku sodu w celu sprawdzenia całkowitego strącenia chlorku ołowiu(II). Do probówki nr 3 dodać 3 krople roztworu jodku potasu.
Jaka sól ulegnie wytrąceniu w roztworze, z którego usunięto jony ołowiu w postaci chlorku ołowiu? Wyciągnąć wniosek dotyczący IR otrzymanych soli ołowiu.
4. Warunki rozpuszczania osadów trudnorozpuszczalnych
4.1. Do dwóch probówek (nr 1 i nr 2) wprowadzić po 3 krople roztworu azotanu srebra. Do probówki nr 1 dodać 3 krople roztworu węglanu sodu. Do probówki nr 2 dodać 3 krople roztworu chlorku sodu. Otrzymane osady zadać 4-5 kroplami rozcieńczonego kwasu azotowego.
Który z osadów się rozpuści? Opierając się na prawie IR wyjaśnić proces rozpuszczania się osadu. Dlaczego drugi osad nie rozpuszcza się pod wpływem kwasu?
4.2. W dwóch probówkach (nr 1 i nr 2) wytrącić wodorotlenek magnezu wprowadzając po 2 krople roztworu soli magnezu i wodorotlenku sodu. W obydwu probówkach rozpuścić osady, mieszając je bagietką i dodając z pipetki niezbędną liczbę kropli (należy je liczyć!) 2 M roztworu kwasu solnego − do probówki nr 1 oraz 2 M roztworu chlorku amonu − do probówki nr 2.
W którym przypadku rozpuszczanie osadu wodorotlenku magnezu przebiega łatwiej i dlaczego?
4.3. W dwóch probówkach (nr 1 i nr 2) strącić osad szczawianu wapnia (sól wapniowa + szczawian amonu). Do probówki nr 1 dodać kilka kropli 2 M roztworu kwasu solnego. Do probówki nr 2 kilka kropli 2 M roztworu kwasu octowego.
Wyjaśnić, opierając się na prawie IR, dlaczego osad szczawianu wapnia rozpuszcza się w jednym z kwasów, a jest praktycznie nierozpuszczalny w drugim.
4.4. Eksperyment prowadzimy pod wyciągiem! Do probówki nr 1 wprowadzić 2 krople roztworu siarczanu żelaza(II), do probówki nr 2 wprowadzić 2 krople roztworu siarczanu miedzi(II). Do każdej probówki dodać po dwie krople roztworu siarczku amonu. Osady siarczków zadać 5-7 kroplami 2 M roztworu kwasu solnego. Jeśli osad się nie rozpuści, dodać ostrożnie 5 kropli stężonego HNO3.
Podać jonowe równania reakcji rozpuszczania jednego osadu w kwasie solnym i drugiego osadu w kwasie azotowym. Dlaczego drugi osad nie rozpuszcza się w kwasie solnym? Zwrócić uwagę na wartości IR osadów siarczków.
5. Otrzymywanie trudno rozpuszczalnych związków z innych trudnorozpuszczalnych soli
5.1. Wytrącić osad siarczanu ołowiu(II) (siarczan sodu + azotan ołowiu(II)). Osad odwirować. Odpipetować ciecz znad osadu. Osad zadać kilkoma kroplami siarczku amonu i zamieszać.
Jak zmieniło się zabarwienie osadu? Opierając się na prawie IR oraz wartościach IR dla strąconych soli wyjaśnić przemianę jednej trudno rozpuszczalnej soli w drugą.
5.2. Wytrącić jak w ćwicz. 5.1 siarczan ołowiu(II). Po odstaniu osadu odpipetować znad niego ciecz. Osad zadać kilkoma kroplami roztworu chromianu(VI) potasu i zamieszać bagietką.
Jak zmieniło się zabarwianie osadu? Jaki powstał związek?
Sprawozdanie
Odpowiedzieć na pytania zawarte w opisie wykonania ćwiczeń. Odpowiedzieć na następujące pytania:
1) Jak wpływa na rozpuszczalność trudno rozpuszczalnego osadu wprowadzenie do roztworu nasyconego :
a) jonów wspólnych z jonami osadu
b) jonów reagujących z jednym z jonów osadu? Odpowiedź należy zilustrować dowolnym przykładem.
2) Czy możliwe jest całkowite strącenie jakiegokolwiek jonu z roztworu? Odpowiedź uzasadnić.
Stałe dysocjacji kwasowej i iloczyny rozpuszczalności (25 oC)
Ka |
||||
H2S |
1,1⋅ 10-7 |
H2CO3 |
4,2 10-7 |
|
HS- |
1⋅ 10-14 |
HCO3- |
4,8··10-11 |
|
CH3COOH |
1,8 ⋅10-5 |
H2C2O4 |
5,4·10-2 |
|
|
|
HC2O4- |
5,4·10-5 |
|
IR |
||||
AgCl |
1,7⋅10-10 |
PbCl2 |
1,6⋅10-5 |
|
Ag2CO3 |
6,2⋅10-12 |
PbI2 |
8,7⋅10-9 |
|
AgI |
8,5⋅10-17 |
PbCrO4 |
1,8⋅10-14 |
|
BaSO4 |
1,5⋅10-9 |
PbSO4 |
2⋅10-8 |
|
CaC2O4 |
1,3⋅10-9 |
PbS |
7⋅10-29 |
|
CaSO4 |
2,4 ⋅10-5 |
CuS |
8⋅10-37 |
|
Mg(OH)2 |
8,9⋅10-12 |
FeS |
4⋅10-19 |
|
Ćwiczenie 20
elektrochemia
Cel ćwiczenia: Zapoznanie się z podstawami budowy i działania ogniw oraz doświadczalne wyznaczenie potencjałów normalnych kilku pierwiastków.
Zakres materiału naukowego: Ogniwa galwaniczne: budowa i działanie. Ogniwa stężeniowe, SEM ogniwa, potencjały elektrochemiczne metali, szereg napięciowy metali. Równanie Nernsta. Standardowe półogniwo wodorowe.
Literatura: . L. Jones, P. Atkins, „Chemia ogólna”, PWN Warszawa 2004, Rozdz. 18.3 - 18.10, str. 839 - 861, Rozdz. 18.13 - 18.14, str. 868 - 871.
M. J. Sienko, R. A. Plane, "Chemia. Podstawy i zastosowanie", WNT Warszawa 1999; Rozdz. 11.
Wykonanie ćwiczenia:
Elektroliza wodnego roztworu KNO3.
Do naczynia elektrolitycznego w kształcie litery U wlać 1 M roztwór KNO3 zawierający 5-10 kropel fenoloftaleiny lub wskaźnika uniwersalnego. Oczyszczone elektrody węglowe (podłączone do biegunów bateryjki) wprowadzić do wylotów U-rurki. Przez około 30 minut prowadzić elektrolizę roztworu obserwując zmianę jego zabarwienia w pobliżu elektrod węglowych.
Przy której elektrodzie węglowej nastąpiła alkalizacja roztworu? (sprawdź, do jakiego bieguna bateryjki jest ona podłączona).
Napisać reakcje, które zachodzą na każdej z elektrod oraz sumaryczną reakcję elektrolitycznego rozkładu wody.
Szereg aktywności metali.
Do 6 probówek wprowadzić po ok. 2 cm3 0,5 M roztworów następujących soli: Zn(NO3)2, FeSO4, Pb(NO3)2, SnCl2, Cu(NO3)2 i 0,1 M AgNO3. Do wszystkich probówek wrzucić kawałek cynku. Obserwować i zanotować (wg poniższego wzoru) zmiany zachodzące natychmiast po wrzuceniu metalu i w ciągu następnych 30 min. Zwrócić uwagę na zmianę barwy powierzchni metalu lub roztworu, wydzielanie się gazu. Analogiczne doświadczenie przeprowadzić z cyną, ołowiem, żelazem i miedzią. Obserwacje zapisać w tabelce.
jon metalu→ metal |
Zn2+ |
Fe2+ |
Sn2+ |
Pb2+ |
Cu2+ |
Ag+ |
Zn |
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
Sn |
|
|
|
|
|
|
Pb |
|
|
|
|
|
|
Cu |
|
|
|
|
|
|
Napisać jonowe równania reakcji jednego z użytych metali z roztworami podanych soli. Ułożyć badane pierwiastki metaliczne według malejącej zdolności redukcyjnej, natomiast użyte w doświadczeniu jony metali według rosnących zdolności utleniających.
Wyznaczanie standardowych potencjałów elektrochemicznych metali
3.1. Zbudować półogniwa
Cu | Cu2+(1 M) Pb | Pb2+ (1 M)
Zn | Zn2+ (1 M) C | Fe3+, Fe2+ (0,5 M)
Sn | Sn2+ (1 M) C | I2 , I- (1 M)
Uwaga! Półogniwa miedziowe i cynkowe przygotowuje każda dwuosobowa grupa, do wykorzystania w doświadczeniu 3.2 i 3.3. Pozostałe półogniwa należy sporządzić w jednym egzemplarzu do wykorzystania przez wszystkie grupy w doświadczeniu 3.3 (celem zmniejszenia zużycia odczynników).
W celu zbudowania półogniw należy do zlewek wlać roztwory odpowiednich soli o stężeniu 1 M, w takiej ilości, aby po połączeniu półogniw kluczem elektrolitycznym, klucz był zanurzony na około 0,5 cm. Dla otrzymania półogniwa C|Fe3+,Fe2+ (0,5M) należy zmieszać, w proporcji 1:1, roztwory Fe2(SO4)3 (0,5 M) i FeSO4 (1 M). Klucz elektrolityczny napełnić nasyconym roztworem KNO3 i zamknąć gumowym smoczkiem. Przed każdym pomiarem końce klucza przemyć wodą destylowaną i osuszyć bibułą. Przygotować elektrodę przez dokładne oczyszczenie papierem ściernym, przemycie wodą destylowaną i osuszenie bibułą. Tak przygotowane elektrody zanurzyć w roztworach swoich soli.
3.2. Sprawdzenie znaków elektrod ogniwa Zn | Zn2+ || Cu2+ | Cu
Półogniwa połącz kluczem elektrolitycznym. Do elektrod przymocuj przewody zaopatrzone w „krokodylki”. Umieść na szkiełku zegarkowym złożony sączek bibułowy nasączony roztworem KNO3 z dodatkiem fenoloftaleiny. Na zwilżonej bibule zaciśnij w odległości 0.5 - 1 cm „krokodylki” przewodów połączonych z badanym ogniwem i pozostaw układ na ok. 15 min.
Zaobserwuj zmianę barwy wskaźnika pod ząbkami „krokodylków”. Na podstawie obserwacji poczynionych w ćw. 1 określ, która elektroda jest ujemnym biegunem ogniwa.
Pomiar SEM ogniw.
Elektrody ogniwa Zn | Zn2+ || Cu2+ | Cu połączyć z końcówkami woltomierza, w taki sposób, aby woltomierz wskazywał wartość dodatnią.
Uwaga! Ustalonego dla tego ogniwa połączenia półogniwa
Cu | Cu2+(1M) z woltomierzem nie należy zmieniać we wszystkich pozostałych pomiarach SEM (w dośw. 3.3, 3.4 i 4)
Zmierzyć kolejno SEM ogniw zbudowanych z półogniwa Cu | Cu2+ połączonego kluczem elektrolitycznym z jednym z pozostałych półogniw (wymienionych w punkcie 3.1). Zanotować wartości SEM ogniw, zaznaczyć, które półogniwo jest biegunem dodatnim w każdym z ogniw.
Jeżeli wartość odczytana na woltomierzu jest dodatnia, to oznacza, że biegunem dodatnim jest półogniwo Cu | Cu2+. Jeżeli zaś woltomierz wskazuje wartość ujemną, to oznacza, że półogniwo Cu | Cu2+ jest biegunem ujemnym; wtedy, w schemacie ogniwa, półogniwo to należy zapisać z lewej strony, a dla SEM należy zapisać wartość dodatnią.
Wyniki zestawić w tabelce:
schemat ogniwa* |
SEM ogniwa |
reakcja ogniwa pracującego |
|
|
|
* Zapisać według konwencji sztokholmskiej - z prawej strony półogniwo dodatnie.
Sprawdzić i zanotować, czy SEM ogniwa zależy od głębokości zanurzenia elektrod w roztworze.
Uwaga! SEM ogniwa jest różnicą potencjałów między końcówkami ogniwa otwartego (niepracującego), w którym na elektrodach nie biegną reakcje. Wartość napięcia - najbliższą rzeczywistej wartości SEM ogniwa - woltomierz wskazuje w pierwszej chwili po zamknięciu obwodu. W trakcie pracy ogniwa wartość ta maleje w wyniku zachodzących zmian stężenia i reakcji chemicznych.
Wyznaczenie potencjału standardowego półogniwa Cu | Cu2+
Zmierzyć SEM ogniwa zbudowanego z półogniwa Cu | Cu2+ (1M) i elektrody odniesienia (elektroda kalomelowa w nasyconym roztworze KCl). Zanotować, która elektroda jest dodatnim biegunem ogniwa. Przyjmując, że potencjał standardowy elektrody kalomelowej wynosi +0,244 V i korzystając ze wzoru SEM = Eoprawego - Eolewego obliczyć potencjał standardowy elektrody Cu | Cu2+ .
Z kolei obliczoną wartość Eo (Cu2+/Cu) wykorzystać do obliczenia standardowych potencjałów pozostałych półogniw. Obliczone wartości zestawić w tabelce i porównać z danymi tablicowymi.
Ogniwa stężeniowe
Przygotować po 100 cm3 roztworów CuSO4 o dwóch różnych stężeniach:
1 M i i 0,25 M (roztwór 0,25 M sporządzić przez czterokrotne rozcieńczenie roztworu 1M).
Zmierzyć SEM ogniwa zbudowanego z półogniwa Cu | Cu2+ (1 M) oraz z półogniwa Cu | Cu2+(0,25 M).
Jak można wytłumaczyć różną od 0 wartość SEM w tym ogniwie?
Ćwiczenie 21
kinetyka chemiczna
Cel ćwiczenia. Poznanie praw kinetyki, sposobu wyznaczania szybkości reakcji, rzędów reak cji i wyprowadzania równania kinetycznego.
Zakres materiału. Kinetyka chemiczna i kataliza, kwasy tlenowe siarki (struktura, nazewnictwo, stopnie utlenienia siarki).
Literatura. L. Jones, P. Atkins, „Chemia ogólna”, PWN Warszawa 2004, Rozdz. 13.1 - 13.4 str. 599 - 610.
M. J. Sienko, R. A. Plane, "Chemia. Podstawy i zastosowanie", WNT Warszawa, 1999, Rozdz. 12.2.
__________________________________________________________________
*** W ćwiczeniu badamy kinetykę reakcji utlenienia jonu jodkowego nadtlenodisiarczanem :
S2O82− + 2I− → 2 SO42− + I2 (1)
Reakcję prowadzimy w obecności skrobi, która pod wpływem powstającego jodu zabarwia się granatowo.
Jod można zredukować tiosiarczanem sodu wg reakcji : I2 + 2S2O32− → S4O62− + 2I− (2)
Jeżeli reakcję (1) prowadzić w obecności stechiometrycznej ilości tiosiarczanu sodu, skrobia nie zabarwia się, ponieważ zachodzą dwa procesy:
a) powstawanie I2 - reakcja (1)
b) natychmiastowa redukcja I2 - reakcja (2)
Jeżeli reakcję (1) prowadzić w obecności niedomiaru tiosiarczanu, skrobia zabarwi się dopiero po pewnym czasie od chwili zmieszania reagentów, ponieważ:
a) bezpośrednio po zmieszaniu zachodzą obydwie reakcje - (1) i (2),
b) po wyczerpaniu tiosiarczanu zachodzi tylko reakcja (1), roztwór natychmiast zabarwia się granatowo.
Moment pojawienia się zabarwienia jest miarą czasu, jaki upłynął od chwili rozpoczęcia reakcji S2O82− z I− do chwili, w której ilość produktu tej reakcji, I2, zrównoważy ilość dodanego tiosiarczanu.
Wprowadzenie ściśle określonej i niewielkiej ilości tiosiarczanu sodu pozwala zmierzyć początkową szybkość reakcji (1):
Δ [I2] Δ [S2O32−]
v = ___ = _____
Δτ 2Δτ
Δ [I2] - przyrost stężenia produktu
Δ [S2O32−] - zmiana stężenia jonów tiosiarczanowych od stężenia
początkowego do zera
Δτ - czas, jaki upłynął od chwili zmieszania roztworów do
momentu pojawienia się granatowego zabarwienia .
_______________________________________________________________
Wykonanie ćwiczenia
Do suchej zlewki odmierzyć, za pomocą suchych lub przemytych odmierzanym roztworem pipet, odpowiednie ilości (według tabelki) 0,2 M roztworu KI (zawierającego skrobię) i 0,2 M Na2SO4 (lub KNO3) oraz 10 cm3 0,01 M roztworu Na2S2O3. Do drugiej zlewki odmierzyć odpowiednią ilość 0,2 M roztworu Na2S2O8. Następnie roztwór Na2S2O8 szybko wlać do zlewki zawierającej roztwór KI + Na2S2O3 i włączyć stoper. Roztwór mieszać energicznie bagietką. Z chwilą pojawienia się niebieskiego zabarwienia zatrzymać stoper.
1. Zależność szybkości reakcji od stężenia nadtlenodisiarczanu
Należy wykonać sześć pomiarów w stałej temperaturze, stałej objętości całkowitej roztworu (50 cm3), stałych stężeniach początkowych KI i Na2S2O3 i zmiennych stężeniach początkowych Na2S2O8 We wszystkich przypadkach należy dodać ponadto odpowiednią ilość Na2SO4 dla zachowania stałej mocy jonowej roztworu..
objętości roztworów [cm3]
Pomiar nr |
KI 0,2 M |
Na2S2O3 0,01 M |
Na2SO4 0,2 M |
Na2S2O8 0,2 M |
|||||
1 2 3 4 5 6 |
20 20 20 20 20 20 |
10 10 10 10 10 10 |
15 10 7,5 5 2,5 0 |
5 10 12,5 15 17,5 20 |
2. Zależność szybkości reakcji od stężenia jodku potasu.
Należy wykonać sześć pomiarów w stałej temperaturze, stałej objętości całkowitej roztworu (50 cm3), stałych stężeniach początkowych Na2S2O8 i Na2S2O3 i zmiennych stężeniach początkowych KI. We wszystkich przypadkach należy dodać ponadto odpowiednią ilość KNO3 dla zachowania stałej mocy jonowej roztworu..
Objętości roztworów [cm3]
pomiar nr |
KI 0,2M |
Na2S2O3 0,01M |
KNO3 0,2 M |
Na2S2O8 0,2 M |
1 2 3 4 5 6 |
5 10 12,5 15 17,5 20 |
10 10 10 10 10 10 |
15 10 7,5 5 2,5 0 |
20 20 20 20 20 20 |
Wyniki eksperymentalne zestawić wg poniższych schematów:
Ćwiczenie 1.
temperatura ..................
całkowita objętość roztworu ..................
stężenie początkowe KI ..................
stężenie początkowe Na2S2O3 (cT) ..................
wzrost stężenia jodu Δ [I2] = cT/2 ..................
pomiar nr |
objętość Na2S2O8 [cm3] |
stęż. pocz. Na2S2O8 (cA) [mol/dm3] |
czas reakcji Δτ [s] |
szybkość po- czątkowa (v) [mol/(dm3 •s)] |
k'1=v/ cA |
log cA |
log v |
|
|
|
|
|
|
|
|
Ćwiczenie 2.
temperatura ...................
całkowita objętość roztworu ...................
stężenie początkowe Na2S2O8 ...................
stężenie początkowe Na2S2O3 (cT) ...................
wzrost stężenia jodu Δ [I2] = cT/2 . ...................
pomiar nr |
objętość KI [cm3] |
stęż.pocz. KI (cB) [mol/dm3] |
czas reakcji Δτ [s] |
szybkość po- czątkowa (v) [mol/(dm3 •s)] |
k′2= v/cB |
log cB |
log v |
|
|
|
|
|
|
|
|
Opracowanie wyników.
Szybkość badanej reakcji określona jest równaniem:
v = k • [S2O82−]a • [I−]b
Na podstawie wyników uzyskanych w doświadczeniu 1 i 2 należy wyznaczyć graficznie rząd reakcji, czyli wykładniki potęgowe a i b w powyższym równaniu oraz stałą szybkości reakcji k.
Zależność badana w ćwiczeniu 1 opisana jest wzorem:
v = k′1* [S2O82−]a , gdzie k′1 = k • [I−]b = const ,
po zlogarytmowaniu: log v = log k′1+ a • log [S2O82−]
Na papierze milimetrowym należy sporządzić wykres zależności log v (oś rzędnych) od log [S2O82−] (oś odciętych). Z wykresu obliczyć a (tangens kąta nachylenia prostej) oraz wyznaczyć wartość log k′1 (punkt przecięcia wykresu z osią rzędnych).
Analogicznie na podstawie wyników uzyskanych w ćwiczeniu 2 sporządzić wykres zależności log v (oś rzędnych) od log [I−] (oś odciętych) i wyznaczyć graficznie wartości wykładnika b i log k′2. Zależność badana w ćwiczeniu 2 dana jest wzorem:
v = k′2 • [I−]b, gdzie k′2 = k • [S2O82−]a = const,
po zlogarytmowaniu: log v = log k′2 + b • log[I−]
Znając a i b (zaokrąglone wartości odczytane z wykresów) oraz początkowe stężenie jodku (doświadczenie 1) i nadtlenodisiarczanu (doświadczenie 2) z wartości log k′1 i log k′2 obliczyć stałą szybkości reakcji k (k = k′1/[I−]b = k′2/[ S2O82−]a).
Jaki jest rząd badanej reakcji względem nadtlenodisiarczanu i względem jodku?
Ćwiczenie 22
zwiĄzki kompleksowe
Cel ćwiczenia. Przeprowadzenie szeregu reakcji chemicznych w celu: otrzymania różnego typu związków kompleksowych, obserwacji związków kompleksowych w reakcjach wymiany, zbadania trwałości związków kompleksowych.
Zakres materiału. Związki kompleksowe: definicja, własności, budowa przestrzenna, nomenklatura. Równowaga w roztworach związków kompleksowych. Stała trwałości, stała nietrwałości, chelaty.
Literatura. A. Bielański, "Chemia ogólna i nieorganiczna", rozdz.10.1, 10.3, 10.5, L.Pajdowski, "Chemia ogólna", rozdz. 19.2.
Związki o kationie kompleksowym
1.1. Kompleksowanie wodorotlenku niklu(II)
Wytrącić osad wodorotlenku niklu(II), dodając do roztworu siarczanu niklu(II) taką samą objętość zasady sodowej. Osad odwirować i pipetą usunąć ciecz znad osadu. Do osadu dodać stężony roztwór amoniaku.
Porównać barwę jonów Ni2+ w roztworze siarczanu niklu(II) z barwą otrzymanego roztworu. Napisać równania przeprowadzonych reakcji (l.k. Ni2+ = 6).
1.2. Siarczan tetraaminamiedzi(II)
Do kilku kropli roztworu siarczanu miedzi(II) dodać stężonego roztworu amoniaku aż do całkowitego rozpuszczenia wytrącającego się początkowo osadu soli miedzi. Zanotować barwę roztworu, spowodowaną powstaniem kompleksowego jonu tetraaminamiedzi(II). Do roztworu dodać etanolu. Obserwować strącanie się osadu kompleksu.
Napisać równania reakcji powstawania i dysocjacji otrzymanego kompleksu.
1.3. Akwakompleksy kobaltu(II)
Małą ilość stałego CoCl26H2O rozpuścić osobno w wodzie destylowanej i etanolu. Zwrócić uwagę na różnicę zabarwienia roztworu wodnego i alkoholowego.
Podać wzór koordynacyjny CoCl26H2O (chlorek heksaakwakobaltu(II)), biorąc pod uwagę, że wszystkie cząsteczki wody wchodzą do wewnętrznej sfery koordynacyjnej. Podać równanie dysocjacji tej soli. Jakie jony powodują barwę wodnego roztworu tej soli?
W obecności etanolu liczba koordynacji jonu Co2+ ulega zmianie (jon kompleksowy traci dwie cząsteczki wody). Napisać równanie tej reakcji.
1.4. Hydroliza akwakompleksów
W czterech probówkach sporządzić roztwory następujących soli: Cu(NO3)2, Zn(NO3)2, Fe(NO3)3, Cr(NO3)3, przez rozpuszczenie stałych hydratów soli w wodzie. Za pomocą papierka uniwersalnego zmierzyć pH sporządzonych roztworów.
Zapisać barwy i wzory stałych hydratów oraz barwy i wzory akwajonów obecnych w wodnych roztworach powyższych soli (l.k. = 6, dla Zn2+ l.k. = 4).
Na wybranym przykładzie przedstawić równowagi istniejące w tych roztworach.
Związki o anionie kompleksowym
2.1. Hydroksokompleksy
Do probówek z roztworami soli z dośw. 1.4. dodać 2 M roztworu NaOH, aż do odczynu słabo alkalicznego. Zanotować barwy osadów. Następnie dodawać 6 M roztwór NaOH, aż przestaną zachodzić zmiany.
Które z badanych jonów tworzą hydroksokompleksy? Napisz wzory koordynacyjne otrzymanych hydroksokompleksów, zakładając liczbę koordynacji 4. Na wybranym przykładzie soli metalu o własnościach amfoterycznych napisz równania reakcji zachodzących po dodaniu zasady.
2.2. Tetrajodobizmutan(III) potasu
Do kilku kropli roztworu azotanu bizmutu(III) dodać kroplami roztwór jodku potasowego, aż do wytrącenia się osadu jodku bizmutu(III). Osad rozpuścić w małym nadmiarze jodku potasowego.
Zapisać barwy osadu i roztworu. Napisać równania reakcji.
Wiedząc, że skład otrzymanego związku kompleksowego wyraża się wzorem KIBiI3, podać jego wzór koordynacyjny.
2.3. Ditiosiarczanosrebrzan(I) sodu
Do kilku kropli roztworu azotanu srebra szybko dodać nadmiar tiosiarczanu sodowego aż do rozpuszczenia, wytrącającego się początkowo, osadu tiosiarczanu srebrowego.
Napisać równania reakcji tworzenia się tiosiarczanu srebra i kompleksowego związku srebra (liczba koordynacji Ag+ = 2).
3. Związki zawierające kation i anion kompleksowy
Do kilku kropli roztworu K4[Fe(CN)6] (heksacyjanożelazian(II) potasu) dodać kilka kropli roztworu siarczanu niklu(II). Do otrzymanego osadu heksacyjanożelazianu(II) niklu(II) dodawać stężonego amoniaku do rozpuszczenia osadu. Zaobserwować strącanie kryształów kompleksu.
4. Związki kompleksowe w reakcjach wymiany
4.1. Do roztworu siarczanu miedzi(II) dodać taką samą objętość roztworu K4[Fe(CN)6].
Podać równanie reakcji, barwę produktu oraz jego nazwę.
4.2. Otrzymać roztwór tetratiocyjanianortęcianu(II) amonu, dodając nasycony roztwór tiocyjanianu amonu (NH4SCN) do roztworu azotanu rtęci(II), aż do rozpuszczenia wytrącającego się początkowo osadu tiocyjanianu rtęci. Do otrzymanego roztworu związku kompleksowego dodać taką samą objętość roztworu azotanu kobaltu(II). Wstrząsnąć probówką.
Zwrócić uwagę na zabarwienie tworzącego się osadu tetratiocyjaniano-rtęcianu(II) kobaltu(II). Napisać równania reakcji (l.k. Hg2+ = 4).
5. Badanie trwałości związków kompleksowych. Rozpad kompleksów
5.1. Porównanie trwałości związków kompleksowych
W dwóch probówkach wytrącić chlorek srebra(I), wprowadzając roztwór azotanu srebra do takiej samej objętości roztworu chlorku sodowego. Do pierwszej probówki dodać 3 objętości 1 M roztworu amoniaku. W drugiej rozpuścić osad chlorku srebra, dodając 3 objętości 1 M roztworu tiosiarczanu sodu. Do obu probówek dodać po kilka kropli roztworu jodku potasowego i lekko wstrząsnąć. W której probówce wytrąca się osad jodku srebra(I), nieznikający w trakcie wstrząsania?
Podać równania reakcji chlorku srebra z amoniakiem i tiosiarczanem sodu (l.k. Ag+ = 2), w których otrzymuje się odpowiednie związki kompleksowe, podać równania ich dysocjacji. Wyjaśnić powstawanie osadu jodku srebra w jednej z probówek, opierając się na równaniu dysocjacji odpowiedniego jonu kompleksowego i prawie iloczynu rozpuszczalności. Dlaczego w drugiej probówce osad się nie wytrącił?
Który z otrzymanych kompleksów jest bardziej trwały? Napisać wyrażenie na stałe trwałości obu kompleksów. Która z nich jest mniejsza?
5.2. Rozkład kompleksu przez wytrącenie jonu kompleksotwórczego
Do dwóch probówek wprowadzić roztwór siarczanu miedziowego, do pierwszej dodać roztwór szczawianu amonu, do drugiej — siarczku amonu. Probówki zachować jako wzorcowe (porównawcze).
Napisać równania reakcji.
W dwóch probówkach otrzymać kompleksowy związek miedzi(II), dodając 1 M roztwór amoniaku do roztworu siarczanu miedzi(II), aż do rozpuszczenia, wytrącającego się początkowo, osadu soli miedzi. Zbadać działanie szczawianu amonu i siarczku amonu na otrzymany roztwór kompleksu miedzi(II).
Który odczynnik powoduje wytrącenie osadu? Opisać i wyjaśnić obserwowane zjawiska. Podać równania przeprowadzonych reakcji, równanie dysocjacji elektrolitycznej kompleksowej soli miedzi oraz równanie dysocjacji kationu kompleksowego.
6. Wymiana liganda w jonie kompleksowym
Do pięciu kropli 0,5 M roztworu Fe(NO3)3 dodać 3 krople stężonego HCl, a następnie 1 kroplę 2 M roztworu KSCN, po czym 10 kropli 2 M roztworu KF. Obserwować zmiany barwy zachodzące podczas dodawania kolejnych odczynników.
Przyjmując, że liczba koordynacji jonów Fe3+ w kompleksach z anionami fluorowców wynosi 4, a w kompleksie tiocyjanianowym 6, podać równania zachodzących reakcji. Uszeregować ligandy według malejącej tendencji do tworzenia kompleksów z jonem Fe(III).
Ćwiczenie 6
Rozdzielanie i oczyszczanie substancji. Chromatografia.
Cel ćwiczenia. Zastosowanie chromatografii bibułowej do rozdziału i identyfikacji jonów metali.
Zakres materiału naukowego. Podstawy chromatografii rozdzielczej. Reakcje charakterystyczne.
Literatura. "Preparatyka organiczna" pod redakcją Bochwica PWN W-wa 1975, str. 86-87; dowolny podręcznik analizy jakościowej.
Rozdział na drodze chromatograficznej jonów:
Cu2+, Ni2+, Co2+ oraz Fe3+
Chromatografia obejmuje wiele technik i metod rozdziału, których wspólną cechą jest występowanie dwóch faz: stacjonarnej i ruchomej. Faza stacjonarna, którą może stanowić Al2O3, SiO2, bibuła (substancje o silnie rozwiniętej powierzchni), adsorbuje jony lub cząsteczki rozdzielanej substancji. Przez fazę stacjonarną przepływa w sposób ciągły faza ruchoma (eluent) wymywając składniki rozdzielanej substancji. Różne powinowactwo poszczególnych składników do fazy stacjonarnej sprawia, że wędrują one z różną szybkością wraz z przepływającym rozpuszczalnikiem, co prowadzi do rozdziału.
1.1. Rozdział metodą wstępującą
Na pasek bibuły chromatograficznej o wymiarach dopasowanych do wielkości komory chromatograficznej (cylinder z korkiem) nanieść w odległości 5 cm od końca roztwór zawierający jony Cu2+, Ni2+, Co2+, Fe3+. Roztwór nanosić kilkakrotnie przy użyciu kapilarki, susząc bibułę za każdym razem. Średnica plamki naniesionego roztworu nie powinna być większa od 5 mm. Ołówkiem zaznaczyć miejsce naniesienia roztworu. Do cylindra nalać eluentu, którym jest mieszanina acetonu, stężonego kwasu solnego i wody, do wysokości ok. 1,5 cm. Cylinder zamknąć korkiem z zawieszonym paskiem bibuły. Miejsce naniesienia rozdzielanej próbki powinno się znajdować nad powierzchnią eluentu. Rozwijanie chromatogramu zakończyć, gdy czoło rozpuszczalnika zbliży się do miejsca zawieszenia bibuły. Wyjąć wówczas pasek bibuły z komory, szybko zaznaczyć ołówkiem czoło rozpuszczalnika i pasek wysuszyć. Następnie nasycić chromatogram parami amoniaku. W tym celu umieścić pod wyciągiem duży krystalizator. Do krystalizatora wstawić naczyńko ze stężonym roztworem amoniaku i chromatogram. Całość przykryć szkiełkiem zegarkowym. Po kilku minutach wyjąć chromatogram z krystalizatora, spryskać roztworem dimetyloglioksymu lub kwasu rubeanowodorowego i wysuszyć.
Można również wywołać chromatogram przy użyciu roztworu K4[Fe(CN)6], nie wysycamy go wówczas parami amoniaku.
1.2. Reakcje charakterystyczne
Oddzielnie dla każdego z wymienionych w tytule jonów przeprowadzić na bibule reakcje: a) z amoniakiem b) z amoniakiem i kwasem rubeanowodorowym
c) z amoniakiem i dimetyloglioksymem d) z roztworem K4[Fe(CN)6].
Sporządzona w ten sposób skala barw może być użyta do identyfikacji jonów na chromatogramie, po wywołaniu chromatogramu w odpowiednim odczynniku.
Na chromatogramie otrzymanym metodą wstępującą zmierzyć w mm odległość czoła rozpuszczalnika (A) i środka plamy substancji (B) od punktu startowego. Wyznaczyć dla każdego jonu wartość współczynnika retencji Rf = B/A, który jest wielkością charakterystyczną dla danego związku chemicznego. Uszeregować jony według wzrastającej szybkości ich wędrówki. Zidentyfikować rozdzielone na chromatogramie jony.
1
23
Punkt połowicznego zmiareczkowania (PP)
Punkt równoważnikowy
(PR)
Wyszukiwarka
Podobne podstrony:
Chemia srodowiska egzamin - III rok biologii, chemia środowiska, Dla miszcza
ściąga z analizy instrumentalnej, Chemia Przydatne dla studentów
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
instrukcja - CHEMIA ORGANICZNA I, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratoriu
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
Instrukcja - bomba, Ppoż dla szkoły
INSTRUKCJA?ZPIECZEŃSTWA I HIGIENY PRACY DLA OBSŁUGI WIBRATORA WGŁĘBNEGO ELEKTRYCZNEGO
Ocena środowiska dla turystyki i rekreacji Opracowanie studentów
Chemia i środowisko(2)
Akwakompleksy metali, OŚ, sem II 2 SOWiG, Chemia Środowiska, Seminarium ChŚ
cw 7 wstęp, chemia środowiska
hydroliza polifosforanów, Chemia Przydatne dla studentów
Instrukcje chemia fizyczna
Chemia środowiska
INSTRUKCJA?ZPIECZEŃSTWA I HIGIENY PRACY DLA OBSŁUGI PRASOWALNICY
Chemia środowiska?ŁOŚĆ
Chemia środowiska 4
więcej podobnych podstron