 | Pobierz cały dokument chemia.studia.mbm.chemia.doc Rozmiar 560 KB |
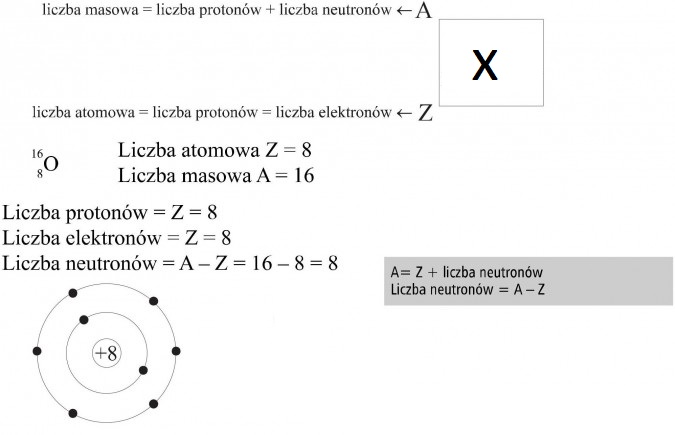
1. BUDOWA ATOMU
2. IZOTOPY WODORU
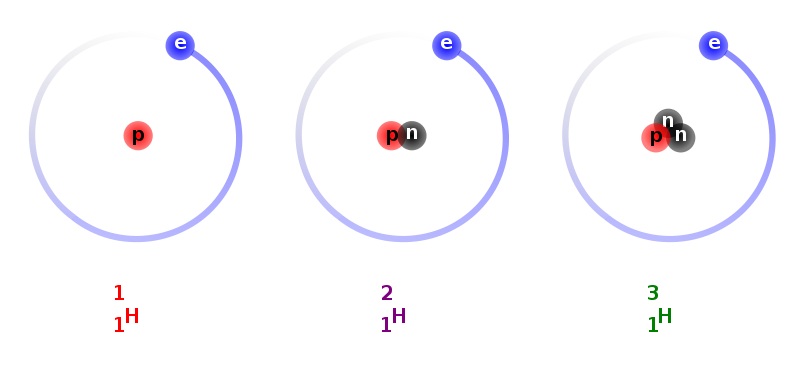
IZOTOPY - atomy mające jądra o jednakowej liczbie atomowej , a różniące się liczbą masową - RÓŻNIĄ SIĘ LICZĄ NEUTRONÓW. odmiany pierwiastka chemicznego różniące się liczbą neutronów w jądrze atomu
Wodór-1 (prot) - Wodór-2 (deuter) - Wodór-3 (tryt)
3. KONFIGURACJA ELEKTRONOWA
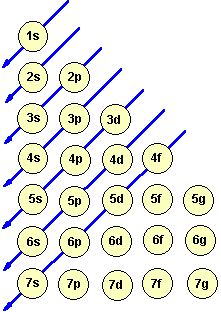
PRZYKŁAD: neon: 1s22s22p6
4. WIĄZANIA:
W tworzeniu wiązania chemicznego biorą udział elektrony znajdujące się na ostatniej powłoce elektronowej pierwiastka i dążą do ośmio-elektoronowej powłoki- takiej jak w gazach szlachetnych - reguła oktetu. Dużą rolę w tworzeniu wiązań ma elektroujemność.
wiązanie jonowe
Wiązanie jonowe - powstaje między atomami, które znacznie różnią się elektroujemnością (różnica elektroujemności jest większa od 1,4). Atomy jednego pierwiastka (określonego jako elektrododatni) tracą swoje elektrony walencyjne na rzecz atomów drugiego z pierwiastków (elektroujemnego). Utworzone w taki sposób jony, dodatni i ujemny, przyciągają się dzięki działaniu sił elektrostatycznych.
Wiązanie atomowe, kowalencyjne - spotykane jest dosyć rzadko. Powstaje ono między atomami tego samego pierwiastka i jest wiązaniem apolarnym. Najczęściej spotykane jest w pierwiastkach występujących w stanie gazowym, np. Cl2, O2, N2 czy I2. W takim przypadku atomy uzyskują konfigurację gazu szlachetnego poprzez utworzenie jednej lub więcej wspólnych par elektronowych, które wchodzą jednocześnie w układy elektronowe obu łączących się atomów. Każdy z nich dostarcza tej samej liczby elektronów.
Wiązanie kowalencyjne spolaryzowane - różni się od wiązania atomowego tym, że tworzą je atomy różnych pierwiastków (których różnica elektroujemności nie jest duża; wynosi od 0,4 do 1,4). W tym przypadku para elektronowa, która łączy atomy, jest przesunięta w kierunku atomu pierwiastka o większej elektroujemności. W wyniku tego przesunięcia tworzy się układ dipolowy i zatracona zostaje równowaga elektryczna. Jeden atom zyskuje ładunek δ+, natomiast drugi δ-.Jako całość cząsteczka jest nadal elektrycznie obojętna, ale w wyniku tego przesunięcia niektóre jej miejsca są w większym stopniu podatne na reakcje chemiczne.
Wiązanie wodorowe - oddziaływanie to jest dosyć słabe i występuje między atomem wodoru przyłączonym do atomu pierwiastka o dużej elektroujemności, (np. fluor, azot lub tlen)
 | Pobierz cały dokument chemia.studia.mbm.chemia.doc rozmiar 560 KB |