 | Pobierz cały dokument sprawko.29a.studia.bio.2rok.chemia.fizyczna.doc Rozmiar 585 KB |
Nina Zarucka
Technologia chemiczna
Wydział Chemiczny
Ćwiczenie nr 29a
Kinetyka konwersji błękitu bromofenolowego.
Ćwiczenie wykonano: 24.03.2003 r.
Sprawozdanie oddano:31.03.2003 r.
Część teoretyczna
Stałą szybkości reakcji nazywamy współczynnik proporcjonalności k w równaniu kinetycznym.
![]()
Energią aktywacji nazywamy minimum energii, jaką powinny być obdarzone cząsteczki, aby mogły przereagować. Można ją obliczyć na podstawie równania Arrheniusa:
![]()
A - współczynnik częstotliwości
Energię aktywacji można również obliczyć znając dwie stałe szybkości danej reakcji w dwóch różnych temperaturach ze wzoru:
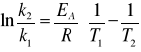
Celem ćwiczenia jest wyznaczenie stałej szybkości oraz energii aktywacji przegrupowania monoanionu błękitu trójfenolowego (II) w bezbarwny trójanion (III). Reakcja zachodzi w środowisku silnie alkalicznym w roztworze NaOH według schematu:
W miarę zwiększania pH zachodzi zmiana w strukturze cząsteczki barwnika. Ponieważ reakcja zachodzi przy dużym nadmiarze (≈ 105) NaOH można ją opisać równaniem kinetycznym I rzędu. Badana reakcja jest procesem odwracalnym przy czy stała równowagi K = k1/k2 =2,5.103 Ze względu na tak silne przesunięcie stanu równowagi możemy uznać reakcję za nieodwracalną.
2. Opis wykonywanych czynności
Zapoznałam się z instrukcja obsługi spektrometru
Przygotowałam roztwory NaOH o stężeniach 2 M, 1 M, 0,5 M
Pobrałam 0,5 ml roztworu podstawowego(błękit bromofenolowy rozpuszczony w wodzie destylowanej), rozcieńczyłam za pomocą roztworu NaOH(2 M)do objętości 10 cm3 i wymieszałam. Następnie pobrałam roztwór do kuwety i zmierzyłam absorbancję przy λ=592 nm. Wykonałam szereg pomiarów w odstępach 2 min.
Identycznie postąpiłam rozcieńczając roztwór podstawowy roztworem NaOH o stężeniu 1 M i 0,5 M
Dla stężenia 0,5 M NaOH wykonałam pomiar w temperaturze 41,5 0C.
Przygotowałam 90 ml 0,5 M roztworu NaOH w kolbie 100 ml i umieściłam w termostacie.
Po ok. 20 min dodałam 2 ml roztworu podstawowego i dopełniłam do kreski roztworem NaOH
Pobierałam w odstępach 2 min roztwór do kuwety i mierzyłam absorbancję.
Wyniki zapisałam w tabeli