Jonofory
Niektóre mikroorganizmy mogą wytwarzać związki, pod wpływem których błony stają się przepuszczalne dla określonych jonów. Te małe, hydrofobowe cząsteczki, zwane antybiotykami jonoforowymi funkcjonują na zasadzie ruchu posuwisto-zwrotnego w celu transportowania jonów przez błonę. [1,2] Ruch ten jest jednokierunkowy, cyklicznej zmianie ulega tylko zwrot. Związki te skłonne są do wiązania różnych cząsteczek lub jonów w aktywnych częściach swojej struktury na zasadzie tworzenia kompleksów typu gość - gospodarz. Zdolność do wiązania z receptorem uwarunkowana jest powinowactwem, cząsteczki wiążącej a związanego jonu i aktywnością wewnętrzną. Umiejętność tworzenia kompleksu zależy od stopnia dopasowania struktury cząsteczki związku (gościa) oraz miejsca aktywnego kompleksującego receptor (gospodarza).[3] W swojej strukturze jonofory posiadają centra elektrodonorowe, które kompleksują określone jony. Zewnętrzna część cząsteczki jest hydrofobowa, dzięki czemu cząsteczki dobrze rozpuszczają się w błonach i mogą przez nie dyfundować. Jonofory działają jako przenośniki, albo jako elementy tworzące kanał dla jonów Na+, K+ czy Ca2+. Jako przenośniki wiążą jon po jednej stronie przenoszą go na drugą stronę. [1-3]
Powinowactwo antybiotyków jonoforowych w stosunku do koordynowanych jonów może wynikać z zarówno ich trójwymiarowej struktury, jak również różnicy pomiędzy energią desolwatacji jonu a jego skompleksowaniem. Czynnikami wpływającymi na selektywność jonoforów są w szczególności:
rozmiar wnęki,
lipofilowość powierzchni,
wiązania wodorowe utrzymujące strukturę,
Istotną rolę w procesie selektywnego rozpoznania molekularnego odgrywa także pH środowiska, siła jonowa oraz rodzaj rozpuszczalnika. [4,5]
Mechanizm transportu kationów
Mechanizm działania jonoforów typu przenośnikowego polega na tworzeniu wiązań koordynacyjnych pomiędzy jonem metalu i kilkoma atomami tlenu, które tworzą wnękę. Centralnie umieszczone atomy tlenu oraz grupy węglowodorowe, umieszczone na obwodzie przenośnika, pełnią istotną rolę podczas transportowania jonów.
Tworzy się kompleks jon-przenośnik (gość - gospodarz), rozpuszczalny w lipidowym wnętrzu błony. Umożliwia to przepływ jonów przez błonę i uwolnienie ich po drugiej stronie. [6]
Rysunek 1. Mechanizm działania jonoforów. Jonofor (oznaczony kolorem zielonym) kompleksuje kation metalu (czerwony) i przenosi na drugą stronę błony komórkowej.
Klasyfikacja jonoforów
Jonofory są grupą związków, która jak dotąd, nie posada jednolitego systemu klasyfikacji. Podział ułatwia uwzględnienie takich kryteriów: pochodzenie, budowa chemiczna, metody transportu, selektywność wobec kompleksowanych jonów. Najprościej antybiotyki jonoforowe można podzielić, ze względu ich pochodzenie na syntetyczne i naturalne.
Schemat 1. Podział jonoforów
Neutralne jonofory
W tej grupie związków wyróznia się zarówno jonofory cykliczne jak i niecykliczne. W tym przypadku antybiotyk jonoforowy jest cząsteczką nie posiadającą ładunku - neutralną, dlatego też uzyskuje on ładunek kompleksowanego jonu. [7,8]
Transport kationów jednowartościowych przez błony, przy użyciu jonoforów neutralnych przedstawia się następująco :
Rysunek 2. Schemat transportu jonów przez jonofory neutralne
Jonofor wewnątrz błony (a) dyfunduje do granicy faz (b) gdzie napotyka na jon. Gdy kation znajduje się w odpowiednim położeniu by oddziaływać z jonoforem (c), solwatująca jon cząsteczka wody jest oddalana i zastępowana przez kompleksujące atomy tlenu (d). Stabilny kompleks M+I przechodzi z granicy faz do wnętrza błony, gdzie zachodzą procesy f-h, odwrotne do procesów b-d. Ostatecznie pusty jonofor dyfunduje do przestrzeni międzykomórkowej (i) przywracając początkowe warunki procesu (a).[8]
Walinomycyna
Walinomycyna jest cyklicznym, neutralnym antybiotykiem jonoforowym, należącym do szerokiej klasy depsipeptydów - związków antybakteryjnych, które zmieniają funkcje i integralność dwuwarstwy lipidowej.
Jonofor jest 12 członowym cyklicznym dodekadepsipeptydem, składającym się z powtarzalnych trzech jednostek tworzących pierścień.
Rysunek 3. Cząsteczka walinomycyny
Ich wzór może być zapisany jako cyklo-(D-walina, L-Lac,L-walina, D-Hyv)3, gdzie Lac oznacza kwas mlekowy, natomiast Hyv - kwas hydroksyizowalerianowy. Walinomycyna została wyizolowana ze szczepu bakterii Streptomyces fulvissimus przez Brockmanna i Schmidta-Kastnera, w 1955 roku. [9-11]
Rysunek 4. Powtarzająca się jednostka walinomycyny: (A) L-mleczan, (B) L-walina,
(C) D-hydroksyizowalerianian, (D) D-walina
Prostota molekularnej struktury walinomycny pozwoliła na wykorzystanie cząsteczki jako modelu do opisania selektywnego transportu kationów jedno- jak i dwuwartościowych przez błony biologiczne. Kompleks jonoforu z kationem metalu jest bardzo stabilny. Walinomycyna odgrywa bardzo ważną rolę. Jej działanie zwiększa przepuszczalność membrany dla jonów potasu. [10,11]
Selektywność w stosunku do kationów metali jednowartościowych jest następująca: Rb+>K+>Cs+>Ag+>NH4+>Na+>Li+. [3] Dla jonów dwuwartościowych: Ba2+ > Ca2+ > Sr2+ > Mg2+.
Podczas kompleksowania, K+, walinomycyna przyjmuje konformacje „szwu piłki tenisowej” i „owija” się wokół kationu. Kompleksowanie kationu następuje przy pomocy atomów tlenu, pochodzących z grup karbonylowych cząsteczek waliny. Podczas kompleksowania kationu zostają również utworzone wewnątrzcząsteczkowe wiązania wodorowe między amidowymi atomami wodoru. Cały kompleks tworzy strukturę rozpuszczalną w błonach, która może transportować kation. [10,11]
Rysunek 5. Schemat kompleksu walinomycyny z K+
Konformacja walinomycyny silnie zależy od rodzaju rozpuszczalnika. Badania rentgenograficzne wykazały, że jonofor przyjmuje co najmniej trzy rodzaje konformacji:
w rozpuszczalnikach niepolarnych nieskompleksowana walinomycyna - struktura jest stosunkowo sztywna
w rozpuszczalnikach polarnych nieskompleksowana walinomycyna - struktura jest elastyczna
kompleks K+ - struktura stabilna [10,12]
Rysunek 6. Różne strukturalne formy walinomycyny. Struktura krystaliczna w : rozpuszczalniku niepolarnym (A), rozpuszczalniku polarnym (B), kompleksie z potasem (C). Linie przerywane reprezentują wiązania wodorowe.
Walinomycyna wykazuje silną aktywnośc biologiczną, działa przeciwbakteryjnie, przeciwwirusowo , przeciwnowotworowo i przeciwgrzybiczno. Jednak ze względu na wysoką toksyczność jej zastosowanie jest ograniczone. Jonofor znalazł zastosowanie w elektrodach jonoselektywnych do wykrywania jonów potasu.
Naturalne jonofory tworzące kanał
Błony biologiczne stanowią dynamiczne, złożone jednostki, których struktura i funkcja są ściśle związane ze środowiskiem zewnętrznym. Podstawową właściwością błon jest grubość warstwy hydrofobowej, która ma ogromny wpływ na białka trans - błonowe. [13,14]
Kanały mogą ulegać zmianom związanym z konformacją, zwijaniem i aktywnością. Prowadzić do tego mogą: hydrofobowe niedopasowanie, różnica w długości hydrofobowych białek transbłonowych i sąsiednich pierścieni lipidów. [15-17] W wyniku zmian konformacyjnych w dwuwarstwie lipidowej powstaje kanał, który zależy od stopnia niedopasowania.
Rysunek 7. Jonofor tworzący kanał
Kanały jonowe są białkami, które regulują transbłonową przepuszczalność jonów przez błony komórkowe. Stanowią one ważną klasę cząsteczek ze względu na swoją zdolność do łączenia wnętrza komórki z jej zewnętrzną stroną, w sposób selektywny. [18,19]
Gramicydyna A
Liniowa gramicydyna należy do rodziny jonoforów tworzących kanał. Antybiotyk wytwarzany jest przez glebowe bakterie Bacillus brevis i składa się z 18 naprzemiennie ułożonych L- i D-aminokwasów. Tworzą one dobrze określone, selektywne dla kationów kanały jonowe w błonach komórkowych. [20,21]
Strukturę kanału „głowa” do „głowy” zaproponował Urry, w 1971 roku.[22,23] Wnętrze kanału ma skład [24]:
HCO-L-Val1-Gly2-L-Ala3-D-Leu4-L-Ala5-D-Val6-L-Val7-D-Val8-L-Trp9-D-Leu10-L-Trp1l-D-Leu12-L-Trp13-D-Leu14-L-Trp15-NHCH2CH2OH
Hydrofobowe łańcuchy znajdują się na zewnątrz dimeru, wnętrze natomiast jest hydrofilowe. Gramicydyna wykazuje zależność od środowiska, dlatego też przyjmuje różne konformacje. Szczegółowy mechanizm działania gramicydyny w membranie nie jest znana. [20,21]
Kanał utworzony jest poprzez transbłonową asocjację dwóch jednoniciowych monomerów. Oba peptydy przypominają strukturę β-harmonijki. Forma ta jest stabilizowana przez piętnaście wewnątrzcząsteczkowych i sześć międzycząsteczkowych wiązań wodorowych. Wielkość porów kanału (średnica około 4 Å) jest wystarczająco duża, aby zapewnić przepływ kationów metali jednowartościowych. [20, 21]
Selektywność wobec kationów jest następująca: Cs+ > Rb+ > K+ > Na+ > Li+.
Rysunek 8. Dimer gramicydyny A spleciony razem (po lewej) i tworzący kanał (po prawej)
Istnieją także homologi gramicydyny - gamicydyna B oraz C, różnące się charakterem reszty aromatycznej umiejscowionej w pozycji 11. Reszta tryptofanowa zastąpiona jest odpowiednio fenyloalaniną i tyrozyną. [21]
Niekorzystną cechą jonoforu jest niska selektywność, związana z transportem. Przez kanał mogą przechodzić zarówno jony jak i substancje niepożądane.
Gramicydyna A wykazuje szeroką aktywność biologiczną. Stosowana jest jako środek przeciwbakteryjny wobec bakterii Gram-ujemnych oraz bakterii Gram-dodatnich, za wyjątkiem bakterii z rodzaju Bacillus.
Jonofory karboksylowe
Jonofory karboksylowe nazywane także antybiotykami polieterowymi, stanowią dużą grupę występujących naturalnie, biologicznie czynnych związków. Są rozpuszczalne w tłuszczach i zdolne do transportu kationów metali przez błony biologiczne. Znanych jest ponad 120 jonoforów karboksylowych występujących naturalnie.[25] Komercyjnie jonofory wykorzystuje się jako środek hamujący kokcydiozę oraz stymulator wzrostu u przeżuwaczy. [26]
Wszystkie zastosowania jonoforów karboksylowych są ściśle związane z ich zdolnością do tworzenia kompleksów z kationami metali i transportowaniu ich przez membranę lipidową. Kation metalu mieści się w „klatce” utworzonej przez atomy tlenu zawarte w strukturze jonoforu. Tworzą się obojętne kompleksy antybiotyku polieterowego z jedno- lub dwuwartościowymi kationami metalu oraz z zasadami organicznymi. Całość staje się lipofilowa i jest transportowana przez błonę. Struktura kompleksu stabilizowana jest przez wewnątrzcząsteczkowe wiązania wodorowe wytworzone między grupą karboksylową i grupami hydroksylowymi.
Mechanizm transportu kationu przez jonofor wynika z jego zdolności do wymiany kationu i protonu. W tego rodzaju transporcie najpierw następuje deprotonacja jonoforu, tworzy się anion jonoforu. Anion antybiotyku wiąże kation metalu (M+), po zewnętrznej stronie, z wytworzeniem obojętnej soli. Kompleks przesuwa się wzdłuż błony, uwalniając po jej wewnętrznej stronie kation. Powstaje anion wiążący proton (H+), tworzy się neutralny polieterowy jonofor w postaci kwasu. Cząsteczka dyfunduje przez błonę, aby znów po zewnętrznej stronie związać kation.
Tylko nienaładowana cząsteczka, zawierająca M+ lub H+, może swobodnie poruszać się w błonie.
Rysunek 9. Mechanizm transportu kationów przez jonofory karboksylowe
Selektywność jonoforów wynika z wielkości „klatki”. Tylko kationy o odpowiednich rozmiarach mogą idealnie dopasować się we wnękę, zbyt duże odkształcają wnękę natomiast małe nie znajdują optymalnej koordynacji.[27-31]
Salinomycyna
Salinomycyna jest nowym antybiotykiem jonoforowym, wytwarzanym przez szczep Streptomyces albus. Jest związkiem o wzorze cząsteczkowym C42H70O11, wykazującym aktywność przeciwko bakteriom Gram-dodatnim, w tym prątków i niektórych grzybów nitkowatych, i jest skuteczna w leczeniu kokcydiozy u drobiu. Wykazuje także właściwości przeciwnowotworowe.
Rysunek 10. Cząsteczka salinomycyny
Salinomycyna jest 100 razy skuteczniejsza wobec komórek raka piersi, niż Taxol - powszechnie stosowany lek chemoterapeutyczny na raka piersi.[32] Antybiotyk przejawia preferencję do kompleksowania kationów jedno- i dwuwartościowych w układzie dwufazowym i pośredniczy w ich transporcie przez błony biologiczne. Selektywność salinomycyny wobec kationów jest następująca: K+ > Na+ > Cs+ > Sr2+ > Ca2+ > Mg2+. [33,34]
Grizoryksyna
Grizoryksyna jest antybiotykiem jonoforowym, z grupy nigerycyn, wyizolowane ze szczepu Steptomyces griseus. [35-37] W swojej budowie związek zawiera otwarty wielopierścieniowy łańcuch polieterowy, mający funkcje kwasową. Występuje w postaci białego proszku, który rozpuszcza się w rozpuszczalnikach organicznych, ale nie rozpuszcza się w wodzie.[35]
Antybiotyk silnie wiąże kationy jednowartościowe, tj.: Na+, K+, Ag+, Li+, Rb+, Cs+, Tl+. Kationy K+ i Ag+ po połączeniu z grizoryksyną dają sole izomorficzne, natomiast kationy Li+, Rb+, Cs+ dają sole amorficzne w postaci ciał stałych. [36] Grizoryksyna wykazuje również powinowactwo do kationów dwuwartościowych, a selektywność zmienia się w szeregu K+ > Na+ > Cs+ > Sr2+ > Mg2+ > Ca2+.
Rysunek 11. Struktura grizoryksyny
Podobnie jak w większości antybiotyków z grupy nigerycyn, kompleksy soli tworzone są gdy kation otoczony jest przez łańcuch cząsteczki. Kation połączony jest wiązaniami koordynacyjnym z czterema atomami tlenu łańcucha polieterowego. [36] Grizoryksyna wykazuje silne działanie przeciwbakteryjne (przeciwko bakteriom Gram-dodatnim) i przeciwgrzybiczne, jednak z powodu dużej toksyczności ma ograniczone zastosowanie przy leczeniu. [35-37]
Monenzyna
Monenzyna A jest znanym naturalnym, polieterowym antybiotykiem jonoforowym, zdolnym do transportu jednowartościowych kationów metali przez błony lipidowe, tworząc z jonami pseudo-makrocykliczne kompleksy. Należy więc do grupy cząsteczek wysoko bioaktywnych.[2,38]
Monenzynę wyizolowano, po raz pierwszy w 1967 roku, ze szczepu Streptomyces cinnamonensis. Cząsteczka składa się z podstawowego szkieletu zawierającego: trzy pierścienie tetrahydrofuranowe oraz dwa pierścienie tertahydopiranowe. Cząsteczka monenzyny posiada ponadto trzy grupy hydroksylowe oraz grupę karboksylowa.
Rysunek 12. Cząsteczka monenzyny A
Podczas tworzenia kompleksów powstaje pseudo-cykliczna struktura stabilizowana przez wiązania wodorowe, tworzone między grupą karboksylową, a dwoma grupami hydroksylowymi. W kompleksie prawie wszystkie atomy tlenu skierowane są do wewnątrz, dzięki czemu cząsteczka staje się lipofilowa i może transportować kationy wzdłuż błon. Strona zewnętrzna jest hydrofobowa. Monenzyna jest w stanie tworzyć kompleksy z kationami metali podobne do niektórych sztucznych analogów, takich jak etery koronowe. [2, 39] Powinowactwo do jonów maleje w szeregu: Na+>K+>Rb+>Cs+>Li+>NH4+.
Monenzyna hamuje wzrost bakterii Gram-dodatnich (aktywność przeciwbakteryjna), oraz skutecznie hamuje kokcydiozę u drobiu i bydła. Wykazuje również aktywność przeciwmalaryczną, antybiotyczną. Reguluje wiele funkcji komórkowych, w tym apoptozę komórek nowotworowych. [39-43]
Niestety monenzyna wykazuje stosunkowo dużą toksyczność. Do tej pory różne modyfikacje monenzyny pozwoliły uzyskać mniej toksyczne pochodne, co umożliwia rozszerzenie spektrum zastosowania antybiotyku. [44]
Syntetyczne jonofory
Obecnie poznano wiele metod syntezy związków wykazujących właściwości kompleksujące w stosunku do kationów metali pierwszej i drugiej grupy układu okresowego. Syntetyczne antybiotyki odgrywają bardzo ważną rolę we współczesnej chemii, biologii, ochronie środowiska. Tworzą podłoże do budowy wielu biomolekularnych urządzeń, których wykorzystanie ciągle wzrasta. [3]
Syntetyczne cykliczne jonofory
Do tej grupy związków zaliczamy etery koronowe, kryptandy, sferandy oraz karcerandy. Jonofory te wytwarzane są przez działalność człowieka.
Etery koronowe
Etery koronowe są najbardziej popularnymi syntetycznymi związkami makrocyklicznymi, które mogą spełniać rolę gospodarzy w stosunku do kationów. [45] Budowa heteromakrocyklicznych cząsteczek zazwyczaj składa się z powtarzających się jednostek eterowych [ - (CH2CH2O)n - ] [46].
Odkrycie, w 1967 roku, eterów koronowych oraz ich zdolność do kompleksowania kationów i cząsteczek zawdzięczamy Pedersenowi. [47]
Etery koronowe znane są z wysokiego i selektywnego powinowactwa do kationów metali jedno- i dwuwartościowych, kationów niemetali i cząsteczek obojętnych. Selektywność wynika z ilości elektrodonorowych atomów tlenu występujących w cząsteczce.
Rysunek 13. Przykładowe struktury eterów koronowych, różniące się wielkością pierścienia.
Cząsteczka eteru wiąże ściśle określony jon, np. wyłącznie K+ lub Mg2+. Trwałość kompleksów zależy od:
rodzaju wnęki
rozmiaru wnęki
czynników konformacyjnych i stereochemicznych
obecność heteroatomów w pierścieniu
Istotną właściwością tych makrocyklicznych związków jest bardzo dobra rozpuszczalność w rozpuszczalnikach polarnych, jak i niepolarnych, wynikająca ze zmianami konformacyjnymi eteru, tzw. „zwijania” i „rozwijania się” [48]
Rysunek 14. Zmiana konformacji ze względu na rodzaj rozpuszczalnika.
Etery koronowe mają bardzo szarokie zastosowanie m.in. w:
elektrodach jonoselektywnych,
procesie ekstrakcji jonów,
procesie katalizy przeniesienia fazowego. [48]
Kryptandy
Syntetyczne niecykliczne jonofory
Podandy
Oligotetrahydripirany
Kwas lasalowy - charakterystyka
Charakterystyka kwasu lasalowego
kwas la salowy
kwas[2R-[2α[2S*(3R*,4S*,5S*,7R*),3S*,5S*],5α,6β]]-6-[7-[5-Etyl-5-(5-etyltetrahydro-5-hydroxy-6-metyl-2H-pyran-2-yl)tetrahydro-3-meyl-2-furanyl]-4-hydroxy-3,5-dimetyl-6-oxononyl]-2-hydroxy-3-methylbenzoilowy
kwas3-metyl-6-[7-etyl-4-hydroxy-3,5-dimetyl-6-oxo-7-[5-etyl-3-metyl-5-(5-etyl-5-hydroxy-6-metyl-2-tetraydropyranyl)-2-tetrahydrofuryl]heptyl]salicylowy
antybiotyk X-537A
jonofor X-4537A
C34H54O8
590.79 g/mol
C 69.12%, H 9.21%, O 21.67%
110 - 114°C
[α]D25 - 7.55° (w metanolu)
Dobrze rozpuszcza się w rozpuszczalnikach organicznych. Nie rozpuszcza się w wodzie.
Budowa i struktura kwasu lasalowego i jego kompleksów
Mechanizm działania
Homologi kwasu lasalowego
Zastosowanie
Literatura:
Kryptandy są trójwymiarowymi cząsteczkami z dwoma atomami azotu, połączone przez trzy mostki, powiązanymi przez jednostki oksaetylenowe. [49] Związki zostały odkryte przez Lehna w 1970 roku.
Rysunek 15. Przykładowe struktury kryptandów.
Kryptandy są analogami eterów koronowych. Różnica polega na zastąpieniu dwóch atomów tlenu atomami azotu, które powiązane są dodatkowym łańcuchem. Łańcuch znajdujący się w strukturze sprawia, że kryptandy można zaliczyć do związków makrobicyklicznych. [45]
Struktura cząsteczki tworzy tzw. „kryptę”, ograniczoną z trzech stron, w której kation koordynowany jest za pomocą donorowych atomów.
Rysunek 16. Kompleks kryptandu z kationem potasu (kolor niebieski atomy azotu, kolor czerwony atomy tlenu).
Wśród syntetycznych jonoforów niecyklicznych wyróżniamy podandy (polietylenoglikole) oraz oligotetrahydropirany.
Podandy to alifatyczne analogi eterów koronowych, charakteryzujące się dużą giętkością.[45] Struktura związków oparta jest na powtarzających się jednostkach -CH2CH2O-, które biorą udział w koordynacji kationu. Na końcach łańcuchów znajdują się zazwyczaj grupy hydroksylowe lub alkilowe. [50]
Rysunek 17. Przykladowe struktury podandów
Związki te kompleksją jony, jednak z mniejszą efektywnością niż etery.[45] Podandy tworzą kompleksy z kationami metali ziem alkalicznych oraz jonami metali przejściowych.[50]
Podandy głównie wykorzystywane są w elektrodach jonoselektywnych do wykrywania kationów pierwszej i drugiej grupy układu okresowego. [50]
Oligotetrahydropirany są alifatycznymi związkami, zawierającymi w swojej strukturze długie łańcuchy połączonych pierścieni tetrahydropiranowych. Znajdujące się w pierścieniach elektrodonorowe atomy tlenu mają zdolność do koordynacji kationów metali oraz protonowanych amin.
Rysunek 18. Struktura oligotetrahydropiranu
Z uwagi na wykazywaną stereochemię związki te przybierają optymalną konformację w stosunku do kompleksowanego jonu, zapewniając jonoforetyczne właściwości. Cecha ta jest znacznie bardziej widoczna niż u eterów koronowych, które zawierają taką samą ilość atomów tlenu.
Polieterowe antybiotyki jonoforowe należą do ważnej grupy naturalnych i bioaktywnych cząsteczek, zdolnych do transportu jedno- i dwuwartościowych kationów metali przez naturalną i sztuczną błonę komórkową.[51-57]
Kwas lasalowy jest jednym z najlepiej poznanych antybiotyków polieterowych. Po raz pierwszy sól sodowa, tego kwasu, została wyizolowana ze szczepu bakterii Streptomyces lasaliensis w 1951 roku przez Bergera i współpracowników.[58]
Lipofilowy charakter determinuje słabą rozpuszczalność w wodzie i mechanizm działania. Kwas lasalowy wbudowuje się w błonę, zmieniając jej przepuszczalność [59] i pozwalając na transport jedno- i dwuwartościowych kationów metali, a także amin, a nawet anionów Cl - przez błony biologiczne. [60] Kwas lasalowy znalazł zastosowanie jako środek stosowany przeciw kokcydiozie u bydła, owiec, drobiu, królików. [61]
Pomimo wielu korzystnych cech kwasu lasalowego, największym ograniczeniem jest wysoka toksyczność związku. W celu pokonania tego problemu prowadzi się badania modyfikacji chemicznych, a także właściwości biologicznych. [62,63] Procesy te poszerzają chemiczne i biologiczne zastosowanie w weterynarii.
Dzięki analizie rentgenograficznej możliwe było określenie konfiguracji na 10 centrach chiralności występujących w cząsteczce kwasu lasalowego.
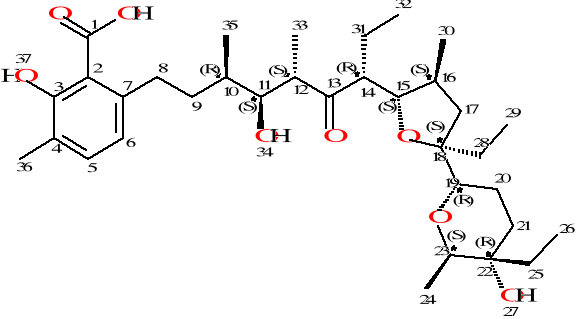
Rysunek 19. Cząsteczka kwasu lasalowego
Nazwa:
Nazwa według CAS (Chemical Abstracts Service):
Inne nazwy:
Wzór sumaryczny:
Masa cząsteczkowa:
Skład procentowy atomów w cząsteczce:
Temperatura topnienia:
Skręcalność właściwa:
Rozpuszczalność:
Kwas lasalowy jest cząsteczką o budowie liniowej. Jego struktura zawiera trzy pierścienie: tetrahydropiranowy, tetrafurynowy i aromatyczny pierścień kwasu salicylowego. Dodatkowo w strukturze znajdują sie trzy grupy hydroksylowe i jedna karbonylowa. [54]
Badania spektroskopowe i rentgenograficzne wykazały, że struktury kwasu lasalowego w postaci ciała stałego i w roztworze chloroformowym są porównywalne. Antybiotyk tworzy kompleksy z jedno- i dwuwartościowymi kationami metali. Do określenia struktur kompleksów użyto metod rentgenograficznych. [55]
Na podstawie badań stwierdzona, że kwas loasalowy w metanolu z kationami jednowartościowymi tworzy monomeryczne kompleksy o strukturze typu RM ( gdzie R = kwas lasalowy, M = kation metalu). Jednak niektóre kompleksy z jednowartościowymi kationami, w rozpuszczalnikach niepolarnych, tworzą struktury dimeryczne typu R2M2. Inne struktury dimeryczne typu R2M obserwuje się dla większości kompleksów z kationami dwuwartościowymi. [55]
Przykładem struktury dimerycznej R2M może być kompleks z jonami baru. Struktura kompleksu wykazuje pseudo-dwukrotną symetrię. Kation koordynowany jest przez 8 atomów tlenu pochodzących od dwóch cząsteczek kwasu lasalowego i cząsteczki wody. [57]
Rysunek 20. Struktura kompleksu kwasu lasalowego z Ba2+
Dla kompleksu kwasu lasalowego kationem Ag+ otrzymanego w rozpuszczalniku nipolarnym obserwuje się inną dimeryczną strukturę (R2M2). Struktura ma dwuktrotną symetrię, a każdy kation Ag+ koordynowany jest przez 5 atomów tlenu anionowej formy jonoforu oraz atom tlenu pochodzący z grupy karboksylowej sąsiedniej cząsteczki kwasu lasalowego. [55]
Rysunek 21 Struktura kompleksu kwasu lasalowego z Ag+
Kwas lasalowy działa jako przenośnik jedno- i dwuwartościowych kationów metali, a także amin i anionów chlorkowych przez błony komórkowe. [56]
Jonofor zmienia przepuszczalność błony wbudowując się w jej strukturę. Pozwala to na transport jonów, które w normalnych warunkach nie są przenoszone. Kwas wiąże kation po stronie zewnętrznej i przechodząc do wnętrza komórki wymienia kation metalu na jon H+. Wymiana prowadzi do zmiany wartości pH i wzrostu ciśnienia osmotycznego wewnątrz komórki. Skuteczność tego procesu silnie zależy od struktury kompleksu kwasu lasalowego z kationem metalu. [61, 66, 67]
Istnieje pięć homologów kwasu lasalowego różniące się zamianą występującej w kwasie la salowym A grupy metylowej na etylową w homologach B, C, D, E. Homologi te zostały zaobserwowane w 1974 roku przez Bergera i współpracowników. Natomiast w kwasie izolasalowym następuje zmniejszenie pierścienia tetrahydropiranowego na tetra furanowy. Struktury tych związków przedstawione są poniżej:
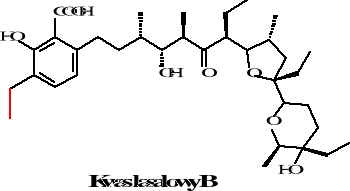
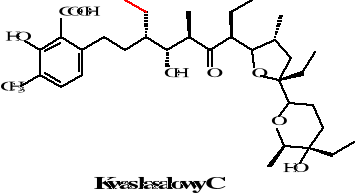
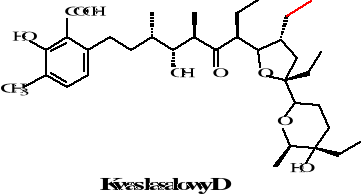
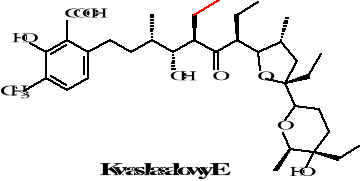
Rysunek 22. Struktury homologów kwasu lasalowego
Sól sodowa kwasu lasalowego jest jednym z najczęściej stosowanych antybiotyków w weterynarii jako środek przeciw kokcydiozie wywołanej w hodowli drobiu, owiec oraz bydła. Stosowany jest również jako niehormonalny promotor wzrostu u przeżuwaczy. [8]
Kwas lasalowy wykazuje szeroką gamę aktywności biologicznej w tym aktywność przeciwbakteryjną, przeciwgrzybiczną, przeciwpasożytniczą, przeciwwirusową. Szczególnie dopływ kationów Na+ do komórek bakterii Gram-dodatnich i bakterii beztlenowych prowadząc do zmiany pH oraz wzrostu ciśnienia osmotycznego wewnątrz komórki powodując obrzęk, wakuolizację, a w konsekwencji śmierć komórki.[69, 72]
Ostatnio podjęto badania aktywności cytostatycznej kwasu lasalowego wobec linii ludzkich komórek nowotworowych. Wykazały one, że kwas lasalowy przejawia silniejszą aktywność cytostatyczną niż cis-platyna i jest obiecującym kandydatem na nowe leki przeciwnowotworowe. [70, 73]
[1] Murray R. K., Granner D. K., Mayes P. A., Rodwell V. W. Biochemia Harpera. Warszawa : Wydawnictwo Lekarskie PZWL, 1995. ISBN 83-200-1798-X.
[2] Pantcheva IN, Dorkov P, Atanasov VN, Mitewa M, Shivachev BL, Nikolova RP, Mayer-Figge H, Sheldrick WS, Crystal structure and properties of the copper(II) complex of sodium monensin A, Journal of Inorganic Biochemistry, 2009, 103, p. 1419-1424.
[3] Schroeder, G., Gierczyk B., Syntetyczne receptory jonowe - jonofory, Syntetyczne receptory jonowe, „BETAGRAF”P.U.H. Poznań, 2005, p. 4-6, ISBN 83-89936-05-4.
[4] W. Burgermeister, R. Winkler-Oswatitsch, Complex formation of monovalent cations with biofunctional ligands, Topics in Current Chem, 1977, 69, p. 91-196.
[5] R. Hilgenfeld, W. Saenger, Structural chemistry of natural and synthetic inoophores and their complexes with cations, Host Guest Complex Chemistry II, Topics in Current Chem., 1982, 101, p. 1-82.
[6] L., Stryer. Biochemia. Warszawa : Wydawnictwo Naukowe PWN, 2003.
[7] R. Ferdani, G.W. Gokel: Ionophores. W: Encyclopedia of supramolecular chemistry, p. 1401-1411.
[8] B. Pressman. Biological applications of ionophores, Annu. Rev. Biochem., 1976, 45, p. 501-530.
[9] L. K. STEINRAUF, Crystal structures of valinomycin with potassium tetrachloroaurate and rubidium tetrachloroaurate with comparisons to other monovalent cation complexes, Proc. Int. Symp.Biomol. Struct Interactions, Suppl. J· Biosci., 1985, 8, p. 293-306
[10] A. Ozdemir, I. K. Lednev , S. A. Asher, UVRR spectroscopic studies of valinomycin complex formation in different solvents, Spectrochimica Acta Part A, 2005, 61, p. 19-26
[11] C. M. Halsey, D. A. Benham, R. D. JiJi, J. W. Cooley, Influence of the lipid environment on valinomycin structure and cation complex formation, Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2012, 96, p. 200-206.
[12] I. L. Karle, Conformation of Valinomycin in a Triclinic Crystal Form, Journal Of The American Chemical Society, 1975, 97, p. 4379-4386.
[13] M.Ø. Jensen, O.G. Mouritsen, Lipids do influence protein function—The hydrophobic mismatch hypothesis revisited, Biochim. Biophys. Acta, 2004, 1666, p. 205-226.
[14] A.G. Lee, How lipids affect the activities of integral membrane proteins, Biochim. Biophys. Acta, 2004, 1666, p. 62-87.
[15] J.H. Kleinschmidt, L.K. Tamm, Secondary and tertiary structure formation of the β-barrel membrane protein OmpA is synchronized and depends on membrane thickness, J. Mol. Biol., 2002, 324, p. 319-330.
[16] I.M. Williamson, S.J. Alvis, J.M. East, A.G. Lee, Interactions of phospholipids with the potassium channel KcsA, Biophys. J., 2002, 83, p. 2026-2038.
[17] F. Dumas, J.-F. Tocanne, G. Leblanc, M.-C. Lebrun, Consequences of hydrophobic mismatch between lipids and melibiose permease on melibiose transport, Biochemistry, 2000, 39, p. 4846-4854.
[18] E.C. Cooper, L.Y. Jan, Ion channel genes and human neurological disease: recent progress, prospects and challenges, Proc. Natl. Acad. Sci. U.S.A., 1999, 96, p. 4759-4766.
[19] T.J. Jentsch, C.A. Hübner, J.C. Fuhrmann, Ion channels: function unravelled by dysfunction, Nat. Cell Biol., 2004, 6, p. 1039-1047.
[20] D. A. Kelkar , A. Chattopadhyay, The gramicidin ion channel: A model membrane protein, Biochimica et Biophysica Acta, 2007, 1768, p. 2011-2025.
[21] D. A. Kelkar, A. Chattopadhyay, Modulation of gramicidin channel conformation and organization by hydrophobic mismatch in saturated phosphatidylcholine bilayers, Biochimica et Biophysica Acta, 2007, 1768, p. 1103-1113.
[22] Wallace B. A. 1986. Structure of gramicidin, Biophys. J., 1986, 49, p. 295-306.
[23] Urry D. W., The gramicidin A transmembrane channel: a proposed 7r(L,D) helix. Proc. Natl. Acad. Sci. USA, 1971, 68, p. 672-676.
[24] B. Roux, M. Karplus, Ion transport in a model gramicidin channel. Structure and thermodynamics Biophys. J., 1988, 53, p. 297-309.
[25] C.J. Dutton, B.J. Banks, C.B. Cooper, Polyether ionophores, Natural Product Reports, 1995, 12, p. 165-181.
[26] T.R. Callaway, T.S. Edrington, J.L. Rychlik, T.L. Genovese, T.L. Poole, Y.S. Jung, K.M. Bischoff, R.C. Anderson, D.J. Nisbet, Ionophores: Their use as ruminant growth promotants and impact on food safety, Current Issues in Intestinal Microbiology, 2003, 4, p. 43-51.
[27] M. Dobler, Natural Cation-binding Agents, In Comprehensive Supramolecular Chemistry: Molecular Recognition: Receptors for Cationic Guests: Vol. 1; Gokel G.W. (Ed), Pergamon, 2004, p. 267-313, 2004.
[28] B.C. Pressman, Antibiotics and their complexes, Marcel Dekker Inc., 1985, p. 1-18.
[29] H. Tsukube, K.Takagi, T. Higashiyama, T. Iwachido, N. Hayama, Biomimetic membrane transport: Interesting ionophore functions of naturally occurring polyether antibiotics toward unusual metal cations and amino acid ester salts, Inorganic Chemistry, 1994, 33, p. 2984-2987.
[30] H.H. Mollenhauer, D.J. Morre, L.D. Rowe, Alteration of intracellular traffic by monensin; mechanism, specificity and relationship to toxicity, Biochimica et Biophysica Acta - Reviews on Biomembranes, 1990, 1031, p. 225-246, 1990.
[31] M. Inabayashi, S. Miyauchi, N. Kamo, T. Jin, Conductance change in phospholipid bilayer membrane by an electroneutral ionophore, monensin, Biochemistry, 1995, 34, p. 3455-3460.
[32] Miyazaki Y., Shibuya M., Sugawara H., Salinomycin. a new polyether antibiotic, Journal of antibiotics, 1974, 28, p. 814-821.
[33] Presman, B. C., Ionophorous antibiotics as models for biological transport, Fed. Proc., 1968, 27, p. 1283-1288.
[34] Mitani, M., T. Yamanishi, Y. Miyazaki, Salinomycin: A new monovalent cation ionophore, Biochem. Biophys. Res. Commun., 1975, 66, p. 1231-1236.
[35] Gachon P., Kergomard A., Staron T., Esteve C., Grisorixin, an ionophorous antibiotic of the nigericin group I. fermentation, isolation, biological properties and structure, J. Antibiot., 1975, 28, p. 345-349.
[36] Gachon P., Kergomard A., Staron T., Esteve C., Grisorixin, an ionophorous antibiotic of the nigericin group II. Fermentation, isolation, biological properties and structure, J. Antibiot., 1975, 28, p. 351-357.
[37] Cuer A., Dauphin G., Beloeil J. C., Microbial conversion of grisorixin, a monovalent cation ionophorous antibiotic, Journal of antibiotics, 1982, 36, p. 20-24
[38] Huczyński A., Brzezinski B., Bartl F. Structures of complexes of benzyl and allyl esters of monensin A with Mg2+, Ca2+, Sr2+, Ba2+ cations studied by ESI-MS and PM5 methods. Journal of Molecular Structure., 2008, 886, p. 9-16.
[39] Brzeziński B., Huczyński A., Łowicki D.,Stefańska J. Syntheses, structural and antimicrobial studies of a new N-allylamide of monensin A and its complexes with monovalent metal cations. Tetrahedron, 2009, 36, p. 7730-7740 .
[40] Huczyński, A., Ratajczak-Sitarz, M., Katrusiak, A., Brzezinski, B. Molecular structure of rubidium six-coordinated dihydrate complex with monensin A. Journal of Molecular Structure, 2008, 888, p. 224-229.
[41] Huczyński A., Łowicki D., Brzezinski, Bartl F, Spectroscopic, mass spectrometry, and semiempirical investigations of a new 2-(2-methoxyethoxy)ethyl ester of Monensin A and its complexes with monovalent cations, Journal of Molecular Structure, 2008, 879, p. 14-24.
[42] Huczyński A., Przybylski P., Brzezinski B., Bartl F., „Monensin A metyl ester complexes with Li+, Na+, and K+ cations studied by ESI-MS, 1H- and 13C-NMR, FTIR, as well as PM5 semiempirical method” Biopolymers, 2006, 81, p. 282-294
[43] Huczyński A., Michalak D., Przybylski P., Brzezinski B., Bartl F., Spectroscopic, mass spektrometry and semiempirical investigation of a new Monensim A allyl ester and its complexes with Li+, Na+, and K+ cations, J. Mol. Struct. 2007, 828, p. 130-141
[44] Huczyński A., Przybylski P., Brzezinski B., Bartl F., Spectroscopic and semiempirical studiem of a proton channel formed by the methyl ester of Monensin A, J. Phys. Chem. B, 2006, 110, p.15615 - 15623
[45] G. Schroeder, J. Wyrwał, Maszyny molekularne, Seria: Chemia Supramolekularna,
„BETAGRAF” P. U. H., Poznań 2004, ISBN 83-918771-9-1, s. 8.
[46] W. Lu, W. Qiu, J. Kim, O. Okobiah, J. Hu, G. W. Gokel, D. Zhong, Femtosecond studies of crown ethers: supramolecular solvation, local solvent structure and cation-p interaction, Chemical Physics Letters, 2004, p. 394, 415-422.
[47] Pedersen, C. J. J. Am. Chem. Soc. 1967, 89, p. 2495-2496, p. 7017-7036
[48] Yin Li, Péter Huszthy, Ildikó Móczár, Balázs Szemenyei, Sándor Kunsági-Máté, Solvent effect on the complex formation of a crown ether derivative with sodium and potassium ions. Thermodynamic background of selectivity, Chemical Physics Letters, 2013, 556, p. 94-97.
[49] K. E. Krakowiak, J. S. Bradshaw, H. An, R. M. Izatt, Simple methods for the preparation of cryptands, Pure and Applied Chemistry, 1993, 65, p. 511-514.
[50] M. S. Won, Y. J. Bae, S. S. Lee, Y. B. Shim, Determination of Hg2+ ions using electrodes modified with dithia-podands having different end alkyl chain lengths, Electroanalysis, 2001, 13, p. 1003-1007.
[51] J.W. Westley, A proposed numbering system for polyether antibiotics, 1976, 29, p. 584-586
[52] S. Lindenbaum, L. Sternson, S. Rippel, Fluorimetric determination of complexation constants for the ionophore antibiotic X-537A with biogenic amines, 1977, 8, p. 268-269.
[53] M. Schadt, G. Haeusler, Permeability of lipid bilayer membranes to biogenic amines and cations: Changes induced by ionophores and correlations with biological activities, The Journal of Membrane Biology, 1974, 18, p. 277-294.
[54] Y.N. Antonenko, L.S. Yaguzhinski, A new method of the measurement of the electrically neutral fluxes of cations through lipid bilayer membranes induced by Men+/nH+-exchangers, FEBS Letters, 1983, 163, p. 42-45
[55] G.D.J. Phillies, H.E. Stanley, Hydroxyl deformation frequencies as a probe of hydrogen bonding in lasalocid A (X-537A) and its sodium complex, J. Am. Chem. Soc., 1976, 98, p. 3892-3897.
[56] D.J. Patel, C. Shen, Free acid, anion, alkali, and alkaline earth complexes of lasalocid a (X537A) in methanol: structural and kinetic studies at the monomer level, PNAS, 1976, 73, p. 4277-4281.
[57] C.C. Chiang, I.C. Paul, Monomeric forms of the acid ionophore lasalocid A (X-537A) from polar solvents, Science, 1977, 196, p. 1441-1443.
[58] J. Berger, A.I. Rachlin, W.E. Scott, L.H. Sternbach, M.W. Goldberg, The Isolation of Three New Crystalline Antibiotics from Streptomyces, Journal of the American Chemical Society, 1951, 73, p. 5295-5298.
[59] Y. Pointud, E. Passelaigue, J. Juillard, nteractions between metal cations and the ionophore lasalocid. Part 4.—ΔH and ΔS for formation of 1-1 and 2-1 complexes of the lasalocid anion and salicylate with alkaline-earth metal cations in methanol, J. Am. Chem. Soc., 1951, 73, p. 5295-5298.
[60] R.V. Antonio, L.P. da Silva, A.E. Vercesi, Alterations in mitochondrial Ca2+ flux by the antibiotic X-537A (lasalocid-A), Biochim. Biophys. Acta, 1991, 1056, p. 250-258.
[61] R. Pankiewicz, G. Schroeder, B. Brzezinski, 1H, 13C NMR, FT-IR, ESI-MS and PM5 semiempirical study of new lasalocid ester with 3-(methylthio)-1-propanol and its complexes with monovalent cations , Journal of Molecular Structure, 2007, 829, p. 120-127.
[62] R. Pankiewicz, G. Schroeder, B. Gierczyk, B. Brzezinski, F. Bartl, Multinuclear NMR and FTIR studies of new polyoxaalkyl esters of lasalocid and their complexes with lithium and sodium cations, Biopolym.: Biospectr., 2002, 65, p. 95-110.
[63] R. Pankiewicz, G. Schroeder, P. Przybylski, B. Brzezinski, F. Bartl, Lasalocid polyoxaalkyl esters complexes with Li+, Na+, K+, Rb+ and Cs+ cations studied by ESI MS and semiempirical methods, J. Mol. Struct., 2004, 688, p. 171-176.
[64] A. Huczyński, T. Pospieszny, M. Ratajczak-Sitarz, A. Katrusiak, B. Brzezinski, Structural and spectroscopic studies of the 1:1 complex of lasalocid acid with 1,5,7-triazabicyclo[4.4.0]dec-5-ene, J. Mol. Struct., 2008, 875, p. 501-508.
[65] Lindoy L. F. “Outher-sphere and inner-sphere complexation of cations by the natural inophore lasalocid A”, Coordination Chemistry Reviews, 1996, 148, p. 349-368
[66] V.C. Langston, F. Galey, R. Lovell, W.B. Buck, Vet. Med., 1985, 80, p. 75
[67] V. Rada, M. Marounek, Effect of monensin on the crop microflora of broiler chickens, Ann. Zeotech., 1996, 45 , p. 283-288.
[68] D.A. Kevin II, D.A.F. Meujo, M.T. Hamann, Polyether ionophores: broad-spectrum and promising biologically active molecules for the control of drug-resistant bacteria and parasites, Expert Opin. Drug Discov., 2009, 4, p.109-147
[69] A. Huczyński, J. Rutkowski, J. Wietrzyk, J. Stefańska, E. Maj, M. Ratajczak-Sitarz, A. Katrusiak, B. Brzezinski, F. Bartl, X-ray crystallographic, FT-IR and NMR studies as well as anticancer and antibacterial activity of the salt formed between ionophore antibiotic Lasalocid acid and amines, J. Mol. Struct., 2013, 1032, p. 69-77.
[70] J. W. Westley, E. P. Oliveto, J. Berger, R. H. Evans, jr. R. Glass, A. Stempel, V. Toome, T. Williams, Chemical transformations of antibiotic X-537A and their effect on antibacterial activity, J. Med. Chem., 1973, 16, 397-409.
[71] J. W. Westley, J. Schneider, R. H. Evans, jr. T. Williams, A. D. Batcho, A. Stempel, Nitration of antibiotic X-537A and facile conversion to 6-hydroxy-2,7-dimethyl-5-nitroquinoline, J. Org. Chem., 1971, 36, p. 3621-3624.
[72] H.T. Cao, T. Roisnel, A. Valleix, R. Gree, A Tandem Isomerization-Mannich Reaction for the Enantioselective Synthesis of β-Amino Ketones and β-Amino Alcohols with Applications as Key Intermediates for ent-Nikkomycins and ent-Funebrine, Eur. J. Org. Chem., 2011, p. 3430-3436.
[73] C.-H. Zhao, L. Liu, D. Wang, Y.-J. Chen, You have full text access to this content
Asymmetric Mannich-Type Reaction of a Chiral N-(tert-Butylsulfinyl) Ketimine with Imines: Application to the Synthesis of Chiral 1,3-Diamines, Eur. J. Org. Chem., 2006, p. 2977-2986.
[74] A. Ting, S.E. Schaus, You have full text access to this content
Organocatalytic Asymmetric Mannich Reactions: New Methodology, Catalyst Design, and Synthetic Applications, Eur. J. Org. Chem., 2007, p. 5797-5815.
[75] K. Matsumoto, K. Joho, S. Mimori, H. Iida, H. Hamana, A. Kakehi, Regioselective Mannich Reaction of Phenols under High Pressure Using Dichloromethane as C1 Unit, Heterocycles, 76, 2008, p. 1061-1067.
[76] K. Bujnowski, A. Adamczyk-Woźniak, L. Synoradzki, o-Aminomethylderivatives of phenols. Part 3. Mechanistic investigation of a Mannich reaction of phenols with N-methylenealkylamines, ARKIVOC, 2008, 13, p. 106-114.
Strona | 24
Wyszukiwarka
Podobne podstrony:
mgr kubus puchatek przykladowa praca magisterska(1) 7GCBLITMRQOMO25Z6XNDUCDV3OR5KUQFZNX2PZA
Nieszpory I, Studia, PRACA MGR - TEOLOGIA, praca magisterska - poszczegвlne elementy, rozdział II
Celebracja Nieszporów, Studia, PRACA MGR - TEOLOGIA, praca magisterska - poszczegвlne elementy, rozd
pyt mgr zim ogolne, Nauka, Akademia Leona Koźminskiego, Praca magisterska
Praca Dyplomowa `Relacje Bank-Przedsiŕbiorstwo`, prace doktorskie, magisterskie, prace doktorskie,
PRACA DYPLOMOWA(22), prace doktorskie, magisterskie, prace doktorskie, magisterskie, babkakiepska -
Rys Historyczny, Studia, PRACA MGR - TEOLOGIA, praca magisterska - poszczegвlne elementy, rozdział I
Analiza ekonomiczna praca mgr, PRACA MAGISTERSKA INŻYNIERSKA DYPLOMOWA !!! PRACE !!!!!!
Praca magisterska, Prace dyplomowe i magisterskie, praca mgr.o dzieciach, New Folder
Celebracja Nieszporów (2), Studia, PRACA MGR - TEOLOGIA, praca magisterska - poszczegвlne elementy,
III Celebracja - Eucharystia, Studia, PRACA MGR - TEOLOGIA, praca magisterska - poszczegвlne element
WSTĘP, Studia, PRACA MGR - TEOLOGIA, praca magisterska - poszczegвlne elementy, wtęp i zakończenie
praca mgr, PRACA MAGISTERSKA INŻYNIERSKA DYPLOMOWA !!! PRACE !!!!!!
praca magisterska Akty kończące ogólne postępowanie administracyjne
więcej podobnych podstron