Kol.1
1.Obliczyć wartości ciepeł molowych pod stałym ciśnieniem (T=298K)wszystkich substancji biorących udział w reakcji:
N2(g) + 3H2(g) = 2NH3(g) +Q
oraz ΔCp tej reakcji.
Rozw.
![]()
n- ilość moli w cząsteczce
l=0 - dla cząsteczek liniowych
l=1 - dla cząsteczek nieliniowych
Cp=Cv + R R=8,314 [kJ/mol·K]
N2 - cząsteczka liniowa, n=2, l=0
![]()
H2 - cząsteczka liniowa (Cp - jak wyżej)
NH3 - cząsteczka nieliniowa, n=4, l=1
![]()
![]()

1b.Obliczyc wartości ciepeł molowych pod stałym ciśnieniem. (T=298K) wszystkich substancji biorących udział w reakcji N2 +3H2=2NH3 oraz ΔCp tej reakcji.
2.Standardowa entalpia spalania gazowego propanu wynosi -2220 kJ/mol , a standardowa entalpia parowania ΔHpar ciekłego propanu 15 kJ/mol. Obliczyć wartość standardowej entalpii spalania i standardowej energii wewnętrznej spalania ciekłego propanu.
ROZW.
C3H8(g) + O2 = CO2 + H2O ΔH=-2220 [kJ/mol]
C3H8(c) = C3H8(g) ΔH=15 [kJ/mol]
Po zsumowaniu:
C3H8(c) = CO2 + H2O ΔH=-2220+15=-2205 [kJ/mol]
2b. Standardowe entalpie tworzenia wody ,dwutlenku węgla, tlenku węgla wynoszą odpowiednio :
-285,9; -393,5; -110,5 [KJ/mol] a standardowa entalpie tworzenia metanu -74,8 kJ/mol. Obliczyć standardowe entalpie i energie wewnętrzna reakcji:
1) CH4 + O2 = C+ 2H20(c)
2) CH4+2O2=CO2+2H20(c)
ROZW.
![]()
1)
![]()
![]()
![]()
![]()
2)
![]()
![]()
![]()
3.Standardowe entalpie tworzenia:
H2O(g) , CO2(g) , CH4 wynoszą:
-241,8 kJ, -393,5 kJ, -78,4 kJ
Obliczyć entalpie reakcji: CH4(g)+2O2=2H2O + CO2 w temp. 1500K i pod ciśnieniem 1 bar.
![]()
31,46 +0,00339T
![]()
30,00 +0,01071T
![]()
44,14 + 0,00904T
![]()
31,2 + 0,003T
Rozw.
CH4(g)+2O2=2H2O(g) + CO2(g)
![]()
![]()
![]()
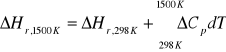
![]()
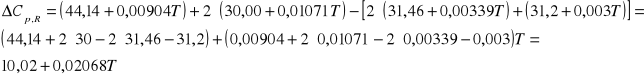
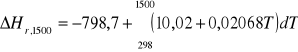
3b. Standardowa entalpia tworzenia gazowego amoniaku w temp.298K wynosi -46,2KJ/mol ciepła molowe wynoszą:
![]()
29,1 +0,002T
![]()
27,1+0,006T
![]()
25,9+0,032T
Obliczyć ΔH i ΔU dla reakcji powstawania gazowego amoniaku w temp.400K.
ROZW.
![]()
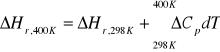
![]()
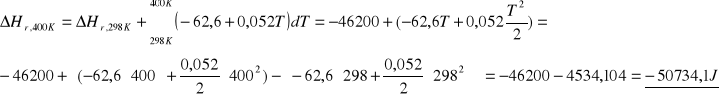
![]()
![]()
![]()
![]()
Kol.2
1.Stała równowagi reakcji Fe3O4(s) + CO = 3FeO(s) + CO2 przy 850K wynosi Kp=1,2 , mieszaninę złożoną z 1 mola Fe3O4 ; 1,5 mola CO ; 0,7 mola FeO; 0,4 mola CO2 ogrzano do temperatury 850K przy całkowitym ciśnieniu 5 bar. Obliczyć ilość poszczególnych reagentów w stanie równowagi.
ROZW.
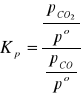
![]()
![]()
![]()
![]()
|
Fe3O4(s) |
CO |
FeO(s) |
CO2 |
Było[moli] |
1 |
1,5 |
0,7 |
0,4 |
|
Co-α |
Co-α |
Co+3α |
Co+α |
Jest[moli] |
0,454545 |
0,954 |
2,3364 |
0,945 |
2.Obliczyć stałą równowagi Kp reakcji C(s) + ½ O2(g) =CO(g) w temperaturze 1000K na podstawie danych:
Kp298=1,06·1024
ΔHo298= -110,5 kJ/mol
Cp(C)/[J/mol·K]=17,5 + 0,00427T
Cp(O2) /[J/mol·K]=31,46 + 0,0034T
Cp(CO) /[J/mol·K]=28,41 + 0,0041 T
ROZW.
![]()
![]()
średnia entalpia dla temperatury średniej: ![]()
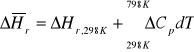
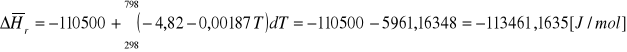
![]()
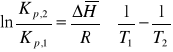
![]()
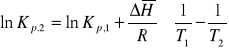
![]()
![]()
3. Prężność pary cieczy w zakresie temperatur 200-260K jest opisana przez : ln(p/Tor)=16,255-2501,8/T [K]
Tor=133,33Pa
Oblicz entalpię parowania tej cieczy.
Rozw.
![]()
![]()
![]()
![]()
1a. Oblicz stałą równowagi Kp w temperaturze 298K dla następującej reakcji
CO2(g) + 2H2(g) = CH3OH(g). Wiedząc ,że standardowa zmiana potencjału termodynamicznego dla reakcji: CO2(g) + 2H2 = CH3OH(c)
![]()
a prężność pary metanolu w temperaturze 298K wynosi: 16,2 kPa.
ROZW.
CO2(g) + 2H2(g) = CH3OH(c)
![]()
CH3OH(c)= CH3OH(g).
![]()
p=16200Pa
po=100000Pa
![]()
![]()
![]()
![]()

2a. Dla reakcji syntezy acetylenu 2C(s) + H2(g) =C2H2(g) w zakresie temperatur 700-1500K i przy ciśnieniu 1 bar, standardowa entalpia reakcji jest funkcją temperatury: ![]()
Obliczyć wartość stałej równowagi Kp,2 w temperaturze 1500K, jeżeli w temperaturze 700K Kp,1=7,94·1013.
ROZW.
![]()
![]()
![]()
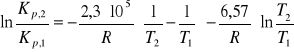
![]()
![]()
3a. Dla reakcji: 3Fe2O3 = 2Fe3O4 + ½ O2 ,
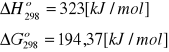
Oblicz stałą równowagi Kp tej reakcji:
a) 298K
478K.
ROZW.
a)
![]()
![]()
![]()
![]()
b)
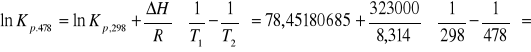
127,5449509
![]()
4a. Stała równowagi reakcji syntezy amoniaku NH2 + 3H2 = 2NH3 w temperaturze 400K wynosi Kp,1=1,26·10 -7 . Obliczyć stałą równowagi Kp,2 , w temperaturze 500K jeżeli w podanym zakresie temperatur standardowa entalpia reakcji: ![]()
.
ROZW.
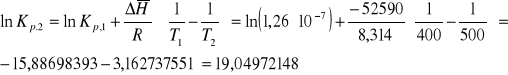
![]()
4.1/str. 41 skrypt
4.4/str. 43 skrypt
4.6/str. 45 skrypt
4.8/str. 47 skrypt
5a. Stała równowagi reakcji H2 + Cl2 = 2HCl można wyrazić równaniem: ![]()
. Znaleźć standardowe entalpie tej reakcji dla temperatury 1000 K.
ROZW.
![]()
![]()
![]()
6a.W temperaturze 1000K i pod ciśnieniem 1 bar z mieszaniny zawierającej początkowo 1 mol SO2 ; 0,6 moli O2 w trakcie ustalania się równowagi powstało 0,22 moli SO3. Wyznaczyć stałą równowagi ciśnieniowej Kp reakcji. 2SO2 + O2 = 2 SO3
ROZW.
|
SO2 |
O2 |
SO3. |
było |
1 |
0,6 |
- |
|
1- α |
0,6- α/2 |
α |
jest |
0,78 |
0,49 |
0,22 |
Σn=1,49 moli
![]()
![]()
![]()
![]()
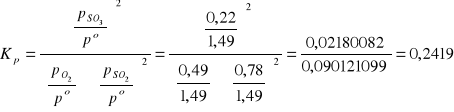
Kol. 3
1.Prężności par substancji A i B w temp. 323K wynoszą odpowiednio 0,0467 i 0,1 MPa. Obliczyć całkowitą prężność i skład pary pozostającej w równowadze z roztworem składającym się z 5 moli substancji A i & moli substancji B (roztw. doskonały).
Rozw.
nA=5 moli
nB=7 moli
poA=0,0467 MPa=46700 Pa
poB=0,1 MPa=100000 Pa
xA=![]()
xB=1-xA
xB=![]()
pA= xA· poA=19458,333 Pa
pB= xB · poB=58333,333 Pa
p =pA +pB=77791,666 Pa
Skład pary:
yA=![]()
yB=1-yA
yB=![]()
1b. Obliczyć aktywność i współczynnik aktywności eteru w mieszaninie z etanolem wiedząc, że jego ułamek molowy w roztworze wynosi 0,6 a w parze 0,75.
Całkowite ciśnienie nad roztworem wynosi 3,6·104Pa. A prężność pary nad czystym eterem jest równa 3,87·10 4Pa.
2.Obliczyć temperaturę wrzenia roztworu otrzymanego po rozpuszczeniu 0,8 g naftalenu(n) w 50g chloroformu(ch).
Temperatura wrzenia chloroformu wynosi Twrz=61,1oC. Molowa entalpia parowania ΔHp=29,37 [kJ/mol].
Masy molowe: Mch=119,4 g/mol
Mn=128,2 g/mol
Rozw.
mn=0,8 g rozpszczono w 50 g chloroformu.
Twrz ,ch=61,1 oC=334,25 K
ΔHp=29,37 [kJ/mol]=29370 [J/mol]
ΔTwrz=Ke · m m [mol/1000 g rozp]
nn=![]()
0,006240249 molen — 50 g ch
x molin — 1000 g ch
x=0,1248 molin molalność:0,1248 [moli/kg rozp]
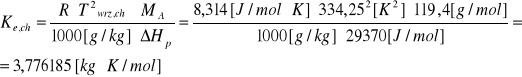
MA=Mch - masa cząsteczkowa rozpuszczalnika,
ΔTwrz=3,776185 · 0,1248 = 0,47126 K
ΔTwrz,R= Twrz ,ch+ ΔTwrz = 334,7212 K.
2b. W 100kg wody rozpuszczono 3,7488g substancji.
Temp. wrzenia tego roztworu była wyższa od temp wrzenia rozpuszczalnika o ΔT=0,2107K.
Obliczyć masę molową substancji rozpuszczonej wiedząc ,że był nią siarczan sodowy .
Obliczyć współczynnik izotoniczny i, Ke=lub wody 0,512[ kg· K/mol]
ROZW.
3.Obliczyć wielkość nadmiaru powierzchniowego Γ2 etanolu w roztworze wodnym o C=0,5 [mol/dm3] w temperaturze 298K wiedząc, że zależność napięcia powierzchniowego roztworu od stężenia przedstawia równanie empiryczne:
![]()
0,072 -0,5·10 - 4C +0,2 ·10 -7C2
ROZW.
![]()
-0,5·10 - 4 +2·0,2·10 -7 C
C=0,5 mol/dm3=500 mol/m3
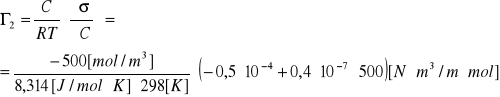
Γ2=0,000006054= 6,054·10 -6[mol/m3]
3b. ![]()
0,073-1,09·10 -4 +1,07·10-7 c2
Kol.4
1.Roztwór zawierający 0,025 mola Na2SO4 w 100 g wody poddano elektrolizie w aparacie Hittorfa. Na anodzie przebiegła reakcja: 2H2O = 4 H+ + O2 +4e- po zakończeniu elektrolizy przestrzeń anodowa zawierała 100 g H2O i 0,01 mola jonów H+, które oznaczono przez ![]()
miareczkowanie, tNa+=0,390. Określić liczbę moli jonów Na+ , SO3 2 - po zakończeniu doświadczenia. MNa=23g/mol , MS=32g/mol.
2.Korzystając z równania Hickla-Debaya obliczyć średni współczynnik aktywności jonów , oraz aktywność elektrolitu roztworze wodnym Al2(SO4)3 o stężeniu m=0,02 mol/kg
A=0,509 , a·B=1 , a2=?
ROZW.
![]()
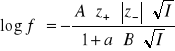
![]()
![]()
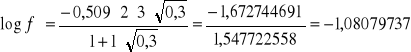
![]()
![]()
![]()
![]()
![]()
![]()
![]()
3.Standardowa siła elektromotoryczna ogniwa:
Pt, H2(g)│HClaq│AgCl(s),Ag(g)
Zależy od temperatury w następujący sposób: Eo=0,2224-6,4 · 10 -4(T-298) [V]
Obliczyć: ΔGo, ΔHo, Ka reakcji zachodzącej w tym ogniwie oraz silę elektromotoryczną w temperaturze 328K
ROZW.
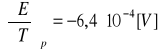
![]()
![]()
![]()
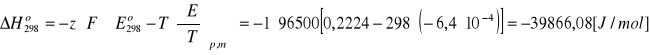
![]()
![]()
![]()
Kol.5
1.Reakcja rozkładu nadtlenku wodoru przebiega zgodnie z równaniem:
H2O2=H2O +1/2 O2
Kinetykę tej reakcji badano miareczkując za pomocą roztworu KMnO4 próbki o jednakowej objętości (5cm3) pobierane co pewien czas. Otrzymano następujące wyniki:
t [min] |
127 |
135 |
141 |
148 |
V[cm3] |
9,50 |
7,01 |
5,58 |
4,28 |
Wyznaczyć rząd i stałą szybkości reakcji.
ROZW.
Metoda różnicowa Van't Hoffa.
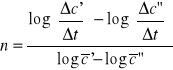
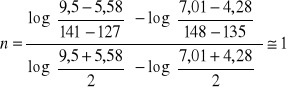
Dla reakcji I rzędu:
![]()
zatem:
![]()
![]()
![]()
![]()
2Stała szybkości reakcji : CH3COOH3 +NaOH =CH3COONa +CH3OH ,
wynosi 4,9 [dm3/mol·min] w temperaturze 293K. Obliczyć jaki procent estru ulegnie zmydleniu w tej temperaturze po 8-miu minutach, jeżeli początkowe stężenie estru i zasady są jednakowe i wynoszą 0,03 [mol/dm3].
ROZW.
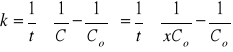
![]()
![]()
![]()
zostało: 46%
przereagowało:54%
3. Zależność stałej szybkości reakcji rozkładu arsenowodoru AsH3 od temperatury, w zakresie 500-1000K, przedstawia równanie:
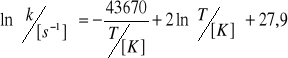
Wyznaczyć zależność energii aktywacji od temperatury oraz energię aktywacji w temperaturze 800K.
![]()
po zlogarytmowaniu:
![]()
po zróżniczkowaniu:
![]()
![]()
pochodna równania
![]()
![]()
![]()
![]()
[J/mol]=3,24246[MJ/mol]
4.Reakcja pierwszego rzędu: A→produkt , ustalono ze po jednej godzinie A/Ao = 0,125.Początkowo w układzie znajdowało się 0,2 mola gazu A (warunki normalne). Wyznaczyć czas połowicznego przereagowania oraz początkową szybkość reakcji.
ROZW.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
5.Okres połowicznego rozpadu reakcji I-rzedu wynosi :
τ1=100 min przy T=323K,
τ2=15 min przy T=353K.
Obliczyć Ea.
ROZW.
Równanie Arrheniusa: ![]()
po scałkowaniu: 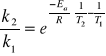
i po zlogarytmowaniu: 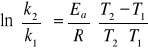
![]()
o
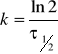
![]()
![]()
, lub: ![]()
![]()
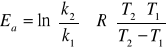
![]()
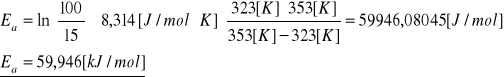
6.Po 800 s przereagowała połowa początkowej ilość substancji. Jaka część po 1100s ?
dla reakcji I rzędu,
dla reakcji II rzędu.
ROZW.
a)
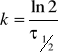
![]()
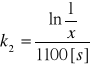
![]()
![]()
![]()
zostało:38,55%
przereagowało:61,45%
b)
![]()
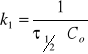
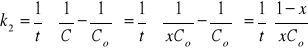
![]()
![]()
![]()
![]()
zostało: 36,347%
przereagowało: 64,63%
7. A+B→produkty, T=298K
Wyjściowe jednostkowe stężenie produktów:
t |
0 |
30 |
60 |
180 |
360 |
C |
0,05 |
0,0485 |
0,0472 |
0,0426 |
0,0386 |
Wyznaczyć rząd i stałą szybkości reakcji.
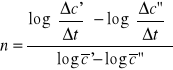
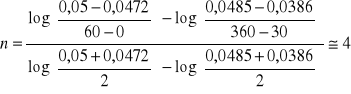
(1/3-2/5)
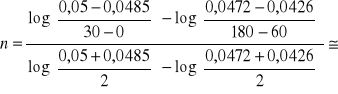
2,8 (1/2-3/4)
18
Wyszukiwarka
Podobne podstrony:
ZADANIA Z ĆWICZEŃ(1)
kryteria do zadania cwiczeniowego
Zadaniedo8 ćwiczenia KORELACJA, Rok I, matematyka
cwiczenia kolosy egzaminy
psio zadania cwiczenia-1, Programowanie
Zadania - ćwiczenia, Fizyka - zestaw zadań, Fizyka
Zadania ćwiczenia 9
ZC dwa kolosy, Studia, UR OŚ, semestr IV, zagrożenia cywilizacyjne, ćwiczenia, kolosy
Cel i zadania ćwiczeń oddechowych
zadania z ćwiczeń, 2, Zad
Zadania - ćwiczenia, ciepło, Zadania
zadania z ćwiczeń, stata2, 1)Wariancja skosnosci ma zawsze wartosc dodatna - NIE
zadania z ćwiczeń, 1.1, 1
zadania z ćwiczeń, stata2, 1)Wariancja skosnosci ma zawsze wartosc dodatna - NIE
zadania z ćwiczeń, 1.1, 1
zadania cwiczeniowe 2011-12
Zadania-cwiczenia2
ĆWICZENIA LOGOPEDYCZNE STYMULUJĄCE ROZWÓJ MOWY DZIECKA W WIEKU PRZEDSZKOLNYM, dla dzieci różńości, n
więcej podobnych podstron