Przenoszenie acetylo-CoA z mitochondrium do cytoplazmy
(narysować cykl + opisać)
-synteza kwasów tłuszczowych przebiega w cytozolu, ale acetylo-CoA powstaje z pirogronianu w mitochondriom
-dlatego też synteza kwasów tłuszczowych wymaga przeniesienia acetylo-CoA z mitochondriom do cytozolu -> dlatego ten proces
-sam acetylo-CoA nie może przenikać przez wewnętrzną błonę mitochondrialną, dlatego dochodzi do kondensacji acetylo-CoA ze szczawiooctanem, prowadzącej do powstania cytrynianu
-cytrynian jest transportowany do cytozolu, gdzie ulega rozszczepieniu przez liazę cytrynianową zależną od ATP, co umożliwia odtworzenie acetylo-CoA i szczawiooctanu
-szczawiooctan nie może jednak wrócić przez błonę mitochondrialną (u zwierząt), dlatego ulega przemianie do jabłczanu i pirogronianu
Miejsca regulatorowe w cyklu Krebsa
Regulowane są 3 enzymy wchodzące w cykl i dehydrogenza pirogronianowa;
-syntaza cytrynianowa
-dehydrogenaza cytrynianowa
-dehydrogenaza α-ketoglutaranu
-dehydrogenaza pirogronianowa
reakcja hamowana przez ATP i NADH, stymulowana przez ADP
reakcja hamowana przez bursztynylo-CoA i NADH
reakcja hamowana przez ATP i cytrynian
Na regulacje cyklu mają wpływ:
-dostępność do substratów
-hamujące działanie nagromadzonych produktów
-allosteryczne hamowanie przez następne intermediaty cyklu oparte na mechanizmie sprzężania zwrotnego
-enzymy
1. Syntetaza cytrynianowa -> hamowana przez cytrynian i ATP
2. Dehydrogenaza izocytrynianowa -> hamowana przez NADH i ATP, lecz aktywowana ADP
3. Dehydrogenaza α-ketoglutaranowa -> hamowana przez NADH i bursztynylo-CoA
4. Dehydrogenaza pirogronianowa -> hamowana przez NADH i acetylo-CoA (hamowanie produktu)
Podsumowując, cykl przebiega szybciej, gdy poziom energii w komórce jest niski (duże stężenie ADP, małe stężenie ATP i NADH), a zwalnia swój przebieg, gdy dochodzi do akumulacji ATP (a zatem także NADH, busztynylo-CoA i cytrynianu)
Czółenko jabłczanowo- asparaginianowe
Czółenko to funkcjonuje w sercu i wątrobie
Szczawiooctan w cytozolu ulega przekształceniu w jabłczan przez cytoplazmatyczną dehydrogenazę jabłczanową. Na tym etapie następuje reoksydacja NADH do NADH+.
Jabłczan przeniesiony do mitochondriom przez przenośnik jabłczanowo-α-ketoglutaronowy
U zwierząt szczawiooctan nie przechodzi przez wewnętrzną błonę mitochondrialną, dlatego też w reakcji transaminacji zostaje przekształcony w asparaginian, który wówczas wychodzi z mitochondriom i w cytozolu ulega powtórnemu przekształceniu w szczawiooctan, dzięki transaminacji
Rezultatem netto tego cyklu reakcji jest przeniesienie elektronów z NADH wytworzonego w cytozolu do NADH wytworzonego w matrix mitochondrialnym.
4. ENZYMY W REPLIKACJI DNA U PROCARYOTA I EUCARYOTA
Polimeraza RNA (prymaza)
-katalizuje syntezę startera (krótki odcinek RNA o długości ok. 5 nukleotydów)
-może syntetyzować starter bezpośrednio na 1-niciowej matrycy DNA, ponieważ, jak wszystkie inne polimerazy RNA, do rozpoczęcia syntezy nie wymagają startera
Polimeraza DNA I
-katalizuje przyłączenie kolejnych deoksyrybonukleotydów do grupy 3'-OH istniejącego już fragmentu DNA
-w środowisku reakcji musi znajdować się starter z wolną grupą 3'-OH, do której przyłączy się polimeraza i nastąpi wydłużenie
-ma aktywność edytorską - dokonuje korekty błędów w DNA, polegającej na usuwaniu niepoprawnie dobranych nukleotydów
-degraduje starter i zastępuje go DNA
-zlokalizowana w jąderku syntetyzuje pre-rRNA, rRNA 28S, 18S, 5,8S
Polimeraza DNA II i III
-również katalizują syntezę DNA z 5'-trifosforanów deoksyrybonukleotydów zgodnie z instrukcjami matrycowego DNA
-wymagają startera z wolną grupą 3'-OH i wydłużają go w kierunku 5' -> 3' oraz wykazują aktywność egzonukleazy w kierunku 3' -> 5'
-(II) występuje w nukleoplazmie i odpowiada za syntezę pre-mRNA, mRNA i małych jądrowych (snRNA) uczestniczących w dojrzewaniu
-(III) występuje w nukleoplazmie, wytwarza pre-RNA i tzw. 5S-rRNA, tRNA i frakcji regulacyjnych np. 7SRNA i snRNA
-w prokaryota mogą tylko jedną polimerazą RNA, która katalizuje syntezę wszystkich rodzajów RNA wykorzystując do tego informacje zawarte na jednej nici dwuniciowej cząsteczki DNA
Helikaza DNA
-rozplata dwuniciowy heliks poprzez degradację wiązań wodorowych między zasadami
-wykorzystuje ATP jako źródło energii
Białko DBP i 5SB
-zapobiega odtwarzaniu suę par zasad czyli ponownemu tworzeniu wiązań wodorowych
-dzięki niemu każda z dwóch nici wyjściowego DNA jest gotowa do replikacji
Ligaza DNA
-łączy fragmenty DNA występujące w postaci fragmentów okazaki
Topoizomeraza I (tylko prokaryota)
-enzym rozkładający wiązania fosfodiestrowe w jednej z nici DNA (umożliwia to swobodną rotację nici wokół drugiej roziętej nici)
Topoizomeraza II (tylko prokaryota)
-enzym rozkładający dwa złączone pierścienie tworzące szczelinę przez którą może się wydostać drugi enzym
-następnie ten sam enzym spaja rozcięte kręgi i w rezultacie tworzą się dwa koła
5. Funkcja dehydrogenazy glutaminowej
1) katalizuje redukcyjną aminację α-ketoglutaranu; pośredniego metabolitu CKTK
-dehydrogenaza ta działa zarówno z NAD, jak i z NADP
2) bierze udział w katabolizmie aminokwasów
-dehydrogenaza glutaminianowi składa się z 6 identycznych podjednostek i podlega regulacji allosteryczne
-inhibitory allosteryczne -> GTP, ATP
-aktywatory allosteryczne -> GDP, ADP
-w momencie gdy stan energetyczny komórki jest niski dehydrogenaza glutaminianowa i zwiększa się utlenienie aminokwasów
-powstające szkielety węglowe są zużywane, następnie jako paliwo metaboliczne, wchodzą do cyklu kwasu cytrynowego i w końcu, uwalniające energię podczas fosforylacji oksydacyjnej
6. Pomost łączący glikolizę z cyklem Krebsa (napisz reakcję)
*glikolizę z cyklem Krebsa łączy oksydacyjna dekarboksylacja pirogronianu zachodząca w matrix mitochondrialnym
To nieodwracalne przekazanie produktu glikolizy do cyklu kwasu cytrynowego jest katalizowane przez kompleks dehydrogenazy pirogronianowej
*pirogronian (glikoliza) ulega redukcyjnej karboksylacji
-powstały jabłczan włącza się do CKTK, gdzie z udziałem dehydrogenazy jabłczanowej ulega odwodornieniu do szczawiooctanu
*
Fosfoenolopirogronian -> to jeden z końcowych produktów glikolizy
*
7. Czółenko glicerolo-3-fosforanowe
Czółenko błonowe to połączone reakcje enzymatyczne pozwalające obejść barierę przepuszczalności. Takie reakcje są konieczne gdyż wewnętrzna błona mitochondrialną jest nieprzepuszczalna dla NADH, dlatego NADH wytworzone w cytoplazmie podczas glikolizy musi być z powrotem utleniony.
1) fosfodihydroksyaceton jest redukowany w CYTOZOLU do glicerolo-3-fosforanu przez dehydrogenazę glicerolo-3-fosforanową. Na tym etapie następuje również reoksydacja NADH do NAD+.
2) glicerolo-3-fosforan dyfunduje do wewnętrznej błony mitochondriom gdzie ulega przekształceniu do dihydroksyacetonu przez mitochondrialną dehydrogenazę glicerolo-3-fosforanową, która zamiast z NAD+ współpracuje z FAD. FADH2 związany jest z enzymem (E. FADH2) ulega reoksydacja przez przeniesienie jego elektronów do ubichinonu znajdującego się w wew. bł. mitochondrialnej.
Czółenko przenosi do mitochondriom 2e z NADH i wprowadza je do łańcucha transportu elektronów.
8. Powiązanie syntezy fosforanu kreatyny (fosfagenu) z cyklem ornitynowym
1) arginina - produkt pośredni cyklu mocznikowego; ulega kondensacji z glicyną i powstaje guanidynooctan
2) guanidynooctan - jest etylowany przez dawcę reszty metylowej (S-adenozynometioninę) do keratyny
3) keratyna - ulega fosforyzowaniu i przechodzi w fosforan keratyny
Fosforan keratyny występuje w mięśniach, stanowi zapas łatwo mobilizowanej wysokiej energii.
Bierze udział w przemianie energii w mięśniach.
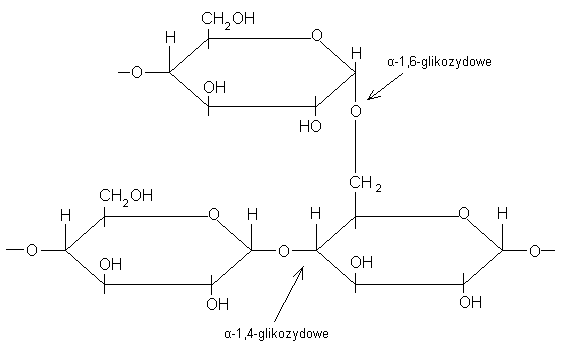
9. Enzymy rozkładające glikogen
GLIKOGEN - jest polisacharydem o rozgałęzionym łańcuchu, zawierający reszty glukozy połączone wiązaniem:
-α-1,4-glikozydowym
-α-1,6-glikozydowym
Rozgałęziona struktura glikogenu powoduje, że jest on łatwiej dostępny dla enzymów powodujących jego rozpad
-FOSFORYLAZA GLIKOGENOWA (FOSFORYLAZA)
-rozbija wiązanie α-1,4-glikozydowe
-usuwa kolejno reszty glukozy z nieredukującego końca cząsteczki glikogenu w formie glukozo-1-fosforanu
-nie potrafi rozerwać wiązania α-1,6-glikozydowego
-drugim substratem, który „współpracuje” z fosforylazą jest fosforan nieorganiczny (Pi)
-fosforylacja usuwa tylko te reszty glukozy, które są oddalone od miejsca rozgałęzienia o więcej nić 5 jednostek
ENZYM USUWAJĄCY ROZGAŁĘZIENIA: fosfoglukometaza
Usuwa wiązania α-1,4-glikozydowe w miejscach rozgałęzienia
Dalszy los glukozo-6-fosforanu zależy od tkanki:
-w wątrobie: znajduje się enzym glokozo-6-fosfataza przekształcająca go w glukozę, która następnie dyfunduje do krwi
-w mięśniach: proces rozkładu glikogenu służy do uzyskania energii, dlatego też glukozo-6-fosforan jest natychmiast metabolizowany w szlaku glikolizy. W tej tkance nie ma glukozo-6-fosfatazy.
GLUKOAMYLAZA
-rozkłada wiązania α-1,4- i α-1,6-glikozydowe do glukozy
-rozkład następuje w przewodzie pokarmowym kręgowców (bo to enzym hydrolityczny)
10. Powiązanie cyklu mocznikowego i Krebsa
(reakcje prowadzące do wspólnych metabolitów)
Oba cykle połączone są przez fumaran i transaminacje szczawiooctanu do asparaginian.
-synteza fumaranu przez liazę argininobursztynianową łączy cykl mocznikowy z cyklem Krebsa
-fumaran jest produktem pośrednim cyklu Krebsa, który po uwodnieniu tworzy jabłczan, który utlenia się do szczawiooctanu
-powstały szczawiooctan może ulegać transaminacji np. do asparaginian i powrócić do cyklu mocznikowego
11. Przenoszenie CoA-SH z cytoplazmy do mitochondrium
-cząsteczki acetylo-CoA o krótkich i średnio długich łańcuchach ( do 10 at.) łatwo przenikają przez wew. bł. mitochondrium
-przejście cząstek acetylo-CoA o dłuższych łańcuchach wymaga już specyficznego mechanizmu transportu
-reszty acylowe cząstek acetylo-CoA o dłuższych łańcuchach przekraczają wewnętrzną błonę po sprzężeniu z polarną cząsteczką karnityny, która występuje zarówno u roślina jak i u zwierząt
-reakcja sprzęgania katalizowana jest przez enzym ulokowany na zewnętrznej części wewnętrznej błony mitochondrium (ACYLOTRANSFERAZA KARNITYNOWA I) i polega na usunięciu CoA oraz zastąpieniu go karnityną
-translokaza karnityna/acylokarnityna transportuje acylokarnitynę przez wewnętrzną błonę mitochondrium do matrix
-cząsteczki karnityny są uwalniane do acylokarnityny a grupa acylowa z powrotem przenoszona jest na CoA
-reakcja katalizowana jest przez acylotransferaze karnitynową II, znajdującą się na wewnętrznej błonie mitochodnium, od strony matrix.
12
13. Degradacja Edmana
Służy do oznaczania N-końcowych aminokwasów w białkach
14. Transaminacja asparaginowa (reakcja z udziałem koenzymu)
-jako koenzym fosforan pirydoksalu
Transaminacja - proces przeniesienia grupy aminowej z aminokwasu na odpowiedni alfa-ketokwas
Aminokwas z koenzymem tworzy przejściowe połączenie typu zasada Schaffa. Podwójne wiązanie xxx przegrupowanie i rozerwanie. Uwalnia się alfa-ketokwas oraz fosforan pirydoksalu.
15. Fosforylacja substratowa w CKTK (cyklu kw. trikarboksylowych)
Proces ten katalizowany jest przez syntetazę byrsztynylo-CoA
-energia uwalniana podczas rozerwania wiązania byrsztynylo-CoA jest wykorzystywana do syntezy
-GTP (u zwierząt)
-ATP (wyłącznie u roślin)
Fosforylacja substratowa - przeniesienie P, aby powstał związek wysokoenergetyczny np. ATP, GTP
16. Reakcje glukoneogenezy zachodzące w mitochondrium
Glukoneogeneza
- proces, w którym zachodzi synteza glukozy z prekursorów nie będących cukrami
-ma duże znacznie dla podtrzymania zawartości glukozy we krwi podczas głodowania lub intensywnego wysiłku fizycznego
-zachodzi w wątrobie, w mniejszym stopniu w nerkach
-większość enzymów glukoneogenezy znajduje się w cytozolu, natomiast karboksylaza pirogronianowa jest w matrix mitochondrialnym
17. Różnice w budowie i funkcji glikogenu i celulozy
GLIKOGEN
Budowa:
-zbudowana z jednostek glukozowych połączonych wiązaniem α-1,4-glikozydowym, w ten sposób tworzy się długi łańcuch
-co 10 jednostek następuje rozgałęzienie łańcucha (wiązanie α-1,6-glikozydowe)
-zakończeniem każdego łańcucha jest koniec nieredukujący z wolną grupą 4'OH
Enzymy:
-wiązania α-1,4-glikozydowe rozkłada fosforylaza glikogenowa
α-1,6-glikozydowe rozkładają enzymy usuwające rozgałęzienia
-każdy wyprostowany odcinek łańcucha glikogenu tworzy konformacje otwartej helisy, która zwiększa jego dostępność dla enzymu
CELULOZA
Budowa:
-nierozgałęziony łańcuch
-zbudowany z jednostek glukozy połączony wiązaniem β-1,4-glikozydowym
-wiązania β między resztami glukozy tworzą długie, proste łańcuchy ułożone równolegle we włókna
Enzymy:
-ssaki, włącznie z człowiekiem, nie mają enzymów rozkładających celulozę
-przeżuwacze nie mają takiego problemu, posiadają enzym - celulazę -> wytwarzają go bakterie żyjące w ich przewodzie pokarmowym
18. Rola asparaginianu w cyklu mocznikowym
Asparaginian kondensuje się z cytruliną, do argininobursztynianu za pomocą syntetazy asparaginobursztynianowej.
Przemiany szczawiooctanu w komórce:
1) Transaminacja do asparaginianu, który może następnie powrócić do cyklu mocznikowego
2) Kondensacja z acetylo-CoA do cytrynianu, który dalej ulega przekształceniom w CKTK
3) Przekształcenie w glukozę podczas glukoneogenezy
4) Przekształcenie w pirogronian
19. Reakcja katalizowana przez oksydazę glukozową
Oksydaza glukozowa
-stosuje się go do pomiaru stężenia glukozy we krwi u pacjentów chorych na cukrzycę
-nie powoduje żadnej zmiany absorbancji podczas przemiany substratu w produkt
(ochrona produktów spożywczych przed utlenieniem- zapobiega ciemnieniu żywności)
Wytworzony H2O2 można poddać działaniu kolejnego enzymu - peroksydazy - która przemienia równocześnie związek bezbarwny w barwny (chromogen(, którego absorbancję łatwo jest zmierzyć.
-Jeśli aktywność pierwszego enzymu ma być mierzona dokładnie, to drugi enzym (peroksydaza) musi być użyty w nadmiarze, tak aby ten drugi enzym nie stanowił ograniczającego etapu w tym złączonym pomiarze.
20. Napisz reakcje, przy pomocy których jon amonowy jest dostarczany do cyklu mocznikowego
21. Wspólne elementy strukturalne dla wszystkich tRNA
Każdy z tRNA ma strukturę drugorzędową przypominającą liść koniczyny
Struktury typu spinka do włosów nazywane są ramionami tRNA:
-ramię antykodonowi - zawiera w swojej pętli 3 nukleotydy tworzące antykodon, parujące się w trakcie translacji z komplementarnym kodonem w MRNA
-ramię D (lub DHU) - zawiera dihydrouracyl (zmodyfikowany nukleozyd pirymidynowy)
-ramię T (TΨC) - zawiera jeszcze inny zmodyfikowany nukleozyd (pseudourycynę) leżącą w sekwencji TΨC, za względu na zawartość specyficznej sekwencji nukleozydofosforanów, służy ona jako punkt zaczepu dla enzymu aktywującego aminokwasy
-niektóre tRNA mają również dodatkowe ramię (zmienne), którego długość waha się od 3 do 21 nukleotydów
-cząsteczki tRNA mają też ramię aminokwasowi (to właśnie do tego ramienia, do gr. 3'OH adenozyny występującej w sekwencji CCA, przyłączany jest aminokwas w aminoacylo-tRNA
Przeniesienie zaktywowanych aminokwasów na mRNA znajdujące się na rybosomie (w celu wytworzenia aktywnej formy aminokwasu, czyli aminoacylo-tRNA, następuje działanie specyficznego enzymu - syntezy - aminoacylo-tRNA z wybranym aminokwasem i ATP)
22. Fermentacje alkoholowe (glicerolowa, etanolowa), napisz reakcje
* Fermentacja etanolowa
* Fermentacja glicerolowa
23. Narysuj 2 nukleotydy purynowe poł. wiązaniem międzycząsteczkowym
24. Napisz wzory 2 nukleozydów purynowych występujących w DNA
* Purynowe
* Pirymidynowe
25. Reakcja katalizowana przez transaminazę alaninową,
z udziałem odpowiedniego koenzymu
26. Wyjaśnij pojęcia struktur białek: a-heliks, b-heliks, struktura beta
=> należą do III-rzędowych struktur
Za względu na stopień zwinięcia łańcucha polipeptydowego wyróżnia się:
-α helisę (prawoskrętną) - struktura regularna
-β helisę (lewoskrętna) - struktura regularna
-strukturę β (pasmowa, pofałdowane kartki)
α helisa: forma śruby prawej
-stanowi cylindryczne, spiralne ułożenie aminokwasów w łańcuchu polipeptydowym, utrzymywane dzięki wiązaniom wodorowym
-na 1 obrót α helisy przypada 3,6 aminokwasów (0,54nm)
-odległość między dwoma aminokwasami wzdłuż α helisy = 0,15nm
-wszystkie łańcuchy boczne aminokwasów znajdują się na zewnątrz cylindrycznej helisy
Struktura β:
-wiązania wodorowe powstają między przylegającymi częściami polipeptydu
-płaskie wiązanie peptydowe sprawia, że łańcuch polipeptydowy przyjmuje postać pofałdowanej kartki z łańcuchami bocznymi znajdującymi się niżej lub wyżej płaszczyzny
-łańcuchy polipeptydowe sąsiadujące ze sobą w strukturze β mogą być:
a) równoległe
b) antyrównoległe
-struktury β są zawsze lekko zakrzywione i w obecności kilku łańcuchów polipeptydowych mogą się ścieśnić i tworzyć beczułkę
=> kilka struktur β to podstawa wytrzymałości
27. Kazeina (występowanie+ budowa)
-białko mleka (76-86%)
-podstawowa masa twarogów i serów twardych
-należy do fosfoprotein ze względu na związany estrowo fosforan z gr. OH (Ser i Thr)
* fosfor wiąże dużo Ca2+ => kazeinian wapnia, a związany Ca odznacza się znaczną przyswajalnością
-enzym zwany reniną lub podpuszczką, wytwarzany w ścianie żołądka młodych ssaków, powoduje wytrącanie białka związanego z jonami Ca2+ , przekształcając sól wapienną kazeiny w parakazeinian wapnia
-w trakcie wytrącania białka w odczynie kwaśnym, sól kazeinogenu przekształca się w wolną kazeinę, a jon Ca2+ przechodzi do roztworu => odbija się to ujemnie na wartości odżywczej serów twarogowych w porównaniu z serami podpuszczkowymi
-kazeina nie jest białkiem jednorodnym, gdyż składa się z frakcji α, β i χ
-po oddzieleniu z mleka wytrąconej kazeiny pozostaje żółtawy roztwór, zwany serwatką, zawierający białka typu albuminy i globuliny.
28. Różnice między: glutationem, glutaminą, glutenem
1) GLUTATION
Tripeptyd: 5-gutanylo-cysteinylo-glicyna (5-Glu-Cys-Gly)
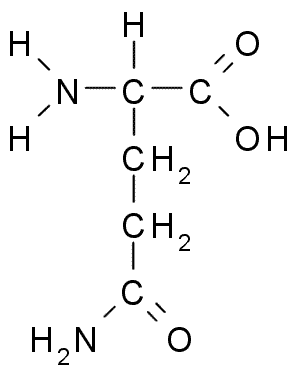
2)GLUTAMINA (Glu)
-Aminokwas białkowy kwaśny
-amid kwasu glutaminowego
-występuje w szczególnie dużych ilościach w białkach roślinnych
-stanowi bogatą rezerwę azotową
-uczestniczy w biosyntezie nukleotydów purynowych
3) GLUTEN
Wyjątek wśród białek elastomerycznych
-występuje jako białko zaporowe ziarniaków pszenicy, żyta ale nie owsa
-pełni funkcje magazynowania azotu dla rozwijającego się zarodka
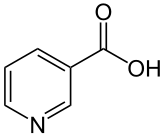
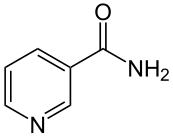
29. W skład jakiego koenzymu wchodzi wit. PP? Napisz jej wzór
-witamina PP (niacyna) wchodzi w skład koenzymów przenoszących protony i elektrony współdziałających z oksydoreduktazami, a konkretniej dehydrogenazą, a mianowicie: dinukleotyd nikotynoamidoadeninowy (NAD+) i fosforan dinukleotydu nikotynoamidoadeninowego (NADP+)
=>cząsteczki obu koenzymów składają się z 2 nukleotydów powiązanych przez fosforany
->pierwszym, nukleotydem jest AMP
-> drugim nukleotydem jest amid kwasu nikotynowego = niacyna (Wit. PP)
*zapobiega chorobie skóry (pelagra)
*bogatym źródłem są Ryny, mleko, nasiona roślin
*Trp zapobiega brakom wit. PP, bo jest jej prekursorem w biosyntezie
![]()
![]()
30. Glutation- budowa i funkcje
Budowa:
*tripeptyd o nazwie 5-glutamylo-cysteino-glicyna (5-Glu-Cys-Gly)
*symbol formy zredukowanej/utlenionej = 2G-SH/G-S-S-G
*jedno z wiązań jest nietypowe, gdyż tworzy je grupa 5-karboksylowa Glu (glutaminian), a nie jak w białkach grupa przy C1
Funkcje:
*dzięki grupie hydroksylowej pochodzącej z Cys, łatwo ulega odwodornieniu z wytworzeniem glutationy utlenionego
2G-SH <-> G-S-S-G + 2H+ +2e
*ze względu na odwracalność reakcji 2G-SH/G-S-S-G jest biologicznym przenośnikiem elektronów
*koenzym liazy laktoiloglutationowej, katalizującej przemianę metyloglioksalu do kwasu mlekowego
*jego biosynteza zachodzi w wątrobie
*występuje w żółtku jaj i czerwonych ciałkach krwi
*wyizolowany po raz pierwszy w drożdżach
31. Mechanizm wodorowania NAD+ -----> NADH + H+
*mechanizm przemian ich grupy czynnej (amidu kwasu nikotynowego) w reakcji oksydoredukcyjnej
32. B-utlenianie kwasów tłuszczowych
-rozpad kwasów tłuszczowych, czyli B-oksydacja, polega na utlenieniu długołańcuchowych kwasów tłuszczowych, czemu towarzyszy wytworzenie ATP
-cykl B-oksydacji obejmuje powtarzającą się sekwencję 4 reakcji, z czego reakcjami, w których następuje utlenianie to reakcje nr 1 i nr 3
1) utlenianie acylo-CoA do enoilo-CoA, zawierającego w łańcuchu kwasu tłuszczowego wiązanie podwójne trans- B, czemu towarzyszy powstanie FADH2 (redukcja katalizowana przez dehydrogenazę acylo-CoA)
3) utlenianie 3-hydroksyacylo-CoA do 3-ketoacylo-CoA, czemu towarzyszy powstanie NADH (reakcja katalizowana przez dehydroksyacylo-CoA)
33. Przemiana kw. fosfatydowego do TAG
34. Synteza CP (karbamoilofosforanu) u ssaków i bakterii
*u ssaków i roślin
*N-acetyloglukozoaminian -> kofaktor w reakcji zachodzącej u ssaków
*N-acetyloglutaminian
*u bakterii:
*karbamoilofosforan - służy w przemianie ornityny w cytrulinę jako dawca grupy karbamoilowej i energii
35. Elongacja w procesie biosyntezy białka
-na tym etapie kodon inicjujący (AUG) znajduje się w miejscu P z tMet-tRNA związanym przez sparowanie kodonu z antykodonem
-cząsteczka aminoacylo-tRNA odpowiadająca drugiemu kodonowi wiąże się w miejscu A rybosomy w reakcji wymagającej GTP i katalizowanej przez czynnik elongacyjny EF-T
-wiązanie peptydowe jest tworzone prze peptydotransferazę między końcem C grupy aminoacylo-tRNA w miejscu P, a grupą aminową aminoacylo-tRNA w miejscy A. Koniec karboksylowy zostaje odłączony od tRNA w miejscy P i dołączony do N-końca aminokwasu z tRNA w miejscu A
-w ostatniej reakcji etapu translokacji uwolniony tRNA opuszcza miejsce P, nowo utworzony peptydylo-tRNA przemieszcza się z miejsca A do P a rybosom przesuwa się wzdłuż mRNA o 3 nukleotydy, aby umieścić następny kodon w miejscu A
*
-kompleks z metionylo-tRNA umieszczony w obszarze P rybosomy, jest gotowy do wydłużenia łańcucha peptydowego
1) związanie tRNA pasującego do kodonu znajdującego się w obszarze A rybosomy i niosącego aminokwas następny w łańcuchu peptydowym
2) wytworzenie wiązania peptydowego z uwolnieniem tRNA z obszaru P i przeniesieniem rosnącego peptydu na tRNA w obszarze A
3) translokacja peptydylo-tRNA z obszaru A do P, usunięcie uwolnionego tRNA z rybosomu i przeniesienie mRNA o jeden kodon do przodu w celu umieszczenia następnego kodonu w obszarze A
36. Przenoszenie AMP (reakcja z ATP) z aminokwasami i kw. tłuszczowymi
-reakcja przenoszenia AMP na kwas tłuszczowy lub aminokwas, w wyniku czego powstają aminoacylo- lub acylo-AMP, są to kluczowe reakcje przy aktywacji kwasów tłuszczowych poprzedzające B-utlenianie kwasów tłuszczowych
Ad - adenozyno
Rb - ryboza
37. Etap elongacji w kom. prokariotycznych
-po zakończeniu inicjacji transkrypcji podjednostka sigma opuszcza centrum aktywne, odłącza się od holoenzymu
-etap elongacji syntezy RNA rozpoczynający się po utworzeniu pierwszego wiązania fosfodiestrowego jest katalizowany przez rdzeń polimerazy RNA
-w powstającym transkrypcje pierwszym nukleotydem jest zawsze pppG lub pppA
-polimeraza RNA dokonuje syntezy łańcuchów RNA w kierunku 5'-3', wykorzystując jako substraty 5'-trifosforany czterech rybonukleozydów (ATP, CTP, GTP, UTP)
-grupa 3'OH znajdująca się na końcu rosnącego łańcucha RNA atakuje fosforan alfa nowo wchodzącego 5'-trifosforanu rybonukleozydu -> co prowadzi do powstania wiązania 3',5'-fosfodiestrowego i uwolnienia pirofosforanu
-kompleks utworzony przez polimeraze RNA, matrycę DNA oraz rosnący transkrypt jest określany jako bąbel transkrypcyjny => to rejon DNA, w którym dwuniciowa helisa DNA ulega otwarciu, umożliwiając zajście transkrypcji
-dwuniciowy DNA ulega rozplataniu przed bąblem transkrypcyjnym i ponownemu splataniu po przeciwnej jego stronie
38. Powstawanie adrenaliny w organizmach
-hormon wytwarzany przez rdzeń nadnerczy, a także wydzielany na zakończeniach włókien pozazwojowych współczulnego układu nerwowego
-powoduje wzrost tętna i ciśnienia krwi
-wzmaga koncentrację i niweluje senność
-powoduje ogólne pobudzenie organizmu
-hamuje perystaltykę jelit
-nazywana jest hormonem stresu
39. Enzymy rozkładające wiązanie a-1,6-glikozydowe w skrobi
*GLUKOAMYLAZA
rozkłada po kolei każde wiązanie a-1,4- i a-1,6-glikozydowe w skrobi od końca niealdehydowego
*AMYLO-1,6-GLUKOZYDAZA
Atakuje dekstryny o krótkich łańcuchach, ale na skrobię działa słabo
*ENZYM R
Rozkłada miejsca rozgałęzień (wiązań a-1,6-glikozydowe) w amylopektynie
*PULLULANAZA
Rozkłada wiązanie a-1,6-glikozydowe skrobi, występuje u bakterii
40. Wymień reakcje nieodwracalne w glukozie. Napisz jedną z nich
*fosforylacja glukozy
*fosforylacja fruktozo-6-fosforanu
*przeniesienie grupy fosforytowej z PEP na ADP
41. Produkty dekarboksylacji aminokwasów (składniki, enzymy, aminy biogenne).
Przykłady występowania w koenzymie.
-w reakcji dekarboksylacji aminokwasów wydziela się CO2 i powstaje amina biogenna (-> o dużej aktywności biologicznej)
-enzymy katalizujące tą reakcję to dekarboksylazy aminokwasowi -> należą do klasy liaz i są rozpowszechnione szczególnie wśród bakterii
-enzymy wymagają współudziału koenzymu - 5-fosforanu pirydoksalu, z którym aminokwasy tworzą również połączenie; zasadę Schaffa
42. Udział Asp w biosyntezie nukleotydów pirymidynowych
43. tRNA - budowa i funkcje
Budowa:
-typowa cząstka zawiera 70-90 nukleotydów, będąc przez to najmniejszą cząsteczką w komórce
-występuje w cytoplazmie podstawowej
-masa cząsteczkowa 25kDa
-struktura pierwotna i wtórna dobrze poznana
-ma strukturę II rzędową => w formie liścia koniczyny, w której to antykodon jest dostępny na końcu pętli antykodonowej
*antykodon to trójka nukleotydów, którymi tRNA dopasowuje się do właściwego kodonu mRNA
Funkcje:
-wiąże i transportuje zaktywowane aminokwasy z cytoplazmy do miejsc syntezy białka -> rybosomów
8dla poszczególnych aminokwasów istnieją różne tRNA różniące się swym antykodonem
-każda cząstka tRNA niesie tylko jeden aminokwas
-cząstka tRNA przyjmuje strukturę „liścia koniczyny” zawierającą wewnątrzcząsteczkowe rejony sparowane tworzące cztery ramiona tej struktury
=> 3 spośród tych ramion są strukturami typu spinki (trzon + pętla)
=> w pętli ramienia antykodonowego jest zawarta sekwencja antykodonu
=> każda cząsteczka tRNA na końcu 5' zawiera grupę fosforanową, a na końcu 3' znajduje się sekwencja CCA z wolną grupą 3'-OH
44. Synteza 4-węglowego kw. tłuszczowego
45. Narysować nukleozydy pirymidynowe RNA połączone wiązaniem międzynukleotydowym
46. Funkcje syntazy aminoacylo-tRNA
-aby wziąć udział w syntezie białka, każdy aminokwas musi zostać kowalencyjnie związany z cząsteczką tRNA, ponieważ synteza białka zależy od adapterowej funkcji tRNA, umożliwiającej poprawne wbudowanie aminokwasu
-wiązanie kowalencyjne otworzone między aminokwasem i tRNA zawiera dużą ilość energii, która umożliwia oddziaływanie aminokwasy z końcem rosnącego łańcucha polipeptydowego i utworzenie w tym miejscu wiązania peptydowego => aktywacja aminokwasu
Funkcje syntetazy aminoacylo-tRNA:
-przeniesienie zaktywowanych aminokwasów mRNA znajdujących się na rybosomach
-wytworzenie aktywnego aminokwasu - aminoacylo-tRNA
-funkcja kontrolna w precyzyjnym dopasowaniu dwóch składników (wiązanie estrowe)
-specyficzność syntetazy w stosunku do aminokwasu i antykodonu w tRNA
-występuje 20 syntetaz (każdy aminokwas ma swoją)
Reakcja:
47. Reakcje syntezy sacharozy
48. Przykład fosforylacji substratowej w glikolizie
Fosforylacja substratowa - przeniesienie reszty fosforanowej na związek taki, aby powstał produkt z wiązaniem wysokoenergetycznym, np. ATP
*w glikolizie mamy dwa miejsca fosforylacji substratowej:
49. Reakcje przenoszenia reszt difosforanowych za pomocą ATP
Przeniesienie reszty difosforanowej na 5-P-rybozy z wytworzeniem 5-P-rybozo-1-difosforanu (PRPP) - związek o zasadniczym znaczeniu przy syntezie nukleotydów. Reakcja jest katalizowana przez difosfokinazę 5-P-rybozy.
50. Przemiany glicerolu prowadzące do glukoneogenezy
51. Przemiany kwasu fosfatydowego w lecytynę
1) kwas fosfatydowy pod wpływem fosfatazy ulega hydrolizie do fosforu i a,B-diacyloglicerolu
2) a,B-diacyloglicerol, aktywna cholina (CDP-chd) służy jako koenzym transferaz i przenosi resztę fosforanową choliny na a,B-diazyloglicerol tworząc cząsteczkę lecytyny
52. Enzymy rozkładające wiązania a-1,4-glikozydowe w skrobi (plus wzory
produktów)
-są to enzymy amylolityczne otrzymywane ze skiełkowanego ziarna zbóż (jęczmień)
-a-AMYLAZA
Rozpuszcza skrobię skleikowaną, a następnie ją hydrolizuje o amylozy i amylopektyny
-AMYLAZA i AMYLOPEKTYNA
Rozkładane są do szeregu wielocukrów od sześcioglukozowych do maltozy
-B-AMYLOZA
Rozkłada co drugie wiązanie a-1,4-glikozydowe, powstaje maltoza i izomaltoza
-GLUKOAMYLOZA
Rozkłada wiązanie a-1,4(1,6)-glikozydowe w amylopektynie, powstaje glukoza
53. Nukleotydy pirymidynowe w DNA połączone wiązaniem międzycząsteczkowym
54. Fosforylaza glikogenowa, jej regulacja i aktywacja + funkcje
Funkcje:
-katalizuje rozkład glikogenu
-rozbija wiązania a-1,4-glikozydowe
-usuwa kolejne cząsteczki glukozy z nieredukującego końca cząsteczki glikogenu (zachodzi dla cząsteczek oddalonych od miejsca rozgałęzienia o 5 reszt)
Budowa:
-występuje w 2 wzajemnie przekształcających się formach a i b (a-aktywna, b-nieaktywna)
-forma a <-> forma b - poprzez fosforylację pojedynczej reszty seryny w każdej z podjednostek -> kinaza fosforylazowa
Regulacja:
-w mięśniach szkieletowych duże stężenie AMP powoduje aktywację fosforylazy b
-duże stężeniem ATP i 6-P-glukoza powoduje, że fosf. b jest nieaktywna
-podczas wysiłku ATP maleje a AMP rośnie i wtedy fosf. b staje się aktywna, co powoduje szybki rozpad glikogenu
-fosf. a jest stale aktywna - brak oddziaływań ATP, AMP
55. Synteza glikogenu
Enzymy syntetyzujące glikogen:
-syntaza glikogenowa współdziała z AGP-azą (występuje w wątrobie i mięśniach zwierząt)
-glikogenina - wydłuża łańcuch a-glukanu
-amylo-1->4,1->6-glikozylotransferazy - tworzy wiązania i rozgałęzienia
56. Jakie produkty z cyklu fosforanów pentoz wchodzą bezpośrednio do glikolizy (reakcje)
-aldehyd 3-P-glicerynowy
-fruktozo-6-P
57. Z których metabolitów cyklu Krebsa powstają aminokwasy monoaminodikarboksylowe (reakcje)
*ze szczawioictanu -> asparaginian
*z a-ketoglutaranu -> glutaminian
*redukcyjna aminacja a-ketoglutaranu
*z fumaranu -> asparaginian
58. Udział glicyny w syntezie nukleotydów purynowych
-do PRPP (5-fosforan 1-difosforanu rybozy) przyłącza się grupa NH2 (poz. 9) z glutaminy
-w pozycję (4,5,7) włącza się glicyna
-w pozycję (8) włączana jest grupa CH3 przenoszona przez THF i HCOOH, zużywane jest ATP na zamknięcie pierścienia imidazolowego
-w poz. (3) włączana jest gr. NH2 z glutaminianu
-CO2 przenoszony przez karboksybiotynę z udziałem ATP włączony jest w pozycję (6)
-w poz. (1) wchodzi gr. Nh2 z asparaginianu
-w poz. (2) wchodzi CH3 przenoszony przez THF i HCOOH, ATP zamyka pierścień pirymidynowy
59. Reakcje powstawania H2O2
2 enzymy z klasy oksydoreduktaz: KATALAZA, PEROKSYDAZA
Aktywność katalazy:
60. Cykl aktywnego metylu
Grupa Ado-adenozylowa pochodząca z ATP
Rola: S-adenozylometionina
-donor grup metylowych w licznych reakcjach biologicznych, np. fosforan kreatyny i synteza kwasów nukleinowych
61. Aminy biogenne w funkcji hormonów
-TRYPTAMINA
Działa stymulująco na mięśnie gładkie naczyń krwionośnych,, powstała przez dekarboksylację tryptofanu
-SEROTONINA
Hormon trawienny, pobudza perystaltykę jelit, powstała przez dekarboksylację 5-hydroksytryptofanu
-HISTAMINA
Hormon trawienny, pobudza wydzielanie soku żołądkowego i obniża ciśnienie tętnicze krwi, produkt dekarboksylacji histydyny
-KADAWERYNA -> lizyny
-AGMATYNA -> argininy
-PUTRESCYNA -> ornityny
Powyższe aminy to produkty procesu gnicia, w którym pełnią funkcje wzrostowe.
62. Reakcja polimerazy (DNA i RNA) przy dołączaniu kolejnego
(deoksy)rybonukleotydu
DNA: A, G, C, T
RNA: A, G, C, U
TRANSKRYPCJA
Proces syntezy RNA na matrycy DNA, katalizowany przez polimerazę RNA (nowo wchodzący nukleotyd tworzy komplementarną parę zasad z kolejną zasadą matrycy DNA). Uwolniony zostaje pirofosforan, cząsteczka wydłużana jest w kierunku 5' -> 3'.
Składa się z 3 etapów
REPLIKACJA
powielanie DNA. Następuje rozplecenie podwójnego heliksu na dwie nici i dobudowę do każdej z nich nowej. Nić pierwotna stanowi matrycę.
63. Hemoglobina-przykład białka allosterycznego
(wyjaśnienie pojęcia "allosteria" + rodzaje hemoglobiny)
ALLOSTERIA
Odwracalna modyfikacja struktury wtórnej pod wpływem wiązanych w ściśle określonym miejscu cząsteczki, tzw. Elektronów allosterycznych, w miejscy -centrum allosterycznym
Wiązanie O2 odbywa się za pomocą His 8 w heliksie F, a po przyłączeniu zbliża się His E7 (łączy się z O3) lecz dodatkowo pełni 2 funkcje; ochrania Fe2+ przed utlenieniem oraz ogranicza powinowactwo hemu do CO. O2 oddysocjowany zostaje za pomocą 2,3-bisfosforanu. CO2 łączy się z białkiem globiną przez azot aminokwasów N-końcowych tworząc karbaminian.
Powinowactwo Hb do O2 i CO2 zmienia się w zależności od stężenia tych związków w tkance.
Rodzaje:
-methemoglobina - utleniony Fe3+ (nie wiąże O2)
-nitrozohemoglobina - powstaje pod wpływem NO3- i NO2-
Poza tlenem z Hb mogą łączyć się związki, które blokują jej działanie, np. CO (wiąże się nieodwracalnie)
64. Monooksygenazy, dioksygenazy-mechanizm działania, przykłady.
-Monooksygenazy, czyli oksygenazy mieszane lub hydrokslazy - enzymy hydrolizujące, wymagające donora H+
Katalizują reakcję:
-katalizują wprowadzenie do substratu połowy cząsteczek tlenu z utworzeniem grupy hydroksylowej. Drugi atom tlenu jest równocześnie wiązany w cząsteczkę wody z udziałem czynnika redukującego (NADH lub NADPH) co wyzwala energię swobodną wykorzystywaną w reakcji, np.:
-deoksygenazy, czyli transferazy tlenowe lub oksygenazy właściwe,
Katalizują one reakcję ogólną:
-enzymy te uczestniczą zarówno w przemianach anabolicznych prowadzących do tworzenia ważnych składników, np. wit. A z karotenów
-zapoczątkowują kataboliczne procesy degradacji związków pierścieniowych
-atakują podwójne wiązanie w substancjach alifatycznych lub aromatycznych.
Wyszukiwarka
Podobne podstrony:
Przenoszenie acetylo, biotechnologia UP Wrocław losowe pierdoły, Biochemia
PYTANIA, biotechnologia UP Wrocław losowe pierdoły, Biochemia
Komis, biotechnologia UP Wrocław losowe pierdoły, Biochemia
biochemia egzaminy, biotechnologia UP Wrocław losowe pierdoły, Biochemia
tabela biochemia, biotechnologia UP Wrocław losowe pierdoły, Biochemia
3 koło biochemia, biotechnologia UP Wrocław losowe pierdoły, Biochemia
pytania na biochemie, biotechnologia UP Wrocław losowe pierdoły, Biochemia
biochemia pytania kolo 1, biotechnologia UP Wrocław losowe pierdoły, Biochemia, Biochemia
MIKROBIOLOGIA ZYWNOSCI KOLOKWIA, biotechnologia UP Wrocław losowe pierdoły, mikro żywności
M+ÂŹ (Biotechnol.) (1), biotechnologia UP Wrocław losowe pierdoły, mikro żywności
wyklad bio 5, biotechnologia UP Wrocław losowe pierdoły, Biologia komórki, Biologia komórki, ściągoi
II rok grupy[1]to (2), biotechnologia UP Wrocław losowe pierdoły, Analiza żywności, analiza
II O- Biochemia cwiczenie 5, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 1, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
sprawozdanie z miareczkowania, UP Wrocław, IŚ I SEM, Chemia
Chemiczne środki ochrony roślin, Ogrodnictwo UP Wrocław, semestr V, Ochrona roślin - środki ochrony
ochrona wlasnosci intelektualnej, Inżynieria Środowiska UP Wrocław I semestr, OWI
UP Wrocław lista zadan, Technologia Informacyjna semestr 1 oraz Informatyka i komputerowe wspomagan
więcej podobnych podstron