1. Zapisz liczby kwantowe opisujące powłokę 2 i 3
n = 2 l = ............... m = ....................
l = ............... m = .....................
n = 3 l = ............... m = ....................
l = ............... m = .....................
l = ............... m = .....................
Z powyższego schematu widać, że im większa powłoka, tym więcej podpowłok znajduje się w obrębie tej powłoki.
Wiedząc, że po dostarczeniu odpowiedniej energii atom może ulec wzbudzeniu, przy czym elektron wzbudza się tylko w obrębie danej powłoki. Korzystając z tych informacji podaj konfigurację atomu azotu i fosforu w stanie podstawowym i w stanie wzbudzonym i na tej podstawie wyjaśnij, dlaczego w połączeniach z chlorem azot może tworzyć tylko chlorek azotu (III), a fosfor chlorek fosforu (III) i chlorek fosforu(V)
azot - stan podstawowy:
azot - stan wzbudzony:
fosfor - stan podstawowy:
fosfor - stan wzbudzony:
Wyjaśnienie.
2. Hybrydyzacja jest to stan atomu, w którym następuje wymieszanie energii orbitali atomowych, tak aby powstałe orbitale miały taką samą energię. Wymieszaniu mogą ulegać tylko orbitale tej samej powłoki, najczęściej pod wpływem wzbudzenia. Jeżeli w twotzeniu cząsteczkui biorą udział więcej niż jeden elektron, to na pewno nastąpiła hybrydyzacja, gdyż każdy z tych elektronów ma inną energię (nawet jak znajduje się na tej samej powłoce. W tworzeniu wiązań mogą brać udział TYLKO elektrony niesparpwane). Na podstawie tych informacji i wyjaśnienia z zadania 1 zaproponuj, jaki rodzaj hybrydyzacji będzie występował w chlorku fosforu (III) i chlorku fosforu(V), a jaki w chlorku azotu(III)
chlorek azotu (III) - powstał z elektronów w atomie wzbudzonym na orbitalach : ........................., w wyniku tego hybrydyzacja
tego atomu w tym związku jest równa ........................
chlorek fosforu (III) - powstał z elektronów w atomie wzbudzonym na orbitalach : ........................., w wyniku tego hybrydyzacja
tego atomu w tym związku jest równa ........................
chlorek fosforu (V) - powstał z elektronów w atomie wzbudzonym na orbitalach : ......................, w wyniku tego hybrydyzacja
tego atomu w tym związku jest równa ........................
3. Azot może występować na bardzo wielu stopniach utlenienia. Zapisz związki chemiczne, w których azot występuje na najniższym i najwyższym stopniu utlenienia. Podaj ich nazwy i podaj charakter chemiczny tych związków.
|
azot na najniższym stopniu utlenienia |
azot na najwyższym stopniu utlenienia |
wzór chemiczny związku |
|
|
nazwa związku |
|
|
charakter chemiczny związku |
|
|
równanie chemiczne potwierdzające charakter chemiczny związku |
|
|
4. Kwas azotowy (V) wykazuje właściwości utleniające zarówno w postaci stężonej jak i rozcieńczonej. Można to wykazać w doświadczeniu z metalami szlachetnymi lub półszlachetnymi (potencjał elektrochemiczny wyższy od wodoru). Kwas ten wywołuje utlenienie tych metali, powstaje odpowiednia sól (azotan(V)) oraz tlenek azotu. W przypadku stosowania kwasu stężonego powstaje brunatny tlenek azotu (IV), przy rozcieńczonym tlenek azotu (II). Na podstawie tych informacji napisz równania reakcji i uzgodnij je metodą bilansu elektronowego.
stężonego kwasu azotowego (V) ze srebrem
rozcieńczonego kwasu azotowego (V) z bizmutem (bizmut występuje w związkach w postaci jonów trójdodatnich)
5. Na podstawie poniższych informacji zidentyfikuj tlenki azotu.
substancja ta jest gazem bezbarwnym brunatniejącym na powietrzu ....................
substancja jest ciałem stałym, gwałtownie reagującym z wodą. W wyniku tej reakcji
powstaje mocny kwas utleniający ......................
Tlenek powstaje w wyniku utlenienia substancji z punktu a) ..........................
substancja jest nietrwałym gazem, którego gęstość w warunkach normalnych jest równa
1,96 g/dm3 .....................................
tworzy się podczas oziębiania równomolowej mieszaniny substancji a) i c) ........................
6. Bezbarwny, stężony roztwór kwasu azotowego (V) po pewnym czasie żółknie. Wyjaśnij co jest tego przyczyną i zapisz równanie zachodzącej reakcji.
7. Tlenek azotu (II) i tlenek azotu (IV) tworzą dimery. Na podstawie budowy cząsteczki wyjaśnij, co jest tego przyczyną .
8. Przedstaw za pomocą równań reakcji przemiany opisane schematem
1 2
N2 -----------------> NH3 -----------------> (NH4)2CO3
| 3 4
| -------------> NH4HCO3 ------------> NH3 + CO2 + H20
1. ......................................................................................................................
2. . ......................................................................................................................
3. . ......................................................................................................................
4. . ......................................................................................................................
9.
Ogólną zawartość białek w materiale biologicznym oznacza się metodą Kjeldahla. Oznaczenie to
przebiega w kilku etapach.
Etap I - rozkład stężonego kwasu siarkowego (VI) do tlenu i związku siarki (IV) w temperaturze 573 K w obecności katalizatora np. CuSO4,
- utlenianie substancji organicznych zawartych w badanym materiale z wydzieleniem
CO2, H2O i NH3. Jest to tzw. proces mineralizacji.
Etap II - ulatnianie się powstałych gazów z wyłączeniem NH3, który reaguje z kwasem siarkowym (VI) użytym w nadmiarze.
Etap III - działanie na mieszaninę poreakcyjną stężonym roztworem (ok. 40%) NaOH. W wyniku zachodzących reakcji następuje całkowite zobojętnienie nieprzereagowanego H2SO4 oraz wydzielenie amoniaku, który następnie jest oddestylowany z udziałem pary wodnej.
Etap IV - pochłanianie oddestylowanego amoniaku w roztworze kwasu borowego H3BO3 (powstaje wówczas diwodoroboran amonu).
Etap V - miareczkowanie powstałego diwodoroboran amonu mianowanym roztworem kwasu solnego wobec odpowiednich wskaźników alkacymetrycznych.
Ułóż równania reakcji chemicznych zachodzących podczas oznaczenia przyjmując, że związkiem organicznym będzie kwas 2-aminopropanowy
Etap I
................................................................................................................................................................................
........................................................................................................................................................................................
Etap II
................................................................................................................................................................................
........................................................................................................................................................................................
Etap III
................................................................................................................................................................................
Etap IV
........................................................................................................................................................................................
Etap V
........................................................................................................................................................................................
10. Podaj jak zmieniają swój charakter chemiczny tlenki azotowców typu E2O3 w zależności od masy atomowej.
azot ................................. fosfor ..................... arsen ......................... antymon ........................... bizmut ........................
11. Podaj stopień utlenienia azotu w podanych związkach:
CZĄSTECZKA |
Li3N |
NH4Cl |
N2O |
N2O4 |
NaNO3 |
N2 |
NO2- |
stopień utlenienia |
|
|
|
|
|
|
|
12. Fosfor otrzymuje się ogrzewając ortofosforan(V) wapnia z tlenkiem krzemu(IV) i węglem w piecach elektrycznych bez dostępu powietrza. Otrzymuje się wtedy fosfor w postaci pary (P4), tlenek węgla(II) i metakrzemian wapnia (CaSiO3). Napisz równanie powyższej reakcji oraz oblicz, ile kg fosforu można otrzymać z 1 tony minerałów fosforanowych zawierających 60% fosforanu(V) wapnia. Należy przyjąć, że wydajność reakcji wynosi 100%.
równanie reakcji
.................................................................................................................................................................................................................
obliczenia
13. Fosfor biały (P4 ) jest bardzo aktywny. Reaguje on na przykład z roztworem siarczanu(VI) miedzi(II). W reakcji tej powstaje wolna miedź, a także kwas siarkowy(VI) i kwas ortofosforowy(V). Napisz równanie tej reakcji. Wśród substratów należy uwzględnić wodę.
14. Fosfor spalany na powietrzu tworzy P4O10, który w reakcji z wodą tworzy kwas ortofosforowy(V). Kwas ten można również otrzymać działając na ortofosforan(V) wapnia kwasem siarkowym(VI). Napisz 3 równania opisanych reakcji oraz zaproponuj wyjaśnienie dlaczego kwas ortofosforowy(V) można otrzymać działając H2SO4 na ortofosforany(V).
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
15. Sole kwasu ortofosforowego(V) są stosowane jako nawozy sztuczne. Jednym z nich jest tzw. superfosfat podwójny o wzorze Ca(H2PO4)2. Oblicz zawartość % fosforu w tym związku.
16. Fosfor tworzy różne odmiany alotropowe. Zdefiniuj na czym polega zjawisko alotropii i wymień dwa inne pierwiastki tworzące takie odmiany - podaj nazwy tych pierwiastków i ich odmian alotropowych.
alotropia jest to ........................................................................................................................................................................................................................................................................................................................................................................................................................................................
pierwiastki występujące w odmianach alotropowych z grupy 16 to tlen i siarka.
tlen występuje jako .............................................................................., a siarka występują jako .................................................................
17. Znanym nawozem sztucznym jest także precipitat o wzorze CaHPO4 · 2H2O. Oblicz, ile kg tego nawozu należy użyć, aby dostarczyć glebie 142 kg fosforu.
18. . Tłuszcze złożone to grupa związków zróżnicowana pod względem struktury i funkcji. Jedną z grup tych związków stanowią fosfolipidy, występujące między innymi we wszystkich błonach biologicznych. Jedną z grup fosfolipidów stanowią fosfoglicerydy,
czyli związki pochodzące od glicerolu, w którym 2 grupy hydroksylowe są zestryfikowane kwasami tłuszczowymi, a jedna kwasem ortofosforowym(V) lub jego pochodnymi. Napisz wzór półstrukturalny fosfolipidu, w którym 2 grupy -OH zareagowały
z kwasem stearynowym a jedna z kwasem ortofosforowym(V).
19. Kwas ortofosforowy(V) można otrzymać również działając na fosfor (P4) parą wodną. Oprócz kwasu w tej reakcji powstaje wodór.
Napisz równanie tej reakcji i oblicz, ile dm3 powstającego gazu w temperaturze 1000C pod ciśnieniem 105Pa wydzieli się w tej reakcji, jeżeli przereagowało 24,8 g fosforu a wydajność tej reakcji wynosi 100%.
20. Fosfor reagując z wodorem tworzy fosforiak PH3. Związek ten można otrzymać również
działając gorącym roztworem KOH na fosfor (P4). Powstaje wtedy PH3 i diwodorofosforan(I) potasu KH2PO2 oraz woda. Napisz powyższe równanie reakcji, uzgodnij za pomocą bilansu elektronowego. Wskaż utleniacz i reduktor występujący w tej reakcji. Jak nazywa się ten typ reakcji redox..
równanie reakcji:
bilans elektronowy
reakcja utlenienia ......................................................................................................
reakcja redukcji .............................................................................................
utleniacz ................................ reduktor ................................
reakcja ta nosi nazwę reakcji ..........................................................
21. W przypadku zatrucia arszenikiem obecność tej trucizny w organizmie można wykazać, działając na pobraną próbkę wodorem, powstającym w reakcji cynku z kwasem solnym. Wydzielający się w tej reakcji arsenowodór poddaje się dalszym badaniom.
Równanie otrzymywania arsenowodoru ma postać:
......As2O3 + ........Zn + ........H+ = .........Zn2+ + .........H2O + ..........AsH3
Uzgodnij powyższe równanie metodą bilansu elektronowego używając równań jonowo - elektronowych i podaj jaką rolę w tym procesie pełni arszenik.
bilans elektronowy
Arszenik pełni rolę .........................................................................
22. Który z poniższych schematów można wykorzystać do otrzymywania i zbierania amoniaku
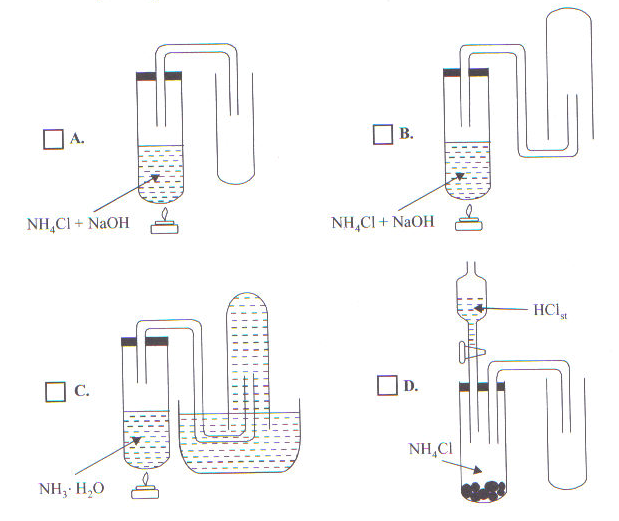
Zapisz równanie zachodzącej reakcji i wyjaśnij, dlaczego ten sposób zbierania amoniaku uważasz za właściwy.
23. Zaprojektuj doświadczenie, w którym wykażesz amfoteryczny charakter tlenku arsenu (III). W tym celu wybierz odczynniku z grupY: kwas solny, woda, wodorotlenek sodu, wodorotlenek wapnia, kwas fosforowy (V)
wybrane odczynniki ..........................................................................................
opis słowny doświadczenia
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
obserwacje
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
wnioski
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
równania reakcji potwierdzające wnioski
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
24. Z ilu atomów składa się cząsteczka siarki w stanie pary, jeśli gęstość par siarki w przeliczeniu na warunki normalne wynosi 11,43 g/dm3
25 Po jakim czasie 100μg próbki izotopu promieniotwórczego 218Po o czasie połowicznego rozpadu 3,03 min. zmaleje o 25mg?
26. W których probówkach metale rozpuszczą się z wytworzeniem soli?
Napisz odpowiednie równania reakcji
27. Znając położenie selenu w układzie okresowym podaj:
konfiguracje elektronową elektronów walencyjnych .............................................
najniższy i najwyższy stopień utlenienia w związkach ...........................................
określ, czy jest metalem, czy niemetalem: ...........................................................
podaj wzór kwasu tlenowego , który tworzy będąc na najwyższym stopniu utlenienia .................
Określ moc kwasu selenowodorowego w stosunku do kwasu siarkowodorowego ......................
28. Określ wodnego roztworu siarczku sodu. Podaj reakcję hydrolizy w postaci jonowej skróconej. Podaj typ hydrolizy
odczyn .............................................................
równanie reakcji ............................................................................................
ryp hydrolizy ..............................................................
29. Pierwiastki 16 grupy układu okresowego tworzą kwasy beztlenowe o wzorze ogólnymH2X. Napisz wzory tych kwasów i ustaw je wraz ze wzrastającą mocą.
30. Narysuj wzór elektronowy jonu amonowego i hydroniowego i uzupełnij tabelę, podając ile wiązań atomowych, jonowych ,kowalencyjnych spolaryzowanych i koordynacyjnych występuje w tych cząsteczkach oraz kształt tej cząsteczki (wybierz z podanych: liniowy, płaski trójkątny, piramidy trygonalnej, tetraedryczny)
|
jon amonowy |
jon hydroniowy |
wzór sumaryczny |
|
|
wzór elektronowy |
|
|
kształt |
|
|
liczba wiązań atomowych |
|
|
liczba wiązań kowalencyjnych spolaryzowanych |
|
|
liczba wiązań jonowych |
|
|
liczba wiązań koordynacyjnych |
|
|
31. Z położenia pierwiastka arsenu w układzie okresowym wnioskujemy, że jego stopnie utlenienia w związkach chemicznych mogą być zawarte między:
32. Dlaczego stężony kwas siarkowy (IV) nie może być produktem handlowym?
33. Ułożyć równanie rakcji stężonego kwasu siarkowego (VI) z węglem, wiedząc, że jednym produktem jest bezwonny, cięży od powietrza gaz powodujący zmętnienie wody wapiennej, a drugi bezbarwny o ostrym duszącym zapachu, który z wodą tworzy nietrwały kwas. Uzgodnij równanie za pomocą bilansu elektronowego
34. Zaproponuj, w jaki sposób otrzymać siarkowodór, mając do dyspozycji cynk, siarkę, kwas solny i siarczan (VI) miedzi(II)
35. Przepuszczono mieszaninę wodoru i siarkowodoru przez płuczki z a) wodorotlenkiem sodu, b) kwasem solnym, c) roztworem siarczanu (VI) miedzi (II). Po przejściu przez którą płuczkę otrzymano czysty wodór. Uzasadnij pisząc odpowiednie równania reakcji.
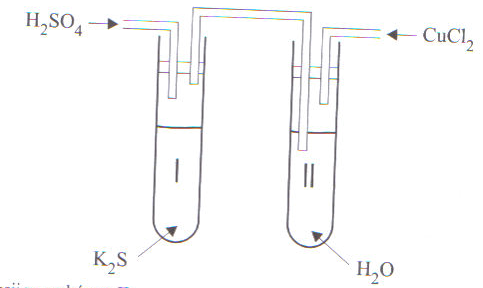
36. Przeprowadzono doświadczenie:
Podaj obserwacje w probówce II
Zapisz zachodzące równania reakcji
Wyszukiwarka
Podobne podstrony:
powtórka 2 zadania, Chemia zadania
powtórka 3 borowce, Chemia zadania
powtórka 2 zadania, Chemia zadania
chemia zadania 2 id 113035 Nieznany
Chemia zadania D
Chemia zadania 1
Chemia zadania, doświadczenia
alkohole - zadania, Matura, Chemia, zadania z organicznej
zbior zadan z chemmiii, chemia, zadania
mol stechiometria, AdrianM, LO, CHEMIA, ZADANIA
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
Powtorka! Chemia Gimnazjum Portal wiedzy o chemii id 37986
Chemia Zadania pH
Chemia zadania 5
zadania dodatkowe - dyfuzja i gestość, chemia, zadania dodatkowe
zadania dodatkowe - wiazania i izotopy, chemia, zadania dodatkowe
więcej podobnych podstron