Wykład 1 1 X 08
Podstawowe pojęcia, struktura komórki, katabolizm i anabolizm. Organiczne związki azotu - aminy, nitrozwiązki, aminokwasy, zasady purynowe i zasady pirymidynowe, alkaloidy.
Biochemia - Nauka na pograniczu chemii organicznej, medycyny i biologii, zajmująca się substancjami organicznymi o dużym znaczeniu biologicznym, takimi jak białka, węglowodany, lipidy, kwasy nukleinowe, aminokwasy oraz przemianami chemicznymi zachodzącymi wewnątrz żywych komórek
Biochemia żywienia - w dużym stopniu zajmuje się podstawowymi składnikami żywności, ich metabolizmem oraz opisem biotechnologicznych procesów stosowanych przy wytwarzaniu żywności
PODZIAŁ ORGANIZMÓW NA PODSTAWIE ANALIZY GENETYCZNEJ
Bacteria (bakterie)
Archea (archeony)
Eukarya (Eucaryota, Eukaryota)
Podstawowe elementy komórki
Błona komórkowa
Jądro komórkowe
Mitochondrium
Chloroplast
Retikulum endoplazmatyczne
Szorstkie
Gładkie
Podstawowe pojęcia:
Metabolizm - całokształt procesów biochemicznych zachodzących w żywych komórkach, np. przemiana materii, energii
Anabolizm - przebudowa i synteza złożonych substancji z prostych związków. Przykładem jest rozwój mięśni u sportowców. Dominuje u młodych osób
Katabolizm - proces rozpadu złożonych związków na proste, z uzyskaniem energii. Dominuje u osób starszych
Szlak metaboliczny - ciąg reakcji zachodzących po sobie i prowadzących do uzyskania produktu
Cykle biochemiczne - szlaki metaboliczne, w których końcowy produkt jest jednocześnie substratem rozpoczynającym cały szlak
Reakcje termodynamiczne korzystne i niekorzystne są ze sobą sprzężone
Reakcja A+B C+D
Wzór na zmianę energii swobodnej:
![]()
![]()
=0 - reakcja nie przebiega, stan równowagi
![]()
>0 - reakcja niekorzystna energetycznie, nie przebiega (energia substratu jest mniejsza od energii produktu)
![]()
<0 - reakcja korzystna energetycznie, układ dąży do obniżenia swojej energii, reakcja zachodzi
![]()
- zmiana energii swobodnej
![]()
- zmiana standardowej energii swobodnej
R - stała gazowa
T - temperatura absolutna
[A],[B],[C],[D] - stężenia molowe poszczególnych substancji
ATP - adenozynotrifosforan, uniwersalny przenośnik energii w organizmach żywych. Jest bogaty w energię dzięki 2 bezwodnikowym wiązaniom fosforanowym
Adenina + ryboza + trifosforan
ODDZIAŁYWANIA MOLEKULARNE
Wiązania kowalencyjne C-C C=O E>300 kJ/mol
Wiązania elektrostatyczne (w roztworze wodnym, dla dwóch różnoimiennych ładunków w odległości 0,3 nm E = ok. 6 kJ/mol)
Wiązania wodorowe E=4-13 kJ/mol
Oddziaływania Van der Waalsa E=2-4 kJ/mol (dla 1 pary atomów)
Oddziaływnaia hydrofobowe (w środowisku wodnym) i odpychanie się atomów (zawada przestrzenna)
PODSTAWOWE ZWIĄZKI ORGANICZNE
Kwas glutaminowy
Glicyna
Leucyna
Alanina
Doświadczenie Ureya - Mittlera (stymulacja warunków prebiotycznych): pod wpływem wyładowań elektrycznych
Z NH3, CH4, H2, H2O powstały aminokwasy (rys);
Z HCHO - różne cukry: ryboza;
Z HCN - adenina, składnik DNA
Aminy - arylowe i alkilowe pochodne amoniaku
Biogenne (dekarboksylacja aminokwasów) - toksyczne, silne działanie fizjologiczne
Putrescyna (z ornityny)
Kadaweryna (z lizyny)
Tyramina (z tyrozyny)
Histamina (z histydyny)
Tryptamina (z tryptofanu)
Cysteamina (z cysteiny), skł. CoA
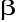
-alanina - (z asparaginianu) skł. CoA4-aminomaślan
Histamina
Gromadzi się w zepsutym mięsie ryb jako efekt działania enzymów bakteryjnych, duże stężenia histaminy (np. kilkaset mg/100g mięsa makreli, tuńczyka) powoduje zatrucia
Pełni funkcję hormonu - stymuluje skurcz mięśni gładkich, stymuluje wydzielanie śluzu
Azotany (V), (III)
Żywność źle uprawiana, przede wszystkim przenawożona, gł. warzywa liściaste - burak, seler, szpinak, rzodkiewka, sałata, marchew, kapusta; najmniej warzywa owocowo - nasienne - groch, fasola, bób, ogórek, pomidor
Woda pitna dla zwierząt: zanieczyszczona ściekami komunalnymi i odchodami zwierzęcymi, również nawozami spływającymi z pól uprawnych
Wyładowania atmosferyczne
Procesy przetwórcze, peklowanie mięsa (różowa barwa i aromat)
AZOTANY III SĄ BAKTERIOSTATYCZNE, np. dla Clostridium Botulinum, mogą neutralizować kancerogeny powstające w wyniku pirolizy białek
N-Nitrozoaminy
Posiadają silne właściwości rakotwórcze, obecne w pelowanym mięsie, wędzonych rybach, piwie, sosie sojowym
Prekursory:
Azotany (V) (warzywa nawożone, zanieczyszczone środkami nawożącymi)
N-Nitrozoaminy powstają głównie w środowisku kwaśnym, w żołądku, w wyniku nitrozowania amin obecnych w żywności, przy udziale azotanów (III) lub (V) (zredukowanych wcześniej do azotanów (III))
DEN
N-Nitrozodimetyloamina
N-Nitrozopyrroidyna
N-Nitrozopiperydyna
Neurotransmitery (tzw katecholoaminy, pochodne tyrozyny)
Adrenalina
Noradrenalina
Dopamina
Tyrozyna
Adrenalina - hormon odpowiedzialny za reakcję „walcz lub uciekaj”, wytwarzany w części rdzeniowej nadnerczy, stymuluje rozkład glikogenu w mięśniach
Noradrenalina - regulacja rozkładu triacylogliceroli (hormon kataboliczny) przez aktywację cyklazy adenylowej
Dopamina - niski jej poziom powoduje chorobę Parkinsona, lekiem są inhibitory enzymu rozkładającego dopaminę (oksydazy monoaminowej)
Pierścienie heterocykliczne z azotem
Pirydyna
Amid kwasu nikotynowego, wit PP
Pirodoksal
Pirydoksyna
Pochodne pirydyny - np. wit. PP, wit, B
Pochodne pirazyny charakteryzują się intensywnym zapachem, występującym w pieprzu (2-metoksy-3-izobutylopirazyna), ziemniakach - zapach pleśni (2-metoksy-3-izopropylopirazyna) i zielonym groszku
Zasady azotowe występujące w kwasach nukleinowych
Adenina RNA, DNA
Cytozyna RNA, DNA
Guanina RNA, DNA
Tymina DNA
Uracyl RNA
Pirymidyna
Puryna
Alkaloidy
Kofeina - w kawie, herbacie, coca-coli, czekoladzie, pobudza ośrodkowy układ nerwowy i znosi zmęczenie psychiczne i fizyczne, poprawia sprawność myślenia, działa moczopędnie
Efedryna - stosowana przy odchudzaniu, ogranicza łaknienie, przyspiesza tempo spalania tkanki tłusxczowej; powoduje bezsenność, ogólne pobudzenie, podwyższone ciśnienie krwi, zaburzenia w metabolizmie glukozy
Nikotyna - składnik dymu tytoniowego, ma wpływ na działanie układu krwionośnego, podnosi stężenie CO2 we krwi; palenie tytoniu uzależnia
Teobromina, teofilina - działa moczopędnie, obniża ciśnienie krwi
Wykład 2 8 X 08
Aminokwasy, peptydy, białka (klasyfikacja, budowa, funkcje).
Aminokwasy - elementarne składniki białek, peptydów i ich pochodnych
Zawierają conajmniej:
1 grupę aminową
1 grupę karboksylową
Aminokwasy „białkowe”: centralny atom węgla C-alfa, do którego przyłączony atom wodoru, grupa alfa-aminowa, grupa alfa-karboksylowa oraz grupa boczna o zróżnicowanej budowie
Z wyjątkiem glicyny aminokwasy budujące białko w związku z występowaniem węgla asymetrycznego, mają konfigurację L (grupa NH2 z lewej strony we wzorze strukturalnym)
Podział aminokwasów
Naturalne
Białkowe (L)
Pierwszorzędowe (kodowane)
Endogenne (syntetyzowane w organizmie człowieka)
Egzogenne (dostarczane wraz z pożywieniem, nie mogą być syntetyzowane w organizmie człowieka)
Drugorzędowe
Trzeciorzędowe
Niebiałkowe (D,L)
Syntetyczne (DL,L,D)
Aminokwasy naturalne, białkowe, pierwszorzędowe, hydrofobowe
Glicyna (Gly, G), alanina (Ala, A), walina (Val, V), leucyna (Leu, L), izoleucyna (Ile,I), metionina (Met,M), prolina (Pro, P), cysteina (Cys, C);
Fenyloalanina (Phe, F), tyrozyna (Tyr, Y), tryptofan (Trp, W)
Aminokwasy naturalne, białkowe, pierwszorzędowe, z grupą boczną obdarzoną ładunkiem i polarne bez ładunku
Arginina, lizyna, histydyna, asparaginian, glutaminian, seryna, treonina, asparagina, glutamina
(imidazol - daje pochodną histydynę; guanidyna - daje pochodną argininę)
Zmiana stanu jonizacji aminokwasów w zależności od pH
pI - punkt izoelektryczny - wartość pH, w którym sumaryczny ładunek jest równy 0 (przeważa forma jonu obojnaczego - forma dwubiegunowa)
NH3+, COOH COO-, NH3+ COO-, NH2
Kwaśne obojętne zasadowe
Aminokwasy naturalne, białkowe, pierwszorzędowe, egzogenne (AKE niezbędna)
Grupa aminokwasów, które nie mogą być syntetyzowane w organizmie zwierzęcym i muszą być dostarczane z pożywieniem:
Fenyloalanina
Izoleucyna
Leucyna
Lizyna
Metionina
Treonina
Tryptofan
Walina
(U dzieci dodatkowo histydyna i arginina)
Białko roślinne zawiera mniej lizyny, treoniny, metioniny, argininy, tryptofanu w porównaniu do białek zwierzęcych (kanapki z szynką!!)
Brak argininy u mężczyzn bezpłodność
Tryptofan i lizyna - ważne w okresie ciąży i karmienia
Aminokwasy naturalne, niebiałkowe
Wytwarzane są w organizmach żywych, mogą wchodzić w skład peptydów, ale nie można ich uzyskać w wyniku hydrolizy białek
Hydroksyprolina - obecna w kolagenie, stabilizuje go w tkance łącznej i w kościach - nieprawidłowości - szkorbut
Ornityna, Cytrulina - cykl mocznikowy
Kwas L-alfa-aminoadypinowy (prekursor w syntezie penicyliny)
Aminokwasy kontaktowe
Najbardziej reaktywne aminokwasy, często występujące w centrach aktywnych enzymów:
Kwas asparaginowy, glutaminowy
Lizyna
Histydyna
Seryna
Treonina
Cysteina
Wiązanie peptydowe
Wiązanie peptydowe (amidowe) powstaje na drodze kondensacji grupy alfa-aminowej i alfa-karboksylowej dwóch aminokwasów - powstaje dipeptyd + woda
Powstawanie wiązania peptydowego wymaga dostarczenia energii. Wiele aminokwasów tworzy łańcuch polipeptydowy
Kolejność aminokwasów to sekwencja aminokwasów poczynając od aminokwasu z wolną grupą alfa - aminową (N-koniec peptydu)
Przykłady oligopeptydów
Glutation - tripeptyd, pełni funkcje przy regulacji potencjału redox w komórce, usuwa szkodliwe nadtlenki (reakcja)
Oksytocyna - hormon, reguluje skurcze macicy i gruczołów mlekowych
Wazopresyna - hormon, stymuluje i reguluje resorbcję wody w nerkach
Aspartam - słodki peptyd, zastąpił sacharynę w słodzikach - 200x słodszy niż sacharoza - napoje gazowane „dietetyczne” znanych firm
Insulina - hormon regulujący poziom cukru we krwi (51 reszt AA)
Glukagon (29 AA) - działanie przeciwne do insuliny
Penicyliny - antybiotyki peptydowe - hamują syntezę ściany komórkowej bakterii, np. penicylina G-benzylopenicylina
Fallotoksyny i amatotoksyny - mikotoksyny
Struktury białka
Białko to polipeptyd złożony z co najmniej 100 reszt aminokwasowych przyjmujących określoną konformację przestrzenną, jego masa zwykle przekracza 10 kDa. Białko ma strukturę I, II, III i ewentualnie IV-rzędową
I-rzędowa struktura białka
Zapisana w genach kolejność aminokwasów w łańcuchu białkowym - powstaje na rybosomach w procesie translacji, utrzymywana przez silne wiązania kowalencyjne - wiązania peptydowe
Wiązanie peptydowe jest płaskie, ma charakter wiązania podwójnego - nie ulega rotacji
Wiązania z udziałem C-alfa mogą ulegać rotacji' umożliwiając zwijanie się białek na różne sposoby
II-rzędowa struktura białka - są to lokalne struktury powstające w wyniku tworzenia się wiązań wodorowych pomiędzy tlenem grupy C=O, a wodorem grupy N-H dwóch niezbyt odległych od siebie w łańcuchu wiązań peptydowych w obrębie tego samego łańcucha polipeptydowego
Zwrot beta
Pętla omega
Helisa alfa
Beta harmonijka (struktura beta)
Występowanie struktur II-rzędowych, aminokwasy często występujące i zakłócające strukturę II-rzędową
Helisa alfa - ferrytyna, miozyna, fibryna skrzepów krwi (AA często występujące: Ala, Glu, Leu; AA zakłócające: Val, Thr, Ile, Ser, Asp, Asn, PRO)
Harmonijka beta - białka wiążące kwasy tłuszczowe (AA często występujące: Val, Ile; AA zakłócające: PRO)
Zwroty beta i pętle omega - występują na powierzchni białek, odpowiadają za oddziaływanie białek z innymi białkami lub ligandami (AA często występujące: Gly, Asn, Pro)
Struktura III-rzędowa
Wzajemne położenie elementów struktury drugorzędowej stabilizowane przez oddziaływania hydrofobowe reszt aminokwasowych, tworzenie mostków dwusiarczkowych -S-S-, powstających pomiędzy dwiema resztami Cysteiny w łańcuchu, wiązania wodorowe, siły van der Waalsa;
Wiązania jonowe
Wiązania wodorowe
Wiązania hydrofobowe
Mostek dwusiarczkowy
Oddziaływania elektrostatyczne dipol-dipol
Struktura IV-rzędowa
Dotyczy białek posiadających więcej niż jeden łańcuch polipeptydowy, opisuje ilość i wzajemne ułożenie podjednostek cząsteczkowych (pojedynczych łańcuchów) białek, utrzymywane jest przez wiązania dwusiarczkowe, siły elektrostatyczne, wiązania wodorowe i oddziaływania hydrofobowe
Powstawanie wiązań dwusiarczkowych: 2 cysteiny 2H+, 2e-, -S-S-
Denaturacja i renaturacja
Denaturacja białka - zjawisko praktycznie nieodwracalne (wyjątek rybonukleaza), powoduje dużą zmianę konformacji cząsteczki białka z równoczesną utratą jej biologicznej aktywności, zachodzi pod wpływem
Wysokiej temperatury
Mocnych kwasów i zasad
8M mocznika
6M chlorku guanidyny
Detergentów
Niektórych związków aromatycznych
Wysokiego stężenia jonów metali
Denaturacja - znaczenie
Powoduje zmianę punktu izoelektrycznego i obniża rozpuszczalność białka
Wykorzystywana jest w procesie obróbki produktów żywnościowych, w celu inaktywacji enzymów katalizujących niepożądane reakcje, np. powodujących ciemnienie owoców i warzyw (oksydaza - o - difenolowa), mięknięcie kwaszonych ogórków (enzymy pektynolityczne), hydroliza tioglikozydów nasion rzepaku (tioglukozydaza)
Białka proste - w wyniku ich całkowitej hydrolizy powstają tylko aminokwasy lub ich pochodne, przyjmują postać globularną i fibrylarną
Albuminy - mleko, jaja, nasiona zbóż; charakter zapasowy, składnik tkanek stałych
Globuliny - dobrze rozpuszczalne w roztworach soli fizjologicznej, składnik mięśni (miozyna), mleka (laktoglobulina), ziemniaka - tuberyna, enzymy proteolityczne, lipazy
Fibrynogen - występuje w osoczu krwi, białko włókienkowe
Fibroina - głównie składnik naturalnego jedwabiu, zawiera głównie Gly i Ala
Keratyny - dużo aminokwasów zasadowych i alfatycznych, słabo rozpuszczalne w typowych rozpuszczalnikach, odporne na hydrolizę, duży udział beta-harmonijki; keratyna występuje we włosach (wełna), rogach, piórach, paznokciach, kopytach, pazurach i łuskach rogowych - dużo cysteiny - do 12% (trwała ondulacja rozrywanie -S-S- i formowanie nowych, nienaturalnych wiązań disiarczkowych)
Kolageny - zawierają dużo proliny (15%), hydroksyproliny (14%), alaniny (10%) i glicyny (27%), źle rozpuszczają się w zimnej wodzie, po zagotowaniu tworzą żelatynę.
Elastyna - białko włókienkowe, składnik ścięgien, więzadeł i ścian naczyń krwionośnych
Miozyna i aktyna - stanowią 30-40% tkanki mięśniowej, białka włókienkowe umożliwiają kurczenie się mięśni
Histony - zawierają dużo aminokwasów zasadowych (Arg, Liz, His), są dobrze rozpuszczalne w wodzie, blokują i stabilizują cząsteczki DNA w komórkach eukariotycznych
Prolaminy i gluteliny (składnik glutenu) występują w części bielma ziarniaków i są substancjami zapasowymi, zawierają mało Lys, a dużo Asp i Glu
Białka złożone - w wyniku ich hydrolizy powtają aminokwasy i inne niebiałkowe związki
Chromoproteiny - zawierają substancję barwną, (hem - hemoproteiny) skompleksowaną z częścią białkową - hemoglobina - tertameryczne białko odpowiedzialne za transport tlenu we krwi, mioglobina - magazynuje tlen w mięśniach, cytochrom c - przenosi elektrony w łańcuchu oddechowym, katalaza - enzym rozkładający H2O2
Fosfoproteiny - zawierają estrowo związaną grupę ortofosforanową (1-10% P) z resztami seryny lub/i treoniny, np. kazeina mleka, witelina, fosfityna żółtka jaja
Glikoproteiny - zawierają kowalencyjnie związane oligosacharydy, np. glukoamylaza, pektyny, białka błony komórkowej, mucyna
Nukleoproteiny - np. histony połączone głównie wiązaniami jonowymi z kwasami nukleinowymi, budują chromatynę jądrową i rybosomy, jak również wirusy
Lipoproteiny - zawierają tłuszcze, kwasy tłuszczowe, fosfolipidy, steroidy, wchodzą w skład błon komórkowych, pełnią też funkcje transportujące lipidy w osoczu krwi
Metaloproteiny - zawierają koordynacyjnie związane jony metali np. ferrytyna (magazynuje do 20% Fe), plastocyjanina zawiera jon Cu i uczestniczy w transporcie elektronów u autotrofów, proteazy cynkowe i anhydraza węglanowa (Zn)
Kazeina - fosfoproteina
Zakwaszenie mleka do pH 4,5 powoduje w temperaturze pokojowej wytrącanie się wolnej kazeiny - proces odwracalny, po podniesieniu pH do około 6,7; do wytrącania kazeiny stosowany jest kwas cytrynowy lub siarczan amonu, naturalnie wytrąca się pod wpływem kwasu mlekowego - kwaśne mleko zawiera śladowe ilości laktozy, utlenianej do kwasu mlekowego przez bakterie. Kazeinę wytrąca się także podpuszczką, wtedy zawiera więcej wapnia, niż wytrącona kwasem, a w serwatce jest laktoza, ważne dla osób bez galaktozydazy
Podział białek wg wartości odżywczych
Pełnowartościowe - zapewniają prawidłowy wzrost i rozwój organizmu, zawierają wszystkie AA egzogenne
Częściowo pełnowartościowe - wystarczają do podtrzymania życia, ale nie zapewniają prawidłowego rozwoju i wzrostu; zawierają wszystkie AA egzogenne, ale przynajmniej 1 występuje w ilościach niewystarczających (białko zbóż - Lys, białko ryżu - Lys, Thr, kukurydza - Trp, Lys)
Niepełnowartościowe - białka przyswajalne, ale nie wystarczają do podtrzymania życia; nie zawierają jednego lub więcej AA egzogennych: żelatyna (brak Trp, Cys, niedobór Met, Ile, Val, Tyr)
Bezwartościowe - nieprzyswajalne: białko włosów, paznokci, rogów
Funkcjonalne cechy białek w żywności - oddziaływanie z wodą, jonami i innymi związkami organicznymi
Zwilżanie, pęcznienie, rehydratacja, utrzymywanie wody, zwiększanie rozpuszczalności, (znaczenie: hydrofobowość białka, pH, stężenie soli)
Właściwości żelujące, tworzenie ciast, włókien, błon, zmiana lepkości (białko najczęściej zawiera w swoim składzie poniżej 30% reszt AA hydrofobowych, masa cząsteczkowa 23-60 kDa - żelatyna, albumina osocza, niektóre białka z soi) żele stabilizowane są przez wiązania hydrofobowe, wodorowe, elektrostatyczne, mostki disiarczkowe
Tworzenie i stabilizowanie emulsji, tworzenie piany (białko musi mieć hydrofobowe i hydrofilne właściwości, na tworzenie emulsji wpływa pH i stężenie soli)
Modyfikacje białek (właściwych reszt aminokwasowych)
Acetylacja N-końca - odporność na degradację
Hydroksylacja proliny - stabilizuje nowo zsyntetyzowany kolagen
Karboksylacja glutaminianu w protrombinie, jej zakłócenie powstawanie krwotoków
Glikolizacja poprzez resztę asparaginianową - zwiększa hydrofilność białek
Przyłączanie reszty kwasu tłuszczowego do grupy alfa - aminowej lub tiolowej Cysteiny - zwiększa hydrofobowość białka
Fosforylacja hydroksylowych grup Treoniny, Tyrozyny lub Seryny - mechanizm odwracalnej fosforylacji białek
Proteoliza - enzymy trawienne, proces krzepnięcia krwi
Przemiany białek w trakcie przechowywania i przetwarzania żywności
Ogrzewanie
Denaturacja cieplna (gotowanie, pasteryzacja, sterylizacja, pieczenie, smażenie)
Zmiany enzymatyczne (często inaktywacja enzymów endogennych)
Zmiany właściwości reologicznych i uwodnienia
Zmiany barwy (pieczenie, sterylizacja - reakcja grup aminowych białek i aldehydowych sacharydów lub efekt utlenienia lipidów, zmiany chromoprotein mięśni i krwi, reakcje z H2S uwolnionym z AA siarkowych
Powstawanie sieci - reakcja Maillarda oraz reakcja transaminacji
Efekt:
Lepsze smak, barwa, zapach, często strawność i właściwości reologiczne
Inaktywacja endogennych enzymów, inhibitorów, toksyn bakteryjnych
Usieciowanie obniża podatność na proteolizę - trawienie
Zmodyfikowane AA nie są trawione, szczególnie wrażliwe: Cysteina, Lizyna, Metionina, Tryptofan, Arginina, Leucyna
Enzymatyczna modyfikacja białek
Enzymatyczna hydroliza białek (produkcja serów, dojrzewanie mięsa, wytwarzanie piwa, pieczywa - endogenne proteazy lub preparaty enzymów proteolitycznych - produkt: hydrolizaty i aminokwasy
Wytwarzanie plastein - polipeptydy 3kDa o pożądanym składzie AA, stosuje się endopeptydazy, np. pepsynę, papainę i egzopeptydazy, np. pronazę lub dodatek do hydrolizatów białkowych określonych aminokwasów i reakcję transpeptydacji (pozbycie się Fenyloalaniny - dla chorych na fenyloketonurię)
Reakcje katalizowane prze transglutaminazę - transacylacja lub dezaminacja
Reakcja katalizowana przez transglutaminazę - przeniesienie acylu z grupy y - karboksyamidowej reszty glutaminy (donor) na akceptor (I-rzędową grupę aminową)
Akceptor: aminokwas - wzbogacenie białka o ten aminokwas,
Lizyna - sieciowanie białka
Woda - dezaminacja glutaminy
Zastosowanie: wspomaganie żelowania białek w farszach wędlinowych, galaretkach rybnych, produkcja jadalnych błon białkowych, przyłączanie reszt cukrowych, po wcześniejszej aminacji do reszt glutaminy białek roślinnych, wzbogacanie w niezbędne aminokwasy (Metionina, Lizyna)
FUNKCJE BIAŁEK
Kataliza enzymatyczna - enzymy, np.: rybonukleaza A, lizozym, chymotrypsyna, karboksypeptydaza A
Transport i magazynowanie - hemoglobina, transferyna, albuminy, kazeina, gliadyna, zeina, tuberyna
Odpowiedzialne za uporządkowany ruch - składnik mięśni miozyna i aktyna
Funkcje mechaniczno - strukturalne kolagen, białka fibrylarne, keratyny,
Ochrona immunologiczna - swoiste przeciwciała, interferony, białka chroniące przed zamarzaniem
Wytwarzanie i przekazywanie impulsów nerwowych - rodopsyna, białko receptorowe cAMP
Kontrola wzrostu i różnicowania - hormony, białka represorowe
Białka trujące - toksyna błonicy - blokuje syntezę białek na rybosomach
Białka słodkie - taumatyna, monelina (2000x słodsza niż cukier), mogą zastąpić cukier w diecie
W oczyszczaniu wykorzystywane są
Rozpuszczalność(precypitacja - wysalanie siarczanem amonowym)
Masa cząsteczkowa (chromatografia na sicie molekularnym PAGD - SDS)
Ładunek (chromatografia jonowymienna PAGE, ogniskowanie izoelektryczne)
Specyficzność wiązania (chromatografie powinowactwa i hydrofobowe
Wykład 3 15 X 08
Budowa, funkcjonowanie i znaczenie enzymów
Reakcje termodynamiczne - patrz wykład 1
ATP - umieć wzór
ATP + H2O ADP + Pi
![]()
= -30,5 kJ/mol
AMP - adenozynomonofosforan
ADP - adenozynodifosforan
ATP - adenozynotrifosforan
1,3 - bifosfoglicerynian - metabolit pośredni w glikolizie
Fosfageny - związki bogate w energię guanidyno - fosforanowe
Fosforan kreatyny - występuje w tkance mięśniowej kręgowców
Fosfoarginina - występuje w tkance mięśniowej bezkręgowców
Inne związki bogate w energię:
- Tioestrowe (acylomerkaptany) np. acetylo-S-CoA
- UDP - Glc - urydynodifosforan D-glukozy
…
Enzymy - biokatalizatory
W większości białka (wyjątek cząsteczki RNA - rybozymy) cechuje je wysoka wydajność, specyficzność, zdolność do regulacji, tzn do zmiany aktywności w zależności od potrzeb organizmu
Nie zmieniają stanu równowagi reakcji chemicznej
Przyspieszają reakcje poprzez obniżenie energii aktywacji, np. reakcja katalizowana przez pewien enzym uzyskuje stan równowagi po 1s, bez enzymu trwałoby to 10^8s, czyli ok. 3 lata
Kinetyka reakcji enzymatycznych
Szybkość działania enzymu: mierzy się ubytkiem substratów lub przyrostem produktów w przeliczeniu na jednoskę czasu i ewentualnie objętość lub stężenie białka
Przykład: anhydraza węglanowa
CO2 + H2O H2CO3
Zwiększa szybkość reakcji 10 milionów razy
Jedna cząsteczka enzymu uwalnia 600000 cząsteczek CO2 w ciągu sekundy
Jednostki aktywności enzymów
Międzynarodowa jednostka aktywności enzymu (IU) - ilość enzymu, która katalizuje przekształcenie 1 mikromola substratu w ciągu 1 minuty w 30st.C, w warunkach optymalnego pH, temperatury oraz stężeniu substratu wysycającym dla danego enzymu
Katal - jednostka w układzie SI, ilość enzymu, która katalizuje przekształcenie 1 mola substratu w ciągu 1s w 30 st.C w warunkach optymalnego pH, temperatury oraz stężeniu substratu wysycającym dla danego enzymu. 1 IU = 16,67 nanokatali
Aktywność całkowita - liczba jednostek enzymatycznych w preparacie
Aktywność specyficzna - liczba jednostek enzymatycznych przypadająca na 1 mg białka jest to miara czystości enzymu, najwyższa po całkowitym oczyszczeniu enzymu
Aktywność molekularna - liczba obrotów - liczba cząsteczek substratu przekształconych w ciągu 1 minuty prez 1 cząsteczkę enzymu (lub 1 miejsce aktywne) przy pełnym wysyceniu enzymu przez substrat
Miejsce aktywne enzymu
Region, który wiąże substrat i przemienia go w produkt. Trójwymiarowa przestrzeń tworzona przez reszty aminokwasowe (aminokwasy kontaktowe) charakterystyczne reszty tych aminokwasów (grupy katalityczne np COOH, OH, SH, NH2), które mogą być w dużym oddaleniu od siebie w liniowej sekwencji aminokwasowej i bezpośrednio biorą udział w tworzeniu i zrywaniu wiązań z substratem
Często jest to szczelina lub zagłębienie w cząsteczce enzymu o charakterze hydrofobowym - pomaga wypierać wodę, co ułatwia wiązanie się substratu i katalitycznemu przebiegowi reakcji, obecne są polarne grupy AA, są wtedy szczególnie reaktywne
Miejsce aktywne zajmuje stosunkowo niewielką część całkowitej objętości cząsteczki enzymu, pozostała częśc enzymu tworzy miejsca regulatorowe, kanały dla substratów, miejsca oddziaływania z innymi białkami
Modele wyjaśniające wiązanie substratu
W wiązaniu substratów z enzymami bierze udział wiele słabych oddziaływań: elektrostatyczne, wiązania wodorowe, oddziaływania Van der Waalsa, oddziaływania hydrofobowe
Aby doszło do powstania kompleksu enzym - substrat (ES) muszą one posiadać komplementarne kształty
Fisher - model zamka i klucza
Koshland - model indukowanego dopasowania
Model Michealisa - Menten
E+S (k1, k-1) ES (k2) E+P
K1,K-1, K2 - stałe szybkości reakcji
E - enzym
S - substrat
P - produkt
ES - kompleks enzym-substrat
Równanie Michealisa - Menten
![]()
V0 - szybkość reakcji
Vmax - wartość maksymalna szybkości reakcji
[S] - stężenie substratu
Km - stała Michealisa - stężenie substratu [S] (mol/dm3), przy którym V0 = ½ Vmax, a połowa miejsc aktywnych na enzymie jest obsadzona; miara stabilności kompleksu ES
Modyfikacja Lineweaveara - Burke'a równania Michealisa - Menten = równanie wykresu podwójnych odwrotności
![]()
Zastosowanie:
W doświadczalnym wyznaczaniu wartości Km i Vmax
Określeniu typów inhibicji reakcji enzymatycznych
Odstępstwa od modelu Michealisa - Menten
Główne założenia teorii Michealisa - Menten
Enzym katalizuje reakcję z udziałem 1 substratu, powstaje 1 produkt
S+E ES E+P
Reakcja E+P ES nie zachodzi (lub zachodzi bardzo wolno)
Wykres zależności V0 od [S] jest hiperbolą
W rzeczywistości:
Większość reakcji przebiega z udziałem więcej niż 1 substratu
Enzymy allosteryczne (oligomeryczne) działają niezgodnie z kinetyką Michealisa - Menten, wykres zależności V0 od [S] ma kształt sigmoidalny
Sposoby regulacji szybkości reakcji enzymatycznej
Zmiany [S], [P] (1), [E] (2)
Zmiany T (3), pH (4)
Odwracalne modyfikacje kowalencyjne enzymów - fosforylacja
Nieodwracalna modyfikacja kowalencyjna enzymów - proteoliza
Zmiany szybkości syntezy białek enzymatycznych
Zmiany szybkości degradacji enzymów
Inhibitory i aktywatory
Regulacja allosteryczna i przez sprzężenie zwrotne
Enzymy oligomeryczne, w budowie więcej niż 1 miejsce; regulacyjne i katalityczne
Związanie substratu w jednym CA indukuje zmiany konformacji zwiększające powinowactwo innych CA do substratu (kooperatywność)
Niewielka zmiana w stężeniu substratu istotnie zmienia aktywność enzymu
E: ATC-aza karbamoilotransferaza asparaginianowa (I etap biosyntezy pirymidyn)
asparaginian + karbamoilofosforan N-karbamoiloasparaginian + Pi [CTP hamuje, ATP aktywuje]
Hamowanie aktywności enzymów - inhibicja
Inhibitor - cząsteczka działająca na enzym, powoduje zmniejszenie jego szybkości katalitycznej; często są to metabolity, czasem ksenobiotyki (leki, toksyny)
Penicylina - antybiotyk, zakłóca powstawanie ściany komórkowej bakterii, jego działanie polega na łączeniu się z resztą seryny w centrum aktywnym transpeptydazy peptydoglikanu
Typy inhibicji
Odwracalna
Inhibitor wiąże się z enzymem szybko i odwracalnie
Nieodwracalna
Nie można jej przezwyciężyć, usuwając w prosty sposób (np. dializa) inhibitora z enzymu
Inhibitor często wiąże się z enzymem wiązaniami kowalencyjnymi
Diizopropylofluorofosforan DIPF
Amid kwasu jodooctowego
Inhibicja odwracalna
-Inhibicja kompetycyjna - hamowanie współzawodnicze
Inhibitor wiąże się w centrum aktywnym enzymu - współzawodniczy (konkuruje) z substratem o miejsce wiązania w cząsteczce enzymu
Działanie inhibitora można znieść przez zwiększenie stężenia substratu
Substrat i inhibitor są strukturalnie do siebie podobne
Vmax reakcji nie jest zmieniona przez inhibitor kompetycyjny
Wartość Km wzrasta pod wpływem inhibitora kompetycyjnego
Malonian jest podobny do bursztynianu
-Inhibicja niekompetycyjna
Inhibitor wiąże się w innym miejscu enzymu, niż jego miejsce aktywne, powoduje zmianę przestrzennego kształtu enzymu
Działanie inhibitora niekompetycyjnego nie można znieść przez zwiększenie stężenia substratu
Enzym może związać albo inhibitor (EI), albo inhibitor i substrat (ESI)
Vmax reakcji zmniejsza się
Wartość Km nie zmienia się pod wpływem inhibitora niekompetycyjnego
Pepstatyna inhibitor reniny - enzymu proteolitycznego uczestniczącego w regulacji ciśnienia krwi
Izoenzymy - homologiczne enzymy w obrębie danego organizmu, które katalizują tę samą reakcję, różnią się sekwencją aminokwasową (kodowane przez geny z różnych loci) wartościami Km i Vmax właściwościami regulatorowymi, często ulegają ekspresji w róznych tkankach lub organellach lub w różnychstadiach rozwojowych
Umożliwiają zróżnicowaną regulację tej samej reakcji w różnym miejscu i czasie
LDH - dehydrogenaza mleczanowa - enzym oligomeryczny składa się z 4 podjednostek izozym H - ulega ekspresji głównie w sercu, izozym M - mięśnie, wątroba, H i M w 75%są identyczne pod względem skłądu AA
Różnice: duże stężenie pirogronianu hamuje H4, ale nie M4
Izoenzym H4 ma wyższe powinowactwo do mleczanu niż M4
Specyficzność enzymów
Wiele substratów / produktów wykorzystywanych przez enzym, np. chymotrypsyna katalizuje hydrolizę wiązań peptydowych położonych po karbonylowej stronie AA aromatycznych, trypsyna wiązania położone po karbonylowej stronie Lys lub Arg, pepsyna między AA aromatycznymi i AA dikarboksylowymi
Wobec typu katalizowanej reakcji np. reakcja hydrolizy (hydrolazy) lub przenoszenia elektronów (oksydoreduktazy)
Wobec kierunku działania - ten sam substrat, różne enzymy i produkty:
Kofaktory enzymów
Kofaktor - mała cząsteczka niezbędna do zajścia katalizy, nie będąca łańcuchem polipeptydowym i nie zużywająca się w czasie reakcji
Jony metali np. Zn2+ dla karboksypeptydazy
Pochodne witamin - związków organicznych (nazywane koenzymami), które często organizm nie jest w stanie syntetyzować. Ich brak w pożywieniu powoduje choroby z niedoboru
Koenzym związany kowalencyjnie z cząsteczką białka nazywany jest grupą prostetyczną (hem w hemoglobinie), całość tworzy holoenzym, część białkowa nazywana jest apoenzymem
Wybrane koenzymy oksydoreduktaz
-Koenzymy nikotynamidowe
NAD+, NADH - dinukleotyd nikotynamidoadeninowy - forma utleniona/zredukowana
NADP+/NADPH - fosforan dinukleotydu nikotynamidoadeninowego - forma utleniona/zredukowana
SH2 + NAD+ S + NADH
-Koenzymy flawinowe
FAD/FADH2 - dinukleotyd flawinoadeninowy forma utleniona / zredukowana
FMN/FMNH2 - mononukleotyd flawiny (fosforan ryboflawiny) forma utleniona/zredukowana
Międzynarodowa klasyfikacja enzymów
Klasa |
Typ reakcji |
Przykład enzymu |
1. Oksydoreduktazy |
Utlenianie/redukcja |
Dehydrogenaza mleczanowa |
2. Transferazy |
Przenoszenie grup |
Aminotransferaza asparaginianowa |
3. Hydrolazy |
Reakcje hydrolizy |
Ureaza (EC 3.5.1.5) |
4. Liazy |
Utworzenia wiązań podwójnych poprzez dodanie lub usunięcie grup |
Anhydraza węglanowa |
5. Izomerazy |
Izomeryzacja wewnątrzcząsteczkowa, przeniesienie grup |
Izomeraza triozofosforanowa |
6.Ligazy |
Ligacja (połączenie) dwóch substratów na koszt hydrolizy ATP |
Syntetaza glutaminianowa |
Przykłady reakcji
1.Mleczan + NAD+ Pirogronian + NADH
2. Glutaminian + szczawiooctan asparaginian + 2-oksoglutaran
3. Mocznik + H2O CO2 + 2NH3
4. CO2 + H2O H2CO3
5. Fosfodihydroksyaceton (ketoza) Aldehyd 3-fosfoglicerynowy (aldoza)
6. Glutaminian + NH3 + ATP Glutamina + ADP + Pi
Wykład 4 22 X 08
Znaczenie witamin i substancji mineralnych dla organizmów żywych
Definicja, podział:
Witaminy (Kazimierz Funk wyizolował pierwszy związek o charakterze aminy, konieczny do życia, zapobiegał on chorobie beri-beri; vita - życie - nazwał ten związek witamina)
Związki organiczne konieczne do prawidłowego przebiegu metabolizmu u zwierząt i człowieka, nie są syntetyzowane przez te organizmy w wystarczających ilościach lub wcale - dlatego muszą być dostarczane z pożywieniem
Większość witamin jest prekursorami koenzymów i kofaktorów, a ich niedobór prowadzi do zaburzeń w metabolizmie i w efekcie do chorób z niedoboru
Witaminy można podzielić na rozpuszczalne w:
Wodzie - witaminy C, B1,B2,B3,B5,B6,B12,H,kwas foliowy
Tłuszczach - witaminy A, E, D, K
KWAS ASKORBINOWY (witamina C)
Występowanie - surowe owoce i warzywa, np. owoce cytrusowe, truskawki (kwaśny smak)
Znaczenie -
Wychwytywanie wolnych rodników - antyoksydant
Udział w syntezie hydroksyproliny - składnika kolagenu
W gojeniu się ran
W prawidłowym wykształceniu zębów i kości
Powszechnie stosowany jako dodatek do żywności
Zapobiega brunatnieniu produktów
Hamuje powstawanie nitrozoamin
Niedobór - szkorbut, zaćma
Witamina C może być syntetyzowana przez większość zwierząt. Jednak naczelne, świnka morska i niektóre gatunki nietoperzy utraciły tą zdolność
TIAMINA - witamina B1
Występowanie - kiełki pszenicy, otręby, drożdże piwne, melasa, mięso, ziarna zbóż
Znaczenie:
Pirofosforan tiaminy pełni funkcje koenzymu w reakcjach dekarboksylacji, np. dekarboksylacja pirogronianu
W transferze grupy aldehydowej np. aldehyd glikolowy, octowy
Osoby z niedoborem witaminy B1 podatne są na atak komarów
Niedobór - beri - beri, zaburzenia w działaniu układu nerwowego i serca, często dieta bogata w węglowodany
RYBOFLAWINA (witamina B2)
Występowanie - mleko, mięso, ziarna zbóż, jaja, fotolabilna
Znaczenie - prekursor koenzymów: FAD, FMN, biorących udział w reakcjach oksydoredukcyjnych, np. w łańcuchu oddechowym
Nadmierne spożycie jest toksyczne
Niedobór - zapalenia skóry, chelioza, zapalenie śluzówki kącików jamy ustnej
NIACYNA witamina PP (B3)
Występowanie: chude mięso, wątroba, mięso ryb, jaja, drożdże piwne, palona kawa
Znaczenie:
Prekursor koenzymów NAD+ i NADP+
Może być wytwarzana z Trp z niską wydajnością (z 60 mg Trp - 1 mg niacyny)
Podawana regularnie obniża poziom cholesterolu i trójglicerydów we krwi
Niedobór: pelagra = rumień lombardzki, biegunka, majaczenia
Kukurydza jest szczególnie uboga w niacynę
KWAS PANTOTENOWY (witamina B5)
Występowanie: wątroba, mięso, jaja, groch, ziarna zbóż, mleczko pszczele
Znaczenie:
Składnik koenzymu A
Koenzym A bierze udział w syntezie kwasów tłuszczowych (ACP - koenzym A) i w cyklu kwasu cytrynowego (acetylokoenzymA)
Ocet, ostra musztarda, soda oczyszczona, wysoka temperatura rozkładają witaminę B5 w żywności
Witamina B5 pozwala zachować dobrą kondycję i szczupłą sylwetkę
Niedobór: zapalenie i pęknięcia skóry, siwienie włosów, bóle w stawach, rozdrażnienie
WITAMINA B6
Występowanie: drożdże piwne, wątroba, ziarna zbóż, kapusta, mleko, mięso
Znaczenie:
Składnik PAL
Jako koenzym bierze udział w przemianach: aminokwasów (aminotransferazy, dekarboksylazy), glikogenu (fosforylaza glikogenowa)
Udział w procesie syntezy niacyny z tryptofanu
Kofaktor w syntezie GABA
Fotolabilna, duże ubytki podczas przeróbki mleka
Diety i kuracje odchudzające prowadzą często do znacznych niedoborów witaminy B6
Niedobór: zapalenie skóry, zmęczenie, rozdrażnienie, osłabienie mięśni, gościec
BIOTYNA (witamina H)
Występowanie: drożdże, wątroba, żółtko jaj, groch, kalafior
Znaczenie:
Koenzym karboksylaz, dekarboksylaz oraz deaminaz (karboksylaza acetylo-CoA, karboksylaza pirogronianu)
Jako koenzym bierze udział w biosyntezie kwasów tłuszczowych oraz glukoneogenezie
Występuje często w kompleksach z białkiem, połączona za pośrednictwem Lys
Produkowana jest przez bakterie w układzie pokarmowym
Awidyna (glikoproteina) - składnik surowych jaj, wiąże się silnie z biotyną i ogranicza znacznie jej wchłanianie
Niedobór: zmiany na skórze, łojotok, wypadanie włosów, bóle mięśniowe, apatia, halucynacje
KOBALMINA (witamina B12)
Występowanie: brak w roślinach (weganie!!), mięso, wątroba, nerki, mleko, ryby, fotolabilna
Znaczenie:
Udział w izomeryzacji kwasów dikarboksylowych
Udział w przekształcaniu rybonukleotydów w deoksyrybonukleotydy
Przekształcenie homocysteiny w metioninę
Zawiera układ korynowy: 4 zredukowane pierścienie pirolowe z centralnie związanym kobaltem z dołączoną grupą -CH3, -CN, lub adenylową
Do przyswojenia kobalminy niezbędny jest powstający w śluzówce żołądka czynnik wewnątrzpochodny - glukoproteina z kwasem neuraminowym
Niedobór: anemia złośliwa
KWAS FOLIOWY
Występowanie: zielone części roślin, wątroba, drożdże, fotolabilny (opalanie), termolabilny
Znaczenie:
Udział w biosyntezie kwasów nukleinowych
Jako koenzym F (CoF) uczestniczy w przenoszeniu fragmentów jednowęglowych; formylu, aldehydu mrówkowego, hydroksymetylu
Zawiera: pochodną pterydynową, kwas p-aminobenzoesowy (PABA), kwas glutaminowy, występuje w wielu formach
Po raz pierwszy wyizolowany z liści szpinaku (folium - liść)
Niedobór: anemia - zaburzenie wytwarzania czerwonych krwinek, zahamowanie wzrostu
WITAMINA A
Występowanie: wątroba ryb, drożdże, masło, jaja, mleko, fotolabilna (UV)
Znaczenie:
Udział w procesie widzenia
Ochrona przed wolnymi rodnikami
Zbyt duże spożycie jest toksyczne!!!
Prekursorem jest KAROTEN, witamina A występuje w kilku formach, np. retinol, 3-dehydroretinol, łatwo ulega utlenieniu w obecności nadtlenków, metali itp.
Niedobór: kurza ślepota, suchość skóry, kruche paznokcie, zahamowanie wzrostu
WITAMINA D - kalcyferol
Występowanie: tran, wątroba, mleko, masło, jaja, fotolabilna (UV)
Znaczenie:
Udział w gospodarce wapniowo - fosforanowej - ułatwia wchłanianie soli wapnia
Hormon steroidowy
Może być syntetyzowana w skórze (UV) - D3 (czyli nie witamina) lub dostarczana z pożywieniem - D2 i D3
Niedobór: krzywica, osteomalacja - kości są miękkie i podatne na wyginanie
ALFA - TOKOFEROL (witamina E)
Występowanie: oleje roślinne, orzechy, sałata, szpinak, kapusta, masło, jaja, fotolabilna (UV), podatna na utlenienie
Znaczenie:
Udział w prawidłowym funkcjonowaniu narządów rozrodczych
Pełni rolę przeciwutleniacza w błonach komórkowych
Stosowana do stabilizacji tłuszczów w produktach żywnościowych - jełczenie masła, występuje w kilku formach
Niedobór: resorbcja płodu, atrofia jąder, zaburzenie w produkcji spermy, dystrofia mięśni, plamy starcze na skórze („kwiaty starości”)
WITAMINA K
Występowanie: K1 - produkty roślinne - tylko zielone części, ewentualnie oleje roślinne; K2 - tkanki zwierzęce, tran, fotolabilna (UV)
Znaczenie:
Udział w procesie krzepnięcia krwi synteza protrombiny
Udział w formowaniu tkanki kostnej
Posiada właściwości przeciwbakteryjne, przeciwgrzybiczne, przeciwbólowe i przeciwzapalne
Syntetyzowana w jelitach przez bakterie
Niedobór: krwotoki - różne, zakłócenia w pracy jelit
ANTYWITAMINY
Mają podobną budowę i właściwości do witamin
Inaktywują witaminy
Powodują powstawanie nieaktywnych enzymów
Np.
Sulfonilamid dla PABA (składnik kwasu foliowego)
Kwas pirydyno-3-sulfonowy dla niacyny
Kwas glikoaskorbinowy dla witaminy C
SUBSTANCJE MINERALNE
Pierwiastki, kationy i mikroelementy niezbędne dla prawidłowego funkcjonowania organizmów żywych
Podstawowe składniki (99% masy większości komórek) organizmów żywych: C, H, N, O
Inne mikroelementy występujące w organizmach żywych: P, S, Na+, Mg2+, Ca2+, Cl-, Mn, Fe, Co, Cu, Zn
Mikroelementy występujące u niektórych organizmów: B, Al., V, Mo, I, Si
Ca - wapń
Funkcje szkieletowe u zwierząt (kości, zęby) i roślin, uczestniczy w reakcjach enzymatycznych jako kofaktor, pełni role cząsteczki sygnałowej. Wapń wiąże się z białkiem regulatorowym - kalmoduliną stymulując jej aktywność
P - fosfor
Podstawowy składnik kośćca oraz substancji zapasowych w postaci fitynianu u roślin, jony orto, di- i polifosforanowe wchodzą w skład kwasów nukleinowych, koenzymów, związków makroergicznych, fosfolipidów i wielu innych metabolitów
Mg - magnez
Jako kofaktor bierze udział w reakcjach z udziałem ATP, wchodzi w skład magnezoporfiryn budujących chlorofile, czyli uczestniczy w procesie fotosyntezy
Fe - żelazo
Składnik żelazoporfiryn, np. hemoglobiny, mioglobiny (transportują tlen), cytochromów i ferredoksyn (transportują elektrony), leghemoglobiny (uczestniczy w procesie wiązania azotu atmosferycznego), inne enzymy: peroksydazy, katalazy, dehydrogenazy flawinowe. W organizmach żelazo magazynowane jest głównie w ferrytynie
Na - sód, K - potas
Utrzymują stan właściwego uwodnienia organizmu, potas jest aktywatorem niektórych enzymów (kinaza pirogronianowa)
S - siarka
Wchodzi w skład 2 aminokwasów: metioniny i cysteiny oraz 2 witamin: biotyny i tiaminy. Funkcje siarki polegają w głównej mierze na budowaniu centrów aktywnych wielu enzymów (-SH - cysteina), siarka wchodzi w skład wielu białek strukturalnych stabilizując je poprzez mostki dwusiarczkowe (-S-S-), białka żelazowo - siarkowe przenoszą elektrony
Mn - mangan, Zn - cynk, Cu - miedź, Mo - molibden, Co - kobalt OGÓLNIE
Jony metali w dużych stężeniach powodują denaturację białka, z kolei w małych aktywują pewną grupę białek, często również stabilizują strukturę aktywną białek, są składnikami centrów katalitycznych. tworzą kompleksy metal - substrat (kinaza keratyny), które następnie atakowane są przez enzymy, metale mogą uczestniczyć przy przyłączeniu koenzymu do apoenzymu lub substratu do centrum aktywnego enzymów
F - fluor, I - jod, Cl - chlor
Fluor jest składnikiem szkieletu zwłaszcza uzębienia, jod wchodzi w skład hormonów, chlor składnik soku żołądkowego
Wykład 5 29 X 08
Barwniki, karotenoidy i glikozydy, naturalne dodatki do żywności
BARWNIKI
Stosowane do barwienia żywności, pochodzenia roślinnego: curry, szafran, papryka (często aby ukryć wady, zwiększyć atrakcyjność i apetyczność)
Jedyny barwnik pochodzenia zwierzęcego: koszenila, kwas karminowy
Barwniki chinoidowe - koszenila, czerwony barwnik, otrzymywany z pluskwiaków meksykańskich, dobrze rozpuszcza się w wodzie i jest dość trwały
Karotenoidy
Barwniki karotenoidowe: annatto, preparaty z papryki i szafranu
Grupa organicznych związków chemicznych, węglowodory nienasycone o szczególnej budowie, charakterystyczną cechą karotenoidów jest występowanie dwóch pierścieni cykloheksylowych połączonych długim łańcuchem węglowym, w którym występuje układ sprzężonych wiązań podwójnych węgiel-węgiel
Występują one we wszystkich fotosyntetyzujących tkankach (rośliny wyższe, glony, sinice, bakterie fotosyntetyzujące) oraz w płatkach roślin, pyłku, korzeniach, nasionach, owocach a także w żółtku jaja, w maśle, w piórach ptaków, łuskach ryb. Jak dotąd zidentyfikowano i opisano około 800 karotenoidów np.
Alfa-, beta-karoten (marchew)
Kryptoksantyna (pomarańcza),
Luteina (liście),
Likopen (pomidor),
Zeaksantyna (kukurydza),
Astaksantyna (pancerze skorupiaków w postaci estrów z kwasami tłuszczowymi)
Właściwości karotenoidów:
Nie rozpuszczają się w wodzie
Są fotolabilne - ulegają izomeryzacji w obecności światła - tracąc właściwości biologiczne i barwę
Karotenoidy są podatne także na utlenienie i nie odporne na działanie kwasów
Rola karotenoidów
Chronią fotosystem przed uszkodzeniem (fotooksydacją), spowodowane może to być nadmiarem docierającej energii świetlnej, pochłaniają promieniowanie z zakresu widma niebieskiego i fioletowego
Nadają barwę roślinom, ich organom itp.
Prekursory witamin, karotenoidy przemieniają się w witaminy rozpuszczalne w tłuszczach, np. wit. A (pochodna b-karotenu)
Pochodna beta-karotenu jest prekursorem neoretinalu, który po połączeniu z białkiem opsyną tworzy rodopsynę - białko reagujące na bodźce świetlne w oku
Barwniki flawonoidowe
Np. antocyjany (często są to glikozydy: część cukrowa - często glukoza i pochodna kationu flawyliowego) pochodzą z wytłoków winogron, żurawin, czarnych porzeczek i czarnego bzu - barwniki o kolorze czerwonym, fioletowym lub niebieskim
Główne barwniki kwiatów i owoców, często mają gorzki i piekący smak - pokarmowe repelenty
Barwa antocyjanów zależy od pH środowiska, w pH poniżej 7 są one czerwone, a w pH powyżej 7 mają barwę niebieską lub fioletową
W kompleksie z jonami glinu lub żelaza III, to mimo kwaśnego odczynu środowiska, również mają barwę niebieską (np. w kwiatach chabra bławatka)
Betalainy - otrzymywane z buraka ćwikłowego, kwiaty i nasiona niektórych odmian Amarantusa i owoce niektórych gatunków kaktusów, należą do alkaloidów
Obecność betalain wyklucza obecność antocyjanów i odwrotnie
Betanina - dobrze rozpuszcza się w wodzie, trwała w zakresie pH 3,5 - 7,0, wrażliwa na podwyższoną temperaturę i światło
Stosowana np. do „poprawienia” koloru wina
Kurkuma, czyli żółta kurkumina - wytwarzana przez rośliny rodzaju Curcuma
Karmel - zaliczany do barwników naturalnych, mimo, że w naturze nie występuje
Ryboflawina - witamina B2 - wrażliwa na światło, żółty kolor występuje głównie w nasionach,
mleku i mięsie
Barwniki pirolowe, układ pirolowy w formie łańcuchowej lub pierścieniowej
Porfiryny - barwniki pirolowe pierścieniowe (hem, chlorofil)
Bilirubinoidy - barwniki pirolowe łańcuchowe (bilany - produkty katabolizmu porfiryn: bilirubina - główny barwnik żółci, fotochromy (fikobiliny): fikocyjanina i fikoerytryna - barwniki asymilacyjne)
Barwniki porfirynowe
Chlorofil - barwnik absorbujący światło w procesie fotosyntezy, tetrapirolowa budowa z atomem magnezu, jako centralnego jonu metalu, dodatkowo fitol to 20węglowy alkohol o silnie hydrofobowym charakterze, pozwala na zakotwiczenie chlorofilu w błonie aktywnej fotosyntetycznie; chlorofil rozkłada się w podwyższonej temperaturze i pod wpływem kwasów - powstaje oliwkowozielona feofityna - Mg zastępowany jest przez 2 atomy wodoru; Po oderwaniu fitolu i wymianie Mg brunatny feoforbid
Hem - budowa podobna do chlorofilu, w centrum znajduje się atom żelaza, stanowi grupę prostetyczną hemoglobiny - białka przenoszącego tlen we krwi oraz mioglobiny - białka magazynującego tlen w mięśniach
W methemoglobinie (metmioglobinie) żelazo ma +3 stopień utlenienia i przyłączoną grupę OH do wiązania koordynacyjnego, nie może przyłączyć O2 i ma barwę brunatnoszarą, sprzyja temu denaturacja białka - uwalniany jest wtedy hem, który może łatwo się utleniać, aby temu zapobiec stosuje się peklowanie mięsa
Budowa hemu typu a występuje w cytochromie a i w chlorofilach (w chlorofilach zamiast Fe jest Mg), charakterystyczne jest występowanie hydrofobowego łańcucha (fitol - chlorofile), grupy aldehydowej zamiast metylowej
Budowa hemu typu b występuje w hemoglobinie, związany z globiną wiązaniem koordynacyjnym z resztą histydyny poprzez Fe
Budowa hemu typu c występuje w cytochromie c, charakterystyczne tu jest związanie hemu poprzez resztę cysteiny hemu z apoenzymem wiązaniem kowalencyjnym
Rozkład hemu do bilirubiny:
-W pierwszym etapie powstaje CO i uwolniony jest jon Fe3+ - jedyna reakcja w organizmie człowieka, w której efekcie powstaje czad
-Biliwerdyna jest zielonkawa - nadaje zabarwienie sińcom urazy powodują obumieranie erytrocytów i rozpad hemoglobiny
-Bilirubina niepolarny związek, źle rozpuszczający się w wodzie, ma kolor czerwonobrunatny i tworzy kompleksy z albuminą we krwi
-Kompleksy bilirubiny z albuminą wychwytywane są przez komórki wątroby
-W wątrobie do bilirubiny przyłączane są 2 cząsteczki kwasu glukuronowego pochodzące z UDP - glukuronanu; w efekcie powstaje diglukuronid bilirubiny - lepiej rozpuszczalny w wodzie; związek ten przedostaje się do jelita i jest wydalany z żółcią z organizmu - przyczyniając się do powstania charakterystycznego zabarwienia kału
Żółtaczka - nadmierne nagromadzenie się barwników żółciowych, często u wcześniaków: aktywności enzymów wytwarzających diglukuronid bilirubiny są niskie, w życiu płodowym odpowiada za to organizm matki
TERPENY
Związki lipidowe składające się z wielokrotności 5C węglowodoru - izoprenu (2-metylo-1,3-butadienu). Związki te mają strukuturę liniową lub cykliczną. Wiele terpenów nadaje roślinom charakterystyczny zapach lub smak i stanowi główne składniki otrzymywanych z nich „olejków eterycznych”
Przykłady:
Geraniol (olejek z pelargonii)
Limonen (olejek z cytryny)
Mentol (olejek miętowy)
Karwon (olejek kminkowy)
Fitol (składnik chlorofilu)
Kauczuk naturalny (politerpen - składa się z wielu tysięcy jednostek izoprenowych)
GLIKOZYDY - połączenia cukrów, najczęściej glukozy z alkoholami lub fenolami (aglikon)
Gorzki smak lub specyficzny aromat, barwniki (flawinowe) przykłady:
Amigdalina (nadaje smak migdałom, występuje też w pestkach innych owoców) składa się z gencjobiozy - disacharydu, kwasu cyjanowodorowego i aldehydu benzoesowego
Synigryna (występuje w czarnej gorczycy, chrzanie) posiada właściwości bakteriostatyczne
Rutozyd (substancja aktywna Rutinoscorbinu, występuje np. w kwiatach czarnego bzu) - część cukrowa składa się z disacharydu rutynozy: glukoza + ramnoza; część niecukrowa: kwercetyna, antyoksydant, składnik wielu leków
ALKALOIDY - związki organiczne o charakterze zasadowym, najczęściej z heterocyklicznym pierścieniem z N
Nikotyna - silna trucizna
Chinina - lek przeciw malarii, w większych dawkach trująca
Morfina - główny alkaloid opium - mlecznego soku z maku, w małych dawkach środek uspokajający, w większych narkotyk, w medycynie stosowana jako środek przeciwbólowy
Kodeina - składnik opium, lek na kaszel
KWASY ORGANICZNE - metabolity pośrednie, regulacja pH w komórce
Występują w stanie wolnym lub jako sole wapniowe, potasowe, w postaci estrów (olejki eteryczne)
Alifatyczne jednokarboksylowe: octowy (owoce, nasiona przenicy, kukurydzy, powstaje podczas fermentacji octowej, stosowany np. do produkcji marynat), masłowy (występuje w postaci estrów; ester metylenowy - zapach jabłek, etylowy - ananasów), pirogronowy (końcowy produkt glikolizy, substrat w wielu fermentacjach), mlekowy (produkt fermentacji mlekowej - kiszenie ogórków, mleczarstwo)
Alifatyczne wielokarboksylowe: bursztynowy (występuje w owocach - wiśnia, agrest, porzeczka, winogrona), szczawiooctowy i ketoglutarowy (ważne metabolity pośrednie), 1-jabłkowy (owoce, nasiona - stosowany w cukiernictwie i w napojach orzeźwiających), winowy (winogrona, sól potasowa do proszków do pieczenia, napojów orzeźwiających), cytrynowy (cytrusy, porzeczki, maliny, powszechnie stosowany w przemyśle spożywczym, produkowany przez Aspergillus)
Kwasy aromatyczne: benzoesowy, salicylowy, cynamonowy, kumarowy, gallusowy, kawowy, kofeinowy (występują jako estry, składniki olejków eterycznych, alkaloidów i glikozydów)
DODATKI DO ŻYWNOŚCI
Kategorie dodatków do żywności
Zapobiegające zepsuciu (np. konserwanty, kwasy, przeciwutleniacze)
Sensoryczne (barwniki, słodzące, wzmacniające smak i zapach)
Teksturotwórcze (skrobie modyfikowane, zagęstniki, żelujące, emulgatory itp.)
Pomocnicze (np. enzymy, pianotwórcze, przeciwpieniące, rozpuszczalniki)
Klasyfikacja substancji dodatkowych
Naturalne substancje dodatkowe
Substancje chemiczne zdefiniowane, nie przewidziane do spożycia w odpowiednich dawkach. Otrzymywane procesami fizycznymi, mikrobiologicznymi lub enzymatycznymi z artykułów spożywczych lub materiałów pochodzenia roślinnego, zwierzęcego, albo otrzymywane w czasie przetwórstwa żywności. Zalicza się tu sole naturalnych substancji smakowo - zapachowych z anionami Cl, SO4, CO3
Syntetyczne substancje dodatkowe
Syntetyczne substancje (aromatyczne) otrzymywane na drodze syntezy chemicznej i nie posiadające identycznych odpowiedników substancji naturalnych występujących w produktach pochodzenia roślinnego lub zwierzęcego
Identyczne z naturalnymi substancje dodatkowe
Substancje otrzymywane przez chemiczną syntezę lub wyodrębnienie przy stosowaniu procedur chemicznych, pod względem chemicznym są one identyczne z substancjami występującymi w produktach pochodzenia roślinnego lub zwierzęcego
Po co zastępować naturę?
Wanilina - związek zapachowy
Kilogram naturalnej waniliny wyekstrahowany z owoców wanilii (Vanila plantifolia) kosztuje ok. 4 tys USD, kilogram syntetycznej (identycznej z naturalną) waniliny kilkanaście USD
SUBSTANCJE SŁODZĄCE
Białka:
Taumatyna i monelina - ok. 2000x słodsze niż sacharoza, wrażliwe na wysoką temperaturę, monelina jest właściwie polipeptydem: składa się z 2 łańcuchów w sumie z 94 reszt aminokwasów)
Sacharydy:
Laktitol - alkohol cukrowy, produkowany z laktozy - 40% słodkości w stosunku do sacharozy, GI = 4 (indeks glikemiczny = 4, czyli wchłania się słabiej niż glukoza), przyjazny dla zębów
Fruktoza - cukier owocowy, słodsza od cukru o około 50-60%, wolniej się wchłania niż glukoza, czy sacharoza (niższy indeks glikemiczny - GI = 19)
Litesse - polidekstroza - polimer glukozy, przyjazna dla zębów, niski GI = 7
MELAMINA
Melamina i kwas cyjanurowy są bogate w N, dodawana do żywności (paszy) zwiększa ilość „białka” np. w mleku w proszku
Inne źródło - pestycyd cyromazyna (stosowana w chlewniach, kurnikach do zwalczania much) może odkładać się w roślinach jako melamina i w ten sposób trafiać do układu pokarmowego człowieka
Addukt melaminy z kwasem cyjanurowym tworzy kryształki, które mogą odkładać się w nerkach np. dzieci
AMINOKWASY
L-Karnityna - syntetyzowana z lizyny w nerkach, wątrobie i mózgu, działa „odchudzająco” poprzez wpływ na tempo spalania tłuszczu, pełni funkcję przenośnika kwasów tłuszczowych do wnętrza mitochondriów, dużo L-karnityny znajduje się w mięsie, ważny element diety sportowców
Tauryna - wytwarzana z cysteiny, przy współudziale wit B6, aminokwas sulfonowy, działa wzmacniająco na serce, układ krążenia oraz nerwowy, stosowany w rehabilitacji po atakach serca, w leczeniu padaczki i innych pobudliwości nerwowych, posiada właściwości przeciwutleniające i odtruwające, znajduje się w mięsie wołowym, baranim i w rybach
NOBEL 2008 z chemii
Nagrodę Nobla w dziedzinie chemii otrzymali trzej amerykańscy naukowcy - Osamu Shimomura, Martin Chalfie i Roger Tsien pracujący na amerykańskich uczelniach. Komitet Noblowski przy Królewskiej Szwedzkiej Akademii Nauk wyróżnił ich za odkrycie i rozwój zielonego białka fluorescencyjnego GFP (green fluorescent protein) - jednego z podstawowych narzędzi biologii molekularnej. GFP wytwarzane jest przez meduzę Aequorea victoria, składa się z 238 aminokwasów i świeci intensywnie na zielono pod wpływem ultrafioletu
Wykład 7 12 XI 08
Charakterystyka, klasyfikacja i budowa lipidów
Podział lipidów (tłuszczowców)
Lipidy proste
Tłuszcze właściwe - estry kwasów tłuszczowych z glicerolem (triacyloglicerole)
Woski - estry kwasów tłuszczowych z wyższymi alkoholami
Woski prawdziwe
Estry cholesterolu
Estry witaminy A i estry witaminy D
Lipidy złożone
Fosfolipidy - zawierają ortofosforan (lecytyny, kefaliny, sfingomieliny)
Cerebrozydy - glikolipidy - zawierają węglowodany, występują w mózgu
Sulfolipidy - zawierają siarkę
Pochodne lipidów
Sterydy i steroidy
Kwasy tłuszczowe
Wyższe alkohole i inne związki organiczne (np. lipoproteiny)
Znaczenie lipidów
Lipidy generalnie słabo lub wcale rozpuszczają się w wodzie, dobrze natomiast rozpuszczają się w rozpuszczalnikach organicznych
Składnik membran komórkowych - rola budulcowa
Magazynują energię, głównie w postaci triacylogliceroli - rola zapasowa
Niektóre pochodne lipidów pełnią rolę hormonów i witamin - rola regulacyjna
U zwierząt lipidy stanowią formę transportową surowców energetycznych
Podskórna tkanka tłuszczowa u kręgowców pełni funkcję termoizolacyjną
Kwasy żółciowe są naturalnymi detergentami - ułatwiają trawienie tłuszczów w przewodzie pokarmowym
Woski tworzą warstwę ochronną na skórze, włosach, piórach, a także na liściach - zapobiega to utracie wody przez rośliny
TŁUSZCZE WŁAŚCIWE
Tłuszcze właściwe (estry glicerolu - 3 grupy OH): występują głównie w postaci triacylogliceroli, nie rozpuszczają się w wodzie, gromadzą się w komórkach tłuszczowych (zwierzęta), nasionach, owocach (rośliny)
Właściwości fizyczne (stan skupienia) zależą od długości reszt acylowych i ilości wiązań podwójnych
Tłuszcze zwierzęce mają najczęściej konsystencję stałą, a roślinne ciekłą
Pod wpływem ogrzewania z kwasami i zasadami tłuszcze proste ulegają hydrolizie (za hydrolizę enzymatyczną triacylogliceroli odpowiada lipaza trzustkowa), następnie uwolnione kwasy tłuszczowe poddawane są procesowi beta-oksydacji, czemu towarzyszy powstawanie energii
Kwasy tłuszczowe
Podstawowy składnik triacylogliceroli i lipidów tworzących membrany komórkowe
Najczęściej posiadają parzystą liczbę C, cechy fizyczne (lotność, punkt topnienia, rozpuszczalność w wodzie) zależą od długości łańcucha i przekładają się na właściwości tłuszczy, które budują
Niektóre kwasy tłuszczowe o 2 i 3 wiązaniach podwójnych (kwas linolowy, linolenowy i arachidowy) są niezbędnymi składnikami diety ludzi i zwierząt (NNKT lub EFA), a ich brak powoduje występowanie objawów chorobowych
Dzielą się na nasycone i nienasycone (co najmniej 1 wiązanie podwójne - izomeria cis/trans)
Modyfikacje kwasów tłuszczowych
Naturalnie występujące nienasycone kwasy tłuszczowe występują głównie jako izomery cis. Przetwarzanie żywności (np. w wysokiej temperaturze) powoduje izomeryzację trans. Duże spożycie izomerów trans grozi nowotworami i chorobami serca.
Uwodorowanie tłuszczy (utwardzanie) - zapobiega np. jełczeniu, ale powoduje także zmianę konformacji kwasów tłuszczowych
Nasycone kwasy tłuszczowe
Kwas |
Liczba at. C |
Wzór |
Temperatura topnienia C |
Masłowy |
4 |
CH3(CH2)2COOH |
-4,7 |
Kapronowy |
6 |
CH3(CH2)4COOH |
-1,5 |
Kaprylowy |
8 |
CH3(CH2)6COOH |
16,5 |
Kaprynowy |
10 |
CH3(CH2)8COOH |
31,3 |
Laurynowy |
12 |
CH3(CH2)10COOH |
44 |
Mirystynowy |
14 |
CH3(CH2)12COOH |
58 |
Palmitynowy |
16 |
CH3(CH2)14COOH |
63 |
Stearynowy |
18 |
CH3(CH2)16COOH |
70 |
Arachinowy |
20 |
CH3(CH2)18COOH |
76 |
Behenowy |
22 |
CH3(CH2)20COOH |
82 |
Nienasycone kwasy tłuszczowe
Palmitooleinowy |
16 |
CH3(CH2)5CH=CH(CH2)7COOH |
-1 |
Oleinowy |
18 |
CH3(CH2)7CH=CH(CH2)7COOH |
14,5 |
Linolowy |
18 |
CH3(CH2)4(CH=CHCH2)2(CH2)6COOH |
Ciekły |
Linolenowy |
18 |
CH3CH2(CH=CHCH2)3(CH2)6COOH |
Ciekły |
Arachidonowy |
20 |
CH3(CH2)4(CH=CHCH2)4(CH2)2COOH |
Ciekły |
Kwas oleinowy (C9-C10) najbardziej rozpowszechniony w przyrodzie, najwięcej jest go w oleju lnianym, migdałowym i sezamowym
Kwas linolowy (C9-C10 i C12-C13) występuje w oleju rzepakowym, lnianym i tłuszczach zwierzęcych
Kwas linolenowy (C9-C10, C12-C13, C15-C16) występuje głównie w tłuszczach roślinnych
Kwasy omega 3, omega 6 i omega 9
Omega 6 (n-6) - zawierają przynajmniej 2 wiązania podwójne, jedno przy węglu 6 - licząc od grupy metylowej (kwasy linolowy, arachidonowy)
Omega 3 (n-3) - zawierają przynajmniej 2 wiązania podwójne, jedno przy węglu 3 - licząc od grupy metylowej (kwas alfa-linolenowy)
Omega 9 (n-9) - zawierają przynajmniej 2 wiązania podwójne, jedno przy węglu 9 - licząc od grupy metylowej (kwas oleinowy)
Tylko kwasy omega 6 i omega 3 należą do grupy niezbędnych nienasyconych kwasów tłuszczowych (NNKT)
Niedobór: nadmierne łuszczenie się naskórka, utrudniona regeneracja tkanek, zwiększona utrata wody, dolegliwości układu krążenia, obniżona odporność na infekcje, niedorozwój płodu, zaburzenia w wydzielaniu insuliny
Kwasy linolowy i alfa-linolenowy, zwane podstawowymi NNKT, nie są syntetyzowane przez człowieka i zwierzęta
Kwas arachidonowy syntetyzowany jest wyłącznie przez zwierzęta z prekursorów
WOSKI
Woski (estry wyższych alkoholi (min 1 grupa OH): nie rozpuszczają się w wodzie, występują u roślin (pokrywają liście, łodygi, pnie, owoce) i zwierząt (gruczoły łojowe w skórze), chronią przed nasiąkaniem wody, wysychaniem oraz działaniem chemicznym i mikrobiologicznym
Olbrot - wosk z kości czaszkowych wieloryba
Wosk pszczeli
Lanolina - forma wosku cholesterolowego wydzielanego przez skórę ssaków
Wosk karnaubski - występuje na powierzchni liści palmy, np. stosowany wraz z lanoliną do wyrobu past do butów
Kutyna (składnik kutykuli - zabezpiecza rośliny przed nadmiernym parowaniem) i suberyna (składnik korka u roślin) - zabezpiecza rośliny przed nadmiernym parowaniem, infekcjami mikrobiologicznymi i urazami mechanicznymi
Kondycjonowanie bulw ziemniaków - przetrzymywanie po zbiorze w wyższych temperaturach, ma na celu wytworzenie warstwy korkowej
TŁUSZCZE ZŁOŻONE
Fosfolipidy - składają się z glicerolu, kwasów tłuszczowych, ortofosforanu i reszty:
Zawierającej azot (lecytyna, kefalina)
Nie zawierającej azotu (3-fosfatydyloinozytol)
Sfingolipidy składają się z sfingozyny zamiast glicerolu, kwasów tłuszczowych, ortofosforanu i reszty zawierającej azot
Glikolipidy/cerebrozydy składają się z glicerolu, kwasów tłuszczowych i reszty cukrowej
Sulfolipidy - zawierają siarkę
Fosfolipidy zawierające AZOT
Składają się z glicerolu, kwasów tłuszczowych, ortofosforanu i reszty zawierającej azot, np. choliny, kolaminy, seryny
Lecytyna: składnik zewnętrznej membrany komórkowej u roślin i zwierząt, najczęściej zawiera kwas tłuszczowy nasycony i nienasycony. Pi przy skrajnym węglu: alfa, przy środkowym: beta
Lecytyny stosuje się przy produkcji czekolady, margaryny oraz jako antyutleniacze chroniące tłuszcz przed jełczeniem
Z wodą tworzą roztwory koloidalne
Sfingolipidy - składają się ze sfingozyny - pochodnej glicerolu; jeżeli nastąpi N-acylacja grupy aminowej sfingozyny powstaje ceramid
Sfingolipidy dominują w tkance nerwowej
Po przyłączeniu do ceramidu fosfocholiny powstaje sfingomielina
Inne sfingolipidy: cerebrozydy (zawierają galaktozę), sulfatydy (zawierają estry kwasu siarkowego), globozydy (zawierają 2 lub więcej cukrów), gangliozydy (podobne do globozydów, zawierają kwas sialowy)
Glikolipidy
-Celebrozyna - występuje w mózgu, podawana razem z innymi preparatami w leczeniu choroby Alzheimera
-Gangliozydy - zawierają galaktozę i występują w zwojach nerwowych
Sulfolipidy - znaleziono w grzybach, algach, bakteriach, chloroplastach, u niektórych ssaków, występują w formie anionowej w skrajnie kwaśnym środowisku ph=2
Naturalnie występujący w cyjanobakteriach sulfolipid wykazujący właściwości zapobiegające rozwojowi wirusa HIV - inhibitor AIDS
SQDG - występuje w tylakoidach chloroplastów roślin wyższych i niższych; glicerol, 2 reszty acylowe, galaktoza z estrowo zwiazaną resztą sulfonową
POCHODNE LIPIDÓW
Sterydy i sterole
Lipidy pierścieniowe - steroidy:
- Cholesterol
- Hormony steroidowe
-Sole (kwasów) żółciowych (umożliwiają emulgację lipidów włącznie z witaminami rozpuszczalnymi w tłuszczach)
Cholesterol
-Składnik błon komórkowych (ok. 90%), prekursor hormonów steroidowych, witaminy D i soli kwasów -żółciowych
-Synteza cholesterolu odbywa się w wątrobie
-Znajduje się wyłącznie w produktach pochodzenia zwierzęcego
-Nadmiar w diecie prowadzi do miażdżycy
Klasy hormonów steroidowych
Klasa |
Miejsce syntezy |
Hormon |
Działanie |
Progestageny |
Ciałko żółte |
Progesteron |
Przygotowuje podłoże macicy do implantacji jaja, podtrzymanie ciąży |
Androgeny |
Jądra |
Testosteron |
Rozwój drugorzędowych męskich cech płciowych |
Estrogeny |
Jajnik |
Estron |
Rozwój drugorzędowych żeńskich cech płciowych |
Glukokortykoidy |
Kora nadnercza |
Kortyzon |
Pobudza glukoneogenezę i tworzenie glukogenu; zwiększa rozkład tłuszczu i białka |
Mineralokortykoidy |
Kora nadnercza |
Aldosteron |
Zwiększa resorpcję Na+ i wydzielanie K+ i H+ przez kanaliki nerkowe |
Lipoproteiny
Transportują tłuszcz w układzie krwionośnym i limfatycznym
Chylomikrony, syntetyzowane z triacylogliceroli wchłanianych w jelicie; transportują tłuszcz z jelita do narządów obwodowych; nie wykazują ruchliwości elektroforetycznej
Lipoproteiny o bardzo małej gęstości (VLDL) (z ang very low density lipoproteins), pre-beta-lipoproteiny, pochodzą z wątroby; transportują tłuszcz z wątroby do tkanki tłuszczowej
Lipoproteiny o małej gęstości, LDL (z ang low density lipoproteins), beta-lipoproteiny, produkty końcowe katabolizmu VLDL; transportują cholesterol z wątroby do tkanek pozawątrobowych
Lipoproteiny o dużej gęstości, HDL (z ang high density lipoproteins), alfa-lipoproteiny, biorą udział w metabolizmie VLDL, chylomikronów i cholesterolu; transportują cholesterol z tkanek pozawątrobowych do wątroby
Znaczenie kwasów tłuszczowych w diecie
Dostarczają NNKT
W skondensowanej formie energii
Kwasy nasycone głównie produkty zwierzęce
Kwasy nienasycone: oleje roślinne, nasiona, ryby
Dostarczają rozpuszczalne w tłuszczach witaminy
Dostarczają wiele prekursorów do syntez związków organicznych
Stymulują apetyt i dają uczucie sytości
Substytut tłuszczy w diecie
Olestra - nie jest trawiona w układzie pokarmowym (nie dostarcza kalorii - nie jest wchłaniana), a nadaje pożywieniu cech, jakich dałby obecny w nich tłuszcz (dodawana np. do chipsów), odporna jest na wysoką temperaturę
Składa się z 6-8 reszt kwasów tłuszczowych oraz związanej z nimi wiązaniami estrowymi przez grupy OH cząsteczki sacharozy
Wykład 8 19 XI 08
Kwasy nukleinowe: budowa i właściwości
Ekspresja genów:
DNA (replikacja)(transkrypcja) mRNA (translacja) Polipeptyd (białko)
Kwasy nukleinowe
Naturalne, liniowe polimery nukleotydów, służące do przechowywania, przekazywania i ekspresji informacji genetycznej, składają się z zasady azotowej (wzory umieć), cukru pentozy oraz kwasu fosforowego
DNA - kwas deoksyrybonukleinowy
Zapisana informacja, która determinuje strukturę białek, zakodowane informacje dotyczące wzrostu i podziału komórek, występuje powszechnie w eukariota i prokariota, bardziej odporny na hydrolizę niż RNA
RNA - kwas rybonukleinowy - przenosi informacje z DNA do pozostałych komórek, występuje jako jedyny nośnik informacji genetycznej w niektórych wirusach (HIV 1, wirus mozaiki tytoniowej)
Zasada azotowa (umieć wzory)
Pentoza (umieć wzory)
- Ryboza (występuje w RNA)
- Deoksyryboza (występuje w DNA, grupa 2' OH rybozy zastąpiona przez H)
Nukleozydy - połączenie przez C1 cukru z zasadą azotową poprzez atom N - (N1 dla pirymidyn i N9 dla puryn), występujące wiązanie nazywa się N-glikozydowe;
Rybonukleozydy - RNA
Deoksyrybonukleozydy - DNA
Adenozyna - rybonukleozyd
Deoksyadenozyna - deoksyrybonukleozyd - purynowy
Tymidyna - deoksyrybonukleozyd - pirymidynowy
Nukleozydy w DNA
Zasada |
Cukier |
Nukleozyd |
Adenina (A) |
Deoksyryboza |
Deoksyadenozyna |
Guanina (G) |
Deoksyryboza |
Deoksyguanozyna |
Cytozyna (C) |
Deoksyryboza |
Deoksycytydyna |
Tymina (T) |
Deoksyryboza |
Tymidyna |
Dla tymidyny nie trzeba pisać przedrostka „deoksy”, ponieważ tymina występuje tylko w DNA
Nukleozydy w RNA
Zasada |
Cukier |
Nukleozyd |
Adenina (A) |
Ryboza |
Adenozyna |
Guanina (G) |
Ryboza |
Guanozyna |
Cytozyna (C) |
Ryboza |
Cytydyna |
Uracyl (U) |
Ryboza |
Urydyna |
Konformacja nukleozydów (syn-adenozyna i anty-adenozyna) - w naturalnie występujących nukleozydach występują w większości w konfiguracji anty (beta) (wzory umieć) (zasada azotowa znajduje się po przeciwnej stronie wiązania N-glikozydowego)
Nukleotydy - fosforanowe estry nukleozydów, reszta fosforanowa przyłączona jest do grupy hydroksylowej przy C5 reszty cukrowej, powstają 5'-nukleotydy czyli nukleozydo-5'-fosforany, np.
Deoksyadenozyno-5'-monofosforan (dAMP)
Urydyno-5'-monofosforan (UMP)
A także trifosforan nukleozydu
STRUKTURA PIERWSZORZĘDOWA KWASÓW NUKLEINOWYCH
Nukleotydy w nici kwasu połączone są wiązaniem 3'-5' - fosfodiestrowym, 5'-fosforan pierwszego nukleotydu nie jest związany z żadnym innym nukleotydem, a ostatni nukleotyd w łańcuchu ma wolną grupę 3'-hydroksylową
Występuje polarność budowy, oba końce mają odmienne właściwości
W pH obojętnym każda grupa fosforanowa ma pojedynczy ładunek ujemny, dlatego łańcuchy polinukleotydowe nazywa się kwasami
Sekwencja DNA/RNA
Kolejność powtarzających się monomerów (niepowtarzalna i charakteryzująca dany kwas nukleinowy) - różniących się składem zasad,
Poszczególne zasady azotowe zapisywane są literowo (A, G, C, T lub U) od lewej do prawej (od końca 5' 3') np. 5'-AGCT-3' lub w skrócie AGCT,
Ze względu na polarność, TCGA i AGCT to różne związki
STRUKTURA DRUGORZĘDOWA KWASÓW NUKLEINOWYCH
DNA wyizolowano po raz pierwszy w 1869 roku (Mescher)
Model cząsteczki DNA wg Watson i Crick'a - 1953
Odległość między sąsiednimi zasadami - 0,34 nm
Skręt helisy powtarza się co 3,4 nm - na jeden skręt helisy przypada 10 zasad
Średnica helisy - 2 nm
Helisa stabilizowana jest wiązaniami van der Waalsa, oddziaływaniami hydrofobowymi, wiązaniami wodorowymi
DNA występuje przeważnie w postaci dwuniciowej helisy, tworząc drugorzędową strukturę:
Dwa oddzielne łańcuchy, które biegną w przeciwnych kierunkach (antyrównolegle) (5'3' i 3'5'), owinięte są wokół siebie tworząc prawoskrętną helisę
Ujemnie naładowane rdzenie cukrowo-fosforanowe cząsteczek DNA znajdują się na zewnątrz - pełnią funkcje strukturalne
Płaszczyzny zasad, prawie prostopadłe do osi helisy, leżą jedna nad drugą wewnątrz helisy, tworząc komplementarne pary zasad (pary typu Watson - Crick), połączonych wiązaniami wodorowymi (A z T - 2 wiązaniami, G z C - 3 wiązaniami) - pełnią funkcję nośnika informacji genetycznej
Sekwencja 1 nici określa sekwencje drugiej nici, co wykorzystywane jest w procesach replikacji i transkrypcji
Skład zasad wyznaczony doświadczalnie dla różnych organizmów
Gatunek |
A:T |
G:C |
A:G |
Człowiek |
1,00 |
1,00 |
1,56 |
Łosoś |
1,02 |
1,02 |
1,43 |
Pszenica |
1,00 |
0,97 |
1,22 |
Drożdże |
1,03 |
1,02 |
1,67 |
E.coli |
1,09 |
0,99 |
1,05 |
Serratia marcescens |
0,95 |
0,86 |
0,70 |
Stosunki A:T i G:C są bliskie 1,0 i te pary zasad muszą być ze sobą komplementarne, aby ich ilość była taka sama
Rodzaje podwójnej helisy DNA
- B DNA
- A DNA
- Z DNA
B-DNA - prawoskrętna helisa, przeważa w warunkach fizjologicznych, inne C,D,E,P - pełnią często ważne fizjologiczne role
TRZECIORZĘDOWA STRUKTURA DNA
Koliste cząsteczki DNA - powstają w rezultacie kowalencyjnego połączenia dwóch końców liniowej dwuniciowej helisy (w wyniku aktywności ligazy DNA)
Zrelaksowany DNA - nie wykazuje dodatkowych splotów
Superhelikalny DNA - podwójna helisa ulega spiralizacji
Superhelikalny DNA
Kształt bardziej zwarty, niż formy zrelaksowanej
Superhelizacja DNA jest koniecznym warunkiem jego upakowania wewnątrz komórki
Superhelikalny DNA jest mniej stabilny niż zrelaksowany DNA
Powszechnie występuje w przyrodzie ujemnie superhelikalny DNA
Ujemna superhelikalność przygotowuje DNA do procesów wymagających rozdzielenia nici: replikacji, rekombinacji i transkrypcji
Wielkość genomowego DNA niektórych organizmów
Organizm |
Ilość pz |
Długość (mikrometry) |
Konformacja |
Wirusy |
|
|
|
SV40 |
5100 |
1,7 |
Kolista |
Adenowirus |
36000 |
12 |
Liniowa |
Fag lambda |
48600 |
17 |
Kolista |
Bakterie |
|
|
|
E.coli |
4600000 |
1400 |
Kolista |
Eukariota |
|
|
|
Drożdże |
13500000 |
4600 |
Liniowa |
Muszka owocówka |
165000000 |
56000 |
Liniowa |
Człowiek |
3000000000 |
1-2 x 106 |
Liniowa |
Chromosomy eukariotyczne
Zawierają pojedynczą liniową cząsteczkę dwuniciowego DNA
W chromosomach eukariotycznych Dna jest silnie związany z białkami zasadowymi nazywanymi histonami (H1, H2A, H2B, H3, H4) - tworzą w ten sposób nukleosomy
Podwójna helisa paciorki na nitce solenoid rozciągnięta chromatyna ściśnięta chromatyna mitotyczny chromosom
FIZYCZNE I BIOLOGICZNE WŁAŚCIWOŚCI DNA
Topnienie - rozdzielenie helisy na dwa łańcuchy, zerwanie wiązań wodorowych między komplementarnymi zasadami, pomiędzy zasocjowanymi warstwowo parami zasad
Temperatura (temperatura topnienia - utrata połowy helikalnej struktury) - in vitro
Helikazy - energia z hydrolizy ATP - in vivo
Reasocjacja/renaturacja - splatanie nici (ang. annealing) - hybrydyzacja
Denaturacja
Temperatura
Środowisko kwaśne lub zasadowe - niszczenie wiązań wodorowych
Rozpuszczalniki chemiczne (formamid, mocznik) - niszczenie oddziaływań hydrofobowych
Wysokie stężenie H+ powoduje hydrolizę kwasów nukleinowych do zasad azotowych, cukru i fosforanu, umiarkowane środowisko kwaśne powoduje hydrolizę wiązania pomiędzy cukrem i zasadami - umożliwiając sekwencjonowanie kwasów nukleinowych
RNA - stanowi około 5-10% masy komórki (DNA - 1%)
Rodzaje RNA
Rybosomowy RNA - rRNA (E.coli 23S, 16S, 5S) - w połączeniu z białkami tworzy rybosomy, miejsca, w których odbywa się synteza białek - funkcje strukturalne i katalityczne
Informacyjny RNA - mRNA (ang messenger RNA) - przenosi informacje z pojedynczego genu (DNA) do rybosomów - matryca do syntezy białek - około 5% totalnego RNA
Transportujący RNA - tRNA - tworzy estry ze specyficznymi aminokwasami (każdy aminokwas min 1 tRNA), które są wykorzystywane do syntezy białek
Niskocząsteczkowy jądrowy RNA - snRNA (ang small nuclear RNA) - bierze udział w usuwaniu intronów i łączeniu egzonów RNA (splicing RNA), snRNA w cytozolu uczestniczy w kierowaniu białek do określonych przedziałów komórkowych
Struktura RNA (różnice pomiędzy strukturą RNA i DNA):
RNA zawiera rybozę, a nie 2'-deoksyrybozę. Dodatkowa grupa hydroksylowa w RNA sprawia, że jest on bardziej podatny na hydrolizę oraz umożliwia tworzenie się wiązań typu 2'5', a nie tylko typowych 3'5'
W skład RNA wchodzi uracyl zamiast tyminy
Większość cząsteczek RNA występuje w formie pojedynczych nici - wyjątek dwuniciowe RNA niektórych wirusów
Wiele z nich zawiera obszerne rejony o strukturze dwuniciowej helisy (struktura spinki do włosów)
Wewnętrzne pętle
tRNA - podstawowa jego funkcja polega na transporcie odpowiedniego aminokwasu (w formie aminoacylo-tRNA) do miejsca syntezy białka (translacji), na podstawie sekwencji mRNA, czyli kodonu
Struktura tRNA przypomina liść koniczyny
Ramię antykodonowe - zawiera antykodon, parujący się z kodonem w mRNA
Ramię D lub DHU - zawiera dihydrouracyl, specyficznie rozpoznawane przez syntetazę aminoacylo-tRNA - decyduje, który aminokwas będzie przyłączony
Ramię T - zawiera pseudourydynę, służy do mocowania aminoacylo-tRNA na rybosomie
Niektóre tRNA mają również ramię dodatkowe (zmienne), długość od 3-21 nukleotydów
rRNA - tworzy kompleksy z białkami, pełni funkcje strukturalne
W rybosomie mRNA łączy się z odpowiednim tRNA związanym z aminokwasem
Zaktywowane aminokwasy wiążą się w łańcuch polipeptydowy
Proces biosyntezy białka zachodzący na rybosomach, z wykorzystaniem informacji genetycznej zawartej w mRNA nazywa się translacją
KWASY NUKLEINOWE JAKO POŻYWIENIE
Dorosły człowiek pobiera z codziennym pożywieniem średnio 1g DNA oraz 1g RNA. Względnie wysokie ich stężenia są obecne w podrobach i tkance mięśniowej zwierząt. Żywność roślinnego pochodzenia zawiera niższe stężenia DNA
Kwasy nukleinowe, po ich spożyciu, ulegają rozpadowi w przewodzie pokarmowym. Już po przejściu przez dwunastnicę 95% kwasów nukleinowych jest hydrolizowanych. W jelicie cienkim proces rozpadu jest kontynuowany, z udziałem nukleaz trzustkowych. Proces dalszego rozpadu prowadzi do nukleozydów i kwasu fosforowego, z udziałem enzymów znajdujących się na powierzchni śluzówki jelit. Nukleozydy z kolei ulegają rozpadowi do cukrów oraz zasad purynowych i pirymidynowych. W takiej właśnie postaci mogą być przyswajane
Wykład 9 26 XI 08
Ekspresja genów, biosynteza białka, metody biotechnologiczne stosowane w gospodarce żywnościowej.
1. Replikacja DNA w komórkach eukariotycznych:
replikacja - powielanie/synteza DNA, na matrycy rozplecionych nici rodzicielski, w mechanizmie semikonserwatywnym:
w jednym cyklu ilość DNA ulega podwojeniu (konieczność przy każdym podziale komórki),
na zasadzie komplementarności - zapewnia wierności przekazywania informacji genetycznej
w nowych dwuniciowych cząsteczkach DNA jest jedna nowa i jedna stara nić
replikacja rozpoczyna się miejscu inicjacji
replikon - odcinek DNA replikowany pod kontrolą pojedynczego miejsca początku replikacji
substratami dla syntezy DNA są 5`fosforany deoksyrybonuklozydów - dATP, dTTP, dCTP, dGTP, w replikacji u eukariontów bierze udział 5 polimeraz DNA, jony Mg2+ oraz starter (primer) RNA z wolną grupą 3`-OH składającą się z 10-12 nukleotydów, niezbędna jest również matryca DNA i inne enzymy oraz białka.
widełki replikacyjne - miejsce, gdzie następuje rozdzielenie nici rodzicielskich i synteza nowego DNA w sposób nieciągły - replikacja jest możliwa jedynie w kierunku 5`-3`. Oznacza to, że na matrycy nici o orientacji 3`-5` potomny DNA syntetyzowany jest w sposób ciągły nowa nić nazywana jest nicią wiodącą, a na drugiej nici matrycowej o orientacji 5`-3` powstają nowe odcinki DNA (100-200 pz) zwane fragmentami Okazaki, które z udziałem ligazy DNA są łączone w jedną nić.
w procesie replikacji stwierdzono wiele aktywności enzymatycznych:
topoizomeraza - rozpłata podwójną helisę DNA, umożliwiając rozpoczęcie procesu
helikaza - rozrywa wiązania wodorowe między nićmi matrycowego DNA, rozdzielając je
prymaza - syntetyzuje starter - odcinek RNA
polimerazy DNA - syntetyzują DNA, wytwarzają wiązania fosfodiestrowe zgodnie z zasadą komplementarności
egzonukleaza - usuwa startery RNA z nici
ligaza DNA - uzupełnia brakujące wiązania fosfodiestrowe w szkielecie nowozsytezowanej nici DNA - łączy fragmenty Okazaki
2. Transkrypcja u eukariontów
synteza RNA na matrycy DNA, reakcja katalizowana jest u eukariontów przez 3 polimerazy RNA, wymagana jest matryca DNA, substraty: trifosforany rybonukleozydów - ATP, GTP, UTP, CTP, jony Mg2+ i inne enzymy oraz białka
rejon rozplecionego DNA, który ulega transkrypcji wraz z polimerazą RNA syntetyzowanym mRNA nazywany jest bąble transkrypcyjnym
Trzy etapy transkrypcji:
inicjacja - polimeraza RNA rozpoznaje na cząsteczce DNA miejsce promotorowe (kaseta TATA), DNA jest rozpłatana i na jednej z nici - antysensownej (-) rozpoczyna się synteza RNA o sekwencji identycznej do nici DNA nie stanowiącej matrycy - nić kodująca lub sensowna (+)
elongacja - polimeraza RNA syntetyzuje RNA w kierunku 5`-3` używając 5`-trifosforanów jako substraty. kolejne zasady dobudowywane są na podstawie komplementarności zasad, zamiast tyminy występuje uracyl!
terminacja - transkrypcja trwa do mementu, gdy kompleks transkrypcyjny napotka sygnał terminacji np.. palindromowi rejon bogaty w GC w efekcie RNA przybiera postać struktury spinki do włosów, innym sposobem terminacji jest białko rho, które rozpoznaje miejsca terminacji i kończy transkrypcję.
2. Dojrzewanie mRNA u eukariontów:
synteza blokady (kapu) na końcu 5`- przyłączenie 7-metyloguanozyny (m7G), kap zabezpiecza koniec 5` transkryptu przed atakiem rybonukleaz oraz pełni rolę przy biosyntezie białka - tylko mRNA ma kap - rRNA i tRNA kapu nie posiadają
poliadenylacja końca 3` - dołączenie nawet do 250 reszta A - powstaje ogon poly (A), sekwencja ta stabilizuje mRNA ułatwia tworzenie kompleksu z odpowiednimi białkami i utrudnia atak rybonukleazom
splicing - usunięcie sekwencji intronowych i połączenie eksonowych w funkcjonalną cząsteczkę mRNA, katalizowanie przez snRNA - możliwy alternatywny splicing
3. Cechy kodu genetycznego:
kod jest trójkowy, jeden aminokwas kodowany jest przez 3 nukleotydy (grupa 3 zasad kodujących 1 aminokwas nazywana jest kodonem lub trypletem)
kod genetyczny jest nienakładający się = niezachodzący, kodony nie mają elementów wspólnych
nie ma znaków przestankowych = bezprzecinkowy - pomiędzy trypletami nie ma przerw
kod jest zdegenerowany - niektóre aminokwasy są kodowane przez więcej niż 1 kodon np. treonina kodowana jest przez 4 trójki: ACU, ACC, ACA, ACG
kod jest jednoznaczny dana trójka koduje tylko 1 aminowkas
uniwersalność kodu genetycznego polega na tym, że występuje u wszystkich żywych organizmów prawie bez zmian
kod genetyczny - współzależność między sekwencją zasad w DNA (lub mRNA stanowiącym jego transkrypt) a sekwencją aminokwasów w białku
kodon start : AUG
kodony stop: UAA, UGA, UAG
4. Biosynteza białka u eukariotów
zachodząca na rybosomach synteza białka z odpowiednich aminoacylo-tRNA na podstawie sekwencji mRNA czytanej w kierunku 5`-3`, białko syntetyzowane jest od N-końca do C-końca
5. Aminoacylo - tRNA: aktywowane związki pośrednie w biosyntezie białka:
aminokwasy nie mają zdolności rozpoznawania kodonów
(dlatego) związane są ze specyficznymi tRNA
(to) tRNA rozpoznaje kodon
aminacylowanie tRNA zachodzi w dwóch etapach:
1 etap - reakcja aminokwasu z ATP, powstaje aminoacylo-AMP i PP (enzym: syntetaza aminoacylu-tRNA - 20 form - 20 AA
2 etap - reakcja aminoacylu-AMP i tRNA, powstaje aminoacylo-tRNA + AMP (enzym:syntetaza aminoacylu-tRNA, energia z hydrolizy pirofosforanu)
6. 3 - etapowa biosynteza białka - powstawanie wiązania peptydowego pomiędzy aminokwasami:
1 etap - inicjacja - powstaje kompleks mRNA - robosom, pierwszy kodon `start` - AUG (koduje metioninę - Met) wiąże pierwszy aminoacylo-tRNA do inicjacji potrzebne są również białka inicjujące syntezę białka (eIF)
2 etap - elongacja - czytanie kolejnych kodonów, wydłużanie łańcucha polipeptydowego poprzez wytworzenie wiązania peptydowego aminokwasów, dodawanie kolejnych aminokwasów do końca C, w tym etapie biosyntezy białka niezbędne są białka regulujące - czynniki elongacyjne (eEF)
3 etap - terminacja - zakończenie syntezy białka, po odczytaniu kodonu `stop`, peptyd usuwany jest z rybosomu, uczestniczą w tym białkowe czynniki uwalniające (eRF)
7. Obróbka potranslacyjna białka:
fałdowanie
transport do określonych organelli (sekwencje kierujące)
glikozylacja białek - zachodzi w aparacie Golgiego:
oligosacharydy mogą łączyć się przez grupę -OH seryny lub treoniny - wiązanie O-glikozydowe
oligosacharydy mogą łączyć się przez grupę -NH, glutaminy - wiązanie N-glikozydowe
fosforylacja, N-acetylacja, N-formylacja, N-metylacja (cytoplazma lub jądro komórkowe)
hyfroksylacja
ubikwitynacja - naznaczenie do trawienia - wadliwe białka lub o krótkim okresie życia
proteoliza - enzymy trawienne, kaskada krzepnięcia krwi
8. Kontrola ekspansji genów
Na poziomie transkrypcji - wiązanie się białek ze specyficznymi sekwencjami DNA, białkami uczestniczącymi w procesie transkrypcji np. z polimerazą RNA
Procariota:
teoria operonu laktozowego
białko CAP/CRP - 50x stymuluje transkrypcję - `przyciąga` polimerazę RNA do promotorów
Eucariota :
zmianą struktury chromatyny - `urywanie` miejsc wiązania polimerazy RNA - bądź miejsc paromotorowych - kaseta TATA
obecność sekwencji wzmacniających - miejsc wiązania białek regulatorowych - lepsze eksponowanie miejsc wiązania polimerazy RNA
modyfikacja zasad w DNA - metyzacja cytozyny - `wystająca` grupa metylowa zakłóca procesy stymulujące transkrypcję
kompleksowe oddziaływania białko-białko czynników transkrypcyjnych
hormonalnie poprzez jądrowe receptory hormonów np. ERE - estrogen response element
acetylacja histonów - redukcja powinowactwa do DNA - rozluźnienie chromatyny
operon laktozowy - zsynchronizowana zmiana ekspresji kilku powiązanych ze sobą produktów genów nazywana jest operonem np.: operon laktozowy: permeazy galaktozydowej, acetylotransferazy tioglaktozydowej beta-galaktozydazy
gen regulatorowy - koduje białko - represor
gen operatorowy - może się tu wiązać represor - blokując transkrypcję genów struktury
geny struktury - ?
9. elementy inżynierii molekularnej:
enzymy restrykcyjne
PCR i zastosowanie
klonowanie
korzyści z `zabawy` genami
10. enzymatyczny rozkład kwasów nukleinowych
enzymy nukleolityczne katalizując rozkład kwasów nukleinowych hydrolizują wiązania fosfodiestrowe, podział:
deksyrybonukleazy - hydrolizują DNA
rybonukleazy - hydrolizują RNA
nukleazy - nie wykazują specyficzności wobec rodzaju kwasu nukleinowego
11. Historia PCR:
polimerazową reakcję łańcuchową (PCR) wymyślił Kary Mullis w 1983 roku
wynalazca stał się biochemicznym `bożyszczem tłumów`. nagrodą dla Mullisa za to rewolucyjne odkrycie był czek opiewający na kwotę 10000$
korporacja Cetus, dla której od 1979 pracował Mullis, zainkasowała 300 milionów $ za sprzedanie patentu firmie Hoffman La Roche w 1992r
1993 r. Nobel
od 1993 r. Muliis porzuciła naukę i oddał się jak sam mówi swoim trzem pasjom: alkoholowi, pływaniu na desce surfingowej i pięknym kobietom
12. Cykl syntezy DNA w reakcji PCR
PCR - łańcuchowa reakcja polimerazy - umożliwia wielokrotne powielenie dowolnej sekwencji DNA, pod warunkiem, że znane są sekwencje krótkich odcinków DNA po każdej stronie sekwencji przeznaczonej do powielenia
etap 1 - denaturacja matrycy
etap 2 - przyłączenie starterów (hybrydyzacja)
etap 3 - wydłużanie starterów (elongacja)
13. Zastosowanie metody PCR:
badanie żywności w kierunku modyfikacji genetycznej GMO (kukurydza, soja, zboża, pomidory, ziemniaki, buraki cukrowe etc.)
badania mikrobiologiczne żywności (jakościowe i ilościowe) (staphylococcus ureus, salmonelle species, shigella species, listeria species)
badania naukowe (biologia molekularna, biotechnologia, badania ewolucyjne, antropologia, badania środowiskowe)
diagnostyka niepłodności męskiej o podłożu genetycznym (polegająca na braku plemników w nasieniu - mikrodelecja na chromosomie Y)
ustalania pokrewieństwa i ojcostwa
kryminalistyka
14. klonowanie DNA:
powielanie obcego DNA w komórce (bakterii, drożdży, owadów)
wymaga połączenia z wektorem (DNA wirusowym lub plazmidowym) zdolnym do autonomicznej replikacji
klonowanie pozwala uzyskać w dużych ilościach dowolny gen, który następnie można wprowadzić do nowych gatunków tworząc organizm transgeniczny (GMO)
15. Pozytywne aspekty GMO:
wytwarzanie żywności bezpiecznej dla zdrowia, wolnej od zanieczyszczeń chemicznych np. pozostałości pestycydów:
pomidory z tolerancją na herbicydy np. glufosfat (?) (Basta), i glifosat (Rundup)
pomidory z wyciszonym genem poligalakturanozy - owoce dłużej się przechowują, nie miękną, można uzyskać więcej koncentratu
wytwarzanie szczepionek dla potrzeb immunoprewencji rośliny z antygenami przeciwko HBV - wirusowe zapalenie wątroby typu B
genetyczne modyfikacje zwierząt np. mleko: obniżenie poziomu laktozy, wprowadzenie białek ludzkich, zmiany I rzędowej strukturze kazeiny - wprowadzenie dodatkowych miejsc cięcia dla proteolitów, dodatkowe miejsca fosforylacji, wprowadzenie białek przeciwbakteryjnych i obronnych
wytwarzania modyfikowanych roślin dla potrzeb ich uprawy w warunkach niekorzystnych klimatycznie (susza, powodzie, zasolenie, wysoka zawartość metali szkodliwych w glebie)
uzyskiwania na drodze modyfikacji genetycznej rzepaku Canova, z NNKT, których źródłem, w warunkach naturalnych, są przede wszystkim `owoce morza`, głównie ryby
Wykład 10 3 XII 08
Metabolizm węglowodanów. Fermentacje przemysłowe
Metabolizm węglowodanów
Synteza - glukozy, polisacharydów - odbywa się w drodze np. fotosyntezy lub z prekursorów nie będących węglowodanami - glukoneogeneza
Rozkład - węglowodany dostarczane są z pokarmem jako mono-(fruktoza, glukoza), di- (sacharoza, maltoza, laktoza) i polisacharydy (skrobia, glikogen, celuloza).
- Celuloza - składnik błonnika, nie może być trawiona przez ludzi.
Żaden z węglowodanów nie jest niezbędny
- Rozkład glikogenu obok glukoneogenezy - regulacja poziomu glukozy we krwi
Przemiany - reakcje odbywające się w komórkach w celu produkcji zmagazynowanej energii chemicznej lub substratów do syntez
Różne komórki, tkanki i organy (serce, wątroba, mózg), liczne enzymy/izoenzymy
Zmienne warunki: (np. wysiłek, głodowanie, stres)
Glikoliza, cykl pentozofosforanowy, metabolizm monosacharydów - fruktozy, galaktozy
Podstawowe źródło energii dla organizmu. Węglowodany łączą wiele procesów metabolicznych
Glukoza:
Tkanka tłuszczowa Magazynowanie energii
Glikogen
Rybozo-5-fosforan (szlak fosforanów pentoz)
Pirogronian/mleczan (glikoliza/fermentacja)
Transport glukozy z krwi do komórek odbywa się za pośrednictwem insuliny i odpowiednich przenośników
Wątroba jest centralnym miejscem w organizmie, gdzie zachodzą przemiany węglowodanów, pobiera glukozę bez pośrednictwa insuliny, magazynuje w postaci glikogenu i w razie potrzeby uwalnia
Glikoliza - ciąg reakcji zachodzących w cytoplazmie polegających na przekształceniu glukozy w kwas pirogronowy, dostarczający ATP (energii) i intermediatów - substratów w licznych szlakach biosyntetycznych. Ufosforylowanie metabolitów pośrednich zatrzymuje je w komórce (nie mogą przechodzić przez błonę komórkową) i zwiększa specyficzność substratową enzymów (3 ETAPY!!!)
Glukoza + 2Pi + 2ADP + 2NAD+ 2 pirogronian + 2ATP + 2NADH + 2H+ + 2H2O
Synteza 1,3-bisfosfoglicerynianu
Wytworzenie wysokoenergetycznego wiązania fosforanowego pochodzi z utleniania aldehydowej grupy aldehydu 3-fosfoglicerynowego dodatkowo zachodzi w tej reakcji redukcja NAD+
Reakcja katalizowana przez dehydrogenazę aldehydu 3-fosfoglicerynowego
Aldehyd 3-fosfoglicerynowy + NAD+ + Pi 1,3-bisfosfoglicerynian + NADH + H+
Synteza ATP = fosforylacje substratowe
Reakcja katalizowana przez kinazę fosfoglicerynianową
Reakcja katalizowana przez kinazę pirogronianową
Kontrola glikolizy
Heksokinaza - wysokie stężenie glukozo-6-fosforanu hamuje aktywność heksokinazy, pomimo tego, że jest to pierwsza reakcja glikolizy, nie jest ona kluczowa dla szybkości przebiegu procesu
Fosfofruktokinaza - PKF - główna reakcja kontrolna glikolizy - wysokie stężenie ATP jak również cytrynianu hamują aktywność PKF i proces glikolizy. Fruktozo-2,6-bisfosforan, a także wysokie stężenie AMP stymuluje aktywność PKF i całą glikolizę. Niższe pH również obniża aktywność PKF i hamuje proces glikolizy
Kinaza pirogronianowa aktywowana jest przez fruktozo-1,6-bisfosforan, ATP i alanina są inhibitorami allosterycznymi tego enzymu i powodują spowolnienie glikolizy
Glukagon hamuje proces glikolizy
Funkcje glikolizy
Glikoliza to główna droga katabolizmu glukozy do pirogronianu, zachodzi we wszystkich rodzajach organizmów żywych
Wytworzony podczas glikolizy pirogronian jest wyjściowym związkiem do biosyntezy wielu różnorodnych i ważnych substancji. Pirogronian integruje przemiany cukrów, aminokwasów, białek i tłuszczów
Metody pośrednie glikolizy wykorzystywane są do syntezy wielu składników organizmu
Glikoliza jest często jedynym źródłem energii dla wielu mikroorganizmów żyjących w warunkach beztlenowych
W mięśniach i tkance tłuszczowej - heksokinaza (wykorzystuje glukozę i fruktozę, produkt fruktozo-6-fosforan) glikoliza
W wątrobie duże stężenie glukozy, (glukoza częściej wykorzystywana jest jako substrat, Km glu 20x mniejsze niż Km fru dla heksokinazy) fruktoza wchodzi do szlaku fruktozo-1-fosforanowego
Fermentacje/synteza mleczanu - warunki beztlenowe
Synteza alaniny
Wejście do cyklu krebsa poprzez reakcję pomostową katalizowaną przez dehydrogenazę pirogronianową (warunki tlenowe)
Produkcja napojów fermentowanych, twarogów, śmietany, serów, masła (mleczarstwo)
Produkcja etanolu i piwa - ukwaszanie zacierów
Fermentacja ciasta na zakwasie - piekarnictwo
Produkcja kwasu mlekowego - przemysł spożywczy, tekstylny i skórzany
Produkcja kiszonek (kapusta, ogórki, pasze dla bydła)
Pirogronian CO2 + aldehyd octowy
Aldehyd octowy + NADH + H+ etanol + NAD+
Produkcja spirytusu, wina i piwa
Produkcja kefiru
Piekarnictwo - CO2 zapewnia ciastu odpowiednią porowatość
W warunkach naturalnych zachodzi na dnie bagien, w glebach w warunkach beztlenowych
Produkty uboczne: alkohol etylowy, kwas mlekowy, kwas octowy, metan
Wykorzystywana do produkcji kwasu masłowego - surowca do wyrobu olejów aromatycznych i rozpuszczalników
Częsta przyczyna wad i nieprawidłowości w przemyśle spożywczym - zakażenia bakteriami fermentacji masłowej kiszonek owocowych i warzywnych, przetworów mleczarskich (serów), półproduktów gorzelniczych, kiszonek paszowych dla bydła
W przemyśle - produkcja etanolu, wina, piwa, octu, acetonu, butanolu, kwasu cytrynowego, kwaszenie mleka i śmietany, produkcja napojów mlecznych, kiszenie ogórków, kapusty, sporządzanie kiszonek
Umożliwiają regenerację NAD+ i dzięki temu dalszy przebieg procesu glikolizy
Podczas glikolizy powstaje NADH z NAD+
Bez O2, NADH nie może być utleniony do NAD+
Wytwarzana jest energia, mniej jednak niż w procesach tlenowych
Synteza glukozy z prekursorów nie będących cukrami (mleczan, pirogronian, metabolity pośrednie cyklu kwasu cytrynowego, glicerol, szkielety węglowe aminokwasów)
Nie jest to proste odwrócenie procesu glikolizy - oba procesy nigdy nie przebiegają w tej samej komórce w tym samym czasie
Glukoneogeneza ma duże znaczenie w okresie łodu, albo intensywnego wysiłku - utrzymuje poziom glukozy na stałym poziomie we krwi - glukoza jest uniwersalnym „paliwem” dla wszystkich komórek
Proces zachodzący przede wszystkim w wątrobie, w nerkach oraz jelicie cienkim - alternatywa do rozkładu glikogenu, regulowana głównie przez insulinę i glukagon
Wysokie stężenie ATP, alaniny, cytrynianu i acetylo-CoA stymulują, a wysokie stężenie AMP, ADP, hamują proces glukoneogenezy
Niskie stężenie cząsteczki fruktozo-2,6-bisfosforanu przyspiesza proces glukoneogenezy,
Hormony: glukagon - stymuluje, a insulina hamuje proces glukoneogenezy
Pierwsza reakcja glukoneogenezy, katalizowana jest przez karboksylazę pirogronianową w mitochondrium
Reakcja powstawania PEP (fosfoenolopirogronianu), katalizowana przez karboksykinazę fosfoenolopirogronianową w cytoplazmie
W warunkach wysiłku pirogronian utleniany jest do mleczanu w mięśniach (dzięki dehydrogenazie mleczanowej - LDH)
Mleczan następnie wędruje do krwi, z nią do wątroby,
Tu przekształcany jest z udziałem LDH w pirogronian,
Z pirogronianu w procesie glukoneogenezy powstaje glukoza, która wraca do mięśni jako „paliwo”
Regulacja syntezy glikogenu
Syntaza glikogenowa jest enzymem allosterycznym, jak również regulowana jest przez modyfikacje kowalencyjne,
Aktywną formą jest syntaza glikogenowa a, jest to forma zdefosforylowana,
Forma zwykle nieaktywna syntaza glikogenowa b jest ufosforylowana,
Glukozo-6-fosforan jest allosterycznym aktywatorem syntazy glikogenowej b
Wtórny metabolizm glukozy:
Synteza NADPH; wymagany np. w syntezie kwasów tłuszczowych, cholesterolu, neurotransmiterów, nukleotydów, redukcja utlenionego glutationu i monooksygenazy cytochromu P-450 - detoksyfikacja
Synteza pentoz - pentozy są substratem i budulcem wielu biocząsteczek (kwasy nukleinowe, nukleotydy - ATP, koenzymy: NADH, koenzym A, FAD), witaminy
Lokalizacja - cytozol
Szlak bardzo aktywny w tkance tłuszczowej, gruczołach mlecznych i korze nadnerczy
Niska aktywność w mięśniach szkieletowych
Reakcja pierwsza cyklu, katalizowana przez dehydrogenazę glukozo-6-fosforanową.
Dekarboksylacja kwasu 6-fosfoglukonowego (C6C5 + C1), katalizowana przez dehydrogenazę 6-fosfoglukonianową
Reakcje katalizowane przez transketolazę i transaldolazę są odwracalne, końcowe produkty szlaku zależą od potrzeb komórki.
Produktem końcowym może być rybozo-5-fosforan lub glikolityczne intermediaty - fruktozo-6-fosforan lub aldehyd 3-fosfoglicerynowy
Alfa-amylaza (hydrolaza) hydrolizuje wiązania alfa-1,4-glikozydowe, produktem dekstryny i oligosacharydy
Beta-amylaza (hydrolaza) hydrolizuje wiązania alfa-1,4-glikozydowe, produktem jest beta-maltoza
Enzym usuwający rozgałęzienia (transferaza) przenosi fragment złożony z kilku reszt glukozy na koniec innego odgałęzienia umożliwiając atak fosforylazy
Fosforylaza glikogenowa (transferaza=PHS1) rozbija wiązania alfa-1,4-glikozydowe i przenosi kolejno reszty glukozy z nieredukującego końca cząsteczki glikogenu na drugi substrat - resztę ortofosforanu (Pi), powstaje w ten sposób glukozo-1-fosforan - produkt reakcji fosforolizy
Alfa-1,6-glukozydaza (hydrolaza) hydrolizuje wiązania alfa-1,6-glikozydowe, produktem jest glukoza
Regulacja aktywności fosforylazy glikogenowej
Fosforylaza glikogenowa występuje jako forma aktywna - fosforylaza a i zwykle „nieaktywna” fosforylaza b (aktywacja zachodzi po odwracalnej fosforylacji 1 reszty seryny w podjednostce enzymu)
„Nieaktywna” fosforylaza b jest enzymem allosterycznym, dla którego aktywatorem jest AMP, a inhibitorem ATP i glukozo-6-fosforan
Monosacharydy transportowane są następnie poprzez wątrobę do komórek w całym organizmie
Dalsze losy obejmują syntezę kwasów tłuszczowych, aminokwasów, glikogenu, bądź też w procesach katabolicznych ulegają utlenieniu z dostarczeniem energii
Utlenienie glukozy - glikoliza. Produtem końcowym utlenienia glukozy może być pirogronian (w warunkach tlenowych) lub mleczan (beztlenowe, też przy długotrwałym wysiłku)
Trawienie lipidów
Rozkład triacylogliceroli - lipazy
Beta-oksydacja kwasów tłuszczowych - nienasycone i nieparzystowęglowe kwasy tłuszczowe
Synteza kwasów tłuszczowych
Synteza cholesterolu
Występuje w ślinie
Wykazuje wyższe powinowactwo do średniołańcuchowych kwasów tłuszczowych w porównaniu do długołańcuchowych
Chętnie hydrolizuje wiązanie estrowe pomiędzy kwasami tłuszczowymi nienasyconymi a glicerolem
Nie hydrolizuje fosfolipidów i estrów cholesterolu
Działa w jamie ustnej i żołądku - optymalne pH 2,2 - 6,0
Wydzielanie podstawowe i stymulowane pokarmem
Powinowactwo do kwasów tłuszczowych w pozycji alfa
Optymalne pH 7,4 - 8,5
Aktywacja jonami Ca2+ i kwasami żółciowymi
2 izoenzymy różniące się ruchliwością elektroforetyczną: S (slow) i F (fast) zbudowany z formy S i kolipazy
Odbywa się na drodze dyfuzji - bez regulacji
Zależy od ich stężenia w osoczu i aktualnego zapotrzebowania, ilości białek wiążących FA w cytoplazmie komórki i poziomu glukozy we krwi
Utlenianie kwasów tłuszczowych zależy od ich stężenia we krwi w okresie międzytrawiennym - stanowią najbardziej wydajny i główny materiał energetyczny dla większości tkanek: komórek mięśni szkieletowych i sercowych, wątroby, nerek, skóry, ale nie dla mózgu (ciała ketonowe i glukoza)
Wykorzystywane są do syntezy de novo i resyntezy lipidów złożonych itp.
Krótkie łańcuchy łatwo przenikają membranę, dłuższe niż 10 atomów węgla zaktywowane łańcuchy kwasów tłuszczowych, przechodzą przez błonę mitochondrialną przy pomocy KARNITYNY i TRANSLOKAZY karnityna/acylokarnityna, wymagane są także reakcje katalizowane przez 2 izoformy acetylotransferazy karnitynowej I i II
Funkcja ciał ketonowych:
Odzyskanie wolnego CoA, umożliwia to zachodzenie beta-oksydacji sprzężonego z wytwarzaniem acetooctanu
Hydroksymetyloglutarylo-CoA (HMG-CoA) jest prekursorem w syntezie cholesterolu
Gromadzenie energii w tkankach innych niż wątroba (brak transferazy), niepotrzebny jest etap aktywacji kwasów tłuszczowych (oszczędność energii)
Wykorzystywane przed wolnymi kwasami tłuszczowymi i węglowodanami, np. przez mózg w warunkach głodu
Kolejne kondensacje jednostek C2 w postaci acetylo-CoA, w cyklu 4 reakcji (kondensacja, redukcja, odwodnienie, redukcja), prowadzące do powstania długich łańcuchów węglowodorowych. Nie jest to proste odwrócenie beta-oksydacji
Tylko jeden enzym: syntaza kwasów tłuszczowych, związkiem redukującym jest NADPH, proces zachodzi w cytozolu, związki pośrednie w procesie syntezy związane są przez białko ACP (ang Acyl Carrier Protein)
Substraty w reakcji syntezy kwasów tłuszczowych: acetylo-CoA, ATP i NADPH
Acetylo-CoA wymaga przeniesienia z mitochondrium, gdzie powstaje, do cytoplazmy. Acetylo-CoA nie może przeniknąć przez błonę mitochondrialną. Transport odbywa się przez kondensację Acetylo-CoA ze szczawiooctanem - powstaje cytrynian i w ten sposób przedostaje się przez podwójną membranę mitochondrium, cytrynian w cytoplazmie ulega rozszczepieniu z udziałem liazy cytrynianowej zależnej od ATP na szczawiooctan i acetylo-CoA
NADPH pochodzi z cyklu pentozofosforanowego oraz powstaje w reakcji katalizowanej przez enzym jabłczanowy dekarboksylujący zależny od NADP - z jabłczanu powstaje pirogronian i CO2
Rozpoczyna się, gdy węglowodany i energia (ATP) obecne są w dużych ilościach, a brakuje kwasów tłuszczowych
Kluczowym enzymem jest karboksylaza acetylo-CoA, która podlega fosforylacji - postać ufosforylowana jest nieaktywna, odpowiednia kinaza białkowa zależna jest od ATP i AMP. Jeżeli stosunek stężeń ATP/AMP ma dużą wartość, synteza kwasów tłuszczowych zachodzi, w przeciwnym razie jest wyłączona (patrz schemat kontroli aktywności karboksylazy)
Wysokie stężenie cytrynianu aktywuje syntezę kwasów tłuszczowych, natomiast wysokie stężenie palmitynianu hamuje ten proces
Glukagon i adrenalina hamują syntezę KT, z kolei insulina przyspiesza syntezę KT
Synteza pirofosforanu izopentenylu - wytworzenie jednostek pirofosforanu izpopentenylu (C5) zachodzi w cytozolu z acetylo-CoA i acetoacetylo-CoA, powstaje hydroksymetyloglutarylo-CoA (HMG-CoA)
Kondensacja 6 cząsteczek pirofosforanu izopentenylu w cząsteczkę skwalenu
Przekształcenia skwalenu w cholesterol
Znaczenie cholesterolu
Cholesterol i triacyloglicerole transportowane są we krwi w postaci lipoprotein o różnej gęstości:
Lipoproteiny o małej gęstości (LDL) zawierają około 1500 estryfikowanych cząsteczek cholesterolu najczęściej z linolanem, główna funkcja LDL to transport cholesterolu do tkanek obwodowych i regulacja syntezy de novo cholesterolu, w tych miejscach tzw „zły cholesterol”
Lipoproteiny o dużej gęstości (HDL) zbierają cholesterol z osocza obumarłych komórek i błon i transportują go do wątroby, gdzie ulega dalszym przemianom, tzw „dobry cholesterol”
Wysoki poziom cholesterolu we krwi może powodować powstawanie płytki arteriosklerotycznej w naczyniach, spowodowane jest to przez LDL. U zdrowych osób stosunek LDL/HDL wynosi 3,5
Obniżenie poziomu cholesterolu we krwi
2 strategie
Blokada syntezy cholesterolu de novo
Blokada reabsorbcji soli żółciowych w jelicie
Statyny (np. lowastatyna/mewinolina), czyli inhibitory współzawodniczące, które hamują biosyntezę cholesterolu, działają na enzym: reduktaza HMG-CoA
Dodatnio naładowane polimery (np. cholestyramina), które blokują wchłanianie żółci (reabsorpcję) poprzez ich związanie
Dietę bogatą w błonnik, działanie podobne jak cholestyraminy oraz uboga w tłuszcze zwierzęce - jedyne źródło cholesterolu
Część procesu oddychania tlenowego, zachodzi w mitochondriach (lub mezosomach - bakterie) i polega na całkowitym utlenieniu pirogronianu (powstałego w glikolizie) do CO2 i H2O oraz magazynowaniu energii w ATP
Procesy oddechowe dostarczają komórce energii do podtrzymywania wielu endoergicznych reakcji, umożliwiają również magazynowanie i przekształcanie energii
Dodatkowo w tych procesach powstaje wiele ważnych metabolitów pośrednich
Oddychanie tlenowe rozpoczyna się właściwie od rozłożenia substancji pokarmowych (polisacharydy, tłuszcze, białka) do prostych związków (heksozy, kwasy tłuszczowe, glicerol, aminokwasy), które następnie mogą ulec przekształceniu w pirogronian. Proces ten nazywamy trawieniem, u zwierząt i człowieka odbywa się on w przewodzie pokarmowym
Cykl Krebsa i łańcuch oddechowy „kończy” procesy kataboliczne, prowadzące do wytworzenia energii w postaci ATP, oraz CO2
Glikolizy, (w glikolizie glukoza pirogronian)
Przemian niektórych aminokwasów (deaminacje, transaminacje)
Odbywa się poprzez hamowanie produktem: NADH i acetylo-CoA w nadmiarze hamują aktywność tego enzymu
Innym sposobem regulacji aktywności dehydrogenazy pirogronianowej jest odwracalna fosforylacja/defosforylacja katalizowana przez odpowiednią kinazę i fosfatazę dehydrogenazy pirogronianowej. Ufosforylowana postać enzymu jest nieaktywna
Duże stężenie ATP, który jest substratem w reakcji katalizowanej przez kinazę powoduje zahamowanie reakcji dekarboksylacji oksydacyjnej i jednocześnie całego cyklu utleniania cząsteczek pokarmowych do acetylo-CoA
Wysokie stężenie pirogronianu wpływa stymulująco na szybkość całego procesu
Zachodzi w mitochondriach eukariontów (lub cytozolu prokariontów).
Następuje w nim utlenianie grup acetylowych acetylo-CoA do CO2, co uwalnia 4 pary elektronów zmagazynowanych w NADH i FADH2.
Energia chemiczna zmagazynowana w zredukowanych koenzymach uwolniona jest następnie w łańcuchu oddechowym.
W cyklu Krebsa powstaje energia w postaci GTP (lub ATP u roślin) i prekursory dla wielu szlaków biosyntetycznych
Pierwsza reakcja cyklu: syntaza cytrynianowa
Utlenianie izocytrynianu - uwolnienie CO2 - dehydrogenaza izocytrynianowa
Utlenianie bursztynianu (dehydrogenaza bursztynianowa)
Utlenianie jabłczanu (dehydrogenaza jabłczanowa)
Dehydrogenaza pirogronianowa - hamowana przez NADH i acetylo-CoA oraz na drodze modyfikacji kowalencyjnej - fosforylacji/defosforylacji
Syntaza cytrynianowa - hamowana przez cytrynian i ATP
Dehydrogenaza izocytrynianowa - hamowana przez NADH i ATP, aktywowana przez ADP
Dehydrogenaza alfa-ketoglutaranowa - hamowana przez NADH i bursztynylo-CoA
Synteza kwasów tłuszczowych z cytrynianu
Synteza aminokwasów z alfa-ketoglutaranu
Synteza nukleotydów purynowych i pirymidynowych z alfa-ketoglutaranu i szczawiooctanu
Glukoneogeneza z szczawiooctanu
Synteza pierścienia porfirynowego w grupach hemowych z bursztynylo-CoA
Jego pomiar przeprowadza się w stosunku do wodoru, wyrażany jest w woltach (V).
Zmiana potencjału redoks delta-E prowadzonej w pH 7,0 reakcji oksydoredukcyjnej o 1V równa jest zmianie energii swobodnej deltaGo o około 193 kJ/mol.
Potencjał układu zależy od równowagi stężeń molowych formy utlenionej i zredukowanej danego układu
E>0 oznacza, że substancja ma większe powinowactwo do elektronów niż wodór - będzie przyjmować elektrony od wodoru, np. O2 ma potencjał redoks dodatni
E<0 oznacza, że substancja ma mniejsze powinowactwo do elektronów, niż wodór - będzie oddawać elektrony do H+, np. NADH ma potencjał redoks ujemny
Dehydrogenaza NADH - reduktaza NADH-Q = kompleks 1 (około 30 polipeptydów, grupa prostetyczna: FMN FMNH2, niehemowe centra Fe-S = Fe3+Fe2+)
Koenzym Q: ubichinon - CoQ ubichinol - CoQH2
Kompleks cytochromów bc1 = reduktaza cytochromowa = kompleks III (cytochrom b i cytochrom c1 z grupą hemową Fe3+Fe2+
Cytochrom c (z grupą hemową Fe3+ Fe2+)
Oksydaza cytochromowa = kompleks IV (cytochrom a i cytochrom a3 z Cu2+ Cu+
Inhibitory transportu elektronów: rotenon, amytal (dehydrogenaza NADH), antymycyna A (cytochrom bc1), cyjanej, azydek, tlenek węgla (oksydaza cytochromowa)
Kontrola oddechowa - elektrony przepływają przez łańcuch tylko wtedy, gdy potrzebna jest synteza ATP, przy dużym stężeniu ATP transport elektronów nie działa, gromadzi się NADH i FADH2 oraz cytrynian, co hamuje cykl kwasu cytrynowego i glikolizę
Rozprzęgacze - (np. 2,4-dinitrofenol - DNP, termogenina = białko rozprzęgające, białko UCP) hamują syntezę ATP - likwidując gradient H+, nie przerywają transportu elektronów - powstająca energia w jego trakcie uwalniana jest w postaci ciepła - proces nazywa się „bezdrżeniową” termogenezą, przebiega w brunatnej tkance tłuszczowej szczególnie u noworodków i u zwierząt hibernacyjnych
Czółenko glicerolo-3-fosforanowe (elektrony przenoszone są przez membranę w postaci glicerolo-3-fosforanu), utlenianie NADH z cytoplazmy za pośrednictwem tego czółenka umożliwia syntezę 1,5 cząsteczki ATP (zamiast 2,5 cząsteczki)
Czółenko jabłczanowo - asparaginianowe - elektrony przenoszone są przez membranę w postaci jabłczanu, utlenienie NADH z cytoplazmy za pośrednictwem tego czółenka umożliwia syntezę 2,5 cząsteczki ATP (NADH NADH)
W reakcjach świetlnych (faza jasna) syntetyzowane są NADPH i ATP (tzw siła asymilacyjna) - umożliwia ona zajście kolejnych przemian oraz uwalniany jest O2. Reakcje świetlne przebiegają w tylakoidach chloroplastów lub chromatoforach - u bakterii
W reakcjach niezależnych od światła (faza ciemna = cykl Calvina) NADPH i ATP zużywane są w trakcie syntezy węglowodanów z CO2 i H2O (następuje asymilacja CO2). Przebiegają one w stromie chloroplastów
Kompleksu antenowego (kilka tysięcy cząsteczek chlorofilu a i b oraz barwników pomocniczych: karotenoidów lub fikobylin). Kompleks antenowy pochłania (absorbuje) światło słoneczne
Centrum reakcji fotosyntetycznej - 2 cząsteczki chlorofilu, z których przekazywane są elektrony na przenośniki elektronów
Fotosystem I (PSI) - odpowiada za syntezę NADPH oraz uczestniczy w fosforylacji cyklicznej
Fotosystem II (PSII) - odpowiada za fotolizę H2O i uwalnianie O2
Światło jest pochłaniane przez kompleks antenowy PSII i energia kierowana jest do centrum reakcji fotosyntetycznej. Wzbudzony P680 (P680*) emituje elektron o wysokiej energii, który przechodzi do plastochinonu (PQ). PQ odbiera 2 elektrony i 2 jony H+, powstaje PQH2. P680 pozostaje jako kation P680+. P680+ pobiera elektron z H2O, uwalnia O2 i powraca do stanu niewzbudzonego
Elektrony z PQH2 przenoszone są przez kompleks cytochromówbf do plastocyjaniny (PC)
Światło jest pochłaniane przez kompleks antenowy PSI i energia kierowana jest do centrum reakcji fotosyntetycznej. Wzbudzony P700 (P700*) emituje elektron o wysokiej energii, który przechodzi do ferredoksyny. P700 pozostaje jako kation P700+. P700+ przyjmuje elektron z PC i powraca do stanu niewzbudzonego
2 elektrony z 2 cząsteczek zredukowanej ferredoksyny transportowane są na NADP+, reakcje katalizuje reduktaza NADP
Światło jest pochłaniane przez kompleks antenowy PSI i energia kierowana jest do centrum reakcji fotosyntetycznej. Wzbudzony P700 (P700*) emituje elektron o wysokiej energii, który przechodzi do ferredoksyny. P700 pozostaje jako kation P700+. P700+ przyjmuje elektron z PC i powraca do stanu niewzbudzonego
Elektrony z cząsteczek zredukowanej ferredoksyny transportowane są na cytochromybf zamiast na NADP+ (występuje jego niedobór). Następnie elektrony przepływają do plastocyjaniny i z powrotem do kationu P700+
Reakcje wiązania węgla = cykl Calvina - wykorzystywane są tu NADPH i ATP, które powstają w fazie jasnej fotosyntezy, a końcowym produktem jest sacharoza i skrobia
Cykl Calvina obejmuje:
Karboksylacje - przyłączenie CO2 do akceptora, reakcja katalizowana jest przez rubisco = oksygenazę/karboksylazę rybulozo-1,5-bisfosforanu
2-etapowe redukcje - 3C kwasu organicznego do aldehydu (potrzebna jest energia i wodór z koenzymu)
Regeneracje - odtworzenie akceptora CO2
Fotooddychanie - efekt przyłączenia O2 do rybulozo-1,5-bisfosforanu zamiast CO2, ¾ jednostek węglowych jest zachowane, ¼ w postaci CO2 wraca do atmosfery. Wydzielany jest też jon amonowy, nie powstaje ATP i NADPH. Fotooddychanie może powodować do 30% strat w plonach
Fotoinhibicja - hamuje wytwarzanie cukrów poprzez niedobór CO2, ATP i NADPH są produkowane w reakcjach świetlnych, ale za mało jest CO2 do ich pełnego wykorzystania. Występuje w trakcie silnego naświetlenia, suszy oraz w warunkach wysokogórskich
Rośliny gruboszowate - metabolizm CAM - ewolucyjna adaptacja roślin do warunków ubogich w wodę. CO2 pobierany jest tylko nocą i magazynowany jest w wakuolach w postaci jabłczanu. W ciągu dnia przy zamkniętych szparkach następuje dekarboksylacja jabłczanu i asymilacja CO2 w cyklu Calvina
Nie zależy od światła
Może przebiegać całą dobę
Ogranicza ją jedynie dostępność substratów, a wydajność energetyczna przemian nie jest wysoka
Duże znaczenie w cyklach biogeochemicznych: azotu, siarki, węgla, natomiast w mniejszym stopniu przyczynia się do produkcji biomasy
reduktazę azotanową
reduktazę azotynową
Katalizowanych przez syntetazę glutaminową (GS) - ligazę, produktem jest glutamina, koenzymem jest ATP
Katalizowanych przez dehydrogenazę glutaminianową (GDH) - oksydoreduktazę, produktem jest glutaminian, koenzymem może być NADH (kierunek rozkładu glutaminianu) lub NADPH (kierunek syntezy glutaminianu)
Najpierw NH4+ asymilowany jest przez syntetazę glutaminy (GS), wymagana hydroliza ATP
Później następuje redukcyjna aminacja 2-oksoglutaranu gdzie glutamina wykorzystywana jest jako dawca azotu w reakcji katalizowanej przez syntetazę glutaminianową (GOGAT)
glutaminian + pirogronian alanina + 2-oksoglutaran
dehydrogenaza fosfoglicerynowa, aminotransferaza, fosfataza fosfoserynowa
3-fosfoglicerynian -> 3-fosfopirogronian -> 3-fosfoseryna ->seryna
syntetaza asparaginowa (zależna od glutaminy) - rośliny, zwierzęta
asparaginian + glutamina +ATP asparagina + glutaminian + AMP+ PPi
syntetaza asparaginowa:
asparaginian + NH4+ + ATP asparagina + ADP + Pi + H+
reakcja typowa dla mikroorganizmów
asparagina powstaje w dużych ilościach w komórkach wielu roślin, zwłaszcza motylkowych, gromadzony jest w ten sposób zredukowany azot w związkach organicznych
enzym aminotransferaza asparaginianowa (AST)
glutaminian + szczawiooctan asparaginian + 2-oksoglutaran
kwas asparaginowy syntetyzowany jest głównie w drodze transaminacji
enzym asparaginaza
asparagina asparaginian
Białka w procesie trawienia rozkładane są do aminokwasów, których nadmiar nie może być magazynowany w organizmie, mogą być natomiast utleniane w procesie utleniania biologicznego
Aminokwasy te służą do biosyntezy nowych białek
Są źródłem N dla innych biocząsteczek
Proces rozkładu białek jest ściśle regulowany w komórkach - białka przeznaczone do degradacji znaczone są ubikwityną i hydrolizowane przez proteasomy
Z aminokwasów następnie usuwany jest azot
Nadmiar azotu u ludzi wydalany jest w postaci mocznika
Szkielety węglowe aminokwasów białkowych przekształcane są do 7 różnych metabolitów pośrednich, z których mogą być syntetyzowane kwasy tłuszczowe, ciała ketonowe, glukoza i inne biocząsteczki
Masa cząsteczkowa ubikwityny wynosi 8,5 kDa - pełni funkcje znacznika = „czarnej plamy” = sygnału śmierci, występuje u eukariota, jej sekwencja jest silnie zakonserwowana
Ubikwityna łączy się poprzez grupę COOH reszty Gly na C-końcu z ε-aminową resztą Lys wchodzącą w skład rozkładanego białka wiązaniem izopeptydowym kosztem hydrolizy ATP
Obserwuje się różne tempo degradacji białek w komórce - półtrwanie białek może wynosić powyżej 20 godzin i kilka minut. Znaczenie ubikwityną obejmuje także białka nowe z defektem powstałym w procesie translacji
uczestniczą 3 enzymy:
Aktywujący ubikwitynę (E1)
Enzym koniugujący (E2)
Ligaza ubikwitynowo-białkowa (E3) - rozpoznaje N-końcowy aminokwas znaczonego białka
zaznaczone ubikwityną białka są trawione do krótkich peptydów zależnie od ATP w dużych kompleksach (ok. 2000 kD) białkowych nazywanych 26S proteasomami
sama ubikwityna nigdy nie ulega trawieniu
trawienie proteasomami odbywa się w jądrze komórkowym i cytoplazmie i odbywa się na 20S proteasomie, Cap 19S (może przyłączyć się z 2 stron do 20S proteasomu) decyduje które białka ulegają trawieniu
w taki sposób regulowane są m.in.:
białka ulegają rozkładowi pod wpływem peptydaz - endopeptydaz (np. trypsyna, chymotrypsyna, pepsyna, podpuszczka, elastaza, papaina) i egzopeptydaz (karoksypeptydazy, aminopeptydazy) do peptydów i aminokwasów
enzymy proteolityczne w układzie pokarmowym ulegają aktywacji proteolitycznej oraz wykazują specyficzność hydrolizy wobec aminokwasów występujących w łańcuchu polipeptydowym
chymotrypsyna - hydrolizuje wiązania wytworzone przez grupy karboksylowe aminokwasów aromatycznych
trypsyna - grupy karboksylowe L-argininy i L-lizyny,
pepsyna - aminokwasy aromatyczne lub dikarboksylowe - kwas asparaginowy i kwas glutaminowy
poza porteazami trawiennymi wyróżniamy proteazy wewnątrzkomórkowe = katepsyny, które zapewniają dynamiczną równowagę między poziomem białek (aktywnością enzymów) i produktami ich hydrolizy w komórkach
występują u roślin i zwierząt w lizosomach wątroby, nerek i śledziony
katepsyna I i II - endopeptydazy, przypominają w działaniu pepsynę i trypsynę
katepsyna III - aminopeptydaza
katepsyna IV - karboksypeptydaza
Jony CN-, grupy -SH np. cysteiny, glutationu, H2S i zredukowana witamina C aktywują katepsyny, optymalne pH wynosi 4-5
Katepsyny uczestniczą po uboju w procesie dojrzewania mięsa - powodują częściową hydrolizę białek włókna mięśniowego, rozerwanie wiązań disiarczkowych. W efekcie działania katepsyn rośnie strawność białek, stężenie białek rozpuszczalnych oraz oligopeptydów i aminokwasów w dojrzewającym mięsie
W przemyśle mięsnym stosowane są preparaty enzymów proteolitycznych do tenderyzacji (kruszenia i zmiękczania) mięsa - papaina, bromelanina, ficyna
W przemyśle mleczarskim stosowana jest podpuszczka (chymozyna) do ścinania mleka, bez zmiany odczynu, w trakcie dojrzewania serów produkty proteolizy nadają im odpowiedni aromat i smak
serynowe - alkaliczne w centrum aktywnym grupa -OH seryny, histydyna jest donorem protonu - trypsyna, chymotrypsyna
tiolowe - w centrum aktywnym grupa -SH oraz pierścień imidazolowy histydyny, np. papaina, bromelanina, ficyna, różne optimum pH
metalopeptydazy - aktywność zależy od obecności jonów metali: Zn2+, Ca2+, Mn2+ w centrum aktywnym - karboksypeptydazy A i B
karboksylowe - kwaśne, aktywność zależy od obecności w centrum aktywnym niezdysocjowanej grupy karboksylowej - pepsyna, bakteryjna subtylizyna
pirogronian, α-ketoglutaran, bursztynylo-CoA, fumaran, szczawiooctan - aminokwasy glukogenne (może z nich powstać w procesie glukoneogenezy glukoza - większość),
acetylo-CoA, acetoacetylo-CoA - aminokwasy ketogenne (mogą powstawać z nich ciała ketonowe, produkty rozpadu będącego w nadmiarze acetylo-CoA)
oksydacyjna deaminacja glutaminianu - glutaminian powstający w reakcjach transaminacji ulega oksydacyjnej deaminacji, w wyniku tej reakcji powstaje amoniak, reakcja katalizowana jest przez dehydrogenazę glutaminianową GDH, a koenzymem jest NAD+ - reakcja jest w pełni odwracalna,
GDH podlega regulacji allosterycznej. Wysokie stężenie ADP i GDP przyspiesza utlenianie aminokwasów i wytwarzanie szkieletów węglowych, które zużywane są jako paliwo metaboliczne w cyklu Krebsa, powodując wytwarzanie ATP i GTP - które z kolei allosterycznie hamują aktywność GDH
Oksydacja innych aminokwasów przez oksydazy L-aminokwasów, koenzymem jest FMN lub FAD, w tych reakcjach substratem mogą być dowolne L-aminokwasy
u zwierząt i człowieka przyswojony azot z pokarmem używany jest do biosyntezy aminokwasów i białek, nukleotydów i kwasów nukleinowych, hormonów i innych związków zawierających w swym składzie N
nadmiar pobranego azotu gromadzi się jako toksyczny NH3 lub NH4+
u ssaków azot usuwany jest ze złuszczającym się naskórkiem, z kałem, a przede wszystkim z moczem. Organizmy wodne wydalają amoniak bezpośrednio do wody (najprostszy i energetycznie najkorzystniejszy sposób), ptaki i gady z kolei w postaci kwasu moczowego (proces bardziej energochłonny i bardziej skomplikowany niż synteza mocznika, kwas moczowy nie jest rozpuszczalny w wodzie)
dehydrogenazę glutaminową (reakcja odwracalna)
glutaminazę (reakcja jednokierunkowa)
dehydratazy (reakcja jednokierunkowa) np. dehydrataza serynowa
oksydazy (reakcja jednokierunkowa) np. oksydaza glicynowa
mocznik jest stosunkowo mało toksyczny i dobrze rozpuszczalny w wodzie
jego synteza powoduje zakwaszenie płynów ustrojowych, a nie ich alkalizację
wydalanie azotu w postaci amoniaku wymagałoby tworzenie dużych ilości moczu - kilkaset litrów dziennie, co powodowałoby nadmierne odwodnienie organizmu
aktywacja i kondensacja amoniaku z CO2 - reakcja katalizowana przez syntetazę karbamoilofosforanową (zachodzi w mitochondrium)
CO2 + 2ATP + H2O + NH4+ karbamoilofosforan + 2ADP + Pi
Przeniesienie grupy karbamoilowej z karbamoilofosforanu na ornitynę - powstaje cytrulina, reakcja katalizowana przez karbamoilotransferazę ornitynową (zachodzi w mitochondrium):
ornityna + karbamoilofosforan cytrulina + Pi
synteza argininobursztynianu - reakcja katalizowana przez syntetazę argininobursztynianową (zachodzi w cytoplazmie)
cytrulina + asparagininan + ATP argininobursztynian + AMP + PPi
rozpad arininobursztynianu - reakcja katalizowana przez liazę argininobursztynianową (zachodzi w cytoplazmie)
argininobursztynian fumaran + arginina
powstawanie mocznika i ornityny - reakcja katalizowana przez arginazę (zachodzi w cytoplazmie)
arginina + H2O mocznik + ornityna
przekształcenie w asparaginian w reakcji transaminacji
przekształcenie w glukozę w glukoneogenezie
kondensacja z acetylo-CoA do cytrynianu
dekarboksylacja do pirogronianu
Leki - lekomania, narkomania, doping/dopalacze
Zatrucia w miejscu pracy
Skażenie środowiska - powietrze, woda, gleba
Skażenie żywności
Naturalne toksyny
Środki dodawane do żywności
Toksyny produkowane przez drobnoustroje
Rolnictwo
Pestycydy, insektycydy, fungicydy
Leki i dodatki chemiczne do pasz dla zwierząt
Gospodarstwo domowe
Czynniki fizyczne - promieniowanie
Dawka progowa - poniżej nie ma reakcji organizmu na daną toksynę
LD50 - dawka powodująca śmierć 50% populacji
Toksyczność - LD50 dla porównań różnych związków chemicznych
Przenikanie przez skórę - dyfuzja, wnikanie przez kanaliki potowe, wzdłuż torebek włosowych
Poprzez układ oddechowy
Z pożywieniem
Aplikacja celowa - bioterroryzm, kryminalistyka, samobójstwa
Substancje polarne wnikają za pośrednictwem białek
Niepolarne - przez obszary lipidowe
Substancje dobrzez rozpuszczalne w tłuszczach łatwo przedostają się przez skórę do organizmu
Zmienne pH (sok żołądkowy ok.1, jelito cienkie ok. 6-7, płyny komórkowe ok. 7,5) ma wpływ na uprotonowanie grup kwasowo - zasadowych i ewentualne ich przenikanie przez błony
Trucizna może być wydalona po zdeaktywowaniu z organizmu
Trucizna może oddziaływać z biocząsteczkami, powodując ich nieodwracalną inaktywację, np. denaturacja/inaktywacja enzymów - zniesienie działania toksyny polega na syntezie nowej cząsteczki
Skutki odległe:
Kancerogenne (rakotwórcze) - powstawanie nowotworów złośliwych
Mutagenne - zmiany materiału genetycznego
Teratogenne i embriotoksyczne - szkodzą rozwijającemu się płodowi w pierwszych miesiącach ciąży
Cynniki alkilujące związki, które łatwo wprowadzają grupy alkilowe, np. metylowe, do różnych pozycji kwasów nukleinowych
metylosulfonian metylu (MMS),
etylonitrozomocznik (ENU),
IFO - insektycydy fosforoorganiczne, np. melation, dichlorfos - skutecznie działają, mają krótki okres karencji i nie akumulują się w organizmach żywych - zastąpiły preparaty o budowie chlorowcopochodnej, np. DDT
Deaminacja cytozyny
Promieniowanie jonizujące X i γ - powoduje pękanie nici, rozpad zasad i cukrów
Promieniowanie UV - powoduje tworzenie dimerów pirymidynowych z sąsiadujących ze sobą zasad pirymidynowych
Reaktywne związki tlenu: ponadtlenki, nadtlenki wodoru, rodnik hydroksylowy (*OH), powodują utlenienie zasad i zmianę ich właściwości
Analogi zasad - pochodne normalnych zasad, wykazują zmienione właściwości przy tworzeniu par
Duże związki addycyjne - wiążą się kowalencyjnie z zasadami, powodując lokalną denaturację DNA, np. pochjodna benzo[a]pirenu - diol epoksydowy, aflatoksyna B1
Wierność replikacji zapewniana jest przez egzonukleazę sprawdzającą 3' 5' związaną z polimerazą DNA, usuwa ona błędnie wstawione nukleotydy
Alkilotransferaza usuwa grupy alkilowe, przyłączone do zasad - przenoszona grupa alkilowa inaktywuje enzym, przez to 1 enzym katalizuje tylko 1 reakcję naprawy
Glikozydaza DNA usuwa alkilowane zasady, poprzez ich wycięcie
Hydroliza insektycydów (demeton, imidan)
Dealkilacja herbicydów
Chlorowcopochodne - np. chloroform do fosgenu
Grupy nitrowe do alkoholowych
Np. nitrobenzen do fenolu
Wolnych rodników
Substancji silnie elektrofilowych
Naprężonych pierścieni trójczłonowych
Zmiany w strukturze DNA - mutacje i zakłóca procesy replikacji i transkrypcji
Zmiany w strukturze RNA - synteza niepożądanych białek, zmiana aktywności enzymatycznych
Nadtlenek wodoru: H2O2 p-owstaje w reakcjach katalizowanych przez oksydazy (głównie ksantynowa, glukozowa, NADPH)
Jon ponadtlenkowy: O2- - generowany w reakcjach katalizowanych przez oksydazy (głównie reduktaza cytochromu P-450, oksydaza ksantyny, oksydaza NADPH) oraz nieenzymatycznego utleniania Fe2+ tlenem cząsteczkowym
Rodnik hydroksylowy: HO* - powstaje w reakcjach utleniania nadtlenkiem wodoru żelaza (reakcja Fentona) i jonu ponadtlenkowego (reakcja Habera - Weissa)
Obniżenie płynności błon komórkowych (peroksydacja lipidów)
Utrata lub/i zmiana właściwości katalitycznych białek enzymatycznych i destabilizacja białek strukturalnych (utlenienie białek)
Rozregulowanie lub/i unieczynnienie systemu genetycznego (utlenienie puryn i pirymidyn kwasów nukleinowych, rozerwanie wiązań wodorowych wiążących nici)
Dysmutaza ponadtlenkowa (SOD)
Katalaza 2H2O2 2H2O + O2
Enzymy związane z utlenianiem i redukcją glutationu (Gln-Cys-Gly):
Witamina E (α-tokoferol) - przekształca rodniki nadtlenkowe i hydroksylowe oraz nadtlenki lipidów do mniej reaktywnych związków; utleniona forma α-tokoferolu kondensuje z kwasem glukuronowym i wydalana jest z żółcią
Witamina C (kwas askorbinowy) - reaguje z nadtlenkami i rodnikiem hydroksylowym tworząc rodnik kwasu dehydroaskorbinowego, który po reakcji z GSH przekształca się w anion dehydroaskorbinianowy; witamina C redukuje także Fe3+ do Fe2+
Β-karoten - reaguje z rodnikami nadtlenkowymi
Ceruloplazmina - wiąże jony miedzi
Albuminy - wiążą miedź i żelazo
Glutation - akceptor elektronów - tripeptyd występujący w większości tkanej (najwięcej w wątrobie), który „wyłapuje” ksenobiotyki - RX
Siedem typów (A-G)
Dwie podjednostki: ciężka (100 kDa) i lekka (50 kDa)
Podjednostka lekka = enzym proteolityczny
Objawy kliniczne zatrucia: upośledzenie wydzielania śliny, porażenie perystaltyki jelit, zaburzenia mowy i połykania, porażenia mięśni oddechowych (zgon w wyniku uduszenia)
Rozwija się tylko w warunkach beztlenowych
Występuje np. w glebie
Formy przetrwalnikowe obecne np. w miodzie (1 słoik miodu zawiera kilka przetrwalników)
Podczas jednego zabiegu pacjent otrzymuje ponad trzydziestokrotnie mniejsze stężenie niż dawka, która mogłaby zaszkodzić człowiekowi
Botulina może być użyta przez terrorystów - LD50 = 1ng/kg - na powietrzu szybko ulega degradacji
Ilości enzymów
Tempo syntezy i degradacji - ubikwitynozależnej - zmiana szybkości transkrypcji kodujących genów - np. operon laktozowy
Ich katalitycznej aktywności
Odwracalna kontrola allosteryczna (np. ATCaza = transkarbamoilaza asparaginianowa)
Wieloenzymowe układy (brak reakcji ubocznych, mała odległość między enzymem i substratem - duża szybkość reakcji - prawie V??? dobra koordynacja przemiany), np. łańcuch oddechowy, syntetaza kwasów tłuszczowych, dehydrogenaza pirogronianowa
Regulacja poprzez zmianę stężenia substratu
Hamowanie na zasadzie sprzężenia zwrotnego
Odwracalna modyfikacja kowalencyjna (fosforylacja) (np. fosforylaza glikogenowa)
Wtórne cząsteczki sygnalizacyjne
Hormonalna koordynacja metabolizmu
Heterotrimeryczne białka G
Małe GTPazy
Cykliczne nukleotydy (cAMP, cGMP)
Jony wapnia (Ca2+)
Reaktywne formy tlenu (ROS)
Pochodne fosfoinozytoli: trifosforan inozytolu (IP3)
Diacyloglicerol (DAG)
Różne kinazy i fosfatazy białkowe
Ca2+ wiąże się z kalmoduliną oraz innymi białkami - zmiany konformacji
Kompleksy Ca2+ z ufosforylowanymi i glikozylowanymi substratami są często nierozpuszczalne
Białka G aktywują cyklazę adenylanową - uruchamiają syntezę cAMP
Pełna nazwa białek G to „białka wiążące GTP” (GTP - binding protein), ponieważ w stanie aktywnym wiążą GTP (trifosforan guanozyny)
Występują dwa rodzaje białek G:
Heterotrimeryczne białka G (w skład wchodzą trzy podjednostki: α,β i γ)
Monomeryczne białka G (small G proteins)
Receptory sprzężoine z białkiem G są sprzężone z heterotrimerycznym białkiem G
Tylny płat przysadki (synteza w podwzgórzu): oksytocyna, wazopresyna (adiuretyna)
Przedni płat przysadki: gł. hormony tropowe
Szyszynka: melatonina
Tarczyca: tyroksyna (T4), trijodotyronina (T3), kalcytonina
Przytarczyce: parathormon
Grasica: tymulina, tymozyna i tymostymulina
Kora nadnerczy: mineralokortykosteroidy, glikokortykoidy, androgeny
Rdzeń nadnerczy: adrenalina, noradrenalina
Trzustka: insulina, glukagon, somatostatyna
Jądra: testosteron
Jajniki: estrogeny, progesteron
Śluzówka żołądka, dwunastnica i jelito cienkie oraz czcze: sekretyna, cholecystokinina (pankreozymina), gastryna, enterogastron
Zakończenia nerwów: noradrenalina, acetylocholina
Płytki krwi: serotonina
Komórki tuczne (mastocyty): histamina
Różne tkanki: somatostatyna, bradykinina
Uwalniane z fosfolipidów: prostaglandyny - pochodne kwasu arachidowego
Żaden z poznanych hormonów nie jest enzymem ani koenzymem czy grupą prostetyczną
Hormony regulują kierunki i tempo procesów już zachodzących
Substancje dokrewne wpływają na tempo syntezy enzymów i innych białek w komórkach docelowych, np. hormony steroidowe
Modyfikują aktywność już istniejących enzymów, zmieniają selektywnie przepuszczalność błon komórek docelowych, np. aldosteron
Hormony peptydowe i pochodne aminokwasów nie wnikają do wnętrza komórki. Łączą się one z receptorami błonowymi komórki. Te ostatnie aktywują cyklazę adenylanową, która przekształca ATP w cAMP
Transport hormonów odbywa się we krwi. Substancje te są transportowane w postaci związanej z białkami osocza
Resorpcja wody w nerkach
Inaktywacja - wątroba i nerki
Pobudzanie wydzielania:
Wzrost ciśnienia osmotycznego osocza
Zmniejszenie objętości krwi
Stres, nikotyna
Zahamowanie wydzielania:
Wzrost objętości krwi
Spadek ciśnienia tętniczego
Alkohol, kofeina
Skurcz komórek mioepitellalnych gruczołów mlecznych (laktacja)
Skurcz macicy (poród, stosunek płciowy)
Pobudzanie wydzielania
Drażnienie receptorów sutka, szyjki macicy, pochwy
Estrogeny
Zahamowanie wydzielania
Progesteron
Polipeptyd o masie cząsteczkowej u człowieka 5734 Da. Cząsteczka insuliny jest zbudowana z dwóch łańcuchów, A i B, połączonych ze sobą dwoma mostkami siarczkowymi. Trzeci mostek disiarczkowy, łączy aminokwasy łańcucha A. Łańcuch A liczy 21 reszt aminokwasowych, a łańcuch B 30 reszt aminokwasowych. Cząsteczka insuliny może polimeryzować, stąd jej masę cząsteczkową określa się na 5734 - 48000 Da.
W łańcuchu A aminokwasem N-końcowym jest glicyna, aminokwasem C-końcowym asparagina; w łańcuchu B analogicznie fenyloalanina oraz treonina. Sekwencja aminokwasów została po raz pierwszy ustalona przez Sangera w 1955 roku i była pierwszym białkiem, dla którego określono sekwencję aminokwasów
Niedobór insuliny powoduje wzrost poziomu glukozy we krwi i wydalania jej z moczem (cukromocz), zmniejszenie zawartości glikogenu w wątrobie i mięśniach, zwiększoną syntezę cukrów z białek, wzmożony rozkład lipidów i powstawanie związków ketonowych
Wpływ insuliny na proces transkrypcji genu tłumaczy się jej działaniem na zróżnicowanie, wzrost i rozmnażanie komórek
Insulina świni i bydła była stosowana do leczenia cukrzycy do chwili opracowania metody produkcji insuliny ludzkiej z wykorzystaniem technologii rekombinacji Dna. Różnice w składzie aminokwasów insuliny poszczególnych gatunków zwierząt dochodzi do 29 aminokwasów.
Polipeptyd zbudowany z 29 reszt aminokwasowych. Aminokwasem N-końcowym jest histydyna, a aminokwasem C-końcowym treonina
Masa cząsteczkowa wynosi 3485 Da.
Glukagon działa przeciwnie do insuliny. Powoduje szybki wzrost poziomu glukozy we krwi i zmniejsza poziom glikogenu w wątrobie
Aktywuje enzym rozszczepiający glikogen (fosforylazę glikogenową wątroby). Glukagon pobudza też lipolizę i glukanogenezę (?? A nie glukoneogenezę??). W komórkach tłuszczowych hormon ten aktywuje cyklazę adenylową (cAMP), która w komórkach wątrobowych indukuje enzymy glukoneogenezy
Hipoglikemia - poniżej 2,5 mM (45 mg/dL) problemy ze skupieniem uwagi, zawroty, drgawki, śpiączka)
Hiperglikemia/cukrzyca - powyżej stanu normalnego (~6,4 mM - 115 mg/dL) utrata wody, uszkodzenia oczu, nerek, nerwów, serca, naczyń krwionośnych, wzrost glikacji i glikozylacji białek
Zapoczątkowuje i podtrzymuje laktację
Wzmacnia działanie steroidów w jądrach, ale nadmiar prolaktyny hamuje czynność jąder
Wysokie stężenie prolaktyny hamuje owulację
Polipeptyd o masie cząsteczkowej około 23 kDa, składa się z 198 aminokwasów
Pobudzenie wydzielania
Prolaktoliberyna
Estrogeny
(Drażnienie brodawki sutka, ciąża, połóg, stosunek płciowy)
Zahamowanie wydzielania
Prolaktostatyna
Progesteron
Glikoproteina, „magazyn” T3 - trijodotyroniny i T4 - tetrajodotyroniny
Marker nowotworu tarczycy
Stanowi zapas jodu na około 3 miesiące dla organizmu (123 reszty tyrozynowe/cząsteczkę)
Zwiększenie podstawowej przemiany materii (do 100%) niemal wszystkich tkanek (poza mózgiem i jądrami)
Wzrost tempa metabolizmu węglowodanów (a więc zużycia tlenu)
Wzrost tempa metabolizmu lipidów
Niedobór T4 podczas dojrzewania - zahamowanie rozwoju umysłowego - kretynizm
Naturalny hormon steroidowy wytwarzany przez warstwę pasmowatą kory nadnerczy
Hormon stresowy
Stymuluje glukoneogenezę, zwiększa tempo katabolizmu białek, lipolizę
Blokuje pobieranie glukozy przez komórki
Zwiększa skurcz mięśni naczyń krwionośnych i serca
Działa przeciwzapalnie
Występują dobowe wahania stężenia kortyzolu (szczyt poranny)
Hormon sterydowy, wytwarzany przez warstwę kłębkowatą kory nadnerczy
Reguluje gospodarkę wodno-mineralną ustroju poprzez wzrost wchłaniania Na+ i wody przez kanaliki nerkowe
Wpływa na mineralny skład moczu
Powoduje wzrosty ciśnienia tętniczego
Kształtowanie się narządów płciowych oraz drugorzędowych i trzeciorzędowych (popędu) cech płciowych
Gospodarkę lipidową - zwiększają poziom „dobrego” cholesterolu HDL, a obniżają poziom „złego” cholesterolu LDL; zwiększają też wydalanie cholesterolu z żółcią
Gospodarkę wapniową - zwiększają odkładanie wapnia w kościach, zapobiegając osteoporozie
Zwiększanie przyswajania białek
Zwiększanie krzepliwości krwi
Przyrost i zwiększenie pobudliwości mięśni gładkich (macicy i jajowodów)
Rozrost gruczołów błony śluzowej macicy
Po zapłodnieniu - przekształcanie błony śluzowej - umożliwiające zagnieżdżenie się komórki jajowej, zapobiega skurczom macicy
Podstawowy męski steroidowy hormon płciowy należący do androgenów
Produkowany przez komórki śródmiąższowe Leydiga w jądrach, a także w niewielkich ilościach przez korę nadnerczy, jajniki i łożysko
Warunkuje powstawanie męskich cech płciowych (wewnętrzne narządy płciowe, spermatogeneza, niski głos) oraz zwiększenie masy mięśniowej, popędu
Doping w sporcie
Hamuje wydzielanie gonadotropin, T3, T4
Stymuluje: prolaktyny, sen (częste zmiany stref czasowych)
Działa bezpośrednio na komórki docelowe: receptory związane z białkami G (obniżenie stężenia cAMP)
Hamuje aktywność kalmoduliny, pośrednio więc działanie Ca2+ i białek kalmodulinozależnych
Związki organiczne o niewielkiej masie cząsteczkowej, które wpływają na odpowiedź fizjologiczną na bodźce środowiskowe, działają w niewielkich stężeniach (zwykle poniżej 10-7 M). Nie są bezpośrednio zaangażowane w procesy metaboliczne i rozwojowe, ale wpływają na ich przebieg i kierunek
Hormony roślinne są stosowane na dużą skalę w rolnictwie, ogrodnictwie i biotechnologii, do modyfikowania wzrostu i rozwoju roślin
Regulują lub integrują wiele procesów komórkowych i fizjologicznych w tym:
Podział komórkowy
Wzrost komórek na objętość
Różnicowanie komórek
Kwitnienie
Dojrzewanie owoców
Ruch (tropizmy)
Spoczynek nasion
Kiełkowanie nasion
Starzenie się
Opadanie liści
Przewodzenie szparkowe
Pośredniczy w odpowiedziach tropicznych (zaginanie pędu/korzeni) w odpowiedzi na światło i siłę ciężkości
Wytwarzana w stożku wzrostu, hamuje pąki boczne
Opóźnia starzenie liści
Może hamować lub promować (poprzez stymulację etylenem) opadanie liści i owoców
Indukuje zawiązywanie i wzrost owocu (u niektórych roślin)
Opóźnia dojrzewanie owoców
Stymuluje wzrost organów kwiaty
Stymuluje wytwarzanie etylenu
Stymulują podziały komórkowe
Stymulują morfogenezę - inicjację pędu/tworzenie pąka w kulturach tkankowych
Stymulują wzrost pędów bocznych
Stymulują ekspansję liści wynikającą z powiększania komórek
U niektórych gatunków wzmagają otwieranie aparatów szparkowych
Stymulują przekształcenie etioplastów w chloroplasty poprzez stymulacje syntezy chlorofilu
Wydłużanie pędu przez stymulację podziałów i wydłużania komórek
Wypuszczanie pędu kwiatowego i kwitnienie w długim dniu
Przerywa spoczynek nasion u roślin wymagających stratyfikacji lub światła do indukcji kiełkowania
Wytwarzanie enzymów (α-amylazy) w kiełkujących ziarnach zbóż w celu mobilizacji rezerw nasienia
Może opóźniać starzenia w liściach i owocach cytrusów
Stymuluje zamykanie szparek (susza indukuje syntezę ABA)
Hamuje wzrost pędu, ale nie korzenia (może nawet stymulować wzrost korzenia)
Indukuje syntezę białek zapasowych w nasionach
Hamuje efekt giberelin na syntezę de novo α-amylazy
Wywiera pewien wpływ na indukcję i utrzymywanie spoczynku nasion
Indukuje transkrypcję genów, w szczególności kodujących inhibitory proteinaz, w odpowidzi na zranienie (to tłumaczy rolę w obronie przed patogenami)
Wychodzenie ze spoczynku
Wzrost, różnicowanie pędu i korzenia
Opadanie liści i owoców
Otwieranie kwiatów
Starzenie kwiatów i owoców
Dojrzewanie owoców
Analiza składu chemicznego żywności (węglowodany, aminokwasy i białka, lipidy, witaminy)
Biochemia trawienia i przyswajania składników pokarmowych
Wyjaśnianie zachodzących procesów w organizmach żywych, mechanizmów regulujących przemiany anaboliczne i kataboliczne
Poznanie wpływu substancji chemicznych uwalnianych do środowiska przez działalność człowieka na przemiany zachodzące wewnątrz żywych komórek
Wyjaśnienie mechanizmów molekularnych mutacji oraz powstawnie chorób metabolicznych
Wykorzystanie metod inżynierii genetycznej i biotechnologii w hodowli nowych odmian roślin i zwierząt (GMO) z genami warunkującymi wysoką jakość produkowanych surowców żywnościowych
Enzymy, czynniki wpływające na ich aktywność i budowa
Substancje niezbędne do prawidłowego rozwoju organizmu: witaminy, aa egzogenne, kwasy tłuszczowe NNKT
Rozkład substancji zapasowych w organizmach
Sposoby „zdobywania energii przez organizmy - oddychanie, fotosynteza
Ekspresja genów
Rola glukozy w metabolizmie - degradacja, synteza
Choroby związane z zaburzeniami w metabolizmie, niedoborami w diecie
Ksenobiotyki, dodatki do żywności, możliwe zagrożenia, zalety ich stosowania i sposoby ich wydalania
Biochemia - J.M.Berg, J.L. Tymoczko
Krótkie wykłady Biochemia, D. Hames, N.M. Hooper, PWN, 2002 lub późniejsze
Naturalne związki organiczne
Biotechnologia żywności - red. Wł. Bednarski
Chemia żywności 1-3 - red. Z.E. Sikorski, WNT 2007
Materiały do ćwiczeń z biochemii, SGGW, 2001 i późniejszy
1,3-bisfosfoglicerynian + ADP 3-fosfoglicerynian + ATP
Fosfoenolopirogronian + ADP pirogronian + ATP
Glukoza + ATP Glukozo-6-fosforan + ADP
Fruktozo-6-fosforan + ATP Fruktozo-1,6-bisfosforan + ADP
Glukoza 2 pirogronian (2ATP 2ADP ; 4ADP 4ATP; 2NAD 2NADH + H
Metabolizm fruktozy
Metabolizm galaktozy
Galaktozemia: zaburzenia w metabolizmie galaktozy - niemożność przekształcenia galaktozy w glukozę - najczęściej obniżona jest aktywność urydylotransferazy galaktozo-1-fosforanowej
Objawy: po spożyciu mleka biegunka, wymioty, powiększona wątroba, żółtaczka, zaćma (galaktikol - produkt redukcji galaktozy), opóźnienie w rozwoju umysłowym
Przeciwdziałanie: dieta bez laktozy
Metabolizm pirogronianu - 3 postawowe kierunki
Fermentacje - beztlenowe przemiany pirogronianu
Fermentacja mleczanowa - (enzym: dehydrogenaza mleczanowa), zachodzi tu regeneracja NAD+ w warunkach ograniczonego dostępu tlenu (np. podczas pracy mięśnia) po to, aby glikoliza mogła być kontynuowana
Pirogronian + NaDH + H+ mleczan + NAD+
Zastosowania w przemyśle:
Fermentacja alkoholowa - charakterystyczna dla drożdży (2 etapy: 1 reakcja katalizowana przez dekarboksylazę pirogronianową oraz 2 reakcja katalizowana przez dehydrogenazę alkoholową)
Glukoza + 2ADP + 2Pi 2 etanol + 2CO2 + 2ATP
Zastosowanie w przemyśle
Fermentacja masłowa
Glukoza kwas masłowy + 2CO2 + 2H2
Znaczenie fermentacji:
Synteza alaniny z pirogronianu
Synteza alaniny w reakcji katalizowanej przez aminotransferazę alaninową (ALAT) -
pirogronian (glutaminian 2-oksoglutaran) Alanina
Glukoneogeneza
Kontrola glukoneogenezy
Reakcje glukoneogenezy wymagające nakładu energii:
Pirogronian + CO2 + ATP szczawiooctan + ADP + Pi
Szczawiooctan + GTP fosfoenolopirogronian + GDP + CO2
Cykl Corich
Synteza polisacharydów - glikogen
Szlak fosforanów pentoz
2 fazy: utleniająca (powstaje NADPH) i nieutleniająca - przemiany sacharydów
Faza utleniająca:
Synteza NADPH
Glukozo-6-fosforan + NADP+ 6-fosfoglukono-delta-lakton + NADPH + H+
Kwas-6-fosfoglukonowy + NADP+ Rybulozo-5-fosforan + CO2 + NADPH + H+
Kontrola: najważniejsza jest pierwsza reakcja szlaku - nieodwracalna - katalizowana przez dehydrogenazę glukozo-6-fosforanową, enzym ten regulowany jest przez NADP+, duże stężenie tego koenzymu stymuluje jego aktywność
Etap nieutleniający
Fosforoliza i hydroliza glikogenu
Aktywacja kinazy białkowej A zapoczątkowana hormonalnie - rysunek
Rozkład węglowodanów - trawienie
1 etap trawienia polisacharydów rozpoczyna się już w ustach - ślina ma lekko kwaśne pH, zawiera alfa-amylazę - alfa-1,4-endoglukozydazę
Polega na wstępnej hydrolizie polisacharydów do dobrze rozpuszczalnych w wodzie oligosacharydów i disacharydów
2 etap - kwaśna hydroliza polisacharydów w żołądku, aktywność alfa-amylazy obecnej w ślinie ulega zahamowaniu
3 etap degradacji polisacharydów (najważniejszy) rozpoczyna się w jelicie cienkim pod wpływem głównie alfa-amylazy wydzielanej przez trzustkę, produktem jej działania są oligo- i disacharydy. Końcowym produktem trawienia cukrów są monosacharydy również efekt aktywności odpowiednich enzymów hydrolitycznych, disacharydy (inwertazy, laktazy, maltazy, trehalazy)
Degradacja/wchłanianie sacharydów
Zużycie glukozy w czasie:
Etap 1 - po spożyciu pokarmu. Wszystkie tkanki zużywają glukozę
Etap 2 - po wchłonięciu. Regulacja poziomu glukozy we krwi. Rozkład glikogenu, glukoneogeneza
- Mleczan
- Pirogronian
- Glicerol
- Aminokwasy
- Oszczędzanie glukozy przez rozkład tłuszczy
Etap 3 - początek głodowania, glukoneogeneza
Etap 4 - środkowy okres głodowania, glukoneogeneza, rozkład ciał ketonowych
Etap 5 - głodowanie
Wykład11 10 XII 08
Metabolizm lipidów
Kwasy tłuszczowe powstają z triacylogliceroli w wyniku działania LIPAZY. Sole żółciowe i zasadowe środowisko ułatwiają działanie lipazie. Innym produktem reakcji hydrolizy triacylogliceroli, poza kwasami tłuszczowymi, jest glicerol, który może być przekształcony w dwóch reakcjach do fosfodihydroksyacetonu, związku pośredniego w procesie glikolizy
Lipaza podjęzykowa
Lipaza trzustkowa
Wychwyt kwasów tłuszczowych przez tkanki
Rozpad kwasów tłuszczowych
Lokalizacja: mitochondrium
Nazywany beta-oksydacją - degradacja kwasów tłuszczowych, która polega na utlenianiu długich łańcuchów kwasów tłuszczowych. Rozpad kwasu tłuszczowego o długości np. 16 C wymaga 7 kolejnych rund reakcji, podczas których dochodzi do odszczepienia jednostki 2C (reszty acylowej). Pojedyncza runda składa się z 4 etapów = 4 reakcji = utlenienie, uwodnienie, utlenienie, tioliza
Aktywacja kwasów tłuszczowych i ich transport do wnętrza mitochondrium
- Aktywacja KT polega na wytworzeniu wiązania tioestrowego z koenzymem A,
- Reakcja wymaga energii - zużywana jest cząsteczka ATP i katalizowana jest przez syntetazę acylo-CoA,
- Zachodzi na zewnętrznej błonie mitochondrialnej.
KT + ATP + HS-CoA Acylo-S-CoA + AMP + Ppi
- Transport do wnętrza mitochondrium
1. Utlenianie Acylo-CoA w mitochondrium
Utlenienie acylo-CoA do enoilo-CoA, powstaje FADH2, enzym: dehydrogenaza acylo-CoA
Acylo-CoA + FAD FADH2 + Enoilo-CoA
2. Uwodnienie Enoilo-CoA do 3-hydroksyacylo-CoA, enzym: hydrataza enoilo-CoA
Enoilo-CoA + H2O Hydroksyacylo-CoA
3. Utlenienie Hydroksyacylo-CoA do 3-ketoacylo-CoA, powstaje NADH, enzym: dehydrogenaza 3-hydroksyloacylo-CoA
Hydroksyacylo-CoA + NAD+ Ketoacylo-CoA + NADH + H+
4. Tioliza = rozszczepienie 3-ketoacylo-CoA przez 2 cząsteczkę CoA, powstają acetylo-CoA (wykorzystywany głównie w cyklu Krebsa) i acylo-CoA (krótszy o 2 atomy C), enzym tiolaza 3-ketoacylo-CoA
Ketoacylo-CoA + CoA Acetylo-CoA + Acylo-CoA (krótszy o 2 C)
Powstawanie ciał ketonowych
Lokalizacja: wątroba
Alternatywa dla cyklu Krebsa w celu „zagospodarowania” acetylo-CoA
Do ciał ketonowych zalicza się: acetooctan, 3-hydroksymaślan oraz produkt dekarboksylacji acetooctanu - aceton. Ciała ketonowe dobrze rozpuszczają się w wodzie, ich stężenie we krwi może być wyższe niż stężenie kwasów tłuszczowych
Początek: odwrócenie reakcji katalizowanej przez tiolazę 3-ketoacetylo-CoA
Wyczuwalny w oddechu aceton: nie leczona cukrzyca lub kwasica ketonowa
Nienasycone kwasy tłuszczowe (nawet 50 % lipidów roślinnych i zwierzęcych)
Początkowy etap beta-oksydacji przebiega normalnie, do momentu dojścia do podwójnego wiązania cis C=C między C3 i C4, konieczna jest wtedy odpowiednia izomeraza (wytwarza wiązanie podwójne trans między C2 i C3, które może ulec odwodnieniu i dalszym przemianom w cyklu).
Dla wielonienasyconych kwasów konieczna jest odpowiednia reduktaza
Nieparzystowęglowe KT
- Występują rzadko w przyrodzie
- W ostatnim możliwym etapie beta-oksydacji otrzymywany jest propionian (5C C3 + C2), a z niego po przekształceniach bursztynian - substrat z cyklu Krebsa, z niego z kolei powstaje szczawiooctan - związek glukogenny, konieczne są biotyna i witamina B12
Zysk energetyczny procesu beta-oksydacji
Reakcja sumaryczna: palmitoilo-CoA + 7 FAD + 7 NAD+ + 7 CoA + 7 H2O 8 acetylo-CoA + 7 FADH2 + 7 NADH + 7 H+
1 runda beta-oksydacji dostarcza 1 cząsteczki FADH2 i 1 cząsteczki NADH, co odpowiada 4 cząsteczkom ATP z fosforylacji oksydacyjnej. Dodatkowo energia uzyskana jest w cyklu Krebsa ze spalenia acetylo-CoA (1 cząsteczka acetylo-CoA odpowiada 10 cząsteczkom ATP)
Dla palmitynianu C16 będzie to odpowiednio
7 x 4ATP + 8Acetylo-CoA x 10 ATP = 28 + 80 = 108 ATP
Dla stearynianu C18
8 x 4ATP + 9 Acetylo-CoA x 10 ATP = 32 + 90 = 122 ATP
Na aktywację kwasu tłuszczowego przed beta-oksydacją zużywane jest 1 cząsteczka ATP, ale hydrolizie ulegają 2 wiązania makroergiczne (ATP AMP + PPi), co odpowiada hydrolizie 2 cząsteczek ATP do ADP
Całkowity zysk utlenienia palmitynianu wynosi więc 106 ATP, a stearynianu 120 ATP
Porównanie wydajności energetycznej utlenienia stearynianu (C18:0) i glukozy (3xC6)
Całkowite utlenienie stearyno-CoA dostarcza 120 cząsteczek ATP
Całkowite utlenienie glukozy (C6) dostarcza 30 cząsteczek ATP x 3 (18 C) = 90 ATP
Utlenienie kwasów tłuszczowych jest bardziej wydajne niż utlenienie glukozy
Synteza kwasów tłuszczowych
Transport acetylo-CoA do cytozolu
Karboksylacja acetylo-CoA do malonylo-CoA, enzym karboksylaza acetylo-CoA, zawierająca biotynę jako grupę prostetyczną
Acetylo-CoA + HCO3- + ATP malonylo-CoA + ADP + Pi + H+
Cykl wydłużania się kwasów tłuszczowych rozpoczyna się wytworzeniem kompleksów z białkiem ACP: acetylo-ACP i malonylo-ACP (z uwolnieniem CoA) (enzymy: transacylaza acetylowa/transacylaza malonylowa)
Kondensacja acetylo-ACP i malonylo-ACP, enzym: enzym kondensujący acylomalonylo-ACP
Acetylo-ACP i malonylo-ACP acetoacetylo-ACP + ACP + CO2
Redukcja acetoacetylo-ACP do hydroksybutyrylo-ACP, koenzymem jest NADPH, enzym: reduktaza beta-ketoacylo-ACP
Acetoacetylo-ACP + NADPH + H+ Hydroksybutyrylo-ACP + NADP+
Odwodnienie D-3-hydroksybutyrylo-ACP do krotonylo-ACP, enzym: dehydrataza 3-hydroksyacylo-ACP
Hydroksybutyrylo-ACP Krotonylo-ACP + H2O
Redukcja krotonylo-ACP do butyrylo-ACP, koenzymem jest NADPH, enzym: reduktaza enoilo-ACP
Krotonylo-ACP + NADPH + H+ butyrylo-ACP + NADP+
Synteza kwasów tłuszczowych - reakcja sumaryczna wytworzenia palmitynianu
8 acetylo-CoA + 7ATP + 14 NADPH + 6H+ palmitynian + 14 NADP+ + 8CoA + 6H2O + 7ADP + 7Pi
Porównanie rozpadu i syntezy kwasów tłuszczowych
Rozpad kwasów tłuszczowych |
Synteza kwasów tłuszczowych |
Zachodzi w mitochondriach |
Zachodzi w cytozolu |
Redukowany jest NAD+ i FAD |
Utleniany jest NADPH |
Kwasy tłuszczowe wiążą się z koenzymem A |
Kwasy tłuszczowe związane są z białkowym nośnikiem grup acylowych (ACP) |
Poszczególne aktywności enzymatyczne związane są z różnymi enzymami (w procesie biosyntezy białka różne łańcuchy polipeptydowe) |
Za syntezę odpowiedzialna jest syntaza kwasów tłuszczowych (w procesie biosyntezy białka 1 łańcuch polipeptydowy) |
Synteza kwasu fosfatydowego
Lokalizacja: cytozol
- Prekursorem jest glicerol i jego pochodne: fosforan dihydroksyacetonu lub 3-fosforan glicerolu, aktywowane kwasy tłuszczowe uwalniane są z kompleksu syntazy kwasów tłuszczowych
- Powstały kwas fosfatydowy jest substratem w syntezie fosfolipidów - głównego składnika błon komórkowych, lub w syntezie triacylogliceroli
Synteza triacylogliceroli
Lokalizacja: cytozol
- Substratem jest kwas fosfatydowy i zaktywowane kwasy tłuszczowe o łańcuchach składających się z minimum 10 C
- Synteza triacylogliceroli odbywa się po ich strawieniu i wchłonięciu w nabłonku jelita - resynteza, triacyloglicerole następnie transportowane są do wątroby w postaci lipoprotein - chylomikronów (90-95% ich składu)
- Na chylomikrony działa lipaza lipoproteinowa, która uwalnia kwasy tłuszczowe - mogą one ulegać beta-oksydacji lub być zmagazynowane w postaci triacylogliceroli w tkance tłuszczowej
Synteza cholesterolu
- Prekursorem jest acetylo-CoA
- Cholesterol: podstawowy składnik błon komórkowych i prekursor w syntezie chormonów steroidowych (progesteron, testosteron, estradiol, kortyzol)
- 3-etapowa synteza
Acetylo-CoA + acetoacetylo-CoA + 2NADPH + 2H+ + 3ATP pirofosforan izopentenylu + 2NADP+ + 3ADP + Pi + CO2
Synteza kwasów żółciowych
- Kwasy żółciowe są główną postacią wydzielania cholesterolu u ssaków
- Syntetyzowane są w wątrobie
Cholilo-CoA + glicyna = kwas glikocholowy
Cholilo-CoA + tauryna (pochodna cysteiny) = kwas taurocholowy
- Funkcje: detergenty, ułatwiają trawienie lipidów i wchłanianie witamin A, D, E i K
Synteza hormonów steroidowych
Etap 1: usunięcie sześciowęglowej jednostki z cholesterolu - z łańcucha bocznego: powstaje metabolit pośredni pregnelon
Etap 2: modyfikacje pregnelonu z udziałem cytochromu P-450 - monooksygenazy wprowadzającej atom tlenu z udziałem NADPH
Przykłady: progesteron, testosteron, estron, kortyzol, aldosteron
Wykład 12 17 XII 08
Etapy utleniania biologicznego. Fotosynteza.
Utlenianie biologiczne
Etapy procesu utlenienia cząsteczek organicznych do CO2 i H2O połączonego z wytwarzaniem ATP
1 etap - utlenianie cząsteczek pokarmowych do acetylo-CoA
2 etap - cykl kwasu cytrynowego/Cykl Krebsa
3 etap - utlenianie NADH i FADH2 utworzonych w cyklu kwasu cytrynowego w łańcuchu oddechowym
Ad.1. Utlenianie cząsteczek pokarmowych do acetylo-CoA
Powstawanie acetylo-CoA - REAKCJA POMOSTOWA - łączy glikolizę z CKT
Jeden z substratów, jednostka 3C - pirogronian, może pochodzić z:
Acetylo-CoA powstaje z pirogronianu dzięki katalizowanej przez kompleks dehydrogenazy pirogronianowej (katalizuje dekarboksylację oksydacyjną, czyli utlenianie pirogronianu i odłączanie CO2). Reakcja ta stanowi pomost między glikolizą a cyklem Krebsa i zachodzi w matriks mitochondrialnej
Pirogronian + CoA + NAD+ acetylo-CoA + CO2 + NADH
Kompleks dehydrogenazy pirogronianowej składa się z 3 enzymów:
Dehydrogenaza pirogronianowa
Acetylotransferaza dihydrolipoamidowa
Dehydrogenaza dihydrolipoamidowa
I 5 koenzymów:
Pirofosforan tiaminy - TPP
Kwas liponowy
FAD
NADH
CoA
Brak lub obniżona aktywność dehydrogenazy pirogronianowej gromadzenie się alaniny, kwasu mlekowego i pirogronianu, prowadzi do rozległych defektów neurologicznych i śmierci
Regulacja aktywności dehydrogenazy pirogronianowej
Ad.2. Cykl kwasu cytrynowego/Cykl Krebsa
Acetylo-CoA + 3NAD+ + FAD + GDP + Pi + 2H2O 2CO2 + 3NADH + FADH2 + GTP + 2H+ + CoA
Wybrane reakcje cyklu kwasu cytrynowego
Szczawiooctan + acetylo-CoA + H2O cytrynian + CoA + H+
4C + 2C 6C
Izocytrynian + NAD+ alfa-ketoglutaran + CO2 + NADH + H+
6C 1C + 5C
Bursztynian + FAD fumaran + FADH2
4C 4C
L-jabłczan + NAD+ szczawiooctan + NADH + H+
4C 4C
Regulacja CKT
Do czego wykorzystywane są produkty pośrednie powstałe w cyklu Krebsa?
Reakcje anaplerotyczne cyklu Krebsa (uzupełniające)
Cel: uzupełnienie metabolitów z cyklu Krebsa
Fosfoenolopirogronian + CO2 + GTP szczawiooctan + GDP (karboksylaza fosfoenolopirogronianowa)
Glutaminian + pirogronian alfa-ketoglutaran + alanina (aminotransferaza alaninowa)
Glutaminian + szczawiooctan alfa-ketoglutaran + asparaginian (aminotransferaza asparaginianowa)
Potencjał oksydoredukcyjny E, potencjał redoks - jest miarą powinowactwa substancji do elektronów.
Ad.3. Utlenianie NADH i FADH2 utworzonych w cyklu kwasu cytrynowego w transporcie elektronów sprzężonym z fosforylacją oksydacyjną, prowadzącą do syntezy ATP
NADH + H+ + ½ O2 NAD+ + H2O deltaE = +1,14V, deltaGo = -220,2 kJ/mol
Transport elektronów - odbywa się poprzez łańcuch oddechowy, czyli układ przenośników elektronów umiejscowiony na wewnętrznej membranie mitochondrialnej, odpowiedzialny za przepływ elektronów z NADH do tlenu. Elektrony płyną w kierunku od układu o niższym potencjale do układu o wyższym potencjale redoksowym
Synteza ATP:
ADP + Pi + H+ ATP + H2O deltaGo = +30,5 kJ/mol
Utlenienie NADH teoretycznie wystarczyłoby do syntezy 7 cząsteczek ATP
Łańcuch oddechowy - skład:
Pompy protonowe
FADH2, drugi z koenzymów powstający w cyklu Krebsa utleniany jest za pośrednictwem dehydrogenazy bursztynianowej, przeniesione elektrony na ubichinon (CoQ) wchodzą do łańcucha elektronów z pominięciem jednej pompy H+
Uwolniona energia, dzięki zmianie potencjału redoks w łańcuchu oddechowym, służy do wypompowania jonów H+ z matriks mitochondrialnej poprzez wewnętrzną błonę mitochondrialną do przestrzeni międzybłonowej - tworzy się gradient H+, a funkcję pomp protonowych spełniają:
Kompleks dehydrogenazy NADH,
Kompleks cytochromów bc1,
Kompleks oksygenazy cytochromowej
Synteza ATP = fosforylacja oksydacyjna
Enzym: syntaza ATP - największe źródło ATP w komórce, polega na syntezie ATP, zachodzącej podczas utlenienia NADH (2,5 cząsteczek ATP) i FADH2 (1,5 cząsteczki ATP) sprzężonej z transportem elektronów przez łańcuch oddechowy i wytworzeniem w poprzek wewnętrznej membrany mitochondrialnej gradientu protonowego
ADP + Pi + H+ ATP + H2O, deltaGo = +30,5 kJ/mol
Regulacja transportu elektronów:
Reoksydacja cytozolowego NADH wytwarzanego w glikolizie - przenoszenie elektronów z cytoplazmy do mitochondrium - do łańcucha oddechowego. Wewnętrzna błona mitochondrialna nie jest przepuszczalna dla NADH, dlatego konieczne są reakcje enzymatyczne, które „wprowadzą” elektrony ze zredukowanych koenzymów w cytoplazmie do łańcucha oddechowego w mitochondrium
NADH FADH2
FOTOSYNTEZA
Zachodzi w roślinach zielonych, bakteriach fotosyntetyzujących i sinicach (autotrofy = organizmy samożywne). W tym procesie energia słoneczna wykorzystywana jest do syntezy węglowodanów z CO2 i H2O
6H2O + 6CO2 C6H12O6 + 6O2 - 678 kcal
Fotosyntezę można podzielić na 2 fazy
Reakcja sumaryczna cyklu Calvina dla wytworzenia 1 cząsteczki glukozy
6CO2 + 18ATP + 12NADPH + 12H2O C6H12O6 + 18ADP + 18Pi + 12NADP+ + 6H+
Fotosystemy - faza jasna
Energia słoneczna pochłaniana jest w fotosystemach składających się z:
Budowa chlorofilu - układ tetrapirolowy z atomem magnezu, jako centralnego jonu metalu, fitol jest 20C alkoholem o silnie hydrofobowym charakterze, pozwala to na zakotwiczenie chlorofilu w błonie aktywnej fotosyntetycznie
Wyróżniamy 2 typy fotosystemów u roślin wyższych:
Chlorofil występujący w PSI wykazuje maksimum absorbancji przy długości 700 nm - nazywany jest P700, a chlorofil z PSII przy 680 nm - nazywany jest P680
Fosforylacja niecykliczna - fotoliza H2O, uwalnianie O2
Fosforylacja cykliczna - synteza ATP
Odbywa się podczas niewielkiej dostępności NADP+ w chloroplaście, a elektrony wędrują alternatywnym szlakiem:
Porównanie fosforylacji |
|
Cykliczna |
Niecykliczna |
Uczestniczy PSI |
Uczestniczy PSI i PSII |
Powstaje tylko ATP |
Powstaje ATP i NADPH |
- |
Fotoliza H2O, uwalnianie O2 |
Reakcje ciemne fotosyntezy - rośliny C3
Karboksylacja
Rybulozo-1,5-bisfosforan + CO2 + H2O 2 3-fosfoglicerynian
Redukcja 3C kwasu organicznego do aldehydu
1 etap: kwas 3-fosfoglicerynowy + ATP kwas 1,3-difosfoglicerynowy + ADP
2 etap: kwas 1,3-difosfoglicerynowy + NADPH + H+ aldehyd 3-fosfoglicerynowy + NADP+ + Pi
Cykl Calvina
Aldehyd 3-fosfoglicerynowy wykorzystywany jest do syntezy najpierw heksoz, a następnie sacharozy i skrobi. Synteza sacharozy przebiega w cytozolu (sacharoza jest transportowana z miejsca syntezy do wszystkich organów rośliny), a skrobi w chloroplastach
„Modyfikacje” cyklu Calvina
Rośliny C4 - szlak C4 (pierwszy trwały produkt po asymilacji CO2 4C - szczawiooctan lub jabłczan). Występuje często anatomia Kranza: komórki mezofilu, gdzie następuje wiązanie CO2 i komórki pochwy okołowiązkowej, gdzie ma miejsce cykl Calvina - ewolucyjna adaptacja roślin ograniczająca prez separację przestrzenną fotooddychanie (kukurydza, ryż, proso, trzcina cukrowa, amaranthus)
CHEMOSYNTEZA - drugi oprócz fotosyntezy rodzaj samożywności
Energia potrzebna do asymilacji CO2 nie pochodzi ze słońca, a z utleniania związków nieorganicznych lub zredukowanych i prostych połączeń węgla.
Cechy chemosyntezy:
Bakterie azotowe - (Nitrosomonas, utlenia amoniak do azotynów)
2NH3 + 3O2 2HNO2 + 2H2O + 158 kcal
Bakterie metanowe - utleniają metan i inne jednowęglowe związki organiczne
CH4 + 2O2 CO2 + 2H2O + 106 kcal
Wykład 13 7 I 09
Metabolizm związków azotowych: białek, aminokwasów, cykl mocznikowy.
Cykl azotu - obieg azotu w biosferze, obejmuje bakterie, rośliny i zwierzęta. Wszystkie organizmy mogą wbudować NH3 do organicznych związków azotowych - zawierają wiązanie C-N
N2 - stanowiący ok. 80% atmosfery ziemskiej jest nieaktywny chemicznie i tylko nieliczne organizmy są zdolne do jego redukcji zwanej wiązaniem azotu
Jony NO3- obecne w glebie są redukowane przez większość mikroorganizmów i roślin do amoniaku.
Azotowe związki organiczne ulegają przemianom katabolicznym do aminokwasów, porfiryn, nukleotydów oraz w dalszych etapach do amoniaku i azotu atmosferycznego.
Wiązanie azotu:
Przemiana N2 w NH3, przeprowadzana jest przez diazotrofy (np.: Klebsiella, Azotobacter, Rhizobium, sinice) - wiążą one ok. 60% NH2, 15% wiązane jest podczas wyładowań atmosferycznych oraz w wyniku działania promieniowania UV, reszta N2 wiązana jest w procesach przemysłowych
Organizmy żywe wiążą azot poprzez kompleks nitrogenazy, który składa się z 2 białek: reduktazy i nitrogenazy. Elektrony potrzebne w tej reakcji pochodzą ze zredukowanej ferredoksyny, ta powstaje w fotosystemie I, albo w oksydacyjnym transporcie elektronów, transport elektronów z reduktazy do nitrogenazy powiązany jest z hydrolizą ATP.
Reakcja sumaryczna:
N2 + 8e + 8H+ + 16ATP + 16H2O 2NH3 + H2 + 16ADP + 16Pi
Dwustopniowa redukcja jonów NO3-
Jony NO3- ulegają redukcji dwustopniowo, reakcje katalizowane są przez kolejno:
NO3- + NAD(P)H + H+ + 2e NO2- + NAD(P)+ + H2O
NO2- + 3NAD(P)H + 5H+ + 6e -> NH4+ + 3NAD(P)+ + 2H2O
W tkankach fotosyntetyzujących źródłem elektronów może być zredukowana ferredoksyna zamiast NAD(P)H.
Asymilacja azotu - GS
Jedynie azot w postaci NH4+ może być asymilowany do związków organicznych zawierających azot. Odbywa się to u wszystkich organizmów dzięki 2 reakcjom:
Kwas glutaminowy może ulegać reakcji transaminacji - prekursor w syntezie innych aminokwasów w reakcji jego utlenienia powstaje amoniak, który może być wykorzystywany w cyklu mocznikowym, oraz 2-oksoglutaran jeden z metabolitów cyklu Krebsa,
Cykl GS-GOGAT
Przy niskich stężeniach NH4+ kwas glutaminowy syntetyzowany jest w cyklu GS-GOGAT:
Reakcja sumaryczna:
NH4+ + 2-oksoglutaran + NADPH + ATP glutaminian + NADP+ + ADP + Pi
Biosynteza aminokwasów:
Biosynteza aminokwasów może obejmować od 1 do 15 etapów. Najczęściej wiele etapów wymaganych jest w syntezie aminokwasów egzogennych, na drodze ewolucji, u organizmów wyższych, potrzebne enzymy do ich syntezy zostały utracone i aminokwasy te muszą być przyjmowane z pożywieniem
Grupa aminowa potrzebna do syntezy aminokwasów pochodzi najczęściej z reakcji transaminacji glutaminianu, szkielety węglowe wywodzą się z:
- cyklu Krebsa
- glikolizy
- szlaku pentozofosforanowego
Biosynteza i metaboliczne przekształcenia glutaminy.
Glutamina jest jednym z aminokwasów najobficiej występujących we krwi (obok alaniny) - transportuje zasymilowany amoniak, grupa aminowa przekazywana jest z aminokwasu na aminokwas w reakcjach transaminacji. Glutamina jest również prekursorem w syntezie glutationu, puryn i pirymidyn.
Biosynteza alaniny i seryny
Synteza alaniny (enzym - aminotransferaza alaninowa - ALAT):
Synteza seryny składa się z 3 etapów i uczestniczą w niej 3 enzymy:
Biosynteza asparaginy:
Biosynteza asparaginianu
Rozkład białek - wstęp:
Degradacja białek naznaczonych ubikwityną:
Przyłączenie ubikwityny:
Częstotliwość przyłączenia ubikwityny zależy od N-aminokwasu np. dla metioniny półtrwanie białek powyżej 20 lat, arginina lub leucyna poniżej 2 minut,
Inne przykłady: hemoglobina, krystalina białka bardzo trwałe, dekarboksylaza ornityny - półtrwanie ok. 11 minut
Zaznaczone ubikwityną białka trawione są przez proteasomy:
translacja
cykl komórkowy
organogeneza
rytmy okołodobowe
supresja nowotworów
odpowiedź zapalna
metabolizm cholesterolu
wytwarzanie antygenów
Rozkład białek cd.:
Wewnątrzkomórkowe enzymy proteolityczne - katepsyny:
Podział peptydaz:
Rozkład aminokwasów:
Degradacja aminokwasów rozpoczyna się od odłączenia grypy α-aminowej, pozostały szkielet węglowy przekształcany jest do jednego z kilku metabolitów i używany jako paliwo energetyczne:
Lys i Leu - aa tylko ketogenne!
Transaminacja - proces, w którym grupa α-aminowa jednego aminokwasu (donor) jest odłączona i przeniesiona na szkielet węglowy kolejnego aminokwasu (akceptor) najczęściej jest nim 2-oksoglutaran (α-ketoglutaran), a powstaje glutaminian.
Transaminacje katalizowane są przez aminotransferazy (transaminazy), enzymy z klasy transferaz, współpracujące z fosforanem pirydoksalu, pochodnej witaminy B6.
Reakcje te są najczęściej w pełni odwracalne i `anergiczne` - niewymagające i niewytwarzające energii.
Glutaminian + α-ketokwas α-ketoglutaran + α-aminokwas
Oksydoredukcyjne przemiany aminokwasów:
Dekarboksylacja aminokwasów - proces rozkładu aminokwasów, w wyniku którego widzialny jest CO2 i powstają aminy biogenne (histamina, kadaweryna, cysteamina, β-alanina, 4-aminomaślan - GABA), reakcje katalizowane są przez dekarboksylazy aminokwasowe, enzymy z klasy liaz, współpracujące z fosforanem pirydoksalu
Cykl mocznikowy:
NH3 powstaje w różnych reakcjach, katalizowanych przez:
glutaminian + NAD(P) + H2O 2-oksoglutaran + NAD(P)H + H+ + NH3
glutamina glutaminian + NH3
seryna pirogronian + NH3
glicyna glioksalan + NH3
Reakcja sumaryczna cyklu mocznikowego:
HCO3- + NH4+ + 3ATP + asparaginian + H2O mocznik + 2ADP + 2Pi + AMP + PPi + fumaran
Wytwarzanie mocznika jest korzystne z kilku powodów:
Wybrane reakcje cyklu mocznikowego:
Jeden z 2 atomów azotu w moczniku pochodzi z amoniaku, a drugi z asparaginianu, atom węgla pochodzi z CO2.
Zakłócenia w cyklu mocznikowym, powodują gromadzenie się amoniaku we krwi i chorobę zwaną hiperamonemią.
Choroba ta czasem obserwowana u noworodków powoduje zmiany w mózgu, polega ona prawdopodobnie na zwiększonej syntezie glutaminianu i glutaminy (substratem jest NH4+), co wywołuje z jednej strony efekt osmotyczny (obrzęki), a z drugiej strony prowadzi do wyczerpania 2-oksoglutaranu, zaburzając normalny przebieg cyklu Krebsa i wytwarzanie energii, zwłaszcza w mózgu.
Cykl mocznikowy i cykl kwasu cytrynowego są ze sobą powiązane:
Powstający fumaran w cyklu mocznikowym może ulec uwodnieniu do jabłczanu, ten z kolei utleniany jest do szczawiooctanu. Szczawiooctan może ulegać następującym przemianom:
Synteza fosforanu kreatyny
fosforan kreatyny - fosfagen, magazynowany w mięśniach, syntetyzowany z metabolitu pośredniego cyklu mocznikowego - argininy
Niektóre wady dziedziczne metabolizmu aminokwasów |
||
Choroba |
Niedobór enzymu |
Objawy |
Cytrulinemia |
Syntetaza argininbursztynianu |
Letarg, napady padaczkowe, zmniejszenie napięcia mięśniowego |
Fenyloketonuria |
Hydroksylaza fenyloalaniny |
Upośledzenie umysłowe, długość życia do 20-30 lat |
albinizm |
tyrozynaza |
Brak pigmentacji |
Fenyloketonuria - choroba związana z zaburzeniami metabolizmu fenyloalaniny, polega na obniżonej aktywności lub całkowitym braku hydroksylazy fenyloalaninowej lub rzadziej tetrahydrobiopteryny
Objawy: gromadzenie się Phe we wszystkich tkankach, poważny niedorozwój umysłowy
Dieta: uboga w Phe,
Aspartam!!
Wykład 14 14 I 09
Mechanizmy biochemiczne detoksykacji substancji szkodliwych w organizmach żywych.
Substancje szkodliwe/zatrucia
Trucizna - substancja organiczna lub nieorganiczna, która po dostaniu się do organizmu powoduje zaburzenia w jego funkcjonowaniu, inne niekorzystne zmiany w organizmie lub śmierć
Może to być ciało stałe, ciecz lub gaz. Trucizny mogą działać gwałtownie lub gromadzić się w organizmie powodując zatrucia przewlekłe.
„Wszystko jest trucizną i nic nie jest trucizną, tylko dawka decyduje, że jakaś substancja nie jest trucizną” [Paracelsus]
Dawki
Wchłanianie trucizn
Ad.1 - Przenikanie przez skórę
Efektywność przenikania zależy od czasu kontaktu trucizny z powierzchnią skóry
Ad.2 - Wnikanie za pośrednictwem układu oddechowego
Wdychane powietrze z toksynami w nosie, gardle, tchawicy, oskrzelach i pęcherzykach płucnych ma kontakt z układem krwionośnym
Szybkość wnikania toksyn, przy dużych ich stężeniach zależy od szybkości oddychania, przy małych stężeniaach toksyn od szybkości przepływu krwi
Ad.3 - Wnikanie za pośrednictwem układu pokarmowego
Z każdego elementu układu pokarmowego trucizna może przedostać się do krwioobiegu
Działanie trucizny na organizm
Mutageneza
Mutacja - dziedziczna i stała zmiana w sekwencji zasad DNA, powstaje spontanicznie wskutek błędów w replikacji (u bakterii E.coli 1 błąd na 1010 wbudowanych zasad) lub rekombinacji mejotycznej albo w wyniku szkodliwego działania czynników fizycznych lub chemicznych
Mutacja punktowa - zamiana pojedynczej zasady: tranzycja (puryna zastąpiona jest puryną, np. A przez G lub pirymidyna przez pirymidynę (np. C przez T), transwersja (puryna zastąpiona jest przez pirymidynę). Mutacje punktowe nie muszą mieć dużych następstw (mutacje utajone), chyba, że prowadzą do utworzenia kodonu nonsensownego
Mutageny
Alkilacja przeszkadza w rozplataniu dwuniciowego DNA podczas replikacji i transkrypcji powodując często mutacje letalne
Kwas azotawy - powoduje deaminację cytozyny do uracylu i wywołuje tranzycję G C A T, deaminacja adeniny do hipoksantyny - analogu guaniny - powoduje tranzycję A T G C
Inne czynniki fizyczne i chemiczne powodujące mutacje
Naprawa DNA
Fotoreaktywacja
Naprawa DNA uszkodzonego przez działanie UV za pomocą fotoliaz = enzymów fotoreaktywujących, w obecności światła widzialnego - dimery pirymidynowe ulegają monomeryzacji, koenzym: FADH2
Metabolizm ksenobiotyków
Rozpuszczalne w wodzie są wydalane w pierwotnej postaci
Hydrofobowe usuwane są pod wpływem soków trawiennych lub ulegają metabolizmowi, który ma zmienić ich rozpuszczalność w fazie wodnej
Odbywa się to w 2 fazach
1 faza: utlenienie, redukcja, degradacja
2 faza: sprzężenie prowadzące do usunięcia ksenobiotyku z organizmu
Typy reakcji katalizowanych przez cytochromy P-450 - kluczowy enzym
Cytochrom P-450 - enzym z klasy oksydoreduktaz, ma wiele izoform, katalizuje różne reakcje, biorąc udział w procesach detoksykacyjnych ksenobiotyków (200 tys substratów) u wszystkich organizmów żywych
Lokalizacja: głównie retikulum endocytoplazmatyczne i mitochondria, u człowieka w wątrobie
Donorem elektronów w reakcjach z udziałem cytochromu P-450 jest najczęściej NAD(P)H, reakcje polegają najczęściej na przyłączeniu 1 atomu tlenu do substratu
RH + O2 + NADPH + H+ ROH + H2O + NADP+
Alifatyczne hydroksylowanie
Cykloheksan Cykloheksanol
Aromatyczne hydroksylowanie
Benzen Fenol
Epoksydowanie alkenów
Cykloheksen Tlenek cykloheksenu
N-odalkilowanie
CH3N(H)CH3 CH3NH2 + HCHO
O-odalkilowanie
C6H5OCH3 C6H5OH + HCHO
S-utlenienie
CH3SCH3 (CH3)2SO
Redukcyjna dehalogenacja
C6H5CH2Br C5H5CH3
1 faza detoksykacji lipofilowych ksenobiotyków
Wprowadzenie polarnej, reaktywnej grupy funkcyjnej
Epoksydacja
Hydroksylacja
Utlenienie amin
Utlenienie związków siarkoorganicznych
Degradacja
Transformacja grup nitrowych i chlorowcopochodnych
Skutki I fazy detoksykacji ksenobiotyków
Korzystne: wzrost polarności, rozpuszczalności, ułatwienie wydalania
Niekorzystne - pojawienie się w komórkach
Powoduje to:
Reaktywne formy tlenu
Zmiany w komórkach pod wpływem reaktywnych form tlenu
Enzymy antyoksydacyjne
Mangan-SOD: mitochondrialna
Miedź/cynk-SOD: cytosolowo-jądrowa
- Peroksydaza glutationu (GSHOx - metal katalityczny: selen)
- Reduktaza glutationu (GSSGR)
- Dehydrogenaza glukozo 6-fosforanu (G6PDH)
- Dehydrogenaza 6-fosfoglukonianu (6PgaDH)
Nieenzymatyczne antyutleniacze
2 faza - sprzęganie i usuwanie ksenobiotyków
Usuwanie epoksydów
Sprzężenie elektrofilowe
Kwas urydyno-5'difosfo-D-glukuronowy (UDPGA) - jest często substratem w 2 fazie metabolizmu ksenobiotyków - posiadających grupy -OH (ROH)
Po przyłączeniu reszta glukozy zwiększa rozpuszczalność tak zmodyfikowanego ksenobiotyku i ułatwia jego wydalenie z organizmu
BOTULINA (jad kiełbasiany)
Clostridium botulinum
Trucizna?
Jest stosowana w kosmetologii do usuwania zmarszczek mimicznych, powstających w wyniku wzmożonego napięcia lub nawykowego kurczenia niektórych mięśni
Metabolizm etanolu i metanolu
Utlenianie etanolu
Człowiek może rozkładać 7-8g etOH/godzinę - 300 ml piwa, 125 ml wina, 25 ml wódki…
Katalaza:
CH3CH2OH + H2O2 CH3CHO + 2H2O
Cytochrom P-450
CH3CH2OH + NADPH + H+ + O2 CH3CHO + 2H2O + NADP+
Rodniki hydroksylowe
CH3CH2OH + *OH CH3CHOH + H2O
WYKŁAD 15 21.01.2009
Hormony i ich znaczenie dla regulacji metabolizmu. Podsumowanie wykładów
Metabolizm regulowany jest przez kontrolę
Heksokinaza (1 reakcja glikolizy): glukoza + ATP Glukozo-6-fosforan + ADP
Regulacja poprzez zmieniające się stężenie substratu i różnice w powinowactwie enzymu do substratu
4 izoenzymy: I-IV
Heksokinaza II - niskie Km dla glukozy, hamowana przez produkt G6P, duże stężenie G6P hamuje rozkład glukozy, utrzymuje się wysokie stężenie glukozy we krwi
Heksokinaza IV (glukokinaza): wysokie Km dla glukozy (ok. 50x)
Lokalizacja: wątroba
Niehamowana przez G6P
Wzrost stężenia glukozy powoduje jej fosforylację w wątrobie, powstały G6P jest dalej przekształcany w glikogen i kwasy tłuszczowe
Przy niskich stężeniach glukozy we krwi przeważa glikoliza, przy wysokich synteza substancji zapasowych (?)
Wtórne cząsteczki sygnalizacyjne
Białka G
cAMP - stymuluje fosforylację wielu białek docelowych w wyniku aktywacji kinazy białkowej A. Stymulacja fosforolizy glikogenu oraz hamowanie jego syntezy
Hormony - wytwarzane przez organizm, niezbędne dla procesów przemiany materii związki, których zadaniem jest koordynowanie procesów chemicznych zachodzących w komórkach
Wytwarzane przez gruczoły dokrewne
Hormony tkankowe - zazwyczaj działanie miejscowe
Działanie hormonów:
Wazopresyna - syntetyzowana w tylnym płacie przysadki
Oksytocyna - syntetyzowana w tylnym płacie przysadki
Znaczenie glukozy (~6,4 mM - norma)
Glikogen i tłuszcze (zapasy energii)
Glikoliza, cykl kwasów trójkarboksylowych (energia)
Cykl pentozofosforanowy (energia, nukleotydy)
Insulina - wytwarzana przez b komórki wysp trzustki
Zwiększenie wydzielania insuliny wywołuje wzmożoną syntezę glikogenu w wątrobie i mięśniach, oraz syntezę lipidów z cukrów. Insulina wpływa na biosyntezę białek na poziomie translacji mRNA w mięśniach i sercu. Insulina bierze udział też w transporcie metabolitów (glukozy i aminokwasów) przez błony komórkowe
Glukagon - wytwarzany przez komórki a wysp trzustki
Regulacja stężenia glukozy we krwi
3,7 - 5.0 mM (65-90 mg/dL) - na czczo
9-10 mM (160-180 mg/dL) - po posiłku
Podwzgórze - ośrodek głodu i sytości
Trzustka - insulina, glukagon
Nadnercza: adrenalina i kortyzol
Cukrzyca - podwyższony poziom glukozy spowodowany zaburzeniami w wydzielaniu insuliny, działaniu insuliny lub obiema przyczynami naraz.
Typ I - insulinozależna - około 10% chorych
Typ II - cukrzyca insulinoniezależna - około 90% chorych
Choruje 3-4% (w Polsce 1 milion), wzrasta liczba chorych na typ II
Zaburzenia stężenia glukozy we krwi:
Prolaktyna - wytwarzana głównie w przysadce mózgowej
T3 - Trijodotyronina
T4 - tetrajodotyronina (tyroksyna)
Tyreoglobulina:
Działanie T4 - tyroksyny
Kortyzol
Aldosteron
Estrogeny i progesteron
Estrogeny - hormony sterydowe „żeńskie”, ale ich niedobór u mężczyzn powoduje bezpłodność
Odpowiedzialne za:
Progesteron
Testosteron
Melatonina - pochodna tryptofanu, hormon syntetyzowany w pinealocytach szyszynki, wytwarzanie melatoniny hamowane jest pod wpływem światła
Reguluje molekularne zegary całego organizmu:
FITOHORMONY - hormony roślinne
Czy termin „hormon” w odniesieniu do substancji roślinnych jest uzasadniony?
Hormony roślinne |
Hormony zwierzęce |
Tylko małe cząsteczki |
Peptydy/białka oraz małe cząsteczki |
Produkowane w całej roślinie |
Produkowane w wyspecjalizowanych „gruczołach” |
Działają głównie na cele lokalne (sąsiadujące komórki i tkanki |
Działają głównie na cele odległe |
Efekty danego hormonu różnią się w zależności od interakcji z innymi hormonami |
Efekty danego hormonu silnie specyficzne |
Brak centralnej regulacji |
Regulowane przez centralny system nerwowy |
Klasyfikacja hormonów roślinnych
Główne klasy hormonów roślinnych
Auksyny
Cytokininy
Gibereliny
Kwas abscysynowy (ABA)
Etylen
Substancje „hormono-podobne” produkowane przez rośliny
Poliaminy
Kwas jasmonowy
Kwas salicylowy
Brassinosteroidy
Florigeny
Fitochrom (fotoreceptor)
Tlenek azotu
Auksyny - IAA
Stymuluje: wydłużanie komórek, podział komórek w kambium i w kombinacji z cytokininami w kulturach tkankowych, zróżnicowanie elemtów naczyniowych, inicjację korzenia na uciętej łodydze, inicjację korzeni w kulturach tkankowych
Cytokininy
Gibereliny - GA3
Stymuluje
ABA - kwas abscysynowy
Etylen - wytwarzany z aminokwasu metioniny poprzez cykliczny pośrednik ACC - (kwas 1-aminocyklopropanokarboksylowy)
Stymuluje:
Znaczenie biochemii w naukach o żywieniu człowieka
Zagadnienia do egzaminu
BIOCHEMIA
Dr Sławomir Orzechowski
Budynek 37 P/139 (wejście E)
Konsultacje: wtorek 9-10, czwartek 13-14
Zaliczenie przedmiotu:
Zaliczenie ćwiczeń (pow 51% pkt możliwych do zdobycia, w innym wypadku kolokwium zaliczeniowe - materiał SKRYPT SGGW)
Pisemny egzamin (dla osób z oceną 4,5 i 5 możliwość egzaminu tylko z materiału, którego nie było na kolokwiach cząstkowych - z kilku ostatnich wykładów - tzw forma „0”)
Zalecana literatura:
31
Wyszukiwarka
Podobne podstrony:
FIZJOLOGIA wykl 1-15 wnozcik, Wnożcik
Wykł 15 Etyka w pracy socjalnej
Restrukturyzacja wykł 3 15.01.2012, UE Katowice, II stopień sem3, METODOLOGIA PROCESÓW RESTRUKTURYZA
archi wykl 15
biochemia str 15 18 (2)
Egzamin fizjologia 15, studia, biochemia, FIZJOLOGIA
Biochemia - wykl(2), towaroznawstwo, biochemia
biochemia 6 wykl!, Zootechnika SGGW, semestr II, biochemia
III Lipidy, studia, wnożcik, biochemia
Biochemia Wykład VII 9 01 15 r Kwasy nukleinowe, DNA, RNA
Wykład z ćwiczeń - 15.01.2011 (sobota) mgr A. Szczepanek, UJK.Fizjoterapia, - Notatki - Rok I -, Bio
15 BIOCHEMIA 2008 Metabolizm we Nieznany
biochemia przemiany, studia, wnożcik, biochemia
15.Przykłady reakcji utleniania i dekarboksylacji w cyklu Krebsa, Notatki AWF, Biochemia
15 BIOCHEMIA Metabolizm weglowodorow
15 Sprzezenie procesow na przykladzie rekacji biochemicznych
zagadnienia biochemia, WNOŻCiK wieczorowe, semestr III, Biochemia ogólna i żyw
bioch, WNOŻCiK wieczorowe, semestr V, biochemia żywienia
BIOCHEMIA 15
więcej podobnych podstron