VI. WĘGLOWCE
1. Ogólna charakterystyka
|
Węgiel
|
Krzem, German |
Cyna, Ołów |
Metaliczność |
niemetal |
półmetale |
metale |
Elektroujemność |
2,50 |
1,74 2,02 |
1,72 1,55 |
Struktura elektronowa - liczba wiązań chemicznych |
s2p2 → sp3 → 4 wiązania Więcej niż 4 wiązania - tworzą pierwiastki od 3 okresu, tj. od krzemu: np. SiF62-, SnCl62-, [Pb(OH)6]2- (dostępność orbitali d) |
||
Stopnie utlenienia: od -4 do +4
Stopień utlenienia +4 staje się coraz mniej trwały w miarę jak zwiększa się liczba atomowa. Wzrasta natomiast trwałość na
+2 st. utl.
→ węgiel i krzem na +2 stopniu utlenienia występują bardzo rzadko (CO, SiO)
→ german częściej występuje na +2 stopniu utlenienia (GeO,
GeS, GeI2)
→ dla cyny i ołowiu stopień utlenienia +2 staje się najbardziej
trwały (np. SnSO4, PbCl2)
Energia wiązań (kJ/mol):
X: C Si Ge Sn
X - X 346 222 188 147
X - O 358 452
Wyjaśnia to dlaczego węgiel tworzy tak wiele związków → dzięki silnym wiązaniom typu C - C
Drugą przyczyną jest zdolność tworzenia pomiędzy atomami węgla wiązań podwójnych i potrójnych (wiązania typu π) → chemia organiczna
Krzem odgrywa podobną rolę w przyrodzie nieożywionej jak węgiel w przyrodzie ożywionej. Przeważająca część skorupy ziemskiej zbudowana jest z krzemianów. W tym przypadku krzem jest powiązany poprzez: - O - Si - O - Si - O -
2. Węgiel
Rozpowszechnienie - 0,08 % mas. (14-ty pierwiastek)
Minerały: Kalcyt CaCO3
Dolomit (Mg,Ca)CO3
Magnezyt MgCO3
Syderyt FeCO3
W powietrzu ~ 0,04 % obj. (400 ppm).
W stanie wolnym:
odmiany alotropowe - diament
- grafit
ogrzewanie bez dostępu powietrza
Diament ⇔ Grafit
1500 - 2700 K
6 - 12 GPa
katalizator: metale
Oszlifowane diamenty → brylanty
|
DIAMENT |
GRAFIT |
Odległość C - C |
154 pm |
142 i 335 pm |
Gęstość, kg/dm3 |
3,5 |
2,1 - 2,3 |
Przewodnictwo elektryczne przyczyna: hybrydyzacja |
bardzo słabe sp3 |
większe niż diamentu sp2 + el. π |
Właściwości |
twardy |
miękki |
- węgiel bezpostaciowy nie jest odmianą alotropową węgla
- węgiel drzewny
- węgiel kostny silnie zdeformowana
- sadza sieć grafitu
- koks
W roku 1985 Smalley i Curl z Rice University (w Houston) oraz Kroto (Sussex University) odkryli 3 - cią odmianę alotropową węgla, tzw. FULLERENY. Otrzymali oni w jednej szarży 1010 cząsteczek C60 i C70 odparowując grafit za pomocą lasera w strumieniu helu. W ilościach wagowych fullereny zostały otrzymane przez Kratschmara i Fostiropusa z Instytutu Maxa Plancka w Heidelbergu (1990).
Swą nazwę fullureny zawdzięczają amerykańskiemu architektowi FULLERENOWI (projektant pawilonu USA na EXPO'67). Cząsteczka C60 ma kształt piłki nożnej:
Cząsteczka C60 składa się z 20-tu sześciokątów i 12-tu pięciokątów przy czym poszczególne pięciokąty nie stykają się ze sobą. Średnica takiej "piłki fullerenowej" wynosi 710 pm.
Już w XVIII wieku EULLER wykazał, że figura geometryczna zbudowana z dowolnej liczby sześciokątów może utworzyć zamknięty wielościan tylko wtedy, gdy doda się 12 pięciokątów równobocznych.
Kryształy C60 są miękkie jak grafit ale po ściśnięciu do 70% pierwotnej objętości stają się twardsze od diamentu. Posiadają właściwości półprzewodnikowe.
Fulleren C60 krystalizuje w sieci regularnej zewnętrznie centrowanej, tj. typu A1 o stałej sieciowej równej 1417 pm.
Fullereny to nie tylko C60. Zamknięte klastery węglowe wymagają co najmniej 28 atomów węgla przy czym górna granica takich ażurowych cząsteczek wynosi 1500 (są to tzw. fullereny giganty). Stwierdzono istnienie C70, C72, C74, C78, C88, C84, C180, C240, C540 i C1500.
Przykłady:
C60 C240 C540 C1500
Fullereny w swoim wnętrzu mogą pomieścić atomy metali jak np. lantan. Zapisujemy to jako: M@C60.
W 1991 r. odkryto z kolei nanorurki.
Nanorurki to twory o kształcie mikrobambusów a ich rozmiary wynoszą ok. 1 nanometra. Warstwy grafitu zwijają się tutaj nie w kulki (jak w fullerenach) ale w długie rurki.
Ściany rurek zbudowane są więc z sześcioczłonowych pierścieni, jak w graficie. Również w tym przypadku próbuje się wprowadzać atomy metali do ich środka. Powstają więc „metalowe przewody” zbudowane z jednoatomowej warstwy.
Pojawia się pogląd iż nanorurki to czwarta odmiana alotropowa węgla.3. Formy występowania węglowców
|
Odmiany typu diamentu |
Pozostałe odmiany |
|
C |
Diament |
Izolator |
Grafit, fullereny, nanorurki |
Si |
Krzem |
Półprzewodniki |
-
|
Ge |
German |
|
- |
Sn |
Cyna - α (cyna szara) |
|
Cyna-β (cyna biała) (ukł. tetragonalny) - wł. metal. |
|
|
|
Cyna-γ (ukł. rombowy) |
Pb |
Ołów |
|
Odmiana metaliczna (ukł. regularny typu A1) |
Krzem
Si - 28 % mas. w skorupie ziemskiej → krzemiany, glinokrzemiany, krzemionka
Metoda otrzymywania bardzo czystego krzemu:
1o Otrzymywanie:
SiO2 + 2Mg = Si + 2MgO ΔHo = -369 kJ/mol
Inny reduktor - aluminium (aluminotermia)
2o Otrzymywanie SiHCl3:
Si + 3HCl = SiHCl3 + H2
temp. > t. topnienia SiHCl3
3o Frakcjonowana destylacja - usunięcie mniej lotnych chlorków
(BCl3, PCl3)
rozkład
4o SiHCl3 Si
1400 K
5o Dalsze oczyszczanie przez topienie strefowe
German
Odkryty dopiero w r. 1885. Bardzo rzadki pierwiastek.
- jego zawartość wynosi 0,3 - 2,4 ppm
Minerały → germanit Cu3(Ge,Fe)S4
Występuje w popiołach i pyłach dymnicowych niektórych gatunków węgli (do 0,X %). Też w niektórych rudach Zn i Cu.
Otrzymywanie bardzo czystego germanu:
HNO3
1o Germanit GeO2
H2SO4
2o GeO2 + 4HCl = GeCl4 + 2H2O
3o Destylacja GeCl4
hydroliza
4o GeCl4 GeO2
5o GeO2 + 2H2 = Ge + 2H2O
6o Oczyszczanie metodą topienia strefowego - ultraczysty german:
1 atom obcy na 1012 atomów germanu.
Cyna - 4 ⋅ 10-3 % kasyteryt - SnO2 |
Ołów - 2 ⋅ 10-4 % galena - PbS |
Krzem i german to klasyczne półprzewodniki - na 1 atom przypadają po 4 elektrony walencyjne.
Duże podobieństwo do półprzewodników Si i Ge wykazują związki chemiczne typów:
AIVBIV np. SiC
AIIIBV np. GaAs, GaP
AIIBVI np. ZnSe, CdSe, CdS, HgTe
Tutaj na 1 atom przypadają też przeciętnie po 4 elektrony walencyjne.
Tlenek węgla (CZAD): CO
2C + O2 = 2CO
Produkt niecałkowitego spalania węgla - niedostateczny dostęp tlenu.
Otrzymywanie CO z koksu:
gaz C + O2 = CO2 ΔHo = - 393 kJ/mol
genera-
torowy C + CO2 = 2CO ΔHo = +172 kJ/mol
2C + O2 = 2CO ΔHo = -221 kJ/mol
gaz
wodny C + H2O = CO + H2 ΔHo = +131 kJ/mol
Wiązanie w CO:
Hybrydyzacja
diagonalna atomu C:
wymieszanie orbitali
2s i 2px
→ 2 hybrydy typu sp
KK(t)2(2so)2(σx,c-o)2(πy,c-o)2(πz,c-o)2
liczba elektronów na orbitalach wiążących - 6
liczba elektronów na orbitalach antywiążących - 0
rząd wiązania 1/2 (6 - 0) = 3
C ≡ O ← potrójne wiązanie
Moment dipolowy CO: μ = 0,1 D
D l a c z e g o ?
Orbital t atomu węgla równoważy moment dipolowy powstający na skutek przyciągania elektronów wiążących przez atom tlenu |
Dwutlenek węgla (CO2) otrzymywanie:
C + O2 = CO2 ΔHo = -393 kJ/mol
CaCO3 = CaO + CO2 T > 1200 K
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
Suchy lód → stały CO2 - t. krzepn. = 216 K
Kwas węglowy i węglany:
CO2 + H2O = H2CO3
H2CO3 = H+ + HCO3- Ka1 = 2⋅10-4
HCO3- = H+ + CO32- Ka2 = 5⋅10-11
M2ICO3 - (obojętne) węglany; np. Na2CO3, CaCO3
MIHCO3 - wodorowęglany; np. NaHCO3, Mg(HCO3)2
Cząsteczka CO2:
- hybrydyzacja diagonalna orbitali 2s + 2px atomu węgla → orbitale tA i tB
- pokrywanie się hybrydów tA i tB atomu węgla z orbitalami px obu atomów tlenu
→ 2 orbitale wiążące
typu σ
Orbitale 2py i 2pz obu atomów tlenu i atomu węgla oddziaływując na siebie powodują powstanie zdelokalizowanych wielocentrowych wiązań typu π.
Powstają 3 orbitale typu πy i 3 orbitale typu πz:
πy, πyo, πy* oraz πz, πzo, πz*
Konfiguracja elektronowa cząsteczki CO2:
6 + 2 ⋅ 8 = 22 elektrony rozmieszczone są na orbitalach:
KKK(2sA)2(2sB)2(σc-o,A)2(σc-o,B)2(πy)2(πz)2(πyo)2(πzo)2
(A i B to atomy tlenu)
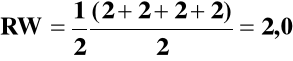
Efekt cieplarniany
Dwutlenek węgla pełni w atmosferze taką rolę jak szklana szyba w szklarni.
Taką rolę pełnią też: O3, tlenki azotu (NOx),CH4 i jego fluorowco-pochodne (freony)
Aż 50 % efektu cieplarnianego spowodowane jest przez CO2
Skąd się bierze CO2 w atmosferze:
- rozkład substancji organicznych w glebie (procesy gnilne),
- spalanie węgla, ropy i jej pochodnych oraz gazu.
Z drugiej strony CO2 jest usuwany z atmosfery.
Fotosynteza materii organicznej:
hυ
nCO2 + nH2O → (CH2O)n + nO2
chlorofil
CaCO3 + H2O + CO2 = Ca2+ + 2HCO3-
Powstają rozpuszczalne w wodzie wodorowęglany
Stężenie CO2 w atmosferze rośnie:
początek XX w. → ~ 280 ppm
2007r. → ~ 390 ppm
Przyrost w skali roku ~ 0,5 %
Jak zapobiegać efektowi cieplarnianemu?
- alternatywne źródła energii (elektrownie wiatrowe, wodne, kolektory słoneczne, energetyka jądrowa)
- spalanie gazu ziemnego daje o 45 % mniej CO2 w porównaniu
z węglem
- powstrzymać wycinanie lasów
b) Tlenki krzemu SiO i SiO2:
SiO2 stanowi 12 % skorupy ziemskiej, a z uwzględnieniem minerałów krzemianowych aż 52 %.
Odmiany krzemionki:
kwarc trydymit krystobalit
α, β α, β, γ α, β
Ponadto bezpostaciowy SiO2 - opal, ziemia okrzemkowa.
Krzem we wszystkich odmianach krzemionki ma liczbę koordynacyjną 4, a tlen 2. Każdy atom tlenu jest wspólny dla dwóch tetraedrów. poszczególne odmiany SiO2 różnią się sposobem ułożenia czworościanów [SiO4]4-.
SiO2 nie rozpuszcza się w wodzie!
Reaguje tylko z HF:
SiO2 + 4HF = SiF4 + 2H2O
i bardzo powoli z wodnymi roztworami NaOH i Na2CO3.
Łatwo natomiast stapia się z tymi związkami:
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + 4NaOH = Na4SiO4 + 2H2O
SiO2 + 2Na2CO3 = Na4SiO4 + 2CO2
c) Kwasy krzemowe
Krzemiany hydrolizują dając kwasy krzemowe:
SiO4 4- + 4H2O = H4SiO4 + 4OH-
⇓
kwas ortokrzemowy
Przez kondensację powstają kwasy polikrzemowe o ogólnym wzorze xSiO2 ⋅ yH2O
Mogą również powstać rozgałęzione łańcuchy:
d) Krzemiany
W krzemianach występują oddzielnie grupy [SiO4]4- lub mogą łączyć się narożami. Takie łączenie daje struktury rozbudowane.
Struktura jonu [SiO4]4- wygląda następująco:
Podział krzemianów:
1o Zawierają pojedyncze grupy [SiO4]4- → ortokrzemiany
Np. oliwin. Pomiędzy tymi grupami są kationy Mg2+ lub Fe2+ → (Mg,Fe)2SiO4
2o Krzemiany wyspowe. Zawierają zespoły 2, 3 lub 6 tetraedrów,
np. beryl - Be3Al2(SiO3)6 o zespołach [Si6O18]12-
3o Krzemiany łańcuchowe i wstęgowe, np. enstatyt - (MgSiO3)
4o Krzemiany warstwowe, np. talk - Mg3Si4O10(OH)2 )
5o Krzemiany o trójwymiarowej strukturze
e) Szkła
Zdolność tworzenia szkieł, tzn. zastygania w bezpostaciową masę wykazują :
- SiO2, B2O3 i P4O10
- ich stopy z tlenkami litowców i wapniowców,
- ich stopy z PbO i Fe3O4
- Także: elementarny selen i polistyren
Jak otrzymuje się szkło?
- stapianie piasku z sodą (Na2CO3) i wapieniem (CaCO3) w temp. ok. 1800 K,
- ponadto dodatki potażu (K2CO3), boraksu (Na2B4O7 ⋅ 10H2O), glejty ołowianej (PbO)
- dodatek substancji barwiących :
Fe(II) na zielono
Fe(III) na brunatno
Au na rubinowo
S z k ł o w o d n e - wodne roztwory krzemianów sodu (Na2SiO3) i
potasu (K2SiO3) → impregnacja tkanin i papy → zwiększa się ich ognioodporność.
f) Tlenki i wodorotlenki Ge, Sn i Pb
+2 stopień utlenienia:
|
Ge |
Sn |
Pb |
XO |
GeO |
SnO |
PbO |
Wodorotlenki |
- |
Sn(OH)2 |
Pb(OH)2 |
Jony |
|
Sn2+ Sn(OH)42- |
Pb2+ Pb(OH)42- |
Wodorki Sn(II) i Pb(II) posiadają właściwości amfoteryczne, tzn. roztwarzają się w roztworach wodnych wodorotlenków:
Sn(OH)2 + OH- = Sn(OH)3- hydrokso-
Sn(OH)2 + 2OH- = Sn(OH)42- cyniany(II)
+4 stopień utlenienia:
|
Ge |
Sn |
Pb |
XO2 |
GeO2 |
SnO2 |
PbO2 |
Kwasy, jony |
H2GeO3, GeO32- H4GeO4, GeO44- |
[Sn(OH)6]2-
|
[Pb(OH)6]2-
|
Otrzymywanie hydroksocynianów(IV) z SnO2 poprzez stapianie z NaOH:
SnO2 + 2NaOH = Na2SnO3 + H2O
Na2SnO3 + 3H2O = Na2[Sn(OH)6]
Minia: Pb3O4 → Pb2IIPbIVO4
4 Związki węgla z azotem i ich pochodne
Cyjanowodór:
HCN → silnie toksyczny (kwas pruski).
Dawka śmiertelna - 50 mg KCN (!) |
HCN ⇔ CN- + H+
bardzo słaby kwas: Ka = 7⋅10-10
HCN występuje w formie 2 odmian izomerycznych:
H - C ≡ N ⇔ C ≡ N - H
cyjanowodór izocyjanowodór
Sole → cyjanki, np. KCN - cyjanek potasu z Fe2+ i Fe3+ tworzy aniony kompleksowe:
[Fe(CN)6]4- aniony heksacyjanożelazianowe(II)
[Fe(CN)6]3- aniony heksacyjanożelazianowe(III)
5. Węgliki
Węgliki to związki węgla z pierwiastkami o niższej elektroujemności niż węgiel.
Są to związki z:
- metalami,
- krzemem i borem.
Wyróżniamy węgliki:
a) jonowe (typu soli),
b) międzywęzłowe,
c) kowalencyjne.
ad a) Zawierają aniony C4-, C22- lub C34-
Al4C3 → metanki (C4-)
Na2C2, CaC2 → acetylenki (C22-)
Mg2C3 → allilki (C34-)
Otrzymuje się je przez ogrzewanie metalu z węglem lub węglowodorem. Krystalizują w sieciach jonowych (kationy metali i aniony C4-, C22- lub C34-).
ad b) Sieć przestrzenna zbudowana z atomów metali a w przestrzeniach międzywęzłowych znajdują się atomy węgla
(rat > 130 pm, rc = 77 pm).
Powstają w bardzo wysokich temperaturach (2300 K) wyniku działania węgla na metale należące do 4, 5 lub 6 grupy - są bardzo twarde, np.: TiC, V2C, WC, W2C
ad c) SiC, B4C
SiO2 + 3C = SiC + 2CO
SiC → karborund → bardzo twardy → elementy grzejne
(sylity) i materiał szlifierski
Ich sieci są atomowe (atomy węgla i krzemu/boru)
Inne związki węglowców
CS2 - dwusiarczek węgla
COS - tlenosiarczek węgla
CF4 - czterofluorek węgla
CCl4 - czterochlorek węgla
CCl2F2 - dichlorodifluorometan (freon)
SiF4 - czterofluorek krzemu
H2SiF6 - kwas heksafluorokrzemowy
GeS - siarczek germanu(II)
SnS - siarczek cyny(II)
PbS - siarczek ołowiu(II)
GeS2 - dwusiarczek germanu(IV)
e) SnCl2 - chlorek cyny(II)
(NH4)2[SnCl6] - sześciochlorocynian(IV) amonu
Pb(NO3)2 - azotan ołowiu(II)
PbSO4 - siarczan ołowiu(II)
PbCO3 - węglan ołowiu(II)
PbCrO4 - chromian ołowiu(II)
PbCl2 - chlorek ołowiu(II)
Zestawienie właściwości kwasowo-zasadowych pierwiastków
grup 14 - 17
Fluorowce |
Tlenowce |
Azotowce |
Węglowce |
||||||||||
st. utl. |
+1 |
+3 |
+5 |
+7 |
st. utl. |
+4 |
+6 |
st. utl. |
+3 |
+5 |
st. utl. |
+2 |
+4 |
F Cl Br I |
- k k k+z |
- k k k+z |
- k k k |
- k k k |
O S Se Te |
- k k+z k+z |
- k k k |
N P As Sb Bi |
k k k+z z z |
k k k k k |
C Si Ge Sn Pb |
- - - k+z k+z |
k k k k k |
Komentarz: st. utl. - stopień utlenienia
k - właściwości kwasowe
z - właściwości zasadowe
k+z - właściwości kwasowo-zasadowe (amfoteryczne)
Koniec rozdz. VI
Władysław Walkowiak Wykład - Chemia Nieorganiczna
1/36
ChN_Wykład 6_VI. Węglowce.
{
}
{
}
Schemat urządzenia do oczyszczania ciał stałych metodą topienia strefowego.
walencyjnych
Wyszukiwarka
Podobne podstrony:
Wykład 10 Pierwiastki -d i -f elektronowe CHC13005w, chemia, chemia ogólna ; nieorganiczna ; metale
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Węglowce (2), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
Wykład Wprowadzenie CHC13005 w, CHEMIA NIEORGANICZNA II CHC 1040 s
Węglowce (1), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
2 chemiaogolna wyklad 290909, Wykład Chemia ogólna i nieorganiczna prof
Chemia ogólna i nieorganiczna wykład
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Chemia ogolna i nieorg 13 2010
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
więcej podobnych podstron