enzymy�3

W czasie hamowania nieodwracalnego cząsteczki inhibitora przyłączają się do centrum aktywnego enzymu za pomocą wiązań kowalencyjnych. W ten sposób powstaje trwały kompleks enzym-inhibitor (El), a działanie enzymu zostaje zahamowane. Do inhibitorów działających w opisany sposób należy większość trucizn, m.in. cyjanek. Proces nieodwracalnej inhibicji jest podstawą skuteczności działania penicyliny i innych antybiotyków z tej grupy. Penicylina hamuje aktywność transpeptydazy - jednego z enzymów odpowiedzialnych za wytwarzanie bakteryjnej ściany komórkowej.
Hamowanie odwracalne może być kompetycyjne lub niekompetycyjne. Każde z nich wiąże się z działaniem określonych inhibitorów. Inhibitory kompetycyjne to substancje o strukturze przestrzennej zbliżonej do struktury cząsteczki substratu (rys. 55). Blokują aktywność enzymu w wyniku bezpośredniego współzawodnictwa z substratem o enzym. Wygrywając współzawodnictwo, zajmują centrum aktywne enzymu, uniemożliwiając tym samym związanie substratu. Do inhibitorów działają*
( pCxlob}UL io )
vd a/rdśHMyn c4wJru$VUC?yr /WUJU,
clo UjyyKfAjll&iu. ^ o ~ S J / W obu wypadkach inhibitor niekompetycyjny powoduje
zmianę struktury przestrzennej całego enzymu, łącznie z jego centrum aktywnym, które przestaje spełniać swoje funkcje. W konsekwencji, mimo że powstaje kompleks en-zym-substrat, dalsze przemiany substratu ulegają zahamowaniu. Działanie inhibitora niekompetycyjnego polega zatem na zmniejszaniu liczby cząsteczek enzymu zdolnego do przekształcenia cząsteczek substratu (a nie, jak w wypadku inhibitora kompetycyjne-go, liczby cząsteczek enzymu zdolnego do związania się z substratem), a w rezultacie na zablokowaniu możliwości osiągnięcia szybkości maksymalnej (Vmax) katalizowanej reakcji. Do inhibitorów niekompetycyjnych należą m.in. niektóre metabolity, które w ten sposób regulują aktywność enzymów, oraz jony metali ciężkich. Ich działania, w odróżnieniu od inhibitorów kompetycyjnych, nie można znieść przez zwiększenie stężenia substratu. _____ ________________________

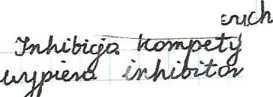
u* jyyuuz.

W latach 60. XX wieku odkryto nową formę regulacji metabolizmu i nazwano ją regulacją allosteryczną. Jest ona związana z funkcjonowaniem enzymów allosterycznych '
Wiele enzymów tego typu składa się z dwóch lub więcej podjednostek, z których każda posiada własne centrum aktywne. Ponadto w obrębie enzymu allosterycznego, zwykle na styku dwóch podjednostek, znajduje się centrum allosteryczne - specjalne miejsce wiążące aktywatory lub inhibitory, które regulują aktywność enzymu. Przyłączenie do centrum allosterycznego aktywatora utrwala aktywną postać enzymu wraz z dostępnym dla substratu centrom aktywnym każdej z podjednostek).
2 kolei związanie inhibitora powoduje zmianę struktury przestrzennej enzymu na nieaktywną- Do substancji, które woływają na aktywność enzymu wskutek przyłączenia się do jego centrum allosterycznego, należą^ m.in. produkty
aktywator w centrum aliosterycznym
inhibitor w centrum aliosterycznym
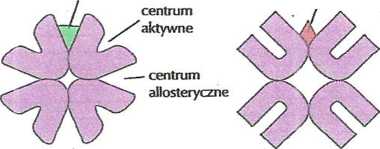
aktywny enzym ailosteryczny
nieaktywny enzym ailosteryczny
E/3. 56. Wpływ inhibitorów i aktywatorów na funkcjonowanie enzymów allosterycznych.
/yuJjętyoJjL

OUXh
/zvw /7vuM^°t)C /KoMAjA ----
rWilwcL cLp /yfc&ewuo, “ - jfm uy
/OiAJjyUciJlu JUsllijj/inM flUOblup U7 jzJjy'JO/yCc£'
ńrtd /yuiMjJcrŁo & dźJbwtMzMj i njjzs*
Wyszukiwarka
Podobne podstrony:
25584 WYKŁAD 2 enzymy cz 1 (45) INHIBITOR KOMPETYCYJNY Inhibitor kompetycyjny wiąże się odwracaln
58 przyłączyli się do nielicznych przedstawicieli Polaków z za kordonu i przed Komisją Graniczną raz
phoca thumb l slajd26 (14) Mikrotubule kinetochorowe przyłączają się do chromosomów w miejscach przy
page0865 857 gdyż każcie nowe podziałanie siły ciężkości wywołuje prędkość przyłączającą się do
IMGR11 Wiązanie RNA Pol i inicjacja • Holoenzym musi przyłączyć się do DNA •
14,15 (3) wiek może się czasem zdarzyć, że poszczególne osoby nie chcą przyłączyć się do jakiegoś ćw
-53- 19 6 8 8 marca Studenci PW przyłączyli się do rozruchów zainicjowanych na terenie Uniwersytetu
nają tańczyć zielistki przyłączają się do nich. W tańcu nabierają soczystych, zielonych barw.
Jesteś studentem z niepełnosprawnościami? Chcesz poznać wspaniałych ludzi? Przyłącz się do
DSC00125 Ł Adsorpcja - rozpoznanie ccptorm na komórce I przyłączenie się do niej. 3.
Akacjusz popierał nowego biskupa i ma nadzieję, że Cyryl przyłączy się do arian. Okazuje się jednak,
wprowadzenie do pedagogiki�4 ; P. H’;Formy pracy uczniów „Dzieci nie są zmuszane do przyłączania się
phoca thumb l slajd36 (2) Właściwości komórek satelitowych Należą do innej populacji niż mioblasty.
więcej podobnych podstron