0000001(1)

układów enzymatycznych, żywy organizm ma bardzo aktywne mechanizmy zdolne do jego rozkładania, zgodnie z reakcją 10-28
2HaOa—2HaO+Oa [10-28]
Do enzymów czynnych przy usuwaniu H202 z komórki należą pero-ksydazy i katalaza. Peroksydazy katalizują przeniesienie odłączonego tlenu na atomy wodoru oderwane z określonych, zwykle aromatycznych substratów, zgodnie z ogólną reakcją 10-29
,H O—H
A/ -f |---► A + 2HaO [10-29]
\H O H
natomiast katalaza może w zasadzie działać bez dodatkowego substratu--donora.
Peroksydazy. Znanych jest zasadniczo kilka peroksydaz: peroksydaza cytochromu c wyizolowana z drożdży, która jest wysoce swoista w stosunku do utlenianego substratu, czyli zredukowanego cytochromu c i szereg innych, występujących bardziej sporadycznie, np. niespecyficzna peroksydaza wyizolowana z chrzanu. Są to zasadniczo enzymy roślinne zawierające hem w charakterze grupy prostetycznej, a u zwierząt występują sporadycznie, np. wykrystalizowano peroksydazę z mleka i z leukocytów. Ta ostatnia ma odmienną budowę układu porfi-rynowego, który stanowi tzw. zielony protohem o bliżej nieustalonej strukturze.
Mechanizm działania niespecyficznej peroksydazy polega na aktywowaniu substratu, który ulega odwodorowaniu w obecności HsOa. a raczej formy nadtlenowej enzymu, której obecność stwierdzono metodą spektralną. Klasycznym przykładem zastosowanym również w analityce do oznaczania aktywności enzymu, jest utlenianie pirogalolu do pomarańczowo zabarwionej purpurogaliny (reakcja 10-30), której ilość łatwo da się oznaczyć kolorymetrycznie. Dalszymi substratami, które mogą być utleniane z udziałem peroksydaz, są inne fenole oraz aminy aromatyczne. Enzym wyizolowany z chrzanu zawiera jedną cząsteczkę hemu na cząsteczkę białka, którego masa cząsteczkowa wynosi 82 000.
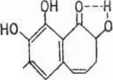
+ 5H20 4- C02
/°H
[10-30]
2 \ —08 +- 3Hj0j -
^OH H0
pirogolol purpurogalina
Katalaza. Katalaza jest enzymem raczej zwierzęcego pochodzenia i występuje np. w znacznym stężeniu w wątrobie. Odznacza się ona bardzo szybkim działaniem, gdyż jej liczba obrotów wynosi 1 250 000 w przeliczeniu na jedno centrum aktywne (ma 4 cząsteczki protohemu na cząsteczkę białka). Mechanizm działania katalazy polega na odwracalnym wytworzeniu nadtlenku enzymu z udziałem tlenu oderwanego z H202 i przeniesieniu tego tlenu na drugą cząsteczkę nadtlenku wodoru. W trakcie tych przemian wartościowość żelaza zawartego w pro-tehemie pozostaje na poziomie 2+. Aktywność enzymu jest silnie ha-
24'
Wyszukiwarka
Podobne podstrony:
996839I4397553962005?3536217 n Określanie podstawowej i całkowitej przemiany materii Każdy żywy orga
IMAG0224 (5) Wolontariat — aktywizacja osób starszych bardzo aktywnie, lecz wyłącznie do czasu osiąg
Jednym z pierwszych wyodrębnionych pierwiastków był bardzo aktywny pierwiastek; zbliżony do biz
Dopasuj nazwę gruntu organicznego do jego opisu zgodnie z klasyfikacją wg normy PN-EN ISO 14688. str
Dopasuj nazwę gruntu organicznego do jego opisu zgodnie z klasyfikacją wg normy PN-86/B-02480. grunt
DSC00809 brać i zażywać ma pozwolenie; {...] ponieważ wszystko w naturze do jego rzemiosła wchodzi,
Dopasuj nazwę gruntu organicznego do jego opisu zgodnie z klasyfikacją wg normy PN-EN ISO 14688. str
Dopasuj nazwę gruntu organicznego do jego opisu zgodnie z klasyfikacją wg normy PN-EN ISO 14688. str
Dopasuj nazwę gruntu organicznego do jego opisu zgodnie z klasyfikacją wg normy PN-86/B-02480. grunt
enzymatycznej aktywności drobnoustrojów ulega zahamowaniu proces rozkładu materii organicznej, a
Wpływ aktywności fizycznej na organizm człowieka Regularna aktywność fizyczna ma duże znaczenie
169 3 7.10.2. Druga zasada termodynamiki u procesach biologicznych Organizm żywy Hanowi układ o bard
11. ESN ( Erasmus Student NetWork) działa w Turku bardzo aktywnie, i organizuje mnóstwo eventów - im
Ćwiczenia grafomotoryczne cz1 00025 Dorysuj kogutowi piękny ogon. Pokoloruj ptaka kredkami. Pamiętaj
Profesor Jerzy Albrycht ukończy! 90 Profesor Jerzy Albrycht ukończy! 90 Jerzy Albrycht ma bardzo lic
KOMPUTER - CZŁOWIEK - PRAWO 501 ma bardzo szerokie zastosowanie, jest to bowiem narzędzie, które uła
więcej podobnych podstron